INTRODUCCIÓN
Musa spp. es uno de los cultivos importantes en más de 120 países y se encuentra ampliamente distribuido en las regiones tropicales y subtropicales de todo el mundo, el estimado de la producción es de 88 millones de toneladas al año con un área calculada de siembra de 10 millones de hectáreas, cuyo fruto contribuye de manera significativa en la seguridad alimentaria (Gosh et al., 2009; Shapira et al., 2009). Los frutos del plátano son altamente energéticos, sus carbohidratos son fácilmente asimilables por el organismo, el fruto está compuesto principalmente de agua, carbohidratos, proteínas y grasas, además es rico en vitamina A, B, C, E y minerales, debido a esto se ha convertido en un producto de alta demanda en la alimentación mundial (López, 1989). Posee diferentes usos entre los que se destacan el medicinal, producción de alcohol y como fuente de fibra (INIBAP, 2001; INIBAP, 2002).
En Bolivia, el banano y plátano se producen principalmente en los departamentos de La Paz, Cochabamba, Santa Cruz, Beni y Pando. El banano es un cultivo abundante en la zona de Caranavi y Alto Beni (La Paz) y la región de Chapare (Cochabamba) y en norte del país (MDRyT, 2011).
La carencia de material de alta calidad es uno de los factores que limitan el buen desarrollo de las plantaciones de plátano y banano. Generalmente la forma convencional de propagación de Musa, es a través de cormos o hijuelos, esta forma de propagación genera plantas idénticas a la planta madre y si se van realizando consecutivamente esta actividad ocasiona desventajas en la producción debido a la acumulación de enfermedades fúngicas, bacterianas y virales, lo cual se manifiesta posteriormente con una reducción en la producción. Además, este método de producción convencional es más laborioso y menos eficiente ya que solo se pueden obtener de 5 a 10 hijuelos por planta en un año y los campos de producción están expuestos a diferentes enfermedades (Rahman et al. 2004).
Con el avance de las herramientas biotecnológicas a través del uso de cultivo de tejidos en la micropropagación clonal in vitro de musáceas, ha permitido la producción masiva de plantas sanas, libres de hongos, nematodos, bacterias y además la multiplicación rápida de genotipo de gran importancia económica en áreas relativamente pequeñas, permitiendo tener poblaciones uniformes con alto rendimiento por hectárea. La multiplicación in vitro ha permitido la eproducción masiva de la especie para plantaciones comerciales, así como, la conservación de germoplasma. La micropropagación, consiste en cultivar un segmento de tejido vegetal con potencialidad de diferenciación bajo condiciones asépticas (dentro de una cámara de flujo laminar), proporcionándole artificialmente condiciones físicas (luz) y químicas (medios de cultivo, pH) para su crecimiento y desarrollo.
La propagación de Musa a través de cultivo in vitro es una técnica que ha sido reportado por varios trabajos utilizando diferentes explantes y métodos de regeneración organogénica (Torrico, 2004) y embriogénica somática (Aguilar et al., 2008). Hasta alcanzar altas tasas de producción mediante sistemas de inmersión temporal (Alvard et al., 1993; Colmenares y Giménez, 2003). En todo el proceso de la micropropagación, una de las limitantes para la propagación in vitro de Musa son las altas tasas de contaminación en los explantes en la fase de establecimiento del cultivo, debido principalmente a contaminación endógena, acentuada en zonas tropicales, donde las condiciones de alta temperatura y pluviosidad hacen que los microorganismos patógenos encuentren un hospedero ideal (Ortega, 2010).
En este sentido, en el presente trabajo de investigación tuvo como objetivo la estandarización del proceso de desinfección de explantes de banano y plátano con distintas concentraciones de hipoclorito de sodio (NaClO), y determinar el medio de cultivo adecuado para la multiplicación in vitro a diferentes concentraciones bencilaminopurina en condiciones de laboratorio.
MATERIALES Y MÉTODOS
El presente estudio estuvo dividido en dos fases, una correspondiente a la colecta del aterial vegetal (fase de campo) y el trabajo de cultivo in vitro en condiciones de laboratorio.
Colecta de material vegetal: Los hijuelos fueron obtenidos de la Estación Experimental Sapecho dependiente de la Facultad de Agronomía, Universidad Mayor de San Andrés (Figura 2), donde se identificaron genotipos de banano de la variedad Enano gigante y de plátano de la variedad Hartón. De la población disponible se seleccionaron 50 individuos elites a ser propagados en función a sus rendimientos, indicados por los técnicos de la Estación Experimental Sapecho y que no presenten enfermedades, este último para minimizar riesgos de contaminación en condiciones de laboratorio. Los hijuelos colectados tuvieron una altura comprendida entre 20 a 25 cm y un diámetro de 18 cm.
Posteriormente, se realizaron el deshojado y eliminación de las raíces hasta reducirlo aproximadamente a 10 a 15 cm de longitud, a la vez fueron sometidos al lavado con abundante agua y seguidamente almacenados en un pack atemperado hasta su llegada a las instalaciones del laboratorio.
La fase de laboratorio se realizó en las instalaciones del laboratorio de Biotecnología vegetal de la Carrera de Biología de la Facultad de Ciencias Puras y Naturales de la Universidad Mayor de San Andrés. Los hijuelos fueron deshojados y lavados en una solución jabonosa y enjuagadas con bastante agua de grifo, seguidamente, fueron desinfectados en función a la metodología recomendada por Torrico (2004) que sugiere hacer una doble desinfección, la primera desinfección consiste en recortar los explantes en tamaño de 10 a 12 cm de longitud de diámetro de aproximadamente 8 a 9 cm y sumergirlos en hipoclorito de sodio al 8 % durante 12 minutos.
En la segunda desinfección (Figura 2) se varió las concentraciones de hipoclorito de sodio de 2 y 4% durante 7 minutos, después fueron enjuagadas tres veces con agua destilada dentro de la cámara de flujo laminar y se redujo de tamaño el explante de aproximadamente 2 cm de altura por 1 cm de diámetro, finalmente fueron sembradas en el medio de cultivo Murashige y Skoog (MS) (1962) con 2 mg L-1 BAP (bencil amino purina) + 1 mg L-1 ANA (ácido naftalen acético).
Para los explantes de plátano (Hartón) adicionalmente, al medio basal MS se suplementó con y sin un agente antimicrobiano denominado PPM (Plant Preservative Mixture) a una concentración de 0.5 ml L-1. Esta situación se consideró debido a que al realizar los cortes en campo de los hijuelos presentaban un líquido de color crema y algo fétido (ver Fig 1).
Por otra parte, los explantes de banano y plátano por presentar fenoles fueron repicados cada 15 días hasta la regeneración de un primordio foliar.
Durante esta fase se evaluó el porcentaje de contaminación fúngica y bacteriana, además del porcentaje de sobrevivencia y grado de oxidación. Para la inducción a la multiplicación in vitro, los brotes establecidos fueron sembrados en dos diferentes medios de cultivo (MC1=MS + 2.5 mg L-1 BAP + 1 mg L-1 ANA) y (MC2=MS + 5 mg L-1 BAP + 1 mg L-1 ANA). Las condiciones en las que permanecieron el cultivo dentro de la cámara de crecimiento tenía un fotoperiodo de 16/8 horas luz y oscuridad, una temperatura de 20±2ºC y una exposición lumínica e 1500 lux.
Para evaluar el efecto de los medios de cultivo en la multiplicación se realizó una prueba de T-student, con 12 repeticiones por tratamiento en el programa estadístico InfoStat versión 2018. Para las variables de porcentaje de sobrevivencia, contaminación y oxidación, fueron evaluadas en una tabla de frecuencias.
RESULTADOS Y DISCUSIÓN
Introducción de los explantes de banano y plátano a condiciones in vitro
En términos absolutos se evidenció que los explantes de banano de la variedad Enano gigante que fueron sometidos a 2 % de hipoclorito de sodio en la segunda desinfección presentaron 60 % de sobrevivencia, el porcentaje restante se contaminó con hongos y bacterias (Figura 3). Sin embargo, al incrementar la concentración al 4 %, presentaron un 80 % de explantes sin ninguna contaminación (Figura 4). Con respecto, a la respuesta obtenida de los explantes de plátano de la variedad Hartón que estuvieron expuestos a una concentración del 2 % de hipoclorito de sodio, en la segunda desinfección, todos presentaron contaminación bacteriana, mientras para una concentración del 4 % se obtuvo un 20 % de explantes sin contaminación.
En ambas variedades se observó que por la naturaleza del cultivo tienen tendencia a oxidarse (Figura 5) y este hecho también se incrementó debido a la aplicación del uso de altas concentraciones de hipoclorito (4 %) en la segunda desinfección.
Como medida para evitar la pérdida de los explantes establecidos se realizó epiques cada 15 días ya que, la oxidación es uno de los factores endógenos del material vegetal que afecta en establecimiento a condiciones in vitro. Al respecto, Jiménez (1999) señala que los fenoles son fitotóxicos durante el cultivo de tejidos y se constituyen en un serio problema para el cultivo in vitro. Si no se controlan los fenoles pueden provocar la muerte de los explantes. Para contrarrestar sus efectos e emplean sustancias antioxidantes como ácido cítrico y ascórbico, y carbón ctivado y se recomienda realizar refrescamiento de medio de cultivo.
El hipoclorito de sodio es un desinfectante común en la desinfección de explantes de bananos (Méndez et al., 1996; Muhammad et al., 2004). La doble desinfección es un método aplicado por varios investigadores, donde la primera desinfección está dado por una fuerte concentración o prolongada desinfección y seguido de una segunda desinfección a una reducción de la concentración o cambio de agente desinfectante (Rahman et al., 2004; Madhulatha et al., 2004).
En el presente estudio, los explantes de las variedades (Hartón y Enano gigante) fueron desinfectados por una doble desinfección, este procedimiento favorece a una desinfección más adecuada, ya que el material vegetal (cormos) se encuentra enterrada en el suelo y están expuestas a una mayor contaminación, por lo que es necesario aplicar una fuerte concentración (al 8 % de cloro comercial) y seguido de una desinfección reducida de acuerdo a lo recomendado por Torrico (2004). Esta combinación de desinfectante 8 y 4 % respectivamente en los explantes de banano favoreció en obtener 80 % de explantes establecidos en condiciones in vitro. Esto contrariamente al uso de altas concentraciones de cloro favorece en la oxidación ya que hipoclorito de sodio es un agente oxidante.
Para minimizar la contaminación los explantes durante la desinfección pueden ser tratados con fungicidas y antibióticos como sugieren Nandwani et al. (2000). Por ello en la variedad Hartón como resultado de la adición de PPM favoreció un 40 % de explantes desinfectados que sin la adición de este antimicrobiano. Para este caso, se empleó la desinfección combinada de 8 y 4% de hipoclorito de sodio espectivamente.
El PPM, es estable al calor, de amplio espectro biosida que reduce la contaminación microbiana en planta cultivos de tejidos (Guri y Patel, 1998). Los ingredientes activos en PPM incluyen metilisotiazolinona, cloruro de magnesio, magnesio nitrato, benzoato de sodio y sorbato de potasio. Juntos estas sales inorgánicas actúan atacando enzimas fundamentales específicos en el ciclo de transporte de electrones y la cadena de Krebs. PPM ha sido mostrado para inhibir el crecimiento de microorganismos, mientras que un mínimo efecto sobre la germinación de semillas in vitro de la mayoría de las especies de plantas ensayadas concentración oscila entre 0.5 y 4.0 ml L-1 (Guri y Patel, 1998).
La aplicación de PPM en plátano favoreció dos veces sin la contaminación, se considera que durante la colecta de los hijuelos se debe verificar que el campo donde crecen los cultivos no se encuentren anegados ya es un foco de infección para la proliferación principalmente de bacterias. Estos patógenos son los contaminantes más comunes y ocasionan serios problemas porque pueden ser sistémicas, así como difíciles de detectar y de eliminar (Leifert et al., 1994; Pérez 1998). Estos microorganismos escapan a los efectos de los esterilizantes superficiales y pueden ser inter o intracelulares.
Multiplicación in vitro
De acuerdo a los resultados obtenidos la prueba de T-students, presentó diferencias significativas y al realizar la prueba de comparación de medias se determinó que el medio de cultivo MS suplementado con (5 mg L-1 de BAP+ 1 mg L-1 ANA) favoreció en la formación de 8 brotes en banano y plátano. No obstante, a una menor concentración de BAP (2.5 mg L-1 + 1 mg L-1 ANA) se redujo la producción de brotes a 3±1 y 2±4. Similar patrón se presentó en cuanto al número de hojas, de la siguiente manera: a mayor concentración de BAP presentó mayor cantidad de hojas (19), a una menor concentración con 14 hojas en ambas variedades estudiadas. Con respecto, a la variable altura de brotes contrariamente en el medio con alta concentración de BAP se obtuvo menor altura y en el medio con mayor concentración de BAP, los brotes alcanzaron mayor longitud (Tabla 1).
Tabla 1 Número de hojas, altura de brote y número de brotes de las dos variedades en respuesta a los dos medios de cultivo empleados.
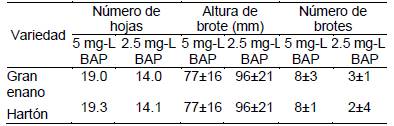
La formación de brotes (Figura 6) es muy variable en función al genotipo que se trabaje, en un estudio de Torrico (2004) en bananos de la variedad Gran enano obtuvo un promedio de 4.03 brotes por vitroplanta en el medio MS + 5 mg L-1 de BAP + 1 mg L-1 ANA. En esta misma concentración en banano en este estudio se duplicó la formación a 8 brotes.
En otros estudios, al incrementar la concentración de BAP de 1 a 3 mg L-1 en plátano bocadillo Musa acuminata, el número de brotes se incrementó de forma proporcional de 5 a 23 brotes, esta diferencia de brotes probablemente se deba a genotipos o variedades, a pesar de que ambas sean especies del mismo género, también presentaron un similar patrón en cuanto a la longitud del brote, mientras mayor es la concentración de BAP se reduce el tamaño de los brotes (Medina et al., 2015). Esta situación puede ser explicada a que BAP es una citocinina que promueve división celular e inhibe la elongación del mismo tal cual como indica (Pierik 1990). No obstante, en otra investigación al trabajar con el plátano Cuerno Gigante al aplicar de 1 a 2 mg L-1 el número de brotes fue muy similar de 1.52 a 1.74 (Chavarría y López, 2010).
CONCLUSIONES
El tratamiento adecuado para la desinfección de banano fue la combinacion de una primera desinfección 8 % de hipoclorito de sodio (NaClO) en una segunda desinfección con 4 % de NaClO que favoreció en obtener 80 % explantes establecidos en condiciones in vitro, sin embargo, en plátanos además de esta combinación fue necesaria la adición de 0.5 ml L-1 de PPM para obtener un 40 % de explantes desinfectados. Los brotes de la variedad Enano gigante (banano) presentaron una mejor respuesta en la formación de brotes (8±3) con la adición de 5 mg L-1 de BAP al igual que la variedad de plátano Hartón con 8±1.