Introducción
La tortuga chaqueña, Chelonoidis chilensis (Gray, 1870), también llamada peta chaqueña, una especie terrestre distribuida ampliamente en el territorio argentino y paraguayo, al igual que en el sur de Bolivia1, su caparazón, dividido en escudos denominados vertebrales (en número de 5), costales (4 pares), y marginales (11 pares)2.
Las tortugas frecuentemente presentan lesiones en su caparazón, por diversos motivos, como cortadoras de césped, vehículos o mordeduras de depredadores, ya sean perros, zorros o ratas3-6. En casos de mordedura de perro, la presentación clínica puede ser diversa, y variar desde abrasiones en el escudo, hasta grietas, fracturas por compresión o la pérdida de partes enteras del caparazón como sus márgenes, exponiendo superficies óseas e incluso vísceras7.
En casos que involucran pérdida de tejido, que produjo la separación de la piel y caparazón, se utilizó exitosamente, la sutura del caparazón, mediante ganchos adheridos7,8.
El propóleo, una resina natural de origen vegetal, colectada por abejas melíferas (Apis mellifera) como material de construcción y protección de la colmena, utilizada por miles de años en la medicina tradicional, con actividad antibacteriana y antifúngica, previniendo e inhibiendo la proliferación de patógenos9. Utilizada durante la fase proliferativa de la cicatrización, no solo tiene efectos antiinflamatorios, sino también, aumenta la capacidad de proliferación, activación y síntesis de fibroblastos, acelerando de esta forma el proceso de cicatrización10.
El propóleo reduce la respuesta inflamatoria aguda, fase en la cual hay neutrófilos en el sitio de la lesión, que en grandes cantidades pueden producir necrosis y daños en el tejido, que a su vez retrasan el proceso de cicatrización10. Al reducir la cantidad de neutrófilos en el sitio lesionado, la proliferación de fibroblastos inicia más temprano, permitiendo una epitelización más acelerada10. Comparando los efectos antibacterianos, antiinflamatorios y antioxidantes obtenidos con la utilización del propóleo en trabajos in vitro, no siempre se logran los mismos efectos in vivo, por las diferencias anatómicas y fisiológicas entre distintas especies animales, no siempre son consideradas al intentar reproducir los hallazgos del laboratorio en un ambiente clínico9. Los reportes sobre la utilización de propóleo para el tratamiento de heridas en tortugas son aún anecdóticos, y es por ese motivo que resulta importante reportar las experiencias en especies nativas. El objetivo del presente reporte fue describir la resolución de traumatismo por mordedura de perro en 2 tortugas chaqueñas (C. chilensis) utilizando tintura de propóleo al 20 %.
Descripción de los casos clínicos
Caso 1. Se presentó al consultorio un ejemplar de tortuga chaqueña, C. chilensis, hembra, adulta, con un peso de 660 g y condición corporal 3/5. Según refirió la tutora, la paciente fue atacada por un canino doméstico, al menos, 12 h, antes de la consulta.
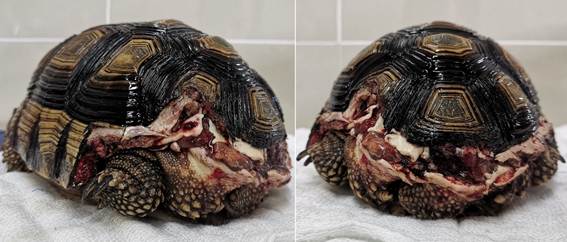
A la inspección clínica se constató la fractura del caparazón en la porción caudal, involucrando la pérdida de tejido óseo a partir del 7mo escudo marginal, de ambos lados, al igual que una significativa porción del 4to escudo costal del lado izquierdo. Se pudo observar la exposición de tejido conectivo (celoma) y musculatura de la zona (Figura 1), mostrándose el tejido con buena vitalidad.
El tejido óseo expuesto del caparazón presentaba escaso desarrollo, sugerente de enfermedad ósea metabólica. Esto último coincide con que la paciente fue alimentada a base de lechuga, tomate y pepino durante más de 10 años.
Se realizó la contención química, utilizando midazolam a 1.5 mg/kg por vía intramuscular (IM)11, debido a que la paciente se encontraba retraída en el caparazón. Se realizó la anestesia local con lidocaína al 1 %, tópica e infiltración local. Una vez relajado el animal, se colocó un acceso intraóseo en el escudo gular con una aguja 21 G, previa antisepsia con alcohol al 98 %, procediéndose a su hidratación con suero Ringer lactato a razón de 20 mL/kg/día, durante 48 h. Se realizó una limpieza profusa de las lesiones con clorhexidina al 0.5 % + glicerina al 4 % (Clorhpet® P’ludos®, Iris SAIC) y solución fisiológica, removiendo con un cepillo suave los contaminantes superficiales.
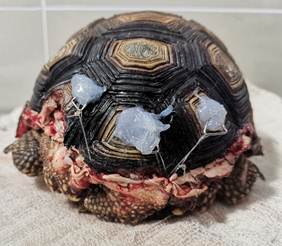
Se fijaron 3 ganchos al caparazón con resina epoxi, buscando puntos intermedios en donde fijar la piel. Caudal a cada gancho se realizaron suturas de aproximación con poliamida 0.30 mm, entre la piel y los ganchos, tratando de evitar una tensión excesiva entre los mismos (Figura 2).
Se instauró como tratamiento antibiótico cefotaxima a dosis de 40 mg/kg, por vía IM, cada 24 h durante 10 días11 acompañado de tramadol a 8 mg/kg, por vía IM, cada 48 h, durante 10 días11,12. Los espacios abiertos entre piel y caparazón fueron tratados cada 24 h, con clorhexidina al 0.5 % + glicerina al 4 % (Clorhpet® P’ludos®, Iris SAIC), durante 15 días, y cubiertos con tintura de propóleo al 20 % (extracto isopropílico) cada 48 h, durante 20 días.
La paciente fue mantenida en un ambiente reducido, sobre una superficie de papel diario, durante todo el periodo de evaluación (5 semanas). Las variables atmosféricas no fueron manipuladas para el tratamiento del animal, registrándose durante el periodo de evaluación un promedio de temperatura de 27° C durante el día y 15° C en la noche.
Se procedió con alimentación forzada, utilizando una sonda rígida de 12 G, realizada sobre la base de la tasa metabólica de mantenimiento (TMM) en tortugas terrestres, utilizando la siguiente fórmula: TMM = K x P0.75, siendo K la constante (32 en tortugas) y P el peso del animal4. Así, se administraron 24 kcal/día, cada 48 h, 2 veces.
A las 72 h del procedimiento se retiró el catéter intraóseo. La paciente fue colocada en baños de agua durante 60 min, cada 72 h, ingiriendo agua con normalidad desde el primer día, y se pudo constatar la primera ingesta voluntaria a los 5 días. Posteriormente, la paciente se alimentaba regularmente de nopal (Opuntia sp.), zapallo hervido (Cucurbita sp.) y alimento comercial para tortugas terrestres.
Caso 2. Se presentó al consultorio un ejemplar de tortuga chaqueña, C. chilensis, macho, adulto, con un peso de 520 g, condición corporal 2/5. Se percibe un cuadro de deshidratación aproximado del 8 %, sugerente debido al hundimiento de los ojos. Según refirió la tutora, el paciente fue atacado por un canino doméstico de raza Dogo Argentino, aproximadamente 1 h antes de la consulta.
A la inspección clínica se constató la fractura del caparazón en la porción caudal, involucrando la pérdida de los escudos marginales 10 y 11 del lado derecho, una porción del 9no escudo marginal del lado izquierdo, la pérdida del escudo anal del caparazón, y el desprendimiento del 11vo escudo marginal del lado izquierdo, que se mantenía adherido a la musculatura. Se pudo observar la exposición de musculatura de la zona (Figura 3), mostrándose el tejido con buena vitalidad.
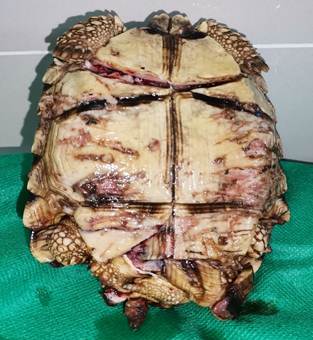
A la inspección del plastrón, se constató la pérdida de continuidad ósea en la unión entre los escudos humerales y pectorales, fractura y hundimiento del escudo femoral derecho, pérdida del escudo anal derecho, y pérdida de continuidad ósea entre los escudos femoral y anal del lado izquierdo (Figura 4).
Se realizó la contención química utilizando ketamina a dosis de 30 mg/kg y midazolam a dosis de 1.5 mg/kg por vía IM11, debido a que el paciente se encontraba retraído en el caparazón. Se utilizaron como analgésicos tramadol a dosis de 10 mg/kg y meloxicam a dosis de 0.1 mg/kg IM11. Posterior a su relajación, luego de 30 min, se aseguró el acceso vascular en la vena yugular derecha con un catéter 24 G, y se inició la fluido terapia con suero Ringer con lactato. Se colocó una sonda gastro-esofágica K30 mediante esofagostomía4,13, para la administración de alimentos. Se procedió a la anestesia local en las lesiones de tejido blando, con lidocaína al 1 %, tópica e infiltración local. Se realizó una limpieza profusa de las lesiones con clorhexidina al 0.5 % + glicerina al 4 % (Clorhpet® P’ludos®, Iris SAIC) y solución fisiológica, removiendo con un cepillo suave los contaminantes superficiales.

Figura 5 Utilización de resina epoxi y ganchos fijados al caparazón para realizar sutura de aproximación
En el caparazón caudal, se aproximó el escudo marginal desprendido y se fijaron 3 ganchos al caparazón con resina epoxi. Caudal a cada gancho se realizaron suturas de aproximación con poliamida 0.30 mm, entre la piel y los ganchos, intentando cubrir el tejido muscular mediante colgajos de piel (Figura 5).
En el plastrón, se aproximaron los fragmentos óseos fracturados, inmovilizándolos con resina epoxi. Se fijó un gancho en la resina epoxi colocada sobre los escudos femorales. Caudal al gancho se realizaron 2 suturas de aproximación con poliamida 0.30 mm, entre la piel y el gancho, intentando cubrir el tejido muscular, reduciendo el espacio muerto (Figura 6).

Figura 6 Aproximación e inmovilización de1 fragmentos óseos, y sutura de aproximación sobre tejido muscular expuesto
Se instauró como tratamiento antibiótico cefotaxima a dosis de 40 mg/kg, por vía IM, cada 24 h, durante 10 días11 acompañado de meloxicam a 0.1 mg/kg11, por vía IM, cada 24 h, durante 4 días, y tramadol a 10 mg/kg, por vía IM, cada 48 h, durante 10 días11,12. Los espacios abiertos entre piel y caparazón/plastrón fueron tratados cada 24 h, con clorhexidina al 0.5 % + glicerina al 4 % (Clorhpet® P’ludos®, Iris SAIC), durante 10 días, y cubiertos con tintura de propóleo al 20 % (extracto isopropílico) cada 48 h, durante 30 días.
La fluido terapia se mantuvo a razón de 20 mL/kg/día como mantenimiento, sumado a 14 mL/día como reposición de déficit, durante 72 h, posterior a las cuales se retiró el catéter intravenoso. El paciente fue colocado en baños de agua durante 30 min, mostrándose muy incómodo dentro del agua, por lo cual se decidió hacerlo cada 5 días.
El paciente fue mantenido en un ambiente reducido, sobre una superficie de papel diario, durante todo el periodo de evaluación (5 semanas). Las variables atmosféricas no fueron manipuladas para el tratamiento del animal, registrándose durante el periodo de evaluación un promedio de temperatura de 34.4° C durante el día y 21.5° C en la noche.
Se procedió a la alimentación forzada utilizando la sonda gastro-esofágica, realizada sobre la base de la TMM en tortugas terrestres, utilizando la siguiente fórmula: TMM = K x P0.75, siendo K la constante (32 en tortugas) y P el peso del animal4. Así, se administraron 20 kcal/día, cada 24 h, durante 17 días, acompañado de agua mineral. La primera ingesta voluntaria se pudo constatar al día 18, posteriormente alimentándose regularmente de nopal (Opuntia sp.) y papaya (Carica papaya).
Resultados
En el caso 1, a los 15 días de evaluación se percibió buena adherencia de la piel al tejido subcutáneo, presentando aún hipersensibilidad a la manipulación de la zona afectada. A las 5 semanas se retiraron las suturas, se constató la adhesión del tegumento y estabilidad de la herida (Figura 7). A la evaluación posterior, la remoción de suturas, la paciente no presentaba signos compatibles con dolor14, desenvolviéndose con normalidad. En ningún momento durante el periodo de evaluación se observaron exudados sero-hemorrágicos o purulentos, cambios de coloración de la piel circundante, ni presencia de olores indicativos de necrosis.
En el caso 2, se retiraron las suturas a las 5 semanas, se constató la adhesión del tegumento y estabilidad de las heridas (Figura 8 y 9). A la evaluación posterior a remoción de suturas, el paciente presentaba cojera del lado derecho, pudiendo asociarlo al dolor14. En ningún momento durante el periodo de evaluación se observaron exudados sero-hemorrágicos o purulentos, cambios de coloración de la piel circundante, ni presencia de olores indicativos de necrosis.
Discusión
El tiempo de resolución de las heridas en tortugas varía dependiendo de su estado nutricional, temperatura ambiental, la presencia de cuerpos extraños o fluidos en la herida, e infección15, razón por la cual resultó importante realizar un acompañamiento nutricional a los pacientes, además del tratamiento medicamentoso, e intentar mantener a los animales dentro de un rango de temperatura óptimo para su especie, denominado POTZ, por sus siglas en inglés (preferred optimal temperature zone, o rango de temperatura óptima preferida). Si bien, en general, se menciona un tiempo de cicatrización de entre 6 y 8 semanas antes de retirar las suturas16,17, las heridas en los 2 pacientes tratados evolucionaron de manera acelerada, logrando una buena adhesión de la piel a las 5 semanas.
Las heridas en tortugas forman una costra seca, persistente sobre el lecho de la herida, y la curación se caracteriza por la epitelización bajo la costra con disminución del espesor de la dermis que se va recuperando lentamente, prolongándose la fase de inflamación hasta 28 a 42 días, mientras que la proliferación del tejido conectivo y su remodelación no se produce de manera clara antes de 42 a 135 días, considerándose curada recién cuando se desprende la costra y la piel que queda expuesta está completamente epitelizada16.
La reducción en el tiempo en comparación a los reportes de otros países podría deberse a que el propóleo acelera el proceso de reparación del tejido por la proliferación de fibroblastos y aceleración de la transformación de fibrocito a fibroblasto, favoreciendo la síntesis y deposición de fibras de colágeno18. El propóleo también incrementa la expresión de varios genes promotores de la cicatrización de heridas, como el factor de crecimiento de fibroblastos 18 (FGF-18) y el factor de crecimiento vascular endotelial A (VEGF-A)10. Se han descrito casos exitosos de cicatrización mediante la utilización de propóleo a distintas concentraciones en especies como cabras18, cérdos19, caninos20,21, conejos22, cuyes23, ratas24, incluso en humanos25. La mayoría de los estudios in vivo sobre distintas heridas sugieren efectos benéficos sobre la cicatrización, sin embargo, aún existe poca información sobre la dosis y efectos secundarios del propóleo en las heridas9.
La miel también ha sido utilizada ampliamente en el manejo de heridas cutáneas en animales silvestres, particularmente tortugas y aves15, ya sea porque promueve el proceso de cicatrización, como también por sus propiedades antibacterianas15,17. Se ha reportado, además, un efecto sinérgico de la miel de abeja con el propóleo en un estudio sobre cicatrización de heridas cutáneas en ratas26.
En casos como los descritos, se podría considerar la utilización de sulfadiazina de plata al 1 %, por su capacidad de penetrar tejidos necróticos y estimular la epitelización, como también hidrogeles e hidrocoloides, que ayudan a mantener la humedad de la herida y facilitan la debridación autolítica15. Un estudio de cicatrización, por segunda intención en tortugas reporta que la administración tópica de insulina mejora la cicatrización de las heridas, acortando el tiempo necesario para la epitelización completa27.
Para la reparación de lesiones, como las reportadas en el presente trabajo, se sugiere la administración de anestésicos y analgésicos por vía intratecal28, pero la técnica requiere un mayor nivel de experiencia. También se podría considerar la administración de tramadol por vía oral, que han reportado buenos niveles de analgesia en tortugas29, aprovechando la utilización de sondas para la alimentación forzada.











 texto en
texto en 
 uBio
uBio