Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista CON-CIENCIA
Print version ISSN 2310-0265
Rev.Cs.Farm. y Bioq vol.8 no.2 La Paz Nov. 2020
ARTÍCULOS ORIGINALES
Validación del método analítico por cromatografía líquida de alta resolución
para la cuantificación de conservantes en jugo de naranja
Validation of the analytical method by liquid chromatography of high resolution for the
quantification of preservatives in orange juice
Myriam Lina Trigo Orsini 1![]() , Elba Amalia Aban Aramayo*
, Elba Amalia Aban Aramayo*![]()
1 Jefe de Laboratorio Control de Calidad de Medicamentos y Biodisponibilidad del Instituto de Servicios de Laboratorio
de Diagnostico e Investigación en Salud – SELADIS, Universidad Mayor de San Andrés, Av. Saavedra 2224.
La Paz, Bolivia. mylitrigo@gmail.com
* Tesista de post grado Laboratorio Control de Calidad de Medicamentos y Biodisponibilidad del Instituto de Servicios de
Laboratorio de Diagnostico e Investigación en Salud – SELADIS, Universidad Mayor de San Andrés,
Av. Saavedra 2224. La Paz, Bolivia
Fecha de recepción: 25 Septiembre 2020 Fecha de aceptación: 18 Octubre de 2020
Resumen
Introducción: La validación es el establecimiento de la evidencia documental de que un procedimiento analítico conducirá, con un alto grado de seguridad a la obtención de resultados precisos y exactos dentro de las especificaciones y los atributos de calidad previamente establecidos.
Objetivo: Validar el método analítico por Cromatografía Líquida de Alta Resolución para la cuantificación de conservantes en jugo de naranja.
Métodos: El método fue validado siguiendo los parámetros referidos en la USP 40 – NF 35: Especificidad, Linealidad, Precisión (Repetibilidad Instrumental, Repetibilidad del Método y Precisión Intermedia) y Exactitud.
Resultados: El método analítico propuesto es Selectivo/Específico, presenta una excelente linealidad dentro del rango de 100 a 1000 ppm, la Precisión presentó resultados de CV < 2% siendo óptimos. La recuperación se encuentra entre 97 a 102% demostrando excelente exactitud.
Conclusión: Se cumplieron todos los parámetros y criterios de validación por lo tanto el método es específico, selectivo, lineal en el intervalo de concentraciones de 100 a 1000 ppm, sensible, preciso, reproducible y exacto.
Palabras clave: Validación, Cromatografía Líquida de Alta Resolución, conservantes, jugo de naranja
Abstract
Introduction: Validation is the establishment of documentary evidence that an analytical procedure will lead, with a high degree of security, to obtaining precise and exact results within the specifications and previously established quality attributes.
Objective: Validate the analytical method by High Resolution Liquid Chromatography for the quantification of preservatives in orange juice.
Methods: The method was validated following the parameters referred to in USP 40 - NF 35, they are Specificity, Linearity, Precision (Instrumental Repeatability, Repeatability of the Method and Intermediate Precision) and Accuracy.
Results: The proposed analytical method is Selective / Specific, it presents an excellent linearity within the range of 100 to 1000 ppm, the Precision presented results of CV <2% being optimal. The recovery is between 97 to 102% showing excellent accuracy.
Conclusion: All the parameters and validation criteria were met, therefore the method is specific, selective, linear in the concentration range of 100 to 1000 ppm, sensitive, precise, reproducible and exact.
Keywords: Validation, High Resolution Liquid Chromatography, preservatives, orange juice
INTRODUCCIÓN
La validación es el establecimiento de la evidencia documental de que un procedimiento analítico conducirá, con un alto grado de seguridad a la obtención de resultados precisos y exactos dentro de las especificaciones y los atributos de calidad previamente establecidos. (A.E.F.I., 2001)
Cuando se trata de un método empleado tradicionalmente por el laboratorio que no esté normalizado, se puede realizar una Validación Retrospectiva, es decir, en base a los datos experimentales que el laboratorio dispone, para la cual se realizará la recopilación de la mayor cantidad de datos históricos disponibles, para luego realizar un proceso de ordenamiento y selección de los datos recopilados, estos datos pueden ser: curvas de calibración, resultados de ensayos, cartas de control, ensayos de aptitud, etc. A través de estos, se deberán determinar los parámetros de validación, y evaluar si los resultados obtenidos para los fines de la metodología son aceptables. En caso de ser un método nuevo (o uno antiguo del que no se dispongan de datos suficientes) se debe realizar una Validación Prospectiva, generando a través de análisis datos experimentales. (ISPCH, 2010)
Parámetros para la Validación. Los requisitos varían desde determinaciones analíticas muy rigurosas hasta evaluaciones subjetivas de atributos. Considerando esta amplia variedad, es lógico que diferentes procedimientos de prueba requieran diferentes esquemas de validación. Según la USP 40-NF 35 los parámetros a evaluar son: Especificidad, Linealidad, Precisión y Exactitud.
SELECTIVIDAD / ESPECIFICIDAD
La selectividad es el grado en que un método puede cuantificar el analito con precisión en presencia de interferentes. Idealmente, la selectividad debería evaluarse para todos los interferentes importantes susceptibles de estar presentes. (Resolución OIV - OENO 8/2005)
La especificidad es la capacidad de evaluar inequívocamente el analito en presencia de componentes que se puede esperar que estén presentes. (ICH Tema Q2, 1995)
LINEALIDAD Y RANGO DE ANÁLISIS
La linealidad es la capacidad de un método de análisis, dentro de un determinado intervalo, de dar una respuesta o resultados instrumentales que sean proporcionales a la cantidad del analito que se habrá de determinar en la muestra de laboratorio. (ISPCH, 2010)
El rango de análisis se define como el intervalo entre la concentración superior e inferior de analito para el cual se ha demostrado la correcta precisión, exactitud y linealidad del método descrito. (A.E.F.I., 2001)
PRECISIÓN
La precisión de un procedimiento analítico expresa el grado de dispersión entre una serie de mediciones obtenidas de muestras múltiples de la misma muestra homogénea bajo las condiciones prescritas. La precisión se puede considerar a tres niveles: repetibilidad, precisión intermedia y reproducibilidad. ![]() (ICH Tema Q2, 1995)
(ICH Tema Q2, 1995)
Repetibilidad. Es la precisión bajo las condiciones de repetibilidad, es decir, condiciones donde los resultados de análisis independientes se obtienen con el mismo método, en ítems de análisis idénticos, en el mismo laboratorio, por el mismo operador utilizando el mismo equipamiento dentro de intervalos cortos de tiempo. (ISPCH, 2010)
Repetibilidad Instrumental. Este parámetro estudia la variabilidad debida únicamente al instrumento y se determina analizando repetidamente una misma muestra de forma consecutiva de 6 a 10 veces. (A.E.F.I., 2001)
Repetibilidad del Método. La repetibilidad del método, en donde se evaluará la variabilidad en la medición de una serie de tomas obtenidas a partir de una muestra homogénea, que se analiza independientemente, desde el principio hasta el final, por el mismo instrumento y el mismo analista. (Reyes Fuentes, 2013)
Precisión Intermedia
Estudia la variabilidad del método efectuando una serie de análisis sobre la misma muestra, pero en condiciones operativas diferentes (diferentes analistas, aparatos, días, etc.) y en un mismo laboratorio.(A.E.F.I., 2001)
Reproducibilidad. Estudia la variabilidad de los resultados inter-laboratorio. El objetivo de este estudio es verificar que el método de análisis proporciona los mismos resultados en diferentes laboratorios. (A.E.F.I., 2001)
EXACTITUD
La exactitud de un procedimiento analítico expresa el grado de concordancia entre el valor que se acepta ya sea como un valor verdadero convencional o un valor de referencia aceptado y el valor encontrado. (ICH Tema Q2, 1995)
MATERIALES Y MÉTODOS
MUESTRA: Las muestras utilizadas se constituyeron en jugo de naranja natural, que fueron fortificadas con los analitos a diferentes niveles de concentración de acuerdo a los requerimientos de Validación.
MATERIALES: Todos los materiales de vidrio fueron: Clase A.
EQUIPOS: balanza analítica SARTORIUS, baño maría STUART, baño ultrasónico GT SONIC, destilador de agua POBEL y sistema de purificación de agua Aqua MAX marca YOUNGLIN.
REACTIVOS: Benzoato de Sodio y Sorbato de Potasio (materia prima), Hexacianoferrato de potasio trihidratado MERCK, Sulfato de zinc heptahidratado SIGMA, Fosfato dibásico de potasio BAKER, Dihidrógeno fosfato de potasio MERCK, Metanol grado HPLC MERCK, Ácido fosfórico 5% y Agua ultrapura.
CONDICIONES CROMATOGRÁFICAS: Corrida isocrática en Cromatógrafo Líquido de Alta Resolución AGILENT TECNOLOGIES 1260 Infinity II con inyector automático y Detector con Arreglo de Diodos a 232 nm, columna C18 Agilent modelo ZORBAX Eclipse XDB – C18 de 4,6 mm de diámetro interno × 150 mm de longitud y volumen de inyección de 20 mL. La Fase Móvil fue una mezcla de Tampón fosfato:Metanol (95:5) pH 6,6 a flujo de 1,2 mL/min y horno a temperatura ambiente.
PREPARACIÓN DEL ESTÁNDAR (PRINCIPIO ACTIVO)
Se pesaron los dos conservantes y disolvieron con agua ultrapura a la concentración requerida de cada parámetro.
PREPARACIÓN DE LAS MUESTRAS (PRINCIPIO ACTIVO + MATRIZ)
Se midió 5 mL de muestra líquida en un matraz aforado de 50 mL, se disolvió con 10 mL de agua ultrapura y se llevó a baño maría a 60˚C por 30 minutos, una vez frio se llevó a baño ultrasónico por 10 minutos.
Se agregaron 5 mL de reactivo de Carrez I y 5 mL de reactivo de Carrez II sucesivamente, se enrasó y se agitó vigorosamente, posteriormente se filtró la solución a través de papel filtro y por último el líquido filtrado se pasó por un filtro de jeringa al vial del equipo.
VALIDACIÓN DEL MÉTODO ANALÍTICO
ESPECIFICIDAD / SELECTIVIDAD: Se prepararon 6 muestras (Principio Activo + Matriz) y 6 estándares (Principio Activo) por separado a la concentración media determinada de 500 ppm.
LINEALIDAD Y RANGO DE ANÁLISIS: Se prepararon 15 Muestras (Principio Activo + Matriz) a 5 niveles de concentración (100, 300, 500, 800 y 1000 ppm) con 3 réplicas por nivel.
PRECISIÓN
Repetibilidad Instrumental: Se preparó 1 estándar (Principio Activo) a concentración de 500 ppm y se realizaron 6 lecturas sobre el mismo vial.
Repetibilidad del Método: Se prepararon 9 Muestras (Principio Activo + Matriz) a 3 niveles de concentración (100, 500 y 1000 ppm) y 3 réplicas por nivel.
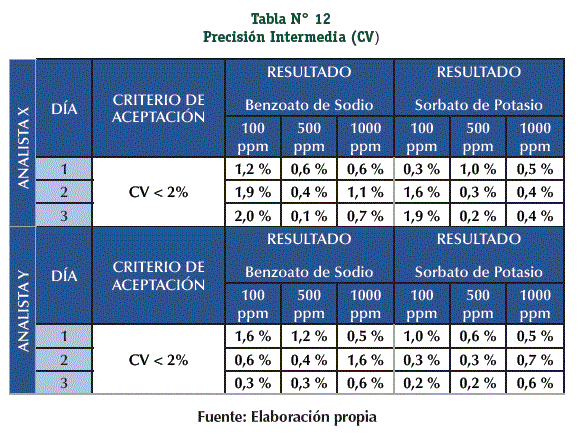
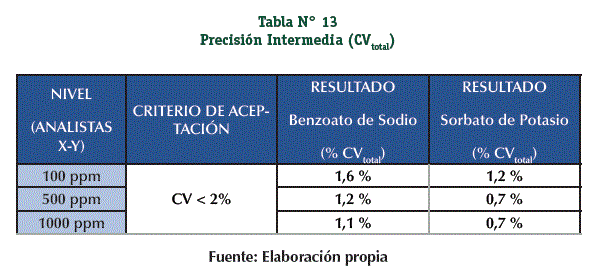
Precisión Intermedia: La realizaron 2 diferentes analistas (Analista X – Analista Y) preparando cada uno 9 Muestras (Principio Activo + Matriz) a 3 niveles de concentración (100, 500 y 1000 ppm) con 3 réplicas por nivel, el ensayo se realizó en 3 días diferentes.
EXACTITUD: Se prepararon 9 estándares (Principio Activo) y 9 muestras (Principio Activo + Matriz) a 3 niveles de concentración (100, 500 y 1000 ppm) y 3 réplicas por nivel.
RESULTADOS
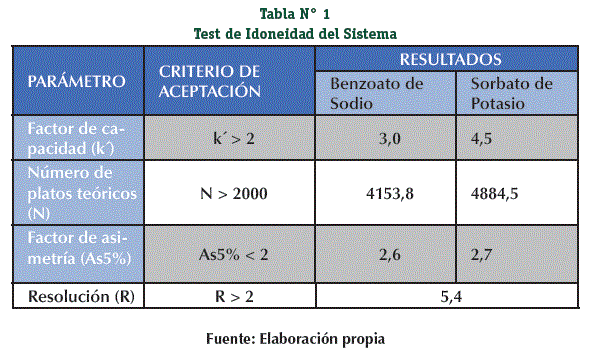
Los resultados de los parámetros del Test de Idoneidad del Sistema (con excepción del Factor de asimetría) se encuentran dentro de los criterios de aceptación, el sistema cromatográfico es idóneo. (Tabla N° 1)
SELECTIVIDAD / ESPECIFICIDAD
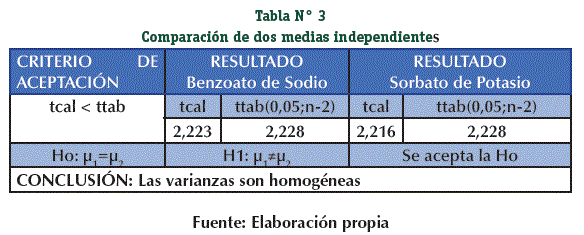
Para determinar que las Varianzas son homogéneas se realiza la prueba de F de Fisher, cumpliendo el criterio de aceptación. (Tabla N° 2)
Comprobada la homogeneidad de varianzas se realiza la prueba de t de Student con una probabilidad del 5% demostrando que no existe diferencia significativa en la determinación del principio activo, se realice en presencia o no de la matriz empleada. (Tabla N° 3)
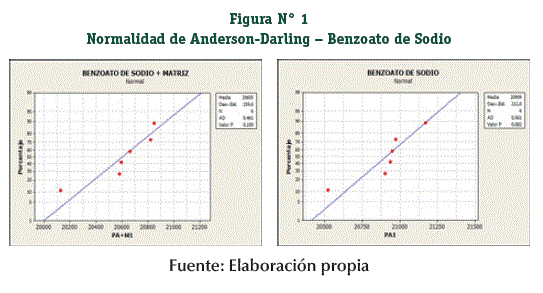
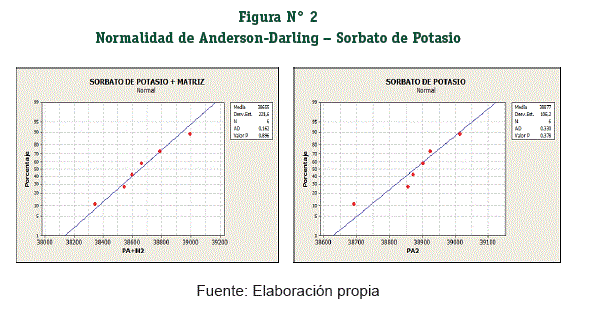
Se comprobó el supuesto de la Normalidad de los grupos muestrales con la prueba de Anderson – Darling (Figuras N° 1 y 2), donde los resultados son P ≥ 0,05 se acepta el supuesto de la Normalidad en todos los grupos muestrales. (Tabla N° 4)
LINEALIDAD Y RANGO DE ANÁLISIS
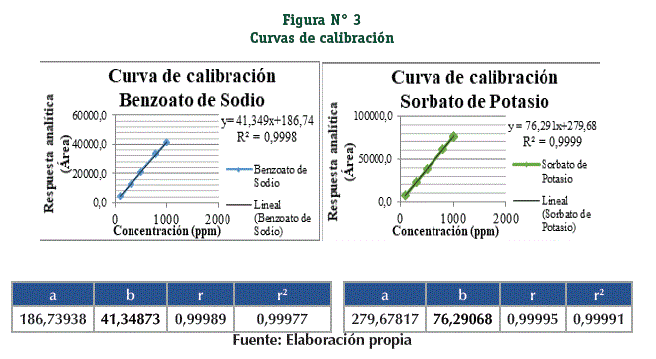
Las curvas de calibración obtenidas al graficar el área integrada contra la concentración de las muestras se presentan en la Figura N° 3. El intervalo evaluado fue de 100 – 1000 ppm.
Se determina el coeficiente de variación de los factores respuesta que expresan la relación entre el área y la concentración, cumpliendo el criterio de aceptación. (Tabla N° 5)
Se aplica el test de Cochran para determinar que las varianzas no sean diferentes con un grado de significación de α = 0,05 cumpliendo con el criterio de aceptación. (Tabla N° 6)
Se realiza la prueba de significación estadística de la desviación estándar de la pendiente, comprobando que la pendiente es estadísticamente diferente de cero para un grado de significación α igual a 0,05. (Tabla N° 7)
Se realiza el test de proporcionalidad comprobando que la ordenada es estadísticamente igual a cero para un grado de significación t de Student (n-2; α = 0,05). (Tabla N° 8)
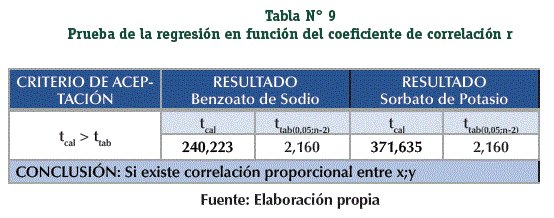
Se demostró la relación de proporcionalidad entre los valores de la concentración (x) y las respuestas analíticas (y) de la recta con la prueba t de Student (n-2; α = 0,05). (Tabla N° 9)
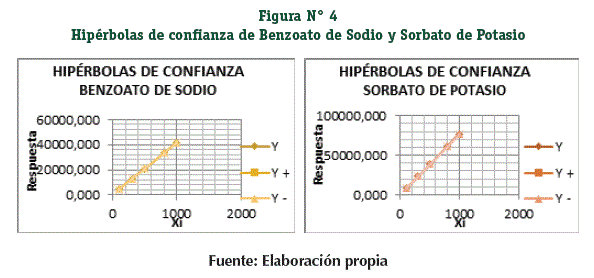
Las hipérbolas de confianza (Figura N° 4) nos indican que todo el sistema (analistas, equipo, condiciones ambientales, materiales volumétricos, reactivos, etc.) funcionan de manera que no interfiere en la interacción: la concentración (x) y respuesta analítica (y).
PRECISIÓN
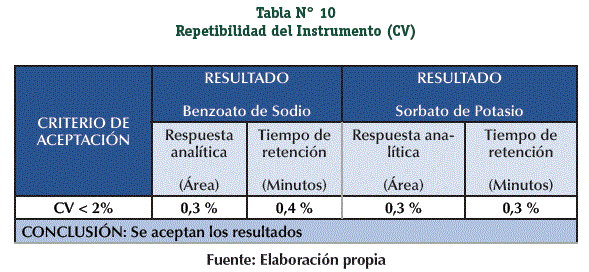
Los resultados obtenidos cumplen con el criterio de aceptación, demostrando que existe repetibilidad del instrumento en respuesta analítica y en tiempo de retención. (Tabla N° 10)
Los resultados obtenidos cumplen con el criterio de aceptación, demostrando que el método analítico es Repetible. (Tabla N° 11)
Se acepta la Precisión Intermedia, todos los datos obtenidos (el resultado total y los resultados independientes) cumplen con el criterio de aceptación (Tablas N° 12 y 13)
EXACTITUD
Se determinó por el test de G de Cochran la igualdad de varianzas con un α = 0,05 cumpliendo con el criterio de aceptación. (Tabla N° 14)
Para confirmar la recuperación media de %R = 99,2 ± 1,1 para el Benzoato de Sodio y %R = 99,3 ± 1,1 del Sorbato de Potasio se realiza el test t de Student también con una probabilidad de α = 0,05. (Tabla N° 15)
CONCLUSIONES
El método analítico por Cromatografía Líquida de Alta Resolución para la cuantificación de conservantes en jugo de naranja es específico, selectivo, lineal en el intervalo de concentraciones de 100 a 1000 ppm, sensible, preciso, reproducible y exacto, cumpliéndose con los criterios de validación y por lo tanto se puede adoptar fácil y cómodamente como método de control de calidad rutinario.
• Se determinó que el método analítico es específico, evidenciándose que la matriz no ejerce ningún efecto durante el desarrollo de la cuantificación, el método permite identificar los conservantes de manera clara e inequívoca.
• Se estableció que el método analítico desarrollado es lineal en el intervalo de concentración estudiada, desde 100 a 1000 ppm demostrando que existe una relación entre la concentración de los conservantes y el área de respuesta analítica y que el método puede ser aplicado con un alto grado de sensibilidad.
• Se comprobó que el método es preciso. Los resultados obtenidos para la precisión del sistema instrumental y del método fueron satisfactorios. La precisión intermedia no presentó variaciones frente al cambio de condiciones operativas.
• Se estableció que el método presenta excelente exactitud, obteniéndose los valores dentro del límite establecido por el Codex Alimentarius que va de 95% a 105%.
REFERENCIAS BIBLIOGRAFÍCAS
A.E.F.I., A. E. (2001). Validación de métodos analíticos. [ Links ]
CODEX ALIMENTARIUS, C. (2015). COMISIÓN DEL CODEX ALIMENTARIUS, Manual de Procedimiento. Roma. [ Links ]
CODEX STAN 192-2007. (s.f.). Norma general del CODEX para los aditivos alimentarios. [ Links ]
CODEX STAN 247-2005. (s.f.). NORMA GENERAL DEL CODEX PARA ZUMOS (JUGOS) Y NÉCTARES DE FRUTAS. [ Links ]
EURACHEM. (2016). La Adecuación al Uso de los Métodos Analíticos. España: euroLab . [ Links ]
Faife López, A. (2009). Validación del método Analítico por Cromatografía Líquida de Alta Presión para la cuantificación de Mupirocina 2% ungüento en Laboratorio Ceguel en el periodo comprendido de mayo a noviembre. Managua - Nicaragua. [ Links ]
Garcia Roche, M. O. (1991). ACCIÓN, USO, ANÁLISIS Y TOXICIDAD DE LOS ADITIVOS ALIMENTARIOS. Valencia, Venezuela: EGN Comunicaciones s.r.l. [ Links ]
ICH Tema Q2. (1995). NOTA DE EXPLICACIÓN DE VALIDACIÓN PROCEDIMIENTOS DE ANALÍTICOS: TEXTO Y METODOLOGÍA. [ Links ]
INT-R03.3170-004. (2014). Validación de metodologías analíticas. [ Links ]
ISPCH, G. T. (2010). Validación de métodos y determinación de la incertidumbre de la medición: "Aspectos generales sobre la validación de métodos". Santiago. [ Links ]
OGA-GEC-016. (2007). Política de Selección y Validación de Métodos de Ensayo. Guatemala. [ Links ]
Quattrocchi, O. A. (1992). Introducción a la HPLC Aplicación y Práctica. Buenos Aires: Artes Gráficas Farro SA. [ Links ]
Resolución OIV - OENO 8/2005. (s.f.). RECOMENDACIONES ARMONIZADAS PARA LA VALIDACIÓN DE MÉTODOS DE ANÁLISIS EN UN SOLO LABORATORIO. Paris.
Reyes Fuentes, Y. M. (2013). Validación de la metodología analítica para la valoración de Calcitonina de salmón mediante Cromatografía líquida de alta eficiencia . Valdivia, Chile. [ Links ]
SERNAC, S. N. (2004). Aditivos alimentarios: Definiciones básicas e información para un uso responsable. Chile. [ Links ]
USP 40-NF 35. (2017). Farmacopea de los Estados Unidos de America (Vol. 1). [ Links ]
Volonté, M. G., & Quiroga, P. (2013). Análisis Farmacéutico. Buenos Aires, Argentina: Editorial de la Universidad de La Plata. [ Links ]