Revista CON-CIENCIA
versão impressa ISSN 2310-0265
Rev.Cs.Farm. y Bioq vol.3 no.1 La Paz jul. 2015
ARTÍCULOS DE INVESTIGACIONES FACULTATIVOS DOCENTE
Comparación del rendimiento del medio de cultivo Löwenstein-Jensen in house y Löwenstein-Jensen comercial, para el aislamientos de Mycobacterium tuberculosis de pacientes con tuberculosis pulmonar
PARISACA MAMANI, SANDRA1 BAUTISTA, ANGELA2 VASQUEZ MICHEL, ANETH1
1 Laboratorio de Microbiología Molecular, Instituto SELADIS, Fac. Cs. Farmacéuticas y Bioquímicas-UMSA.
2 Laboratorio Departamental de Control de la Tuberculosis, La Paz.
FECHA DE RECEPCIÓN: 20 DE MARZO DE 2015
FECHA DE ACEPTACIÓN: 10 DE JUNIO DE 2015
Resumen
La tuberculosis (TB) se ha convertido en un problema de salud mundial. El año 2012 se reportaron 8,7 millones de casos nuevos. Para el diagnóstico de TB en nuestro medio se emplean dos métodos: la tinción Ziehl Neelsen y cultivo. Los medios de cultivo que se utilizan son: Löwenstein-Jensen (LJ), Stonebrink y Ogawa. El LJ es el medio de referencia para la evaluación de nuevos sistemas para el diagnóstico de TB. El presente estudio evaluó el rendimiento del medio LJ comercial y el LJ in house (estandarizado y preparado bajo normas del manual de procedimientos técnicos para Cultivo de mico-bacterias de la Red Nacional de Laboratorios de Tuberculosis de Bolivia.
Se procesaron 185 muestras de esputo BK(+), sembrándose por duplicado en medio LJ in house y en medio LJ comercial. Mediante el LJ in house se obtuvieron 172 cultivos positivos (93%), 9 (5%) negativos y 4 (2%) contaminados; mediante el LJ comercial se obtuvieron 148 positivos (80%), 8 negativos (4%) y 29 (16%) contaminados. En el LJ in house se obtuvo un desarrollo eugónico en 131 (76%) cultivos y disgónico en 41(24%) cultivos; en el LJ comercial se obtuvo un desarrollo eugónico en 29 (20%) cultivos y desarrollo disgónico en 119(80%) cultivos. Al realizar la comparación entre el LJ in house y el LJ comercial se obtuvo un valor kappa de 0,96, demostrando así una fuerza de concordancia de 0,96 (casi perfecta).
Los resultados obtenidos demuestran que el medio LJ in house supera en rendimiento al medio LJ comercial, ya que se obtiene un mejor desarrollo y un menor porcentaje de contaminación, facilitando de esta manera posteriores estudios de sensibilidad y resistencia a fármacos antituberculosos.
Palabras clave
Löwenstei n -J ensen, Tuberculosis, Red Nacional de Laboratorios de Tuberculosis
Abstract
Tuberculosis (TB) has become a global health problem. In 2011 there were 8.7 million new cases. For TB diagnostic are used methods staining and solid media cultures: Löwenstein-Jensen (LJ), Ogawa, Stonebrink. The LJ is the reference media culture for evaluation of new systems for the diagnosis of TB. This study evaluated the performance of the commercial LJ culture media and LJ standardized by the National Tuberculosis Laboratory Network.
185 sputum samples BK(+), being plated in duplicate in the LJ in house medium and commercial LJ medium were processed. By in house LJ medium were obtainned, 172 positive cultures (93%), 9 (5%) negative and 4 (2%) contaminated; through commercial LJ were obtained 148 positive (80%), 8 negative (4%) and 29 (16%) contaminated. In in house LJ medium an eugónic development was obtained in 131 (76%) and disgónic development in 41 (24%) cultures; in commercial LJ we saweugonic development in 29 (20%) and disgonic development in 119 (80%) cultures. When comparing between in house LJ and commercial LJ a kappa value of 0.96 was obtained, demonstrating astrength of concordance of 0.96 (almost perfect).
The results show that in house LJ medium (standardized by the National Tuberculosis Laboratory Network) surpass commercial LJ, as show better development and a lower percentage of contamination, thereby facilitating further drug resistance studies.
Key words
Löwenstein-Jensen, Tuberculosis, National Tuberculosis Laboratory Network
INTRODUCCIÓN
La tuberculosis es una enfermedad infecto-contagiosa que actualmente se ha convertido en un problema de salud mundial. No puede ser considerada como una enfermedad del pasado, ya que actualmente ha vuelto a surgir como problema sanitario de primera magnitud, tanto en los países en vías de desarrollo como en los desarrollados, por las complicaciones que puede ocasionar. (Cárdenas R. 2014)
Al presente, más de 2 000 millones de personas, o sea, un tercio de la población global, están infectadas por el bacilo, y de esa cantidad, de 5 a 10 % se enferman o trasmiten la bacteria en algún momento de sus vidas.Cada segundo alguien contrae la infección y cada 20 segundos hay un fallecimiento por esta causa; además, una de 4 muertes está relacionada con el virus de inmunodeficiencia humana (VIH). Adicionalmente, si se utilizan o administran mal los medicamentos, puede presentarse la tuberculosis multirresistente. (Estrategia Alto a la Tuberculosis, 2012)
Anualmente en Bolivia se registran entre 6.000 a 7.000 casos nuevos de personas con TB. El año 2012, el Programa Nacional de Control de Tuberculosis en Bolivia (PNCT), reportó 7.811 casos de Tuberculosis en todas sus formas, que representa una tasa de incidencia de 72,2 por 100.000 habitantes, de los cuales 6.139 son de TB pulmonar.(PNCT, 2013)
En la actualidad, el PNCT avala como pruebas de rutina para el diagnóstico de tuberculosis dos métodos: la tinción Ziehl Neelsen (baciloscopia) y el cultivo en medios sólidos, pues las técnicas de biología molecular no están al alcance de cualquier Laboratorio (Westwood SA, 1993)
El cultivo permite con certeza realizar la confirmación del diagnóstico de la tuberculosis. Los medios de cultivo que se utilizan en los laboratorios que efectúan aislamiento de Micobacterias en la Red Nacional de Laboratorios de Control de la Tuberculosis de Bolivia, son medios sólidos a base de huevo, Lowenstein Jensen (LJ), Stonebrink y Ogawa, que en este estudio los denominamos "IN HOUSE", ya que fueron estandarizados por los Laboratorios de esta red y son actualmente preparados en el laboratorio de medios de cultivo del Instituto de Laboratorios en Salud (INLASA) y distribuidos a nivel nacional. (Camacho, 2011)
El medio Löwenstein-Jensen sigue siendo el de referencia para la valoración de los nuevos sistemas comerciales y se utiliza rutinariamente para el aislamiento de micobacterias de importancia clínica.
La importancia de contar con un medio de cultivo adecuado, radica en aislar M.tuberculosis a partir de muestras de escasa cantidad de bacilos, paucibacilares, en pacientes con sospecha de TB y radiografía normal. También es de gran importancia en el diagnóstico de la TB infantil y en pacientes con VIH/SIDA y que además propicie el crecimiento de cepas eugónicas, definiéndose como eugónico al crecimiento de colonias mayores a 1 mm de diámetro y fáciles de separar de la superficie del medio, lo contrario a disgónico que es un crecimiento con colonias pequeñas menores de 1 mm.de diámetro, adheridas al medio, las mismas que no tendrán utilidad para realizar las pruebas de susceptibilidad antimicrobiana correspondientes, además de presentarse dificultades al momento de la lectura de resultados.
El presente estudio propone comparar los medios de cultivo Löwenstein-Jensen artesanal y cultivo Löwenstein-Jensen comercial para el aislamiento de M. tuberculosis, y determinar el mejor medio, que permita el aislamiento con menor porcentaje de contaminación, mejor tipo de crecimiento, a partir de muestras de esputo BK (+) provenientes de pacientes que acudieron al Laboratorio departamental de Control de Tuberculosis La Paz, durante febrero a octubre del 2013.
MATERIALES Y MÉTODOS
Material de estudio
El material de estudio estuvo constituido por 185 muestras de esputo de personas BK (+) de ambos sexos confirmadas por baciloscopia mediante tinción de Ziehl Neelsen, recolectadas por el Laboratorio Departamental de Control de Tuberculosis de La Paz, que cumplieron con los criterios de inclusión.
Criterios de inclusión
Pacientes BK (+) de ambos sexos confirmado por baciloscopía continción Ziehl Neelsen y que no hayan recibido tratamiento antimicrobiano.
Criterios de exclusión
Pacientes BK (+) que estén recibiendo tratamiento antimicrobiano.
Muestreo
La selección de la muestra se llevó a cabo mediante el muestreo no probabilístico de conveniencia
Toma de muestra y transporte
Cada muestra de esputo fue tomada por duplicado por personal especializado del área, las muestras de esputo fueron obtenidas por expectoración del árbol bronquial, las cuales tuvieron un volumen aproximado de 2-5ml. Las muestras fueron recolectadas en recipientes con tapa, debidamente rotulados, en algunos casos los recipientes que contenían las muestras BK (+) y cumplían con los criterios de inclusión mencionados anteriormente, fueron inmediatamente transportadas y en otros casos se transportaron en un tiempo máximo de 48 horas, al Laboratorio de Microbiología Molecular del Instituto SELADIS de la Facultad de Ciencias Farmacéuticas y Bioquímicas-UMSA. La alícuota duplicada se mantuvo en el Laboratorio de la Red Departamental de Control de Tuberculosis para su respectiva siembra.
Siembra en medios de cultivo
Cultivo en Löwenstein-Jensen in house: Una alícuota de la muestra se quedó en el Laboratorio Departamental de Control de la Tuberculosis, para realizar el respectivo cultivo. En este laboratorio se decontaminó la muestra mediante el método de Petroff modificado, el cual utiliza NaOH (hidróxido de sodio) como solución digestiva. El medio de cultivo Löwenstein-Jensen sembrado se incubo por 20 a 60 días.
Cultivo en Lowenstein Jensen comercial: Para dar objetividad al estudio no mencionamos marcas, aunque debe informarse que son medios provenientes de industria Norte Americana.
De forma paralela otra alícuota de la muestra fue llevada al Instituto SELADIS, donde se procedió a la decontaminación de la muestra mediante el método de NaOH-NALC (hidróxido de Sodio-Nacetil Lisina). Todas las muestras de esputo fueron digeridas y descontaminadas con solución digestiva (TB Prep Kit Red, Hardy Diagnostic). Un volumen igual de esputo se añadió a 2 ml de solución digestiva, se añadió 9 ml de solución tampón fosfato (pH 6,8). Para luego llevar a centrifugación durante 15 min a 3000g, se sembró dos gotas del sedimento en un medio: Löwenstein-Jensen comercial y se llevó a incubar a 37°C, controlando el crecimiento cada 10 días hasta el día 60.
Comparación de medios de cultivo
Para hacer la comparación de los medios de cultivo, antes mencionados, se procedió a observar los tubos con colonias con características morfológicas típicas de M. tuberculosis, luego se procedió a tomar nota de: Porcentaje de contaminación, tiempo de crecimiento, tipo de crecimiento (eugónico,disgónico) y número de colonias.
Identificación de M. tuberculosis: Se seleccionaron las colonias con características morfológicas típicas de M. tuberculosis, a partir de las cuales se realizó: tinción de Ziehl Neelsen y prueba de la niacina, según la técnica descrita por el manual del fabricante.
Análisis Estadístico
Se describieron los resultados obtenidos en ambos medios de cultivo mediante el número de casos observados y sus porcentajes.
Para estimar la concordancia de resultados obtenidos en ambos medios de cultivo de M. tuberculosis se utilizará el coeficiente de concordancia kappa.
RESULTADOS
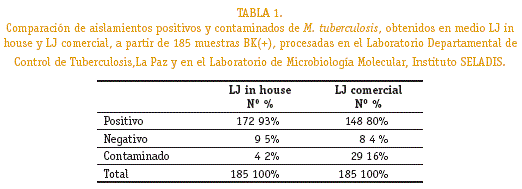
De las 185 muestras, se obtuvieron en el Löwenstein-Jensen in house, 172 cultivos positivos (93%), 9(5%) cultivos negativos y 4 (2%) cultivos contaminados y en el Löwenstein-Jensen comercial se obtuvieron148 (80%) cultivos positivos, 8 (4%) cultivos negativos y 29 (16%) contaminados (tabla 1).
De los 172 cultivos positivos en el LJ in house, se obtuvieron 131(76%) cultivos con desarrollo eugónico y 41(24%) cultivos con desarrollo disgónico. En el LJ comercial de los 148 cultivos positivos, 29 (20%) cultivos presentaron un desarrollo eugónico y 119 (80%) cultivos presentaron un desarrollo disgónico (Tabla 2).
En cuanto al tiempo promedio de días de positividad (desarrollo de colonias) en el cultivo LJ in house (172 cultivos positivos) fue de 33 días y en el cultivo Lowenstein Jensen comercial (148 cultivos positivos) el promedio fue de 22 días (Tabla 3).
Finalmente, para realizar la comparación estadística, entre el LJ in house y el LJ comercial se realizó una tabla de contingencia (Tabla 4), donde solo se tomaron en cuenta 155 cultivos, ya que 30 cultivos resultaron contaminados ya sea en el LJ in house, en el LJ comercial o en ambos cultivos.
A partir de la tabla 4 se pudo calcular el valor kappa, el cual fue de 0,96, indicador de que existe una relación casi perfecta entre el LJ in house y el LJ comercial. (Tabla 5)
DISCUSIÓN
El medio de Lowenstein Jensen (LJ) continúa siendo el método de referencia para la valoración de los nuevos sistemas comerciales y se utiliza rutinariamente para el aislamiento de micobacterias de importancia clínica. (Sepúlveda A., 2001). El LJ in house (Camacho, 2011) es el medio de cultivo más utilizado en nuestro país, por lo cual se realizó la comparación entre este medio y un cultivo LJ comercial utilizado en otros países.
Mediante los resultados obtenidos podemos notar que existe una diferencia en cuanto al desarrollo de M. tuberculosis, entre el LJ in house y el LJ comercial. En el cultivo LJ in house se obtuvo un desarrollo óptimo con un porcentaje de contaminación dentro de lo normal, ya que una tasa de contaminación menor del 2% sugiere una decontaminación y digestión de la muestra severa, las tasas de contaminación mayores de 5-8% se deben a una insuficiente decontaminación. (Asencioc L, 2012).En el caso del LJ comercial la tasa de contaminación supera el 8% por lo cual podríamos pensar que existió una decontaminación insuficiente.
Otro factor por el cual se pudo haber obtenido una tasa elevada de contaminación en el LJ comercial, fue el tiempo que transcurrió desde la recolección de la muestra hasta su procesamiento; ya que existieron algunas muestras que fueron recolectadas y sembradas en el LJ in house, el mismo día; pero, tardaron un par de días hasta que llegaran al instituto SELADIS, para poder ser sembradas en el LJ comercial y durante este periodo varias muestras pudieron no estar refrigeradas. El manual de procedimientos técnicos para cultivo de micobacterias indica que la muestra debe ser enviada inmediatamente al laboratorio donde se realiza cultivo, en un periodo no mayor de los 5 días en condiciones de conservación adecuadas (protegida del calor), desde el momento de recolección de la muestra (Camacho, 2011)
Se obtuvo un mayor porcentaje de cultivos con desarrollo disgónico en el LJ comercial, esto se pudo deber a la mala conservación de algunas muestras, las cuales no fueron refrigeradas desde la recolección de la muestra hasta su llegada al Instituto SELADIS.
Debido al elevado porcentaje de contaminación y desarrollo disgónico en el cultivo LJ comercial, se acudió al Laboratorio de preparación de medios de cultivo del Instituto de Laboratorios en Salud INLASA, que es donde se realiza la preparación y posterior distribución de los medios de cultivo a todos los Laboratorios que conforman la Red Nacional de Tuberculosis, con el fin de distinguir algunas características del medio comercial como ser el pH de este medio, ya que en el catálogo no indicaba el pH al cual se encontraba el LJ comercial,obteniéndose un pH de 7,24.
El bacilo de la tuberculosis sobrevive y se multiplica a un pH cercano al neutro. Para neutralizar la muestra decontaminada con hidróxido de sodio se puede agregar una solución ácida gota a gota hasta que vire un indicador de pH. Este proceso debe ser controlado muy rigurosamente. Cualquier defecto o exceso de la solución ácida origina un pH ácido no apto para el desarrollo del bacilo. Para evitar este riesgo la norma actual refiere aplicar procesos de lavado con un buffer de pH neutro para eliminar la base utilizada para decontaminar. (Barrera L., 2008)
El promedio del día de positividad en el LJ comercial fue menor que el LJ in house, esto se debe a que en el LJ comercial se iniciaron las lecturas de los cultivos al día 15, a diferencia del LJ in house, donde se comenzaron las lecturas al día 20, debido a factor tiempo, ya que los laboratorios pertenecientes a la Red Nacional de Laboratorios de Tuberculosis procesan una gran cantidad de muestras.
CONCLUSIONES
De acuerdo a los resultados obtenidos en este estudio se concluye que:
- Según los valores de kappa obtenidos, los medios LJ in house y LJ comercial, presentan la misma efectividad en el aislamiento de M. tuberculosis, es decir, pueden ser utilizados indistintamente con fines de identificación del bacilo.
- El medio LJ in house, favorece el aislamiento de M. tuberculosis a partir de muestras de esputo BK (+) con menor porcentaje de contaminación, menor tiempo promedio de crecimiento y mayor número de colonias, que con el medio LJ comercial.
- El medio LJ in house, favorece significativamente el crecimiento eugónico de M. tuberculosis a partir de muestras de esputo BK (+), en comparación con el medio Löwenstein-Jensen comercial.La resistencia a medicamentos antituberculosos es un fenómeno en crecimiento que acompaña el cuadro general de la tuberculosis en el mundo y que plantea mayores dificultades para su futuro control. (WHO, 2000). Para que una muestra pueda ingresar al estudio de sensibilidad y resistencia es necesario obtener un desarrollo óptimo en el cultivo; es decir, un desarrollo eugónico; por lo cual podemos indicar que en este caso el uso del LJ artesanales el recomendable para este fin.
AGRADECIMIENTOS
- A la Universidad de Barcelona por el financiamiento del proyecto marco del cual es parte este estudio.
- A la Dra. Carla Jemio Castañon (Responsable del Laboratorio Departamental de Tuberculosis, La Paz), por su apoyo e interés constante para el desarrollo de investigaciones en el Laboratorio a su cargo.
- A la Dra. Orfa Luz Huarina, Dra. Máxima Velarde, Dr. José Melgarejo, quienes contribuyeron en la recolección de muestras y datos fundamentales para este trabajo.
REFERENCIAS
Asencioc L, Quispe N, Vásquez L. (2012) Procedimiento para el control de calidad externo de la prueva rápida MODS (Microscopic Observation Direct Susceptibility) de sensibilidad a los fármacos antituberculosos. Lima. [ Links ]
Barrera L., Malbran CG. (2008) Manual para el Diagnóstico de la Tuberculosis. 2da parte. Cultivo.Organizacion Panamericana de la salud. [ Links ]
Camacho M., Magne M., Mollinedo JC., Calderon L. (2011) Manual de procesamientos técnicos para Cultivo de micobacterias de la Red Nacional de Laboratorios de Tuberculosis. La Paz-Bolivia: PrintArtesGráficas. N° 230. [ Links ]
Cárdenas R., Rivero E., Quirós JL. (2014) Tuberculosis: un desafío para la atención primaria de salud. MedicentroElectron. ene.-mar.;18(1) [ Links ]
Estrategia Alto a la Tuberculosis [2012]. Disponible en: http://www.sld.cu/sitios/tuberculosis/ [ Links ]
Organización Mundial de la Salud. (2013) Tuberculosis. Nota descriptiva N° 04. Washington: OMS; 2013 oct. Disponible en: http://www.who.int/mediacentre/factsheets/fs104/es/index.html [ Links ]
Programa Nacional de Control de la Tuberculosis (2013). Recuperado de http://vigisalud.mspbs.gov.py/index.php?option=com_content&view=article&id=11&catid=23&IItemi=101 [ Links ]
Sepúlveda A., García-Martos P., Rodríguez M.J., MárquezA., PuertoJ.L., Saldarreaga A.(2001) Evaluación del medio de Stonebrink para la recuperación de micobacterias. RevDiagnBiol v.50 n.4 Madrid oct.-dic. [ Links ]
Westwood SA. (1993) Diagnostic mycobacteriology: currents challenges and technologies. Lab Med; 24: 357-361 [ Links ]
World Health Organization.(2000)Antituberculous drug resistence in the world. Report No 2 Prevalence and trends.The WHO/IUATLD Global project on anti-tuberculous drug resistence surveillance. World Health Organization, Geneva [ Links ]











 uBio
uBio