Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista CON-CIENCIA
Print version ISSN 2310-0265
Rev.Cs.Farm. y Bioq vol.3 no.1 La Paz July 2015
ARTÍCULOS DE INVESTIGACIONES FACULTATIVOS DOCENTE
Estandarización de un metodo fluorometrico sobre trofozoitos de giardia lamblia.
CONDO MONTERO, CLAUDIA1
SALAMANCA CAPUSIRI, EFRAÍN1
FLORES, NINOSKA1
GIMÉNEZ TURBA, ALBERTO1
1 Unidad de Evaluaciones biológicas, Área de Química Farmacéutica, Instituto de Investigaciones Fármaco Bioquímicas, Facultad de Ciencias Farmacéuticas y Bioquímicas, Universidad Mayor de San Andres. Av. Saavedra # 2224, Miraflores. La Paz, Bolivia
CORRESPONDENCIA: ALBERTO GIMÉNEZ AGIMENEZ@MEGALINK.COM
FECHA DE RECEPCIÓN: 20 DE MARZO DE 2015 FECHA DE ACEPTACIÓN 10 DE JUNIO DE 2015
Resumen
Giardia lamblia es un protozoo intestinal que causa procesos diarreicos de gran impacto epidemiológico en nuestro país, especialmente en niños. Las drogas utilizadas para el tratamiento son eficientes pero muchas producen efectos secundarios, debido a ello existen búsquedas de nuevos agentes antiparasitarios naturales y sintéticos por lo que existe la necesidad de contar con un método de evaluación antiparasitario in vitro sensible, cualitativo y rápido.
En el presente estudio se estandarizo in vitro una técnica fluorometrica con el indicador resazurina, el mismo que tiene como base los cambios de oxido-reducción del compuesto resazurina (no fluorescente) a resorufina (fluorescente) debido a la reducción química de las oxidoreductasas presentes en las células viables.
Así para la estandarización del método fluorometrico se trabajo con una longitud de excitación y emisión de 540 - 590nm respectivamente, determinando la población parasitaria de trabajo en un rango de 2,5x105 a 1,5 x106 trofozoitos /mL, el tiempo óptimo de incubación se midio a las 2, 3, 4, 5, 6 y 7 horas y la concentración de re-sazurina de 4mM, 2mM, 1mM, 0.5mM y 0.25mM.
Una vez obtenidos los datos se determino de manera in vitro la IC50 de varios antiparasitarios convencionales para el tratamiento de Giardia, trabajando con 7,5x105 trofozoitos /mL, tiempo de incubación 4 horas y concentración de aceptor de electrones 2mM, así mismo se trabajo con Alcaloides Totales de Corteza de la Evanta (Galipea longiflora) a una concentración de 100 ug/mL.
Obteniendo la IC50 de albendazol (0.4 uM), metronidazol (2.1 uM), tinidazol (1.5uM), mebendazol (0.81 uM) y CAT (77 ug/mL).
Logrando estandarizar finalmente un método fluorometrico, sensible y cuantitativo para las evaluaciones anti parasitarias dentro del 1.1.EB.
Palabras Clave Dia lamblia, Susceptibilidad, ometrico, Resazurina, centracion Inhibitoria media (IC50).
Abstract
Giardia lamblia is an intestinal proto-zoan that causes epidemiological impact of diarrheal in our country, especially in children. The drugs used for treatment are efficient but many have side effects due to this there are research for new natural and syn-thetic antiparasitic agents so there is impor-tant to uses a sensitive, qualitative and fast method of in vitro antiparasitic evaluation.
In this in vitro study it was standardized technique with a fluorometric indicator re-sazurin, the same which is based on redox changes from resazurin (nonfluorescent) to resorufin compound (fluorescent) due to chemical reduction present in oxidoreduc-tases viable cells.
So for standardizing the fluorometric method we worked with a length of excitation and emission of 540 - 590nm respectively, determining the parasite population working in a range of 1.5 x106 2,5x105 tro-phozoites / mL, optimal incubation time from 2 to 7 hours and resazurin concentra-tion 4mM, 2mM, 1mM, 0.5mM and 0.25mm.
Once the data determined was ob-tained, we worked in the IC50 of the conventional treatment of Giardia, working with 7,5x105 trophozoites / ml, 4 hours of incubation time and concentration of electron acceptor 2mM, we also determinate the antigiardiasis activity of total alkaloids cortex, CAT, of Evanta (Galipea longiflora). Getting the IC50 of albendazole (0.46 uM), metronidazole (3.12uM), tinidazole (1.22uM), mebendazole (0.43 uM) and CAT (77 ug/mL).
Achieving finally standardize a fluorometric, sensitive and quantitative method for antiparasitic assessments within the IIFB
Key Words
Giardia lamblia, Susceptibility, fluorometric, Resazurin, half Maximal Inhibitory Concentration (IC50).
INTRODUCCIÓN
Giardia lamblia, es un protozoario enterico patógeno capaz de vivir en el ser humano y otros mamíferos cuando es ingerido en su forma infectante, quiste, una vez en el intestino del huésped se convierte en trofozoito, la forma metabólica activa, la cual se multiplica por fisión binaria en la superficie de la mucosa intestinal. Las manifestaciones clínicas puede ir desde asintomática hasta un estado con diarrea aguda o cronica, perdida de peso, malabsorcion llevando a una desnutrición propias en la giardiasis, en algunos casos hay deficiencia de vitamina A, hierro y zinc, Atias (1998: 56). Afecta a cerca de 280 millones de personas cada año a nivel mundial (Upcroft 2001, Ali & Nozaki 2007), especialmente en países en vías de desarrollo ya que es una enfermedad asociada a la pobreza, en Bolivia existen estudios que indican que alrededor del 25% de la población esta infectada (Condori 2008, Alparo I., 2005; Barrientos etal., 2008) afectando mayormente a niños, constituyéndose en un problema de salud pública.
El tratamiento para esta enfermedad es importante desde un punto de vista económico y social, entre los medicamentos utilizados comprende nitroimidazoles, quinacrina y furazolidona, la droga de elección es el metronidazol, aunque existen otras alternativas como el albendazol, sin embargo los efectos adversos que pueden producir que incluyen problemas gastrointestinales, nauseas, dolor de cabeza y leucopenia (Tracy & Webster, 1991) y la inaccesibilidad a estas drogas en ciertas comunidades, impulsa a probar terapias alternativas que ayuden a erradicar este problema, planteándose hipótesis de que ciertas plantas (semillas u hojas) contienen principios activos capaces de inhibir el crecimiento de Giardia lamblia tales son los estudios hechos a Curcubita pepo (Barron Gonzales, 2012), Achyrocline satureioides, Eugenia uniflora, Feoniculum vulgare, Psidiums guajava (Costa et al, 2009), Lip-pia spp. (Ponce- Macotela et al, 2006), Geranium niveum (Calzada et al, 1999), Hovenia dulcis (Gadelha etal, 2005) entre otros que sostienen resultados prometedores a nuevas sustancias terapéuticas antigiardiasicas.
Se han descrito diferentes métodos que permiten determinar la viabilidad celular in vitro facilitado el desarrollo de técnicas de tamizaje a nuevos componentes antiparasitarios (Martinez - Barrio 2011). La técnica espectofotometrica de DPPH que emplea el radical 1,1-difenil-2-picrilhidracriles puede dar variables dispersas debido a que es un radical nitrogenado de larga vida, en algunos casos puede ser inerte y reaccionar lentamente (Barrón etal, 2012). La técnica de recuento celular utilizando colorantes vitales es laboriosa, consume tiempo, no es sensible y es un proceso subjetivo (Marrero-Ponce et al. 2009). Los métodos basados en la reducción de la sal 3-(4,5- dimetiltiasol-2yl) -2,5- difenil tetrazolium bromide (MTT) por las deshidrogenasas mitocondriales de las células viables de cristales de formazan, presentes en los cultivos. Estos métodos son ampliamente utilizados, sin embargo el producto final de esta sal (formazan) es insoluble en agua, por lo que se utiliza solventes orgánicos para solubilizarlo (Calzada etal, 1999), la utilización de análogos de MTT como el XTT sodio (2,3-bis(2-metoxi-4-nitro-5-sulfofenil)-2-h-tetra-zolium-5-carboxanilide) técnica también realizada en el IIFB sin tener resultados satisfactorio debido a la oxidación del medio de cultivo (TYIS-33). La mayoría presentan desventajas por ser de punto final, imposibilitando seguir el comportamiento celular después de ser sometidas a un tratamiento traumático.
La resazurina es un colorante redox que se utiliza para cuantificar la proliferación y observar la citotoxicidad en diferentes tipos celulares (Skehan, 1992). En un utilizaba para determinar contaminación por bacterias u hongos. Exhibe cambios colorimétricos y fluorometricos relacionados a la actividad celular metabólica (Zhang H, 2004). La técnica se basa en la capacidad de células activas metabólicamente que reducen en la mitocondria la resazurina a resoru-fina y dihidroresorufina donde la forma oxidada, resazurina ingresa al citosol y es convertida a la forma reducida por la actividad enzimática mitocondrial aceptando electrones del NADPH, FADH, GMNH, NADH (Makiuchi, 2013).
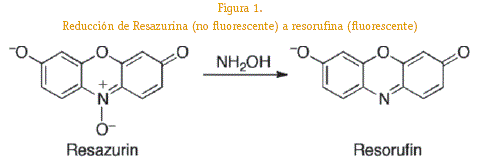
La reducción produce que la resazurina oxidada o no fluorescente la reduzca o cambie a la forma fluorescente, resorufina.
MATERIALES Y METODOS
Cepas utilizadas para los ensayos Los trofozoitos de Giardia lamblia fueron donados por la Unidad de Parasitología de la Universidad Complutense de Madrid, España (2009). Se conservaron en medio TYIS-33 modificado (pH 7.2), se lleno por completo el tubo con el medio debido a que son parasitos anaerobios facultativos, se incubaron de 37°C. Cada 100 ml. de medio contiene: 0.1 g K2HPO4, 0.06g de KH2PO4, 0.1 g NaCl, 3g Extracto de levadura, 0.05g Bilis bovina deshidratada, 1g de glucosa, 0.2g L-cisteina HCl, 0.02g ácido as-córbico, 2.2mg citrato férrico amónico, suplementado con 15 % de suero bovino fetal (SBF) y 3% de solución de vitaminas (Sigma - Aldrich).
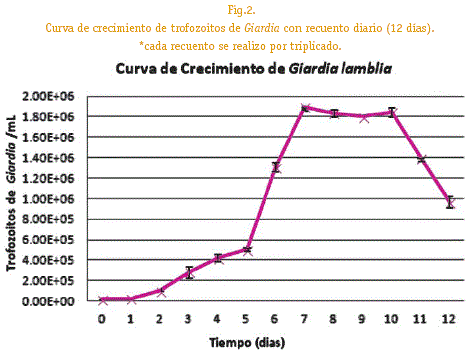
Curva de crecimiento de Giardia lamblia Para conocer la cinética de crecimiento parasitaria se realizó la curva de crecimiento, el proceso consistió en hacer una solución madre con una concentración final de 2x104 trofozoitos /mL con TYIS-33 modificado, luego alicuotar en 10 tubos de 1,5mL. El trabajo se hizo por triplicado. Realizando el recuento celular diariamente en cámara de Neubauer.
Estandarización de la técnica fluorometrica
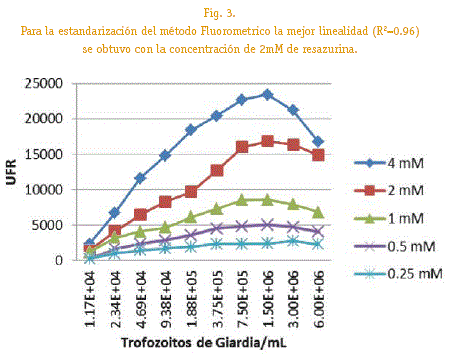
Se hizo una dilución a partir de un cultivo in vitro de trofozoitos en fase de crecimiento logarítmico con una concentración de 1,5 x106 trofozoitos/mL a partir de la cual se realizo diluciones seriadas 1/2 abarcando concentraciones entre 1,5 x106 hasta 2,5x105 trofozoitos/mL, los cuales fueron distribuidos en placas de cultivo de 96 pozos (Cellstar) por duplicado a tres repeticiones, a cada pozo se añadió 10uL de la solución de resazurina (Sigma Aldrich) a diferentes concentraciones (4, 2,1, 0.5,0.25mM) los tiempos de incubación fueron 2,3,4,5,6 y 7 horas. Las placas fueron leídas en un lector de Fluorescencia (SYNERGYHT, Biotek) a una longitud de excitación y emisión de 540 y 590 nm respectivamente. A partir de los datos, se obtuvo curvas de fluorescencia en función a las concentraciones de parásitos y concentración de Resazurina, para los diferentes tiempos de incubación.
Antiparasitarios convencionales fueron adquiridos en la farmacia institucional utilizados para la estandarización.
Albendazol 400mg
Metronidazol 100 mg
Tinidazol 500 mg
Mebendazol 1000 mg
Corteza Alcaloides Totales de Evanta (CAT) 100ug/mL
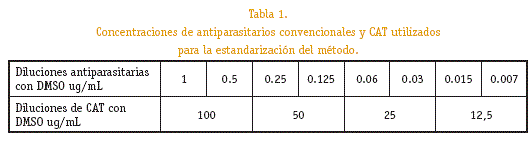
Se disolvieron en Dimestil sulfoxido (DMSO) para obtener una concentración de 100ug/mL y se hicieron diluciones seriadas a partir de 1ug/mL hasta 0,007 ug/mL a partir de la solución madre.
Mientras que de CAT se hicieron diluciones de 100, 50, 25 y 12,5ug/mL.
Preparación de placa de 96 pozos para evaluación de drogas control
Se hizo una dilución 1/10 del cultivo de trofozoitos con glutaraldehido 2.5% para fijar los parásitos y realizar el recuento en cámara de Neubauer. Se ajusto la población a 7,5x105 trofozoitos/mL con medio TYIS-33 modificado, se los distribuyo en placas de 96 pozos (Cellstar) en un volumen de 100μL. A continuación se procedió a añadir las distintas concentraciones de las drogas control a evaluar en volumen similar al de los parásitos, se realizo un control de crecimiento parasitario es decir 100 uL de parásitos ajustados a la concentración ideal mas 100uL medio TYI-S-33, como blanco se utilizo el medio de cultivo. A la placa se añadió (1 OuL/pozo) una solución de resazurina en buffer fosfato salino (pH 7.0) dentro de un CandleJarr un recipiente cerrado de vidrio con una llave de paso en la tapa y una vela encendida en su interior de tal modo que permita la salida del oxigeno y la saturación en el interior del anhídrido carbónico, requerida para el crecimiento de los trofozoitos de Giardia. Las placas se incubaron durante 4 horas a 37°C.
Obtención de la CI50 por el método fluorométrico
Pasado el tiempo de incubación se procedió a la lectura de fluorescencia y determinación de la IC50, con longitud de excitación y emisión de 540 y 590 nm respectivamente, el análisis de datos fue realizado en el programa Gen5, transformando el índice de fluorescencia en porcentaje de viabilidad de los parásitos, donde el 100% representa la fluorescencia del control de parásitos sin droga.
RESULTADOS
Se realizo la curva de crecimiento de Giardia observándose que en los días 5, 6 y 7 hubo el máximo crecimiento por mL y a partir del día 11 las concentraciones parasitarias disminuyen.
Emisión de fluorescencia por población parasitaria utilizando diferentes concentraciones de resazurina
La medición de la fluorescencia a diferentes concentraciones de resazuri-na y población parasitaria, nos muestra que la mayor emisión de fluorescencia es con una concentración de 4mM de resazurina pero la mejor linealidad (R2= 0,96) se obtiene con la concentración de 2mM y la concentración parasitaria que presente una fluorescencia significativa es de 7.5 x105 trofozoitos/mL.
Correlación entre la emisión de fluorescencia de trofozoitos y las diferentes concentraciones de resazurina
En cuanto a la determinación del tiempo se observa que a las 4 horas la emisión de fluorescencia empieza a ser significativa para las concentraciones de rezasurina 2 y 4 mM.

DISCUSION
Se determino la curva de crecimiento in vitro de los cultivos de trofozoitos de Giardia pudiendo observarse que el día 2, luego de la etapa de adaptación, empieza el crecimiento logaritimico de Giardia teniendo así los días 5,6 y 7 como máximos picos de crecimiento logarítmico (Figura2). similares a los que obtuvo Karapetyan en 1963; mientras que Gonzales y Castro en 1986, mostraron que los mayores crecimientos fueron durante los días 4,5, y 6 indicando un descenso del crecimiento en los días sucesivos utilizando medio BI-S-33. Por lo que para los ensayos de estandarización se utilizo cultivos de parásitos de 2 días de incubación puesto que los parásitos se encuentran adaptados al medio de cultivo y metabólicamente activos.
En la Figura 3, se observa una respuesta lineal de la fluorescencia al incremento del número de parásitos siendo la población de 7,5x105 trofozoitos/mL a una concentración de 2mM de resozurina la que presenta un R2 de 0,96 mostrándo cambios de URF de fluorescencia significativos a los cambios de población, variable importante a la hora de medir la IC50 de los compuestos antiparasitarios.
Si bien existen trabajos en donde se utilizan concentraciones bajas de trofozoitos 2x104 trofozoitos/mL (Barron Gonzales, 2007), 5x104 trofozoitos/mL (Cedillo -Rivera, 1992) estas no serian significantes para determinar cambios de población buscados y no existirían cambios en la flurescencia ideales; según Arguello-Garcıa etal., 2004, trabajo con poblaciones de alrededor de 1x106 trofozoitos/mL y Ponce Macotela et al 1,5 x106 trofozoitos/mL en nuestro caso produciría una saturación en cuanto la emisión de fluorescencia.
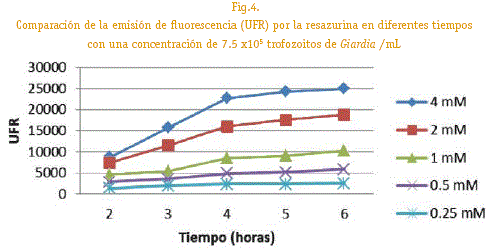
Por otro lado en base a los resultados obtenidos de población parasitaria y concentración de resazurina se determino el tiempo de incubación (figura 4) pudiendo observar una correlación lineal al aumento de tiempo de incubación teniendo una linealidad significativa a 2mM y 4 horas de incubación con un buen coeficiente de correlación lineal (R2=0,91)
Mediante estos parámetros se confirmo la eficacia antiparasitaria in vitro de varios compuestos usados para el tratamiento de esta enfermedad así se verifico la mejor respuesta del albendazol y mebendazol respecto al metronidazol frente a trofozoitos de Giardia con IC50 de albendazol (0,4 uM), metronidazol (2.1 uM), tini-dazol (1,5 uM) y mebendazol (0.81 uM) acercándose a resultados obtenidos anteriormente por estudios de susceptibilidad. (Arguello et al, 2004; Busatti et al, 2007; Echevarria A, 2001) permitiéndonos confirmar la validez de la técnica, trabajando con una concentración de parasitos de 7,5 x105 trofozoitos/mL con un tiempo de incubación de 4 horas validando de esta manera el método fluorométrico.
Las enfermedades parasitarias son un problema de salud publica en todo el mundo especialmente en países en vías de desarrollo si bien existen tratamientos estos presentan efectos secundarios indeseables como ser molestias gastrointestinales, náuseas, dolor de cabeza y leucopenia incluso provocando casos de resistencia, por lo que surge la necesidad de encontrar nuevos agentes o entidades químicas con actividad antiparasitarias, utilizando nuevas técnicas laboratoriales constituyéndose la estandarización de este método fluorometrico en una herramienta sensible y cuantitativa de evaluación no solo de drogas antiparasitarias sino que además sirve para iniciar la búsqueda de una bioprospección de plantas medicinales en el Instituto de Investigaciones Fármaco Bioquímicas.
AGRADECIMIENTOS
Este estudio fue parcialmente financiado por el proyecto ASDI-SAREC 2014 a quien expresamos un especial agradecimiento. Asimismo a la doctora Maria Auxiliadora Dea Ayuela, profesora en Farmacia de la Universidad Complutense de Madrid, España, por la donación de cepas parasitarias.
REFERENCIAS
Ali V, Nozaki T (2007) Current therapeutics, their problems, and sulfurcontainingaminoacid metabolism as a novel target against infectionsby"Amitochondriate" protozoan parasites. Clin Microbiol Rev 20:164-187 [ Links ]
Atias, A., (1998), Parasitología Medica. Chile: Mediterráneo. [ Links ]
Alparo I., (2005). Giardiasisy desnutrición. Bol. ped. 44(3), 163-173. [ Links ]
Arguello-Garcıa R., Cruz-Soto M., Romero-Montoya L. y Ortega-Pierres G. (2004). Variability and variation in drug susceptibility among Giardia duodenalis isolates and clones exposed to 5-nitroimidazoles and benzimidazoles in vitro. Journal of Antimicrobial Chemotherapy (54), 711-721. [ Links ]
Barrientos Galarza PO, Torrico MC, Suárez Barrientos E, (2008) Detección de Cryptosporidiumspp y Giardia larnblia en niños inmunodeprimidos del Hospital del iño Ascencio Villarroel de Cochabamba en agosto de 2007. Gaceta Médica Boliviana.
Barron Gonzalez M., (2012). Inhibicion del crecimiento de Giardia lamblia por acción del extracto acuoso y metanolico de semillas de Curcubita pepo. Rev. Iberoamericana para la investigación del Desarrollo Educativo. 9.1-17. [ Links ]
Busatti H., Vieira A., Viana J., Silva H., Souza-Fagundes E., Martins O., Alves R. y Gomes M. (2007). Effect of metronidazole analo-gues on Giardia lamblia cultures, Parasi-tol Res. 102,145-149. [ Links ]
Calzada F, Cerda Garcia C., Mecks M., Cedillo Riveravera R., Mata R. (1999). Geranins A and B new antiprotozoal Atype proantho-cyanidins from Geranium niveum.J. Nat. Prod. 1999(62), 705-709. [ Links ]
Calzada F, Velázquez C, Cedillo-Rivera R, Esquivel B (2003) Antiprotozoal activiy of the constituents of Teloxys graveolens. Phytother Res 17: 731-732. [ Links ]
Cedillo - Rivera R. y Muñoz O. (1992). In vitro susceptibility of Giardia lamblia to albendazole, mebendazole and other che-motherapeutic agents. J Med. Microbiol. 37.221-224. [ Links ]
CondoriS., (2008). Frecuencia de Giardia lamblia en niños de 0 -15 años de edad que acuden al Hospital La Paz durante los meses de junio- agosto 2007.1. [ Links ]
Costa Brandelli C., Brandt R., Attilio G., Tasca T. 2009. Indigenoustraditional medicine: In vitro antigiardial activity of plants used in the treatment of diarrea. Parasitol Res 2009(104), 1345-1349. [ Links ]
GadelhaA.P.R., Vidal F., Castro T., Lopes C.S., Albarello N., Coelho MGP. YCeu Figuei-redo SFL. (2005). Susceptibility of Giardia lamblia to Hovenia dulcis extracts, Parasitol Res (97), 399-407. [ Links ]
González Castro, J., Bermejo Vicedo, M. T y Palacios González, F. (1986). Desenquis-tamiento y cultivo de Giardia muris. Rev Ibérica de Parasitología, 46 (1),21-25. [ Links ]
Karapetyan A.E., 1963, Determination of growth rate of Lamblia intestinalis cultivation in vivo, Acta Protozool, 1:321-326. [ Links ]
Makiuchi T, Nozaki T. Highly (2013) diver-gent mitochondrion-related organelles in anaerobic parasitic protozoa. Biochi-mie. (13)00427-6. [ Links ]
Marrero-Ponce, Y., Torrens, F., Alvarado, Y.J., Rotondo, R., 2006c. Bond-Based Global and Local (Bond, Group and Bond-Type) Quadratic Indices and Their Applications to ComputerAided Molecular Design. 1. QSPR Studies of Diverse Sets of Organic Chemicals. J. Comput. Aided Mol. Des. 20, 685-701. [ Links ]
Martinez - Barrios E. (2011). Prevalencia de Giardiasis en guarderías infantiles de Tiabaya- Arequipa, Perú. Neotrop. Hel-minthol., Asociación Peruana de Helmintología e Invertebrados Afines (APHIA), 5(2), 257-263. [ Links ]
Ponce-Macotela, M.; Peralta-Abarca, G.; Mar-tínez-Gordillo, M. 2005. Giardia intestinalis and other zoonotic parasites: pre-valence in adults dogs from the southern partof Mexico City. Vet. Parasitol., 131:1-4. [ Links ]
Skehan P, Storeng R, Scudiero D, Monks A, McMahon J, Vistica D, etal. New Colorimetric Cytotoxicity Assay for Anticancer-DrugScreening. J Natl Cancer Inst. 1990; 82 (13): 1107-1112. [ Links ]
Tracy, J.W., Catto, B.A., and Webster, Jr., L.T. (1991). Formation of N-(5-nitro-2-thia-zolyl)- N'-carboxymethylureafrom 5-hy-droxyniridazole: Role of aldehyde dehy-drogenase in the oxidative metabolism of niridazole. Drug Metab. Dispos. 19: 508-515. [ Links ]
Upcroft, P. & Upcroft, J. A. Drug targets and mechanisms of resistance in the anaerobic protozoa. Clin. Microbiol. Rev. 14, 150-164(2001). [ Links ]
Wright C., Anderson M., Allen D., Phillipson J.D., Kirby G., Warhurst D. Y Chang H. (1993). Quassinoids Exhibit Greater Se-lectivity Against Plasmodium Falciparum Than Against Entamoeba Histolytica, Giardia Intestinalis OrToxoplasmaGondii In Vitro. The Journal of Eukaryotic Micro-biology. 40(3), 244-246. [ Links ]
Zhang H., Du G., (2004). Assay of mictochondrial functions by resazurin in vitro. Acta Pharmacol Sinica, 25, 385-389. [ Links ]