Revista CON-CIENCIA
versión impresa ISSN 2310-0265
Rev.Cs.Farm. y Bioq vol.2 no.1 La Paz 2014
ARTÍCULOS DE ESTUDIANTES
Amplificación isotérmica mediada por LOOP (LAMP) de ácidos nuclecios en el diagnostico clínico
SÁNCHEZ, EDWIN1 NINA, MARITZA1 AGUIRRE, PAMELA1 ARCE, MAYRA1 TORO, NEYDA1 VILELA, RODRIGO1
1 Estudiantes de 4to año de la Carrera de Bioquímica FCFB - UMSA
FECHA DE RECEPCIÓN: 16 DE ABRIL DE 2014
FECHA DE ACEPTACIÓN 30 DE JULIO DE 2014
Resumen
A medida que va desarrollando la tecnología, los microorganismos también van aumentando su capacidad de virulencia haciéndose más resistentes a los antibióticos de última generación; pruebas de rutina como la Reacción en Cadena de la Po-limerasa (PCR) son herramientas que nos ayudan en el diagnóstico clínico, pero una de las principales desventajas es su alto costo debido al equipamiento que usa y su la larga duración en que esta puede entregar resultados. Para ello es recomendable usar métodos rápidos, sensibles y específicos que nos ayuden en el diagnóstico de enfermedades infecciosas. Un novedoso método que actualmente se usa en países desarrollados es la Amplificación Isotérmica Mediada por Loop (LAMP) de Ácidos Nucleicos. LAMP brinda resultados en menor tiempo con alta sensibilidad y especificidad, necesitando así de un baño maria que funciona a una sola temperatura entre 60°C a 65°C, 4 cebadores como mínimo y 6 como máximo todos ellos altamente especializados, la DNA polimerasa es la Bst po-limerasa la cual tiene actividad desplazante de cadena que proviene de Bacillus stearo-thermofilus; en caso de amplificar RNA se hace uso de una transcriptasa reversa; los resultados pueden ser vistos a simple vista debido a la turbidez que forma después de la reacción, también se pueden usar reactivos como la calceina (método visual por fluorescencia), CYBR green, que dan cierta coloración cuando la reacción se torna positiva. Los países que están en vías de desarrollo son los que más sufren de infecciones por microorganismos, una de las causas se da por la pobreza y mala alimentación siendo así LAMP una buena opción para incorporar como pruebas de rutina en el laboratorio debido a su bajo costo y a su simplicidad en cuanto a equipos.
Palabras clave
amplificación, isotérmica, LAMP, cebador, loop, enfermedades infecciosas
Abstract
As technology develops, the microor-ganisms are also increasing their ability to become more virulent antibiotic resistant generation; routine tests Polymerase Chain Reaction (PCR) are tools that help us in the clinical diagnosis buta major disadvantage is its high cost due to equipment using the length and where it can deliver results. It is therefore advisable to use rapid, sensitive and specific methods to help us in the diagnosis of infectious diseases. A novel method currently used in developed countries is Mediated Isothermal Amplification Loop (LAMP) Nucleic Acids. LAMP provides results in less time with high sensitivity and specificity, thus necessitating a water bath operating at a single temperature of 60°C to 65°C, 4 and 6 primers at least maximum all highly specialized, DNA polymerase is the Bst polymerase activity which is displacing string comes from Bacillus stearothermofilus; in case of amplifying RNA us-ing a reverse transcriptase is made; the results can be seen with the naked eye due to haze that forms after the reaction, can also be used as reagents calcein (fluorescence visual method), CYBR green, giving a coloration when the reaction becomes positive . Countries that are developing are the worst sufferers of microorganism infections, one of the reasons given by poverty and poor diet and LAMP still a good option to incorporate as routine tests in the laboratory due to it's low cost and simplicity in terms of equipment
Key words
amplification, isothermal, LAMP, primer, loop, infectious diseases
INTRODUCCIÓN
La desventaja de los países en vías de desarrollo, es que las personas están predispuestas a contraer enfermedades infecciosas ocasionadas por microorganismos esto debido a la mala alimentación, la pobreza, el alcoholismo, las drogas. En estos países es muy difícil tener los equipamientos de última generación para el buen diagnóstico clínico.
Las pruebas de rutina como el cultivo y la microscopia siguen siendo métodos tradicionales que se usan en el laboratorio, si bien nos brindan resultados confiables estos lo hacen en un tiempo muy extenso. Además existen patógenos que no se los puede cultivar y si se puede tienen un desarrollo muy lento lo cual hace que se limite el diagnostico.
La observación directa de los microorganismos (parásitos, bacterias, hongos) por microscopía es con frecuencia empleado como método de diagnóstico rápido y sencillo. La robustez y relación costoeficiencia de las pruebas microscópicas hacen que sean aceptables para su uso incluso en laboratorios con recursos limitados en los países en desarrollo. Sin embargo, la poca sensibilidad de la prueba puede llegar a tener consecuencias muy graves; la infección viral también ha sido diagnosticada por cultivo selectivo, seguida por la observación en microscopía electrónica. Un gran inconveniente es el tiempo que tarda y por ende inicio tarde del tratamiento. De acuerdo con ello se requieren métodos de diagnósticos rápidos, sensibles y específicos que ayuden al buen diagnóstico.
Métodos moleculares como la Reacción en Cadena de la Polimerasa ( PCR ), Reacción en Cadena de la Ligasa (LCR), Amplificación Basada en Secuencias de Ácidos Nucleicos (NASBA), y Amplificación por Desplazamiento de Cadena (SDA) se comercializan en forma de kits y es introducido en el diagnóstico de rutina lo cual brinda una mayor garantía de obtener buenos resultados. (Yasuyoshi Mori, Tsugunori Notomi 2009).
En el año 2000, Notomi y colaboradores, publicaron un estudio sobre una nueva prueba molecular llamada LAMP, que consiste en la amplificación de ácidos nucleicos en condiciones isotérmicas. El protocolo de laboratorio para aplicar LAMP acaba de ser examinado y los autores insisten en que, como la señal química de reconocimiento es altamente sensible, el sistema permite la discriminación visual de resultados sin equipos especializados costosos. La empresa Eiken Chemical Company, Ltd. es líder actual en la tecnología de LAMP. (Arroyo, M. I. et al. 2008)
PROPIEDADES DE LAMP
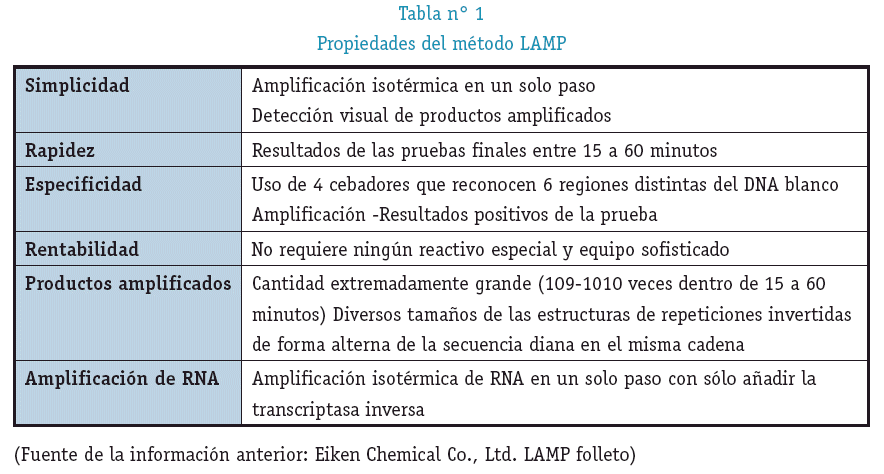
Amplificación Isotérmica Mediada por loop (LAMP) de ácido nucleico amplifica el DNA blanco con alta especificidad, eficacia y rapidez bajo condiciones isotérmicas, que se lleva a cabo a una temperatura constante (entre 60 °C - 65 °C), utiliza una Bst polimerasa con actividad desplazante de cadena. En la tabla N° 1 se muestran las propiedades de LAMP.
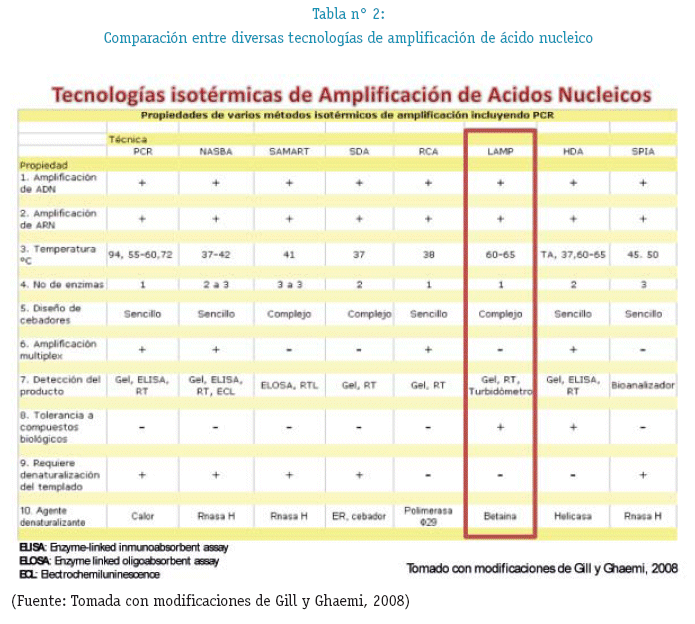
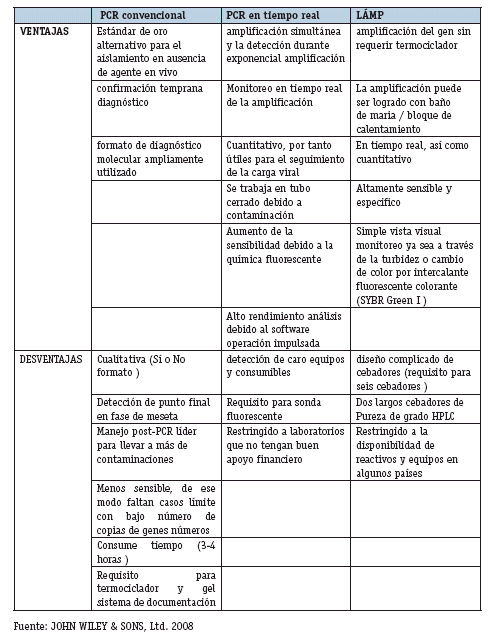
La principal ventaja de LAMP en comparación de la PCR y otros métodos de amplificación de ácidos nucleicos es que no requiere termocicladores, ya que puede llevarse a cabo en dispositivos de calefacción simples tales como baño maria o bloque de calor de laboratorio. (Oriel M. M. Thekisoe and No-boru Inoue 2011). En la tabla N° 2 se muestras las diferencias que tiene LAMP con otros métodos que también son usados en el diagnóstico clínico.
CEBADORES
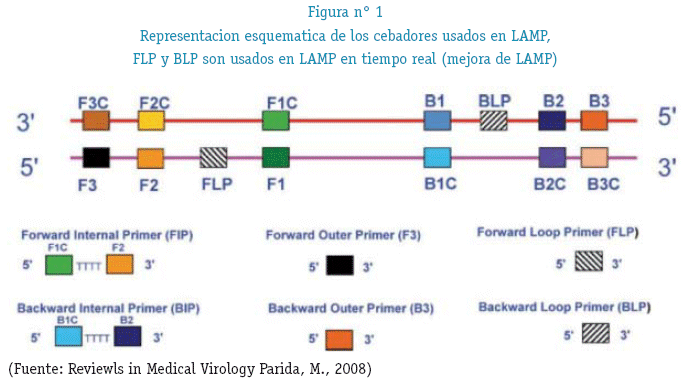
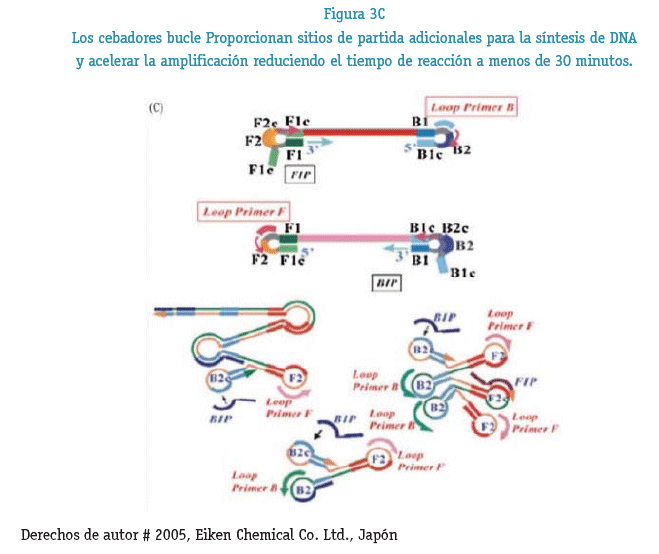
Para llevar a cabo la reacción de LAMP se necesitan un numero de 4 hasta 6 cebadores; 2 cebadores externos F3 y B3, 2 cebadores internos FIP (F1C, F2) y BIP (B1C, B2) que tienen secuencias tanto sentido y antisentido de tal manera que ayuda en la formación de un bucle, 2 cebadores bucle F(FLP) y B(BLP) diseñados para acelerar el reacción de amplificación mediante la unión adicional a sitios que no son accesibles por los cebadores internos. Reconociendo un total de 8 secuencias distintas del DNA blanco (Figura N°1) todos estos cebadores son los que le dan la especificidad al método.
Los cebadores internos se denominan Forward Inner Primer (FIP) y Bac-kward Inner Primer (BIP), respectivamente, y cada uno contiene dos secuencias distintas que corresponden a las secuencias sentido y antisentido del ADN blanco, uno para cebar en la primera etapa y el otro para auto-cebarse en etapas posteriores. Las secuencias (23-24 nucleótidos típicamente) dentro de ambos extremos de la región blanco para la amplificación en un ADN son denominadas F2c y B2, respectivamente. Dos secuencias internas (23-24 nucleótidos típicamente) a 40 nucleótidos de los extremos de F2c y B2 son designadas F1c y B1 y dos secuencias (17-21 nucleótidos) externas a los extremos de F2c y B2 son denominadas F3c y B3. Las secuencias de FIP y BIP son diseñadas así: FIP contiene F1c, un espaciador de TTTT y la secuencia F2 complementaria a F2c. BIP contiene la secuencia B1c complementaria a B1, un espaciador de TTTT y a B2. Los dos cebadores externos consisten en B3 y la secuencia F3 complementaria a F3c. (Arroyo, M. I. et al. 2008)
El contenido de GC de los cebadores debe ser aproximadamente del 50-60% y alrededor de 40-50 % para AT. Los cebadores deben ser diseñados de manera que no se forme fácilmente estructuras secundarias. La secuencia del extremo 3' no debe ser rica en AT o complementarias de otros cebadores. La distancia entre el extremo 5' de F2 y B2 debería ser 120 - 180pb, y la distancia entre F2 y F3 así como de B2 y B3 debe ser 0-20pb. La distancia para las regiones de formación de bucle (5' de F2 a 3' de F1, 5' de B2 a 3' de B1) debe ser 40-60pb. (Parida, M. et al. 2008)
AMPLIFICACIÓN
Se lleva a cabo en dos pasos: no cíclico y cíclicos. Extraido de (Ushikubo H. Principle of LAMP method a simple and rapid gene amplification method. Uirus 2004; 54(1): 107-112.)
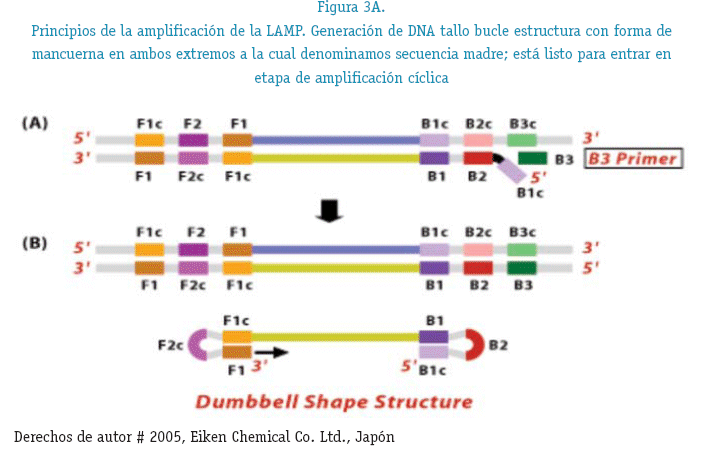
NO CÍCLICO .- Los cebadores inician su acción en dirección 5'->3', el primer cebador en interactuar con el DNA blanco es el FIP el cual se une a su región complementaria F2c y así comienza a sintetizar la hebra complementaria del DNA blanco (figura 3A), el siguiente cebador en interactuar es el F3 uniéndose a la región F3c complementaria del DNA blanco, la Bst polimera-sa tiene una cualidad, esta actúa también como helicasa lo que ocasiona que la doble hebra se abra y la F3 pueda seguir con su camino; por el otro extremo tanto BIP como B3 siguen los mismo paso, la hebra complementaria simple cadena hace que por complementariedad sus extremos formen un loop o buble esta hebra es la que servirá como secuencia madre para la posterior síntesis de DNA.
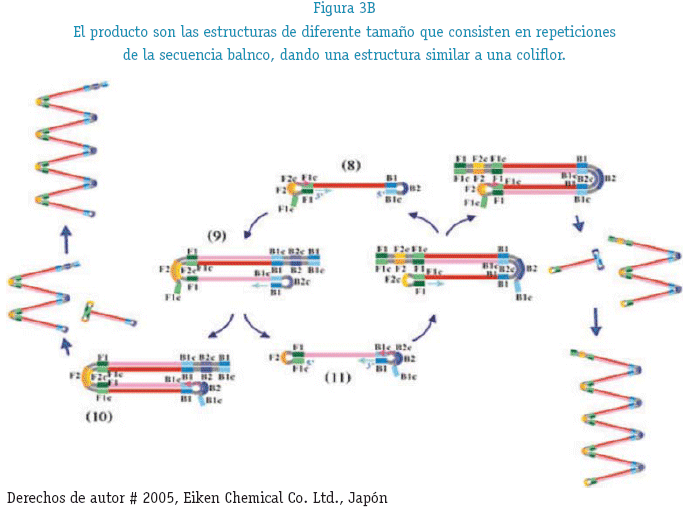
CICLIZACIÓN.- (figura 3B) En la secuencia madre, interactúan nuevamente el cebador FIP donde la región F2 se una a su región F2c de la hebra complementaria realizando la hibridación así como también por el otro extremo BIP donde la región B2 se une a su región B2c de la hebra complementaria, en el transcurso de la polimerización las secuencias sintetizadas van adquiriendo una forma de coliflor.
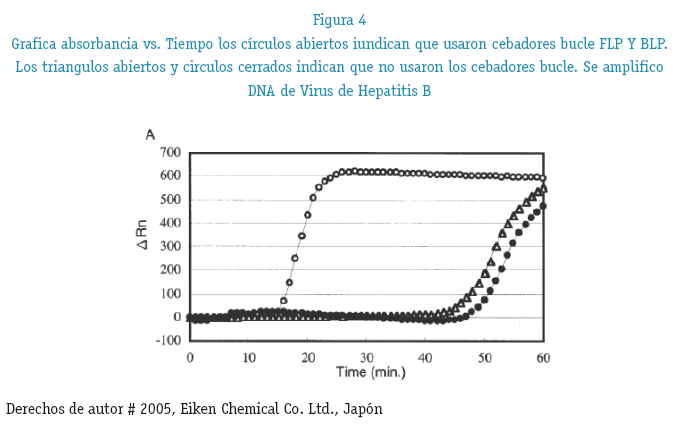
Los cebadores bucle tanto FLP como BLP son los que se utilizan en LAMP EN TIEMPO REAL la cual brinda las primeras señales a los 11 minutos de iniciada la reacción (K. Nagamine, T. Hase and T. Notomi 2002) (figura 4)
Para mejor comprensión del mecanismo de LAMP puede visitarse la página electrónica: vimeo.com/13391184
AMPLIFICACIÓN DE RNA
Se lleva a cabo mediante Transcripción Inversa (RT -LAMP) donde además de los reactivos de DNA para la amplificación (cebadores, ADN polimerasa con actividad de desplazamiento de hebra, sustratos, etc ) se añade trans-criptasa inversa . La detección se puede llevar a cabo en un solo paso. (Parida, M. et al. 2008)
Bst polimerasa
LAMP utiliza Bst polimerasa con temperaturas óptimas oscilan entre 60-65°C y se inactiva a 80°C. Aunque la temperatura de almacenamiento recomendada es - 20°C, la Bst polimerasa es relativamente estable fuera de la cadena de frío durante más de 14 días. La Tabla 3 muestra las características de ADN polimerasa Bst en comparación con la ADN polimerasa Taq que es ampliamente utilizado en la PCR.
Sensibilidad y Especificidad
(Hidekazu Takagi, Makoto Itoh, Mohammad Zahidul Islam, et al. 2009 en su artículo Sensitive, Specific, and Rapid Detection of Leishmania donova-ni DNA by Loop-Mediated Isothermal Amplification) trabajan con parásitos del genero de Leishmania. Para determinar la sensibilidad diluyen una serie de muestras de DNA de L. donovani que va de 100pg a 1fg de concentración, el producto de amplificación se detectó en todas las muestras (Figura 5Ay B) . Por el contrario, con el PCR convencional, la muestra 1fg era demasiado débil para ser juzgado positivo o negativo (Figura 5C carril 6). La PCR anidada mostró un reacción positiva en 100pg hasta 1fg (Figura 5D). Evaluando la sensibilidad de la LÁMP, 20-25 alícuotas con 1fg, 20 (80 %) de 25 alícuotas fueron positivos. Con 100pg, 1 (5 %) de 20 eran positivo. En un experimento similar usando una PCR convencional, 1(7 %) de los 15 resultados de la prueba fue positiva con 1fg de DNA del parasito. La PCR anidada amplificada 11 (55 %) de 20 muestras con 1fg, pero ninguno de los 20 con 100pg . Estos resultados indicaron que nuestra LAMP fue más sensible que la PCR anidada.
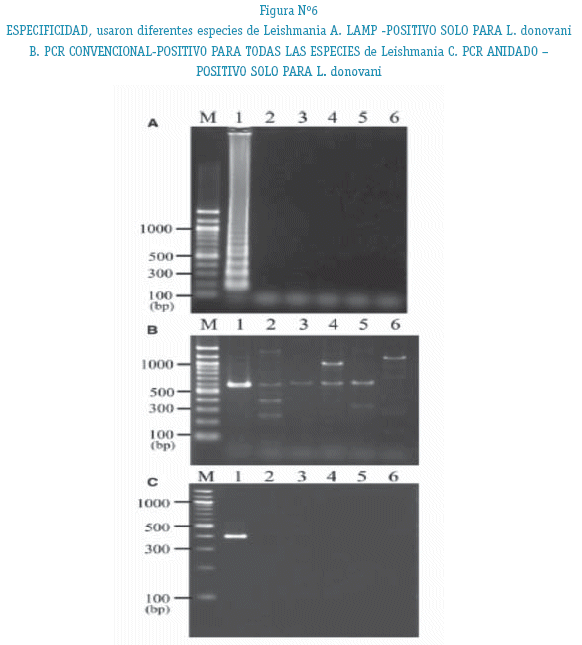
Para evaluar la especificidad de LAMP, fueron examinados las muestras de DNA de las otras cinco especies de Leishmania (L. infantum, L. major, L. mexicana, L. tropica, y L. braziliensis ). Cuando se usó 100ng de ADN para cada muestra de Leishmania, el producto de amplificación no fue detectado (Figura 6A). El mismo resultado se obtuvo con la PCR anidada (Figura 6C). Varios productos de amplificación fueron detectados con la PCR convencional, pero tenían inesperado tamaños (Figura 6B, carriles 2-6). Estos resultados mostraron que la LAMP era específico para la detección de L. donovani.
MÉTODOS DE DETECCIÓN DE LAMP
Turbidez

Detección visual por fluorescencia
La calceína en el reactivo de detección fluorescente de LAMP fue combinada inicialmente con iones de magnesio para conseguir el efecto de amortiguación. La amplificación genera el subproducto, iones pirofosfato, los cuales se unirán y quitarán iones manganeso de la calceína para irradiar fluorescencia. La fluorescencia es intensificada mucho más a medida que la calceína se combina con los iones magnesio. En consecuencia, la presencia de fluorescencia puede indicar la presencia del gen blanco y la detección visual puede lograrse.
Detecccion visual por sustancias que se integran al producto.

Electroforesis
Se hace uso de geles de agarosa para separar los productos de amplificación obtenidos.
VENTAJAS Y DESVENTAJAS DE LAMP FRENTE A OTRAS PRUEBAS
DISCUSIÓN
LAMP es un método que fue estudiado por Notomi et al. el año 2000. A partir del cual surgieron muchas investigaciones tanto en el diagnostico clínico en animales (Ikadai, H., Tanaka, H., et al.(2004) Molecular Evidence of Infections with Babesia gibsoni Parasites in Japan and Evaluation of the Diagnostic Potential of a Loop-Mediated Isothermal Amplification Method. American Society for Microbiology 42 (6) 2465-2469) como en humanos, tambien se realizaron estudios a nivel de enfermedades infecciosas causadas por alimentos (Ohtsuka K., Yanagawa K., et al. Detection of Salmonella enterica in naturallycontaminated liquid eggs by loop-mediated isothermal amplification, and characterization of Salmonella islotes appl Environ microbiol (71) 2005 6730.6735) indican que no se inhibio la reacción con los componentes que tiene el huevo, un caso contrario a este (Wang, D., Huo, G., Wang, F., Li, Y. and Ren, D. Drawback of loop-mediated isothermal amplification 083-086 (2008).) indican que si no se usa el kit para la extracción del DNA de Sall-monella la LAMP sale menos sensible y contrariamente si se usa el kit sale altamente sensible.
Boehme, C. C.,et al. (2007) pp1936-1940 menciona que la prueba es tan facil de realizar que hasta un técnico sin conocimiento la podria realizar, tambien indica que los inhibidores presentes en la sangre no afectan en la reacción y asi refuerza sus resultados con ( Poon et al. 2005) que trabajo con Malaria.
Iwamoto, T., Sonobe,T. and Hayashi, K. (2003) 2616-2622 mencionan que las especies de Micobacterias se pueden identificar en 35 min de un cultivo en medio sólido y en 60 minutos a partir de un cultivo en medio líquido o de esputo muestra de análisis tras la extracción de DNA, concluyen que en el caldo de MGIT usado como medio liquido el numero de células seria minimo al del cultivo en medio solido.
Como ya se habia mencionado antes los inhibidores presentes en diferentes tipos de muestra de alguna forma no afectan a la reacion de LAMP, y debido a la temperatura que se usa ocaciona la formacion de pirofosfato la cual reacciona con el ion magnesio y como consecuencia un medio turbio, en caso de la PCR esto no sucede debido a que el pirofopsfato es hidroliza-do a 94°C.
Relacionando con otros metodos LAMP es el método mas efectivo, si bien muestra igualdad de resultados en cuanto a la PCR nested y la PCR en tiempo real estos métodos son de alto costo y seria muy dificil acoplarlos a paises que se encuentran en vias desarrollo recordando que estos paises son los que mas sufren de enfermedades infecciosas; la utilización de tan solo un baño ma-ria para LAMP hace que podamos optimizar el método en nuestro medio,en Gen Bank ya existen diseños de cebadores para diferntes microorganismos y virus lo cual facilita la incorporacion a un laboratorio.
REFERENCIAS
Adams, E. R., Schoone, G. J., Ageed, A. F., Safi, S. E., and Schallig H. D. F. H. (2010). Development of a Reverse Transcriptase Loop-Mediated Isothermal Amplification (LAMP) Assay for the Sensitive Detection of Leishmania Parasites in Clinical Samples [versión electrónica]. The American Society of Tropical Medicine and Hygiene 82 (4). 591-596 [ Links ]
Arroyo, M. I., Morales, G. P., Sosa, P. A., Car-mona, J., Maestre, A. (2008). Amplificación isotérmica de ácidos nucleicos tipo LAMP para la detección de Plasmodium: nueva técnica diagnóstica [versión electrónica]. Revista de los estudiantes de la Universidad industrial de Santander 21 158-175 [ Links ]
Boehme, C. C., Nabeta, P., Henostroza, G., Raqib, R., Rahim, Z., Gerhardt, M., Sanga, E., Hoelscher, M., Notomi, T., Hase, T. and Perkins, M. D. (2007). Operational Feasibility of Using Loop-Mediated Isothermal Amplification for Diagnosis of Pulmonary Tuberculosis in Microscopy Centers of Developing Countries [version electronica]. American Society for Microbiology 45 (6), 1936-1940
Hidekazu, T., Makoto, I., * Mohammad, Z. I., Abdur, R., A. R. M. Saifuddin, E.,Yoshihisa, H., Eisei, N., and Eisaku, K. (2009). Sensitive, Specific, and Rapid Detection of Leishmania donovani DNA by Loop-Mediated Isothermal Amplification [version electronica]. The American Society of Tropical Medicine and Hygiene 81 (4). 578-582
Iwamoto, T., Sonobe,T. and Hayashi, K. (2003) Loop-Mediated Isothermal Amplification for Direct Detection of Mycobacterium tuberculosis Complex, M. avium, and M. intracellulare in Sputum Samples [versión electrónica]. American Society for Microbiology 41 (6), 2616-2622 [ Links ]
Leo L.M. Poon, Bonnie W.Y. Wong, Edmund H.T. Ma, Kwok H. Chan, Larry M.C. Chow, Wimal Abeyewickreme, Noppadon Tangpukdee, Kwok Y. Yuen, Yi Guan, Sornchai Looareesuwan, and J.S. Malik Peiris (2006). Sensitive and Inexpensive Molecular Test for Falciparum Malaria: Detecting Plasmodium falciparum DNA Directly from Heat-Treated Blood by Loop-Mediated Isothermal Amplification [versión electrónica]. Clinical Chemical 52 (2) 303-306 DOI: 10.1373/clinchem.2005.057901 [ Links ]
Mori Y., Notomi T., (2005) Loop-mediated isothermal amplifi cation (LAMP): a rapid, accurate, and cost-effective diagnostic method for infectious diseases [versión electrónica] J InfectChemother 15, 62-69 DOI 10.1007/s10156-009-0669-9 [ Links ]
Nagamine, K., Hase, T. and Notomi, T. (2002). Accelerated reaction by loop-mediated isothermal amplification using loop primers [version electronica]. Molecular and Cellular Probes 16. 223-229
Notomi, T., Okayama, H., Masubuchi, H., Yonekawa, T., Watanabe, K., Amino, N. and Hase, T. (2000) Loop-mediated isothermal amplification of DNA [version electronica]. NucleicAcids Research 28 (12)
Ohtsuka K, Yanagawa K, Takatori K, HaraKudo Y. (2005) Detection of Salmonella enterica in naturally contaminated liquid eggs by loop-mediated isothermal amplification, and characterization of Salmonella isolates. [versión electrónica] Appl Environ Microbiol 71. 6730-5. [ Links ]
Oriel M. M. Thekisoe and Noboru I. (2011) Molecular Diagnosis of Protozoan Infections by Loop-mediated Isothermal Amplification (LAMP) 1ra edicion [ Links ]
Parida, M., Sannarangaiah S., Kumar Dash P., P. V. L. Rao and Kouichi M. (2008) Loop mediated isothermal amplification (LAMP): a new generation of innovative gene amplification technique; perspec-tives in clinical diagnosis of infectious diseases [versión electrónica] Reviews in Medical Virology DOI: 10.1002/rmv.593 [ Links ]
Wang, D., Huo, G., Wang, F., Li, Y. and Ren, D. (2008). Drawback of loop-mediated isothermal amplification [version electronica]. African Journal of Food Science 2 083-086. online http://www.academi-cjournals.org/ajfs
Zablon Kithinji Njiru, Andrew Stanislaw John Mikosza, Tanya Armstrong, John Charles Enyaru, Joseph Mathu Ndung'u, Andrew Richard Christopher Thompson (2008). Loop-Mediated Isothermal Amplification (LAMP) Method for Rapid Detection of Trypanosoma brucei rhodesiense [versión electrónica]. PLOS Neglected Tropical Diseases 2, Retrieved from www.plosntds.org [ Links ]












 uBio
uBio