Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Revista CON-CIENCIA
versión impresa ISSN 2310-0265
Rev.Cs.Farm. y Bioq vol.2 no.1 La Paz 2014
ARTÍCULOS DE ESTUDIANTES
Desarrollo de un metodo analitico indicador de estabilidad y biodisponibilidad en vitro por hplc para microencapsulado de acido acetilsalicilico y cafeina
CHOQUE, CRISTIAN1
1Laboratorio de Control de Calidad de Medicamentos FCFB-UMSA
CORRESPONDENCIA: CRISTIANDR@LIVE.COM
FECHA DE RECEPCIÓN: 16 DE ABRIL DE 2014FECHADEACEPTACIÓN30DEJU
FECHA DE ACEPTACIÓN 30 DE JULIO DE 2014
Resumen
Se desarrollo de un método analítico indicador de estabilidad y biodisponobilidad por HPLC (Cromatografía Liquida de Alta Resolución) para la determinación de Ácido Acetilsalicílico y su producto de degradación el Ácido Salicílico además de la determinación de la cafeína en una forma farmacéutica sólida en este caso un granulado. Para establecer la valides del método analítico se determinaron los parámetros de especificidad, linealidad e intervalo, precisión, exactitud, límite de cuantificación y límite de detección utilizando un Cromatografo Liquido de Alta Resolución HPLC Agilent, una columna cromatografíca con un base de sílice unida químicamente a una cadena hidrocarbonada de 18 átomos de carbono L1 según USP (Farmacopea de los Estados Unidos) una fase móvil compuesta de 85% de Fosfato Monobásico de Sodio a una concentración 25mM ajustado a pH 2,4 y 15% de Acetonitrilo grado HPLC, este método fue utilizado para la cuantificación del Ácido Acetilsalicílico y Cafeína un granulado que contiene manitol, alcohol, colorante FD&C Yellow N°6, sacarina, aroma naranja spray, bicarbonato de sodio, ácido cítrico, copovidona, copolimero del ácido meta acrílico como agente de recubierta entérica. Luego se determinó la Biodis-ponibilidad in vitro del Ácido Acetilsalicílico micro encapsulado con un agente de recubierta entérica y además de la cafeína en el cual se evidencio que el método analítico tiene la capacidad de cuantificar estos principios activos en una primera etapa sometidos dos horas en fluido gástrico simulado y a partir de ahí una hora en fluido intestinal simulado en el equipo de disolución in vitro Pharma Test
Palabras clave
Validación, Biodisponibilidad, estabilidad, HPLC
Abstract
Is developing a stability indicator and biodisponobilidad analytical method by HPLC ( High Resolution Liquid Chromatography ) for the determination of acetylsalicylic acid and its degradation product Salicylic Acid plus the determination of caffeine in a solid dosage form in this case a granules . To establish the validity of the analytical method parameters specificity, linearity and range, precision, accuracy, limit of quantification and limit of detection using a liquid chromatograph Agilent High Resolution HPLC, column chromatography with silicabased chemically bonded were determined a hydrocarbon chain of 18 carbon atoms, L1 according to USP ( United States Pharmacopeia ) a mobile phase composed of 85% monobasic sodium phosphate adjusted to a concentration of 25 mM at pH 2.4 and 15% HPLC grade acetonitrile, this method was used for the quantification of acetylsalicylic acid and Caffeine granules containing mannitol, alcohol, FD & C Yellow No. 6, saccharin, flavor orange spray, sodium bicarbonate, citric acid, copovidone, copolymer of meta acrylic acid as an agent for enteric coating. Bioavailability vitro micro encapsulated aspirin with enteric coating agent and in addition to caffeine which was evident that the analytical method is the ability to quantify these active ingredients in a first step subjected two hours gastric fluid was then determined simulated and from there an hour in simulated intestinal fluid in vitro dissolution equipment Pharma Test
Key words
validation, bioavailability, stability, HPLC
INTRODUCCIÓN
La tematica actual "Validacion de Metodologias Analiticas Indicadoras de Estabilidad y Biodisponibilidad" tiene una importancia fundamental en el area de la produccion y control de calidad de los medicamentos, la USP (Farmacopea de los Estados Unidos) refiere metodos para el analisis de los principios activos que tienen ciertas particularidades que hacen dificultosa su reproduccion en otros paises como en Bolivia, por ello se dessarrollo un metodo Analitico Indicador de Establidida y Biodisponibilidad en el Laboratorio de Control de Calidad de Medicamentos de la Facultad de Ciencias Farmaceuticas y Bioquimicas de la Universidad mayor de San Andres.(USP.2009:1730-31)
ESTABILIDAD DE MEDICAMENTOS
La estabilidad de medicamentos es la extension del tiempo en el que un producto farmaceutico terminado mantiene entre limites especificados las mismas propiedades que tenia en el momento de su manufactura (propiedades fisicas, quimicas, microbiologicas, biofarmaceuticas, fisicoquimicas, terapeuticas y toxicologicas) despues de un proceso de manufactura definido y en un envase primario y secundario.(OMS,Informe 43.2009.anexo 4)
En el caso del Ácido Acetilsalicílico se requiere de un método analítico validado con la capacidad de cuantificar a este principio activo y su producto de degradación el Ácido Salicílico como se muestra en la siguiente imagen: (Connors, K.A.1986. pp:8-12)
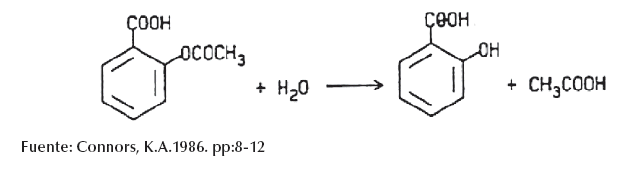
Los parámetros fundamentales para la Validación de un método Analítico los siguientes:
Especificidad y Selectividad
Linealidad e Intervalo de Análisis
Precisión
Exactitud
Límite de Detección y Limite de Cuantificación(Quattrochi, O.A.1992. pp:107-20)
Especificidad
Es la pertinencia del instrumento para detectar un analito. (Quattrochi, O.A.1992.)
Selectividad
Capacidad de un método analítico para identificar y/o cuantificar simultánea o separadamente los analitos de interés de manera inequívoca en presencia de otras sustancias químicas que puedan estar presentes en la muestra. (Quattrochi, O.A.1992.)
Linealidad e intervalo de analisis
Capacidad del Método de proporcionar resultados que son directamente (o por medio de transformaciones matemáticas) proporcionales a la concentración del analito dentro de un intervalo establecido. (Quattrochi, O.A.1992.)
Precisión
Capacidad del método de tener concordancia (menor grado de dispersión) entre una serie de datos de tomas múltiples a partir de una misma muestra(Quattrochi, O.A.1992.)
Exactitud
Capacidad del Método Analítico de expresar la proximidad del valor aceptado convencionalmente como verdadero o un valor de referencia, con el valor experimentalmente encontrado. (Quattrochi, O.A.1992.)
Sensibilidad
Dentro de la sensibilidad se encuentran el Límite de Detección y Límite de Cuantificación que se definen de la siguiente manera: (Quattrochi, O.A.1992.)
Limite de cuantificación
La mínima cantidad de analito en la muestra que se puede cuantificar bajo las condiciones experimentales descritas con una adecuada precisión y exactitud(Quattrochi, O.A.1992.)
Limite de detección
La mínima cantidad del analito en la muestra que se pueda detectar aunque no necesariamente cuantificar bajo las condiciones Experimentales del Método Analítico. (Quattrochi, O.A.1992.)
Objetivo del estudio
Desarrollar un Método Analítico indicador de Estabilidad y Biodisponibilidad para el Ácido Acetilsalicílico por cromatografía liquida de alta resolución (HPLC)
Materiales y métodos

El método analítico esta relacionado con las directrices de "Introducción a la HPLC" el cual da el soporte técnico científico para el desarrollo de métodos analíticos indicadores de estabilidad y biodisponibilidad.
Se utilizaron Ácido Acetilsalicílico, ácido Salicílico y Cafeína Anhidra Estándares de trabajo de referencia obtenidos por normalización interna.
RESULTADOS
Sistema Cromatografico
Longitud de Onda: 215nm
Fase Móvil: Mezcla Filtrada por 0.45 micrómetros con la siguiente composición:
85% de un solución amortiguadora de Fosfato Monobásico de Sodio (NaH2PO4) a una concentración 25mM ajustado con Ácido Fosfórico a pH=2.4
15% de Acetonitrilo (ACN) Diluyente: Fase móvil
Fase Estacionaria: Columna Cromatográfica C18 base de Silica unida a una Cadena Hidrocarbonada de 18 átomos de carbono (L1 según USP).
Flujo: 2ml/min
Volumen de Inyección: 20 microlitros(Quattrochi, O.A.1992.)
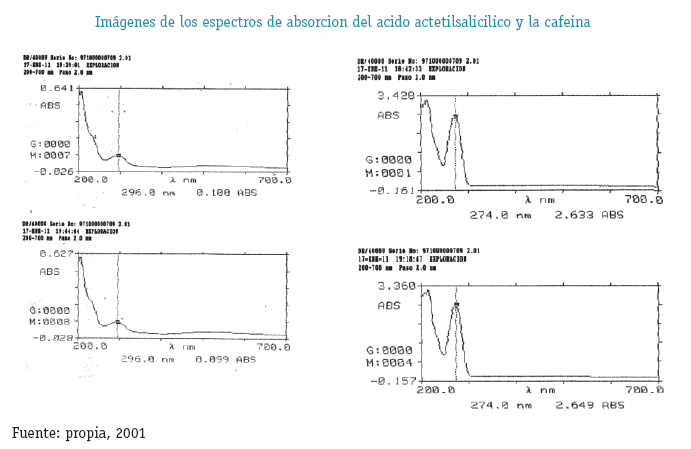
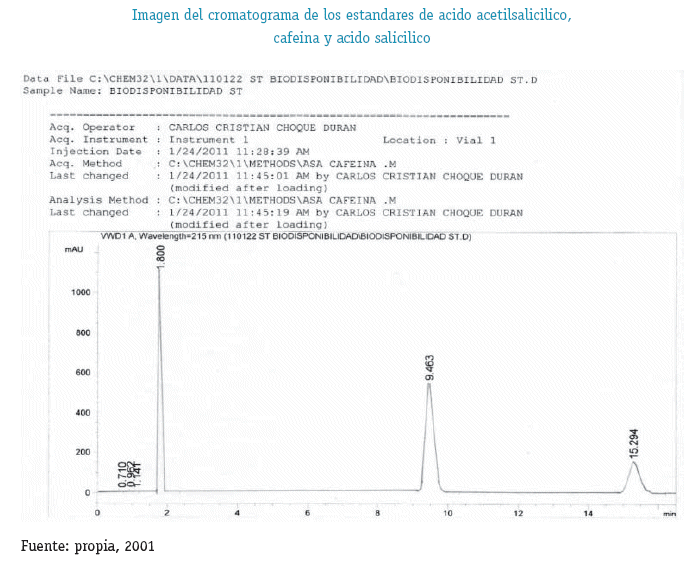

El método es SELECTIVO ya que la resolución entre los picos del Ácido Acetilsalicílico la Cafeína y el Ácido Salicílico tienen un valor mayor a 2.
Además el Método Analítico es Indicador de Estabilidad ya que puede Analizar de manera separada al producto de degradación del Ácido Acetilsalicílico.
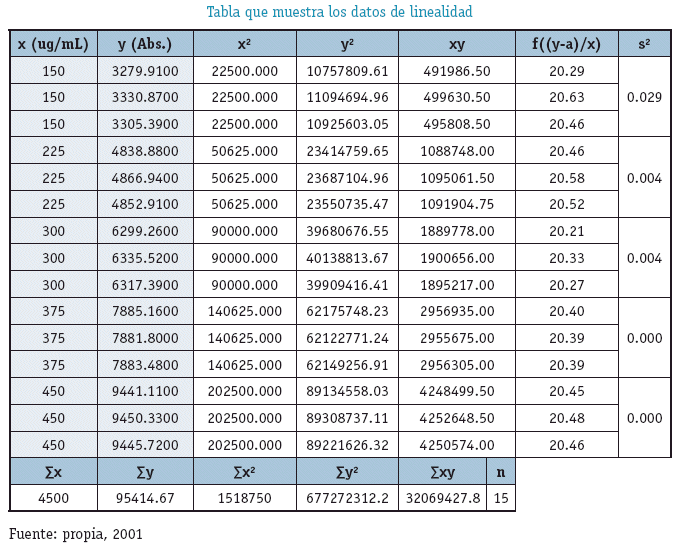
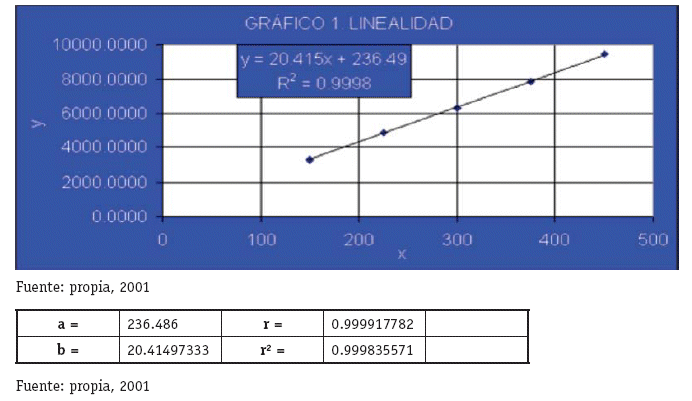

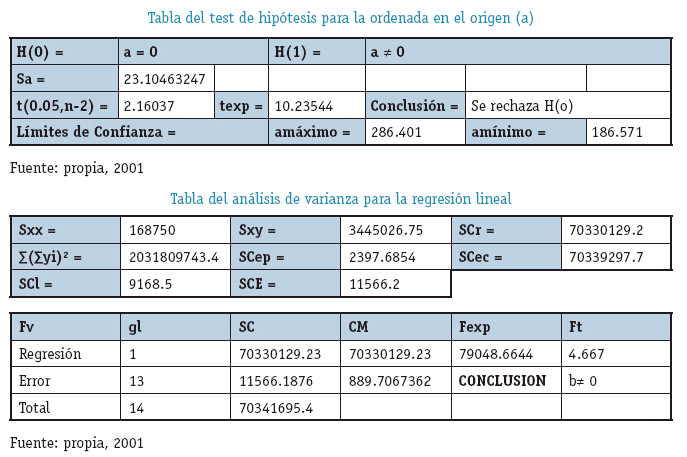
INTERPRETACIÓN
Los resultados evidencian que el Método Analítico es LINEAL en el intervalo de concentraciones Establecido.
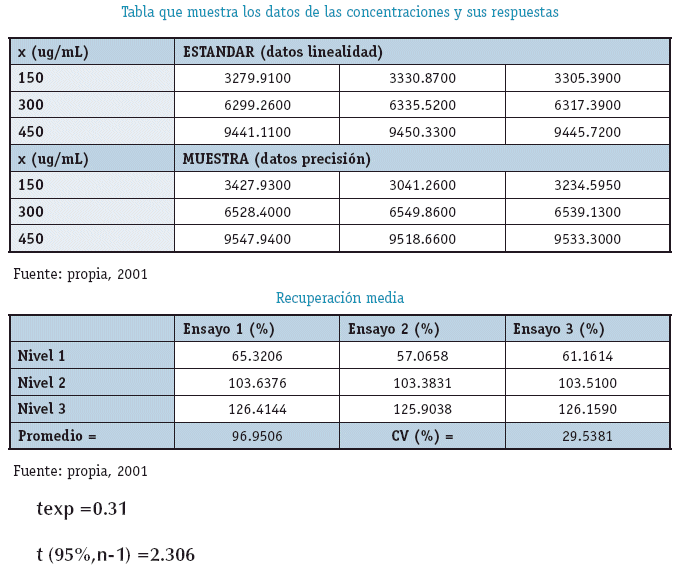
PRESICIÓN
Experimento
Se trabajó con soluciones estándar en concentraciones de 150, 300 y 450 microgramos por mililitro de Cafeína y se obtuvieron los siguientes resultados.
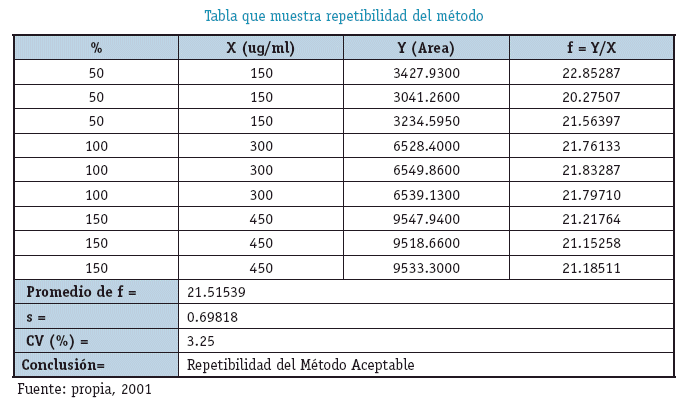
CRITERIO DE ACEPTACION
CV Teórico menor a 6.71%
INTEPRETACIÓN
El Coeficiente de Variación obtenido de los factores de respuesta es de 3.25% menor al Coeficiente de variación Teórico que es 6.71% por lo que se concluye que el método es PRECISO.
EXACTITUD
Experimento
Se prepararon soluciones Estándar y Muestra de concentraciones de 50 a 150%(21)
Principio Activo Puro
Muestra que contiene al principio Activo
INTERPRETACION
El Método Analítico es Exacto ya que el valor de t de Student Experimental es menor que el valor Estadístico de Tablas.
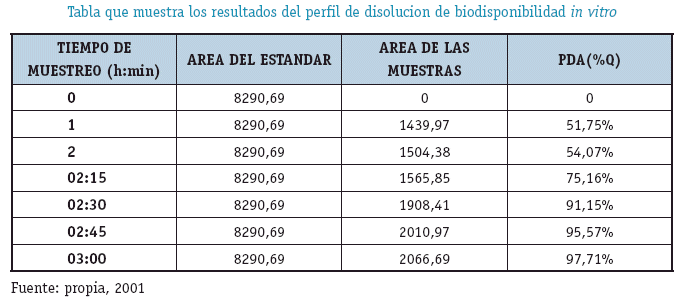
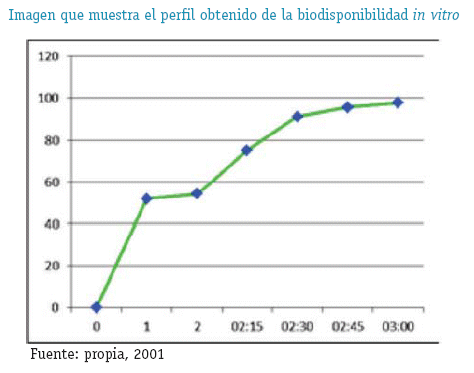
Resultados del Límite de Detección y Limite de Cuantificación (Pérez, J.A. y Forn M.P 2001.pp: 45-94)
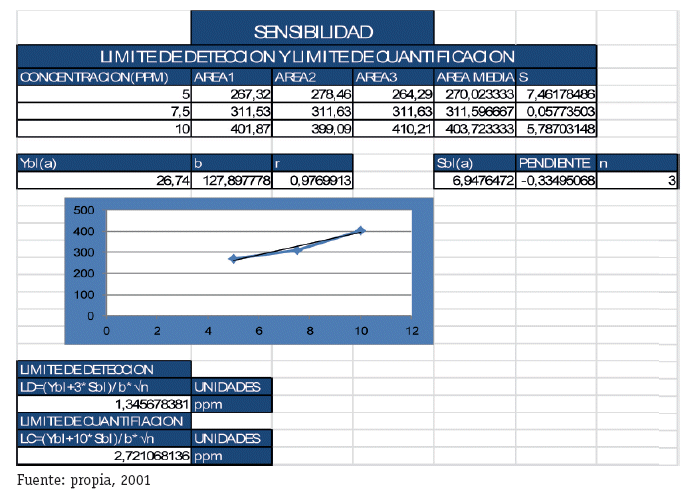

Experimento
Para realizar el experimento se recurrió un equipo de Disolución in Vitro armado con el Aparato 1 (canastilla)

CONDICIONES DE OPERACIÓN DE LA PRUEBA
MEDIO DE DISOLUCION:
750ml de HCl 0.1 N en la Etapa Acida
Añadido de 250ml de Na3PO4 0.2M ajustado a pH 6.8 en la Etapa Amortiguada
TEMPERATURA:
37°C en ambas Etapas VELOCIDAD:100rpm
METODO DE ANALISIS
Cromatografía Líquida de Alta Resolución(HPLC)
ALICUAOTA:
1. 5ml filtrados (OMS .1993.Informe 33. Acapite 2.2)
DISCUSIONES
El método analítico por Cromatografia liquida de alta resolución es capaz de detectar y cuantificar al Ácido Acetilsalicílico y su producto de degradación química el ácido Salicílico por lo que es válido y aceptable bajo los parámetros que exige la Farmacopea de Los Estados Unidos (USP)
AGRADECIMIENTOS
Especial agradecimiento a la Dra. María Luisa Daza Docente de la Facultad de Ciencias Farmacéuticas y Bioquímicas.
A la disponibilidad del Laboratorio de Control de Calidad de Medicamentos de la Facultad de Ciencias Farmacéuticas y Bioquímicas
REFERENCIAS
Comité de Expertos en Especificaciones para preparaciones Farmacéuticas, OMS (2009).Informe 43. Anexo 4 [ Links ]
Comité de Expertos en Especificaciones para preparaciones Farmacéuticas, OMS (1993).Ensayo de disolución para las formas de dosificación oral sólidas. Informe 33. Acapite 2.2 [ Links ]
Connors, K.A. (1986): Chemical Stability of Pharmaceuticals, Nueva York-U.S.A., John Wiley & Sons, pp. 8-12, [ Links ]
Convención de la farmacopea de los Estados Unidos de América (2009): Farmacopea de los Estados Unidos USP-32. Rockvi-lle-Estados Unidos, United Book Press, pp. 1730-31. [ Links ]
Pérez, J. y Forn M. (2001).Asociación Española de Farmacéuticos de la Industria (AEFI) Validación de Métodos Analíticos: Validación de Especialidades Farmacéuticas. Barcelona-España, pp. 45-94 [ Links ]
Quattrochi, O. (1992) Introducción a la HPLC: Cromatografía en Fase Reversa. Buenos-Aires Argentina. Artes Gráficas Farro SA,pp.107-20 [ Links ]
PRORAMAS INFORMATICOS
Microsoft Excel (2010)












 uBio
uBio