Revista CON-CIENCIA
versão impressa ISSN 2310-0265
Rev.Cs.Farm. y Bioq vol.1 no.1 La Paz out. 2013
ARTICULOS DE INVESTIGACIONES FACULTATIVOS DOCENTE
Determinación de valores de referencia hematológicos y bioquímicos en ratones albinos swiss criados y reproducidos en el bioterio de la Facultad de Ciencias Farmacéuticas y Bioquímicas. La Paz - Bolivia
ÁVILA ILLANES, JUAN ANTONIO1
MAMANI CHOQUEHUANCA, BRIGIDA1
RUIZ PINELL, GRACE1
CORRESPONDENCIA: JUAN ANTONIO ÁVILA ILLANES AV. SAAVEDRA N°2224, MIRAFLORES,
LA PAZ-BOLIVIA JUAN_ANTONIO_AVILA@HOTMAIL.COMJUAN_ANTONIO_AVILA@HOTMAIL.COM
1 Instituto de Investigaciones Fármaco Bioquímicas (IIFB), Facultad de Ciencias Farmacéuticas y Bioquímicas, Universidad Mayor de San Andrés.
Resumen
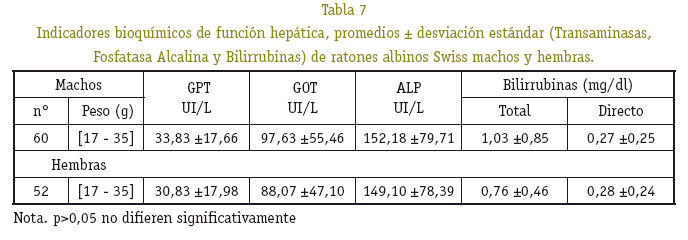
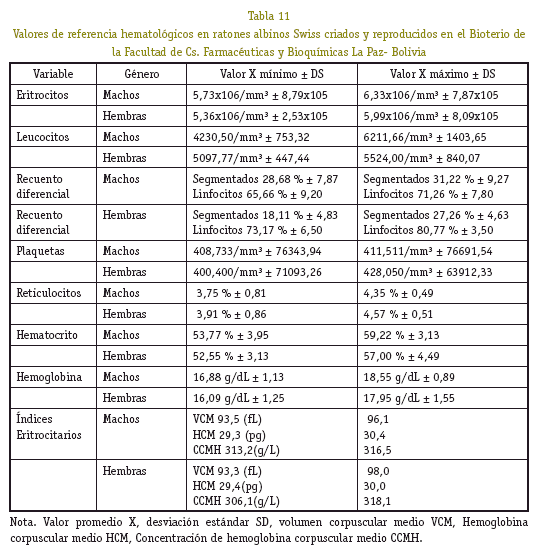
Se ha determinado valores de referencia hematológicos y bioquímicos de función hepática en ratones albinos Swiss machos y hembras de pesos corporales comprendidos entre 15 a 35 g, reproducidos en el Bioterio de la Facultad de Ciencias Farmacéuticas y Bioquímicas de La Paz, Bolivia a 3.600 (m.s.n.m.) para fines de investigaciones biomédicas y farmacéuticas. En las determinaciones se utilizó métodos y técnicas para sangre humana. Los resultados hematológicos: Valores promedios; mínimos y máximos; ± DS, machos (M) y hembras (H) Eritrocitos: (M) 5,73x106/ mm3 ± 8,79x105; 6,33x106/mm3 ± 7,87x105, (H) 5,36x106/mm3 ± 2,53x105; 5,99x106/ mm3 ± 8,09x105. Leucocitos: (M) 4230,50/ mm3 ± 753,32; 6211,66/mm3 ± 1403,65, (H) 5097,77/mm3 ± 447,44; 5524,00/mm3 ± 840,07. Recuento Diferencial: Segmentados (M) 28,68 % ± 7,87; 31,22 % ± 9,27. Lin-focitos (M) 65,66 % ± 9,20; 71,26 % ± 7,80. Segmentados (H) 18,11 % ± 4,83; 27,26 % ± 4,63. Linfocitos (H) 73,17 % ± 6,50; 80,77 % ± 3,50. Plaquetas: (M) 408,733/mm3 ± 76343,94; 411,511/mm3 ± 76691,54, (H) 400,400/mm3 ± 71093,26; 428,050/mm3 ± 63912,33. Reticulocitos: (M) 3,75 % ± 0,81; 4,35 % ± 0,49, (H) 3,91 % ± 0,86; 4,57 % ± 0,51. Hematocrito: (M) 53,77 % ± 3,95; 59,22% ± 3,13, (H) 52,55% ± 3,13; 57,00% ± 4,49. Hemoglobina: (M) 16,88 g/dL ± 1,13; 18,55 g/dL ± 0,89, (H) 16,09 g/dL ± 1,25; 17,95 g/dL ± 1,55. Índices Eritrocitarios: (M) VCM 93,5; 96,1 (fL), HCM 29,3; 30,4 (pg), CCMH 313,2; 316,5 (g/L), (H) VCM 93,3; 98,0 (fL), HCM 29,4; 30,0 (pg), CCMH 306,1; 318,1 (g/L). Los resultados bioquímicos fueron: SGPT/ALT: (M) 33,83 UI/L ± 17,66, (H) 30,83 UI/L ± 17,98. SGOT/AST: (M) 97,63 UI/L ± 55,46, (H) 88,07 UI/L ± 47,10. ALP: (M) 152,18 UI/L ± 79,71, (H) 149,10 UI/L ± 78,39. BT: (M) 1,03 mg/dL ± 0,85, (H) 0,76 mg/dL ± 0,46. BD: (M) 0, 27 mg/dL ± 0,25, (H) 0,28 mg/dL ± 0,24. Los controles de calidad interno que se emplearon, están dentro del margen permitido de precisión (CV<5%) y exactitud (%DVT<10%). El análisis de los indicadores hematológicos guarda relación directamente proporcional al peso corporal de los ratones. Los resultados de función hepática, mostraron gran variabilidad biológica de un ratón a otro.
PALABRAS CLAVE
Ratones albinos Swiss, valores hematológicos, valores bioquímicos.
Abstract
Ithas been determined baseline he-matological and biochemical liver func-tion in male Swiss albino mice and female body weights between 15-35g reproduced in the biotherius Faculty of Pharmaceuti-cal Sciences and Biochemistry of La Paz, Bolivia at 3,600 (m) for purposes of bio-medical and pharmaceutical research. De-terminations were used in methods and techniques for human blood. Hematologi-cal results: Average values; minimum and maximum; ± SD, males (M) and females (F) Erythrocytes: (M) 5,73x106/mm3 ± 8,79x105; 6,33x106/mm3 ± 7,87x105, (H) 5,36x106/ mm3 ± 2,53x105; 5,99x106/mm3 ± 8,09x105. Leukocytes: (M) 4230,50/mm3 ± 753,32; 6211,66/mm3 ± 1403,65, (H) 5097,77/mm3 + 447,44; 5524,00/mm3 ± 840,07. Differen-tial Count: Segmented (M) 28,68 % ± 7,87; 31,22 % ± 9,27. Lymphocytes (M) 65,66 % ± 9,20; 71,26 % ± 7,80. Segmented (H) 18,11 % ± 4,83; 27,26 % ± 4,63. Lymphocytes (H) 73,17 % ± 6,50; 80,77 % ± 3,50. Platelets: (M) 408,733/mm3 ± 76343,94; 411,511/mm3 ± 76691,54, (H) 400,400/mm3 ± 71093,26; 428,050/mm3 ± 63912,33. Reticulocytes: (M) 3,75 % ± 0,81; 4,35 % ± 0,49, (H) 3,91 % ± 0,86; 4,57 % ± 0,51. Hematocrit: (M) 53,77 % ± 3,95; 59,22% ± 3,13, (H) 52,55% ± 3,13; 57,00% ± 4,49. Hemoglobin: (M) 16,88 g/ dL ± 1,13; 18,55 g/dL ± 0,89, (H) 16,09 g/ dL ± 1,25; 17,95 g/dL ± 1,55. Red cell indices: (M) VCM 93,5; 96,1 (fL), HCM 29,3; 30,4 (pg), CCMH 313,2; 316,5 (g/L), (H) VCM 93,3; 98,0 (fL), HCM 29,4; 30,0 (pg), CCMH 306,1; 318,1 (g/L). Biochemical results were: SGPT/ALT: (M) 33,83 UI/L ± 17,66, (H) 30,83 UI/L ± 17,98. SGOT/AST: (M) 97,63 UI/L ± 55,46, (H) 88,07 UI/L ± 47,10. ALP: (M) 152,18 UI/L ± 79,71, (H) 149,10 UI/L ± 78,39. BT: (M) 1,03 mg/dL ± 0,85, (H) 0,76 mg/dL ± 0,46. BD: (M) 0, 27 mg/dL ± 0,25 (H) 0,28 mg/dL ± 0,24. Internal quality controls that were used are within the permissible range of precision (CV <5%) and accuracy (% DVT <10 %). The analysis of indicators re-lated hematological directly proportional to body weight of mice. The results of liver function, showed great biological variability of a mouse to another.
KEY WORDS
Swiss albino mice, hematologic values, biochemical values.
INTRODUCCIÓN
Cada día, alrededor de 25 millones de ratones ayudan a los investigadores de todo el mundo a diseñar tratamientos para diferentes enfermedades humanas, incluyendo el cáncer, las cardiopatías, el virus de la inmunodeficiencia humana (VIH), la malaria, etc. El anuncio de que se acaba de secuenciar más del 95% del genoma de Mus musculus adquiere una trascendencia especial, dadas las similitudes que existen entre el genoma de estos roedores y el humano (Bär, 2004). No sólo es el segundo mamífero cuya secuencia esta completa, sino también un modelo de genética, fisiología y comportamiento, en el que se pueden bloquear genes fácilmente y generar animales transgénicos. Se diría que es el tubo de ensayo que permite investigar sobre muchas condiciones humanas. Este avance adquiere importancia como punto de comparación, para entender la relevancia de los experimentos que se venían haciendo hasta ahora (Quintero, 2008). Los ratones albinos Swiss criados y reproducidos en el Bioterio de la Facultad de Ciencias Farmacéuticas y Bioquímicas (FCsFB) de la ciudad de La Paz a 3.600 m.s.n.m., proporciona ratones aclimatados a este ambiente, proceso que ha llevado al desarrollo de ciertas características bioquímicas, fisiológicas y/o anatómicas que llega ser hereditaria y de base genética permitiendo a esta especie y otras, su supervivencia y reproducción de la forma más ventajosa posible en este ambiente (Aparicio, 2008). Actualmente estos ratones, son usados en estudios de investigaciones biomé-dicas y/o farmacéuticas, llegando a generar respuestas fiables y reproducibles en un experimento. El objetivo del presente estudio busca generar datos que sirvan de referencia respecto a los parámetros hematológicos y bioquímicos de función hepática, empleando métodos y técnicas para determinaciones en sangre humana. Para la fiabilidad de los datos generados se implementó control de calidad interno, de precisión y exactitud en las determinaciones.
MATERIAL Y MÉTODOS
Recolección de la muestra
Las muestras de sangre fueron obtenidas a través de punción cardiaca, tomando en cuenta que su volemia que representa el 7% del peso corporal, aproximadamente entre 1,5 a 2 mL. El volumen de sangre obtenido para las determinaciones hematológicas y bioquímicas fue de 0,8 a 1 mL por cada ratón.
Preparación de los ratones previo a la extracción de la muestras
Los ratones fueron seleccionados al azar, identificados y pesados dándoles todo el confort habitual de su rutina diaria evitando el estrés. Esta etapa es la más importante previo a la extracción de la sangre, ya que el estrés causado por la manipulación e inmovilización suele ocasionar una elevación del hematocrito y recuento de leucocitos así como variaciones en la determinación de pruebas bioquímicas.
Anestesia por inhalación
Para reducir al mínimo el sufrimiento del ratón, se lo anestesió con éter dietílico previo a la extracción de la sangre (Fuentes, 2008).
Extracción de sangre por punción cardiaca
La extracción de sangre cardiaca es la técnica más factible para obtener el volumen suficiente. Se utilizó el protocolo de extracción de sangre por punción cardiaca recomendado por FELASA (Morton, 1993).
RECUENTO CELULAR SANGUÍNEO
Determinación del volumen de EDTA - K3
La cantidad de volumen de anticoagulante EDTA - K3, que se utilizó para el recuento hematológico fue de 10 a 15 uL por cada 1mL de sangre total (Gu-llace, 2001).
Recuento de eritrocitos y leucocitos
El recuento de los eritrocitos y leucocitos se realizó mediante el método manual (recuento en cámara de Neubauer) (Vives, 1997).
Para el cálculo de eritrocitos se empleó la siguiente fórmula:
![]()
RBC = Recuentos de lo hematíes (número de hematíes por mm3 de sangre).
H = Hematíes contados en 5 cuadrantes medianos.
D = Factor de dilución (200)
Para el cálculo de leucocitos se empleó la siguiente fórmula:
![]()
WBC = Recuento de leucocitos (número de leucocitos por mm3 de sangre) L = Leucocitos contados en 4 cuadrantes grandes D = Factor de dilución (20)
Recuento de plaquetas
El recuento de las plaquetas se realizó mediante el método manual en cámara de Neubauer con solución de oxalato de amonio al 1 % monohidrata-do. Se contaron las plaquetas del cuadrante central (lugar de recuentos de glóbulos rojos) en los 5 cuadrantes. El resultado se multiplicó por 1.000, para obtener en mm3 y, correlacionar con la cantidad de plaquetas halladas en el frotis (Botelho, 2001).
Recuento de reticulocitos
Se mezcló sangre total con EDTA-K3, y azul de metileno, la determinación se realizó manualmente (Mckenzie, 1991).
Recuento diferencial de leucocitos o fórmula leucocitaria
Se contaron 100 leucocitos y se calculó el número de cada uno de los tipos de leucocitos que está presente en 1 mm3 de sangre y se determinó a través de la siguiente fórmula:
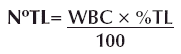
N°TL= Número de un tipo de leucocitos por mm3 de sangre.
WBC= Recuento de leucocitos (número de leucocitos por mm3 de sangre).
%TL= Porcentaje que representa ese tipo de leucocitos
Determinación del hematocrito
El valor del hematocrito (Hto) se determinó, por centrifugación a 1200 rpm en un tubo capilar no heparinizado. El resultado se expresó en porcentaje, método recomendado por el Comité International de Estandarización en Hematología (ICSH) (Botelho. 2001).
Índices eritrocitarios
Se obtuvo del número de hematíes, del hematocrito y de la concentración de hemoglobina en la sangre.
Volumen corpuscular medio (VCM): Es el valor medio de los hematíes.
![]()
Hemoglobina corpuscular medio (HCM): Es el valor medio del contenido de hemoglobina por hematíes.
![]()
Concentración de hemoglobina corpuscular medio (CHCM): Es el valor de la cantidad de hemoglobina en gramos por cada litro (L) de eritrocitos.
![]()
DETERMINACIÓN CUANTITATIVA DE LA HEMOGLOBINA
Método colorimétrico de la cianmetahemoglobina
Se realizó por el método colorimétrico manual de la cianmetahemoglobina con el reactivo de Drabkin concentrado, realizándose paralelamente un control de calidad en precisión y exactitud (Soruco, 2001).
IMPLEMENTACIÓN DE CONTROL DE CALIDAD INTERNO
Se realizó por el método manual de cianmetahemoglobina recomendado por la (ICSH). Se introdujo control de calidad interno tanto de precisión y exactitud (Fernández, 2005). El sistema de control biológico que se utilizó como control de calidad, consistió en una muestra de sangre total con EDTA - K3 obtenido de un ratón escogido al azar, el estándar de hemoglobina y el valor teórico declarado por el fabricante del reactivo.
Control de precisión: Repetibilidad y reproducibilidad
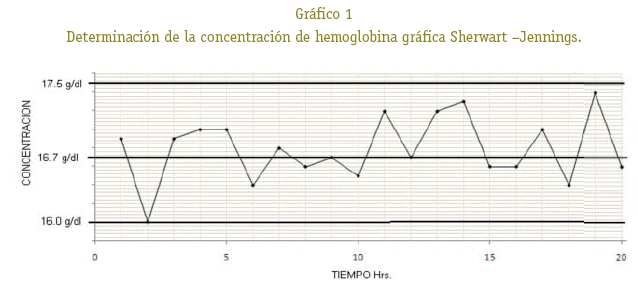
Para el control de calidad de precisión bajo la forma de repetibilidad, se utilizó una muestra de sangre control sin valor declarado, que fue recolectada de un ratón escogido al azar, la muestra fue almacenada por 24 horas y se procesó 20 veces consecutivamente. El ensayo sirvió para introducir este método y controlar el grado de dispersión de las medidas en condiciones óptimas de trabajo. Para el control de calidad de precisión bajo la forma de reproducibilidad, se determinó la concentración de hemoglobina durante 20 veces consecutivamente de una muestra control escogido al azar, en diferentes tiempos y conjuntamente con las muestras de los demás ratones. Las determinaciones se realizaron cada hora por espacio de 20 horas, con los valores obtenidos de la muestra de control se elaboró la gráfica de control Sherwart-Jennings lo que permitió controlar las desviaciones estándares con respecto al promedio, suministrando una imagen de los valores obtenidos en la prueba de precisión, (variabilidad aceptable de CV < 5%) (Vives, 1991).
Control de Exactitud
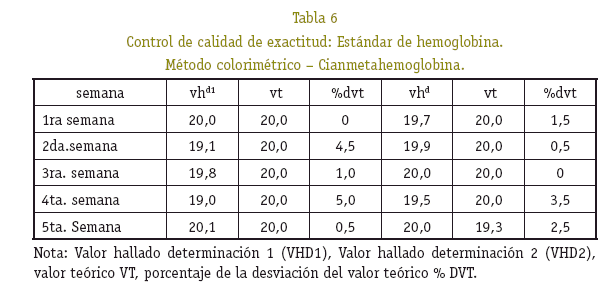
El control de exactitud permitió efectuar un control global del método y la técnica, en la determinación de la concentración de hemoglobina, el cual se realizó paralelamente a la serie analítica de las muestras de los ratones y controles de precisión (Soruco, 2001). Para efectuar este control de exactitud se utilizó el estándar de hemoglobina con una concentración de 20 g/dL, se realizó dos determinaciones una al inicio y otra a la segunda mitad de semana durante cinco semanas, los valores se determinaron con la siguiente fórmula:
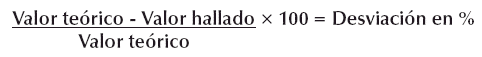
DETERMINACIÓN CUANTITATIVA
Pruebas bioquímicas
Estas determinaciones están diseñadas para ser utilizadas con suero obtenido de sangre total sin anticoagulante, la sangre total se centrifugo por 10 minutos a 5.000 rpm. Se tomó criterios de exclusión como ser: sueros ictéricos, hemolisadosy lipémicos (Fernández, 2005).
Alanina Aminotransferasa (ALT/GPT)
El reactivo de (ALT/GPT) se ajustó a la formulación recomendada por la Federación Internacional de Química Clínica (IFCC). Una vez reconstituido el reactivo (13mMct-Ketoglutarato, 400mM L-Alanina, 0,2 mM NADH, 800 U/L LDH), se pipeteó 1,0 mL de reactivo en un tubo de ensayo, a 37°C para luego añadir 0,10 mL de muestra, se mantuvo la solución a 37 °C durante 60 segundos, y se midió la absorbancia a 340 nm en un equipo STAT - FAX tomando dos lecturas a un minuto de intervalo. Se calculó la media de cambio de absorbancia por minuto ![]() .
.
Aspartato aminotransferasa (AST/ GOT)
Al reactivo de AST se ajusto a la formulación recomendada por la (IFCC) (González, 1998). Una vez reconstituido el reactivo (12 mM 2-Oxoglutarato, 200 mM L-ácido Aspártico, 200 mM L-ácido Aspártico, 0,19 mM NADH, 800 U/L LDH, 600UL MDH, 100 mM Buffer pH 7,8 ± 0,1), se pipeteó 1,0 mL en un tubo de ensayo a 37°C, luego se añadió 100 uL manteniendo la solución a 37 °C durante 60 segundos, se midió la absorbancia a 340 nm en un equipo STAT - FAX tomando dos lecturas de absorbancia a un minuto de intervalo. Se calculó la media de cambio de absorbencia por minuto ![]() .
.
Fosfatasa alcalina (ALP)
El método es una modificación de los métodos de referencia de la Asociación Americana de Química Clínica. Una vez reconstituido el reactivo (P-Ni-trofenil 17 mM, Ión Magnesio 4mM, Buffer (pH 10,2 ± 0,2), se pipeteó 1,0 mL más 25 ![]() de la muestra. Después de un minuto, se midió la absorbancia, repitiendo las lecturas cada minuto durante los próximos dos minutos y se cálculo la diferencia promedio de absorbancia por minuto (Fernández, 2005).
de la muestra. Después de un minuto, se midió la absorbancia, repitiendo las lecturas cada minuto durante los próximos dos minutos y se cálculo la diferencia promedio de absorbancia por minuto (Fernández, 2005).
Bilirrubinas
Se utilizó reactivos para bilirrubinas PLASMATEC (100 ![]() de solución de ácido sulfanílico 30 mM/L, 25
de solución de ácido sulfanílico 30 mM/L, 25 ![]() de solución de nitrito de sodio 50 mM/L, 1,0 mL de solución de cafeína 100 mM/L) y 100
de solución de nitrito de sodio 50 mM/L, 1,0 mL de solución de cafeína 100 mM/L) y 100 ![]() de suero, para la determinación de bilirrubina total y bilirrubina directa (100
de suero, para la determinación de bilirrubina total y bilirrubina directa (100 ![]() de solución de ácido sulfanílico 30 mM/L, 25
de solución de ácido sulfanílico 30 mM/L, 25 ![]() de solución de nitrito de sodio 50 Mm/L, 1,0 mL de solución salina) y 100
de solución de nitrito de sodio 50 Mm/L, 1,0 mL de solución salina) y 100 ![]() de suero, se mezcló y dejó reaccionar por 5 minutos a 25° C, se realizó la lectura a 540 nm.
de suero, se mezcló y dejó reaccionar por 5 minutos a 25° C, se realizó la lectura a 540 nm.
Absorbancia del tubo Total x 17,5 = Bilirrubina Total (mg/dL) Absorbancia del tubo Directo x 17,5 = Bilirrubina Directa (mg/dL) Bilirrubina Total - Bilirrubina Directa = Bilirrubina Indirecta (mg/dL)
Control de precisión y exactitud (suero de control)
Para implementar el control de calidad interno bajo la forma de precisión y exactitud de los métodos utilizados en las determinaciones bioquímicas, se utilizaron dos sueros control liofilizados de valores ya declarados. Se inicio con el suero de control de nivel I, en un segundo periodo se utilizó el suero control de nivel II, estas determinaciones se realizaron paralelamente con las muestras de sueros de los ratones (Sanford, 1985).
RESULTADOS
Recuento celular sanguíneo
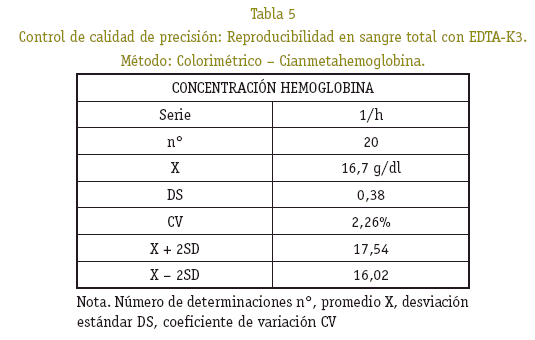
Determinación de la concentración de hemoglobina por el método colorimétrico de la cianmetahemoglobina, control de calidad precisión y exactitud.
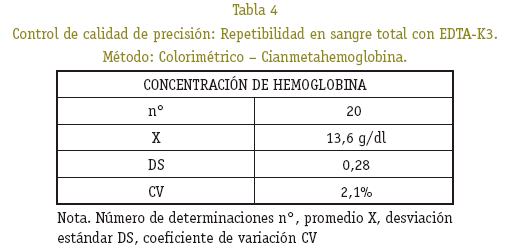
En el gráfico 1 de Sherwart - Jennings se observa una distribución normal, donde las determinaciones realizadas se encuentran dentro de los límites de confianza establecida, por encima y por debajo del promedio, reflejando de esta forma una buena precisión, observándose muy poca variación. La desviación estándar y el coeficiente de variación indican que hubo precisión, donde el error del procedimiento de medición no afecta significativamente la fiabilidad de los resultados de las series analíticas a medir.
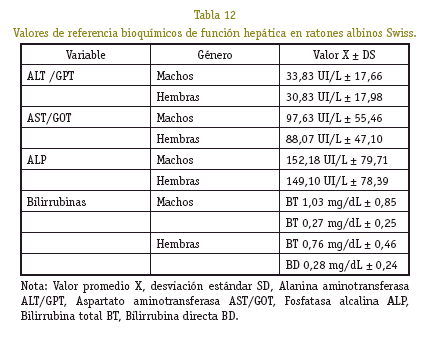
Determinaciones bioquímicas de función hepática.
Determinaciones bioquímicas control de calidad de precisión -exactitud
DISCUSIÓN
Mediante la prueba de "t" Student, se determinó las diferencias significativas (p<0,05) y (p>0,05), a la comparación de las magnitudes medidas de los indicadores hematológicos y bioquímicos de ratones albinos Swiss machos y hembras. La población de referencia se agrupó por género y peso (masa corporal), en 4 grupos, de acuerdo a la repetibilidad de los resultados que mostró una relación directamente proporcional al peso, respecto a los indicadores hematológicos.
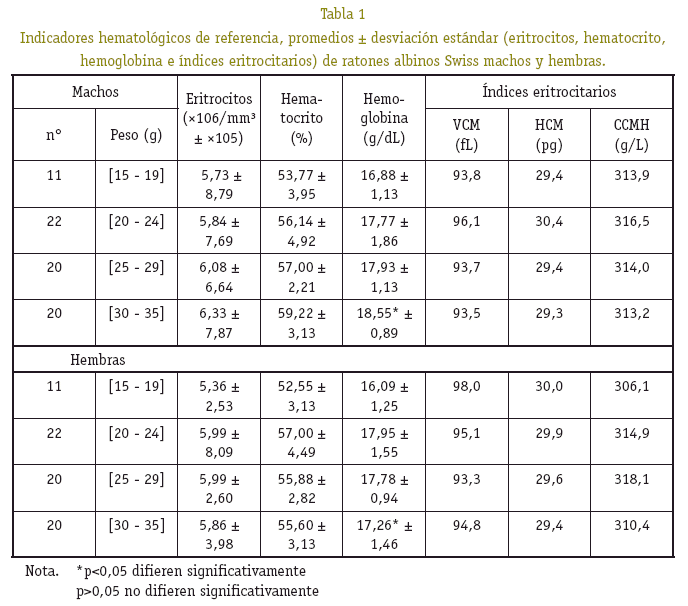
Respecto al número de eritrocitos y del hematocrito no se observó diferencia significativa (p>0,05), en cuanto a la concentración de hemoglobina se observó diferencia significativa (p<0,05). El porcentaje de los elementos de la serie roja, guarda relación directamente proporcional a los grupos de peso (Ver Tabla 1).
Los valores de los índices eritrocitarios: tamaño eritrocitario, el contenido individual de hemoglobina y la concentración de hemoglobina por litro de eritrocitos (VCM, HCM y CCMH), fueron obtenidos a partir de los promedios del hematocrito, concentración de hemoglobina y número de eritrocitos, para citar como valor de referencia por grupo de peso (Ver Tabla 1).
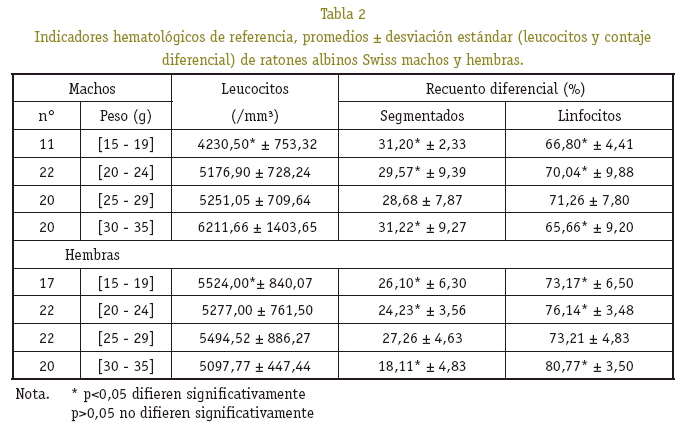
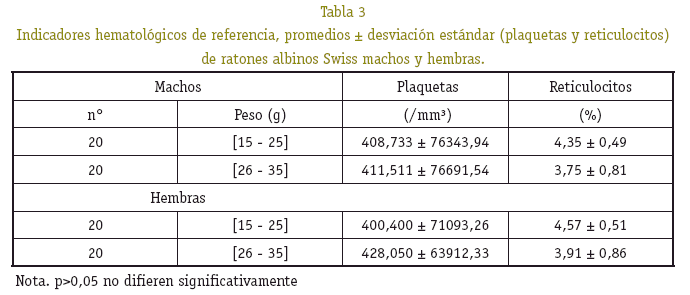
Respecto al número de leucocitos, plaquetas y porcentaje de reticulocitos del grupo de peso entre 15 a 19 g, se observó diferencia significativa (p<0,05), en relación a los demás grupos de peso. Entre machos y hembras no se observo diferencia significativa (p>0,05) (Ver Tablas 2 y 3). En el recuento diferencial de los leucocitos se observó el predominio de dos tipos de células, segmentados y linfocitos en un porcentaje mayor, en los pesos de 15 a 19, 20 a 24 y 30 a 35 gramos se observó diferencias significativas (p<0,05) entre machos y hembras, por lo tanto el porcentaje de cada tipo de célula no guarda relación directamente proporcional con los grupo de peso (Ver Tabla 2).
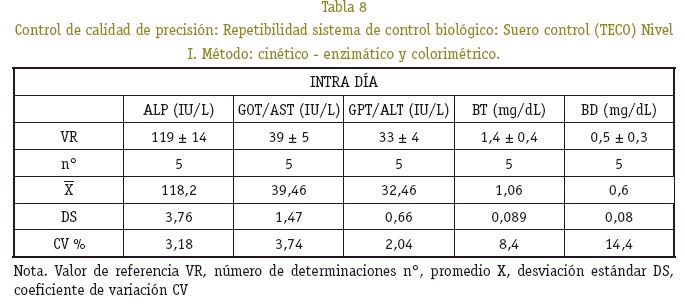
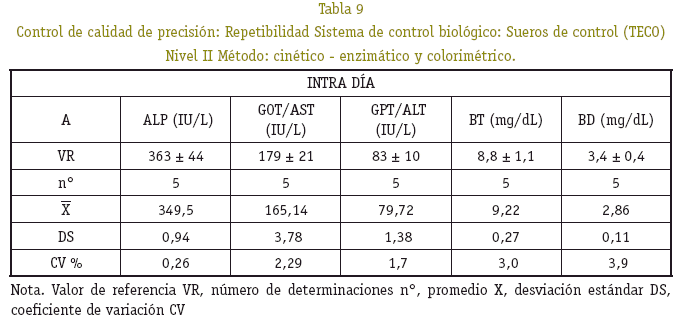
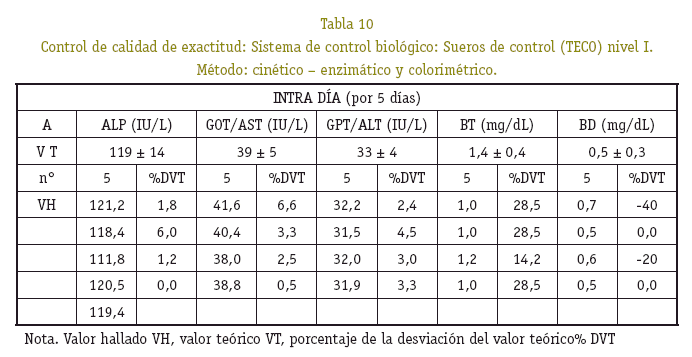
Los resultados en la cuantificación de hemoglobina control, al ser procesado conjuntamente con las muestras estudiadas, se observó que están dentro del rango de precisión, no superan el coeficiente de variación del 5% y exactitud del 10% de la desviación del valor teórico (Ver Tablas 4, 5 y 6).
Se tomaron en cuenta los resultados de transaminasas, fosfatasa alcalina y bilirrubinas en un sólo grupo de peso de 17 a 35 g, por la variabilidad que mostró cada uno de los resultados, asumiendo que la actividad metabólica hepática difiere de un ratón a otro. Los promedios y la desviación estándar de las magnitudes bioquímicas medidas de ratones machos y hembras no mostró diferencia significativa alguna (p>0,05) (Ver Tabla 7). La precisión bajo la forma de repetibilidad y exactitud, en la determinación de la concentración de la fosfatasa alcalina (ALP), transaminasas (ALT/GPT y AST/GOT), bilirrubinas total y directa (BT, BD), presentaron variaciones estrechas con un buen grado de precisión y exactitud (Ver Tablas 8, 9 y 10).
En cuanto a los indicadores hematológicos se pudo apreciar diferencias, entre ratones machos y hembras, criados y reproducidos en similares condiciones, esto no implica necesariamente un significado clínico. La significación estadística es solo descriptiva y su importancia interpretativa esta en base a las consideraciones fisiológicas o factores externos que puedan influir sobre estas. No se realizó una comparación con valores de referencia obtenidos en estudios realizados en otros países ya que estos difieren en la toma de muestra y los métodos de análisis utilizados para medir una magnitud en particular.
La altura de la ciudad de La Paz a 3.600 m.s.n.m es un factor ambiental externo que también llega a afectar a la población de los ratones albinos Swiss criados en el Bioterio (FCsFyB), y se asume que desarrollaron ciertas modificaciones bioquímicas, fisiológicas y de base genética, que les han permitido adaptarse en la forma más ventajosa posible para su supervivencia y reproducción en el Bioterio, lo cual hace que sean diferentes a los ratones albinos criados en cautiverio en otros países. Para poder indicar que los ratones albinos del Bioterio (FCsFyB) son adaptados a esta altura y lo que implica a este proceso, tendría que haber estudios hematológicos, bioquímicos y/o genéticos ya establecidos como referencia para poder realizar un seguimiento y/o comparación de las variaciones que pudieran existir o no frente a los resultados obtenidos. A la ausencia de un seguimiento de lo anteriormente mencionado podemos indicar que los ratones albinos son aclimatados a las condiciones externas e internas del Bioterio y que los valores de referencia establecidos en este estudio son datos de inicio para el seguimiento que se realizará en adelante.
Muy aparte de realizar un seguimiento hematológico y/o bioquímico a los ratones albinos Swiss, mostraron ser reactivos biológicos que proporcionan resultados reproducibles y fiables en un experimento dado, y la buena calidad de la reproducción de estos roedores llega a reflejar en cada uno de los resultados obtenidos en este estudio. Los resultados en este estudio, como valores de referencia hematológicos y/o bioquímicos de los ratones albinos Swiss criados y reproducidos a la altura de la ciudad de La Paz a 3.600 m.s.n.m se convierten en una fuente de referencia para poder desarrollar o hacer seguimientos para nuevas investigaciones o simplemente evaluar la buena salud de los ratones albinos criados en el Bioterio (Ver Tablas 11 y 12). En la situación actual, lo más razonable es adoptar la postura intermedia de considerar el uso de animales en investigación como necesario para ajustarse al imperativo moral de curar y prevenir enfermedades humanas, pero buscando formas de reemplazar, reducir el número y disminuir el sufrimiento.
El experimento mencionado se ha desarrollado bajo estrictos protocolos de investigación siguiendo normas bioéticas que han sido aprobados por el comité de Docencia e Investigación de la Facultad de Cs. Farmacéuticas y Bioquímicas.
AGRADECIMIENTOS
Al Bioterio de la Facultad de Ciencias Farmacéuticas y Bioquímicas de la Universidad Mayor de San Andrés por la dotación de reactivos biológicos.
REFERENCIAS
Aparicio O. (2008) Texto de la medicina de la altura: (11 -145) 1a ed. La Paz-Bolivia: Gmcarters gráficas. [ Links ]
Bär N. (2004) Un hito científico: Se secuen-ció el genoma del ratón, principal modelo experimental. Pro Diversidad. Recuperado de http://www.prodiversitas. bioetica.org/prensa 40.htm [ Links ]
Botelho P. R., Poppe González C. & Calderón V. L. (2001) Procedimientos Técnicos de la red Nacional de Hematología. 1a ed. La Paz-Bolivia: EDOBOL. [ Links ]
Fuentes, FM, Mendoza, R.A, Rosales, A.L. & Cisneros, R.A. (2008) Guía de manejo y cuidado de animales de laboratorio: ratón. Centro nacional de productos biológicos instituto nacional de salud. Lima-Perú; (5-50). Recuperado de http:// www.ins.gob.pe/insvirtual/images/otr-pubs/pdf/GUIA_ANIMALES_RATON. pdf [ Links ]
Fernández EC. & Mazziotta D. (2005) Gestión de la calidad en el laboratorio clínico. (372 - 536). España: Ediciones Panamericana. [ Links ]
González Buitrago A., Arilla Ferreiro E, Rodríguez S. & Sánchez A. (1998) Bioquímica Clínica: (101-608). Madrid: Ediciones Mc Graw. [ Links ]
Gullace F, & Caturini E. (2001). El animal de laboratorio como reactivo biológico. Facultad de Ciencias Veterinarias Universidad de Buenos Aires. Recuperado de http://www.//docs.google.com/viewer?a=v&q=cache:VYpTTldyr18J:box.jisko. [ Links ]
Quintero Z. & Jesús R. (2008) Comparación del crecimiento, parámetros reproductivos y de hematología y glicemia en hámsters (Mesocricetus auratus) alojados a diferentes niveles de intensidad de luz. Zootecnia Trop, 26(1)19-26. Recuperado de http://sian.inia.gob.ve/re-positorio/revistas_ci/Zootecnia Tropi-cal/zt2601/pdf/dejesusr [ Links ]
Mckenzie S B. (1991) Hematología clínica. El manual moderno. (1- 449) México DF. [ Links ]
Morton D. B., Abbot D., Barclay R., Close B.S., Ewbank R. & Gask D. (1993) Extracción de sangre en los mamíferos y aves de laboratorio. Laboratory animals (27:1-22). Recuperado de http://www.secal.es/ficheros/ficheros/22/Refina-miento%20extraccion%20sangre.pd [ Links ]
Vives Corrons JL. & Aguilar Bascope JL. (1997). Manual técnicas de laboratorio en hematología. 2a ed. (1-561). Barcelona: Masson. [ Links ]
Soruco Quiroga A. M., Poppe Gonzales C. & Sánchez Monje C. (2001). Procedimientos Técnicos de la Red Nacional de Química Clínica. (7-1001) Bolivia: Ediciones EDOBOL [ Links ]
Sanford T. D. (1985). Diagnóstico y tratamiento clínico para el laboratorio: (139-519) Barcelona- España: Salvat Editores. [ Links ]











 uBio
uBio