Services on Demand
Journal
Article
Indicators
-
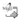 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
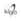 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Journal of the Selva Andina Biosphere
Print version ISSN 2308-3867On-line version ISSN 2308-3859
J. Selva Andina Biosph. vol.4 no.2 La Paz 2016
ARTÍCULO DE INVESTIGACIÓN
Humus líquido y microorganismos para favorecer la producción de lechuga (Lactuca sativa var. Crespa) en cultivo de hidroponía
Liquid humus and microorganisms to promote the production of Lettuce (Lactuca sativa var. Crespa) in hydroponic crop
Velasco José1, Aguirre Gino1, Ortuño Noel1*
1Universidad Católica Boliviana San Pablo, Ingeniería Ambiental, Cochabamba
2Fundación PROINPA, Cochabamba, Bolivia.
*Dirección de contacto: Noel Ortuño-Fundación PROINPA, Casilla 4285, Cochabamba, Bolivia, Telf. (519) 4 43-19595, Fax (519) 4 4319600.
E-mail: noelortunocastro@gmail.com
Historial del artículo.
Recibido diciembre, 2015.
Devuelto septiembre 2016
Aceptado septiembre, 2016.
Disponible en línea, noviembre 2016.
Resumen
En una fase inicial, se instaló un ensayo con cultivo de lechuga hidropónica, considerando todos los macro y micronutrientes necesarios y suficientes para su crecimiento, donde se aplicaron tratamientos con y sin humus líquido, combinando, por separado con la inoculación de micorrizas y bacterias tipo Bacillus. Observándose que el efecto significativo por el uso individual del humus líquido hasta en 50%. Posteriormente se volvió a evaluar en una Fase II, diferentes dosis de solo humus líquido con solo micorrizas. Donde la aplicación de 8 L de humus líquido puro por 36 L de solución stock del cultivo hidropónico, las plantas tuvieron el mayor peso (40.7%), la mayor altura (39%) y la mayor longitud (42%), respecto al testigo. En cambio, la combinación de humus líquido más micorrizas es de 6 litros por 36 L de solución stock, la que estimuló un mayor crecimiento y peso de cultivo de lechuga en condiciones de hidroponía. En general, el uso de humus líquido disminuyó el tiempo de producción de 60 a 52 días.
Palabras clave: Humus líquido, ácido húmico, ácido fúlvico, micorrizas, Bacillus, lechuga, hidroponía.
Abstract
In an initial phase, a trial with growing hydroponic lettuce was installed, considering all the macro and micronutrients necessary and sufficient for growth, where treatments were applied with and without liquid humus, combining separately with inoculation of mycorrhiza and bacteria Bacillus type, observing that the significant effect by the individual use of the liquid humus is up to 50%. Subsequently, in a Phase II, different doses of only liquid humus with only mycorrhizae were evaluated, where applying of 8 L of pure liquid humus per 36 L of stock solution of hydroponics crop, the plants had the highest weight (40.7%), the highest altitude (39%) and the longest (42%) compared to the witness. Instead, the combination of liquid humus plus mycorrhizal is 6 L per 36 L of stock solution, which stimulated a further growth and weight of growing lettuce in hydroponics conditions. In general, the use of liquid humus decreased the production time from 60 to 52 days.
Key words: Liquid Humus, humic acid, fulvic acid, mycorrhizae, Bacillus, lettuce.
Introducción
En Bolivia, la investigación agrícola tiene un proceso de cambio continuo, cuyo (principal desafió) busca maximizar la producción por medio del uso de tecnología generada adecuada y compatible con los recursos ecológicos, económicos y socioculturales de nuestro país.
Los diferentes problemas agroclimáticos como la erosión de suelos, el empleo excesivo de plaguicidas, el cambio climático y sobre todo el sistema minifundista de nuestro país han ocasionado la búsqueda de nuevas alternativas para la producción hortícola, teniendo entre otras a la producción hidropónica. La cual mejora las cosechas aumentando la calidad, reduciendo el periodo vegetativo y siendo una técnica que optimiza el uso del recurso suelo ya que requiere de espacios de cultivo pequeños y permite utilizar productos orgánicos (bioinsumos) durante su proceso de producción. Con todo, el manejo del sistema hidropónico relativamente es más sencillo ya que en todo invernadero el control ambiental es más accesible y la incidencia de plagas menos probable. No obstante, es imprescindible ad quirir los conocimientos pertinentes respecto a su manejo.
En el mejoramiento de la producción hidropónica realizada en muchos países, en los últimos años, se ha incorporado algunas sustancias denominadas bio fertilizantes, los cuales tienen una gran importancia dentro la agricultura orgánica ya que estos mejoran la productividad y calidad de los cultivos. Siendo uno de estos, el humus líquido alcalinizado (parte soluble de la materia orgánica estable), teniendo a sus componentes solubles más importantes los ácidos húmicos, fúlvicos e himatomelánicos, quedando las huminas como componente insoluble (Mackowiak et al. 2001). El ácido húmico es soluble en solución alcalina, pero no en medio ácido, es de color café oscuro, de alto peso molecular (5000-300000 D), altamente polimerizado, íntimamente ligado a arcillas y resistente a la degradación, contiene alrededor de 50-62% de carbono (Canellas et al. 2002). Los ácidos fúlvicos son fracciones húmicas que permanecen en la solución acuosa acidificada, soluble en ácidos y bases. Es pardo–amarillento, de menor peso molecular (900-5000 D) y posee cerca de 43-52% de carbono. Las huminas son la parte no soluble, y por lo tanto no extraíble de las sustancias húmicas (Canellas et al. 2002, Casco & Iglesias 2005). Esta fracción del humus es de mayor peso molecular (más polimerizada). Los ácidos húmicos y fúlvicos ejercen mejoras física, química y biológica en los suelos, que incrementan la productividad y fertilidad (Atiyeh et al. 2002, Fernández-Zabala 2003).
El humus líquido aplicado al suelo o a la planta ayuda a asimilar los cationes macro y micro nutrientes, gracias a su carga eléctrica negativa, al mismo tiempo evita la concentración de sales y estabiliza el pH del sustrato. Crea un medio ideal para la proliferación de organismos benéficos como las bacterias, hongos y otros impidiendo el desarrollo de patógenos, reduciendo sensiblemente el riesgo de enfermedades (Adani et al. 1998, Fernández-Zabala 2003, Rojas-Rodriguez & Ortuño 2007).
También en los últimos años se han incrementado el uso biofertilizantes, se han desarrollado utilizando microorganismos y otros insumos complementarios que son importantes como una alternativa para la producción limpia de cultivos y mejoran la productividad y calidad de los cultivos, estos bioinoculantes promueven el crecimiento o movilizando nutrientes del suelo para la planta (Rodriguez & Ortuño 2007, Ortuño et al. 2013). Bioinoculantes como las micorrizas, ayudan a la planta en la absorción de agua y nutrientes (Fósforo principalmente) y protegen las raíces contra algunas enfermedades radiculares y el hongo recibe de la planta carbohidratos provenientes de la fotosíntesis de la planta (Barea 1991). Otro microorganismos de vida libre y de alta compatibilidad con las plantas es Bacillus subtilis, el que es utilizado como bioinoculante en polvo, esta bacteria vive en simbiosis con las plantas, protege a las raíces contra patógenos de suelo (competencia) y es promotor de crecimiento, ella obtiene carbohidratos de la planta para su reproducción y crecimiento (Schisler et al. 2004).
Estos elementos combinados podrían mejorar la eficiencia en la producción hidropónica. En este sentido, este estudio intenta evaluar bioinoculantes que muestren mayor eficiencia en el incremento de la producción hidropónica del cultivo de lechuga, para determinar la combinación y dosis para el uso de ácidos orgánicos y bioinoculantes en producción orgánica, porque representan una potencial alternativa para mejorar la productividad de cultivos hidropónicos.
Materiales y métodos
El ensayo se realizó en un sistema hidropónico instalado en la Facultad de Ciencias Agrícolas y Pecuarias de San Simón en Cochabamba, la que comprendió dos fases, en la primera se evaluó a una bacteria (Bacillus subtilis) y una micorriza (Glomus fasciculatus) en presencia de humus líquido, y en la segunda para optimizar la dosis de humus líquido en presencia del microorganismo seleccionado en la primera fase.
Para las dos fases se usó cultivo de hidroponía con la técnica de raíces flotantes (Castro 2005), consiste en sumergirlas parcialmente en agua con una solución nutritiva stock que contiene macronutrientes (Nitrógeno, Potasio, Fósforo, Calcio, Azufre y Magnesio) y micronutrientes (Cobre, Boro, Hierro, Manganeso, Zinc, Molibdeno y Cloro) en cantidades requeridas por la lechuga cultivada en hidroponía, tal como lo recomienda Chang (2005). Para la aireación del agua se usó una bomba eléctrica de pecera. Se trabajó en una zona con clima templado seco, temperatura mínima de 1.31 ºC y una máxima de 26.5 ºC.
La unidad experimental consistió de una bandeja de 0.54 m de ancho y 1.13 m de largo por 0.1 m de alto, hechas de madera revestidas con plástico, una vez colocado la solución nutritiva, se tapó con Tecnopor perforado como soporte para las plántulas, donde se las trasplantaron posteriormente (Figura 1).

Las bandejas fueron desinfectadas con hipoclorito de sodio al 1% para prevenir infecciones. Se trasplantaron a una distancia de 0.17 por 0.20 m. de planta a planta. Este material se preparó antes del transplante, realizado a los 15-20 días después del almacigado, cuando las plántulas alcanzaron entre dos a tres hojas verdaderas, teniendo mucho cuidado de no romper el cogollo. Se hicieron perforaciones en el Tecnopor, donde se suspendieron las plántulas con ayuda de una esponja, la que se colocó en el cuello de la planta (Figura 1).
Se usaron plantas de lechuga variedad Crespa, sus hojas son verde claro, forma del limbo ondulado, su ciclo precoz (60 días después del transplante) y su rendimiento es de 8-9 t/ha en campo.
Se usaron micorrizas Glomus fasciculatum, aplicadas a una dosis de 40 g/L de solución stock, a una concentración de 20 esporas/g. También se usó la bacteria nativa, Bacillus subtilis, que está naturalmente en el suelo, proporcionada por la Fundación PROINPA, se aplicó a la dosis de 20 cm3 por 10 L de solución total, el cual se encontraba a una concentración de 2.4x106 esporas/ cm3. Los bioinoculantes fueron aplicados a la solución y fueron agitados hasta verificar visualmente que estaban homogeneizados en toda la solución, tal como lo sugiere Cuesta-Molla & Casadeus-Romero (2003).
Se usó como medio líquido agua y humus líquido de lombriz. El lombricompost fue proporcionado por la Facultad de Agronomía de Universidad Mayor de San Simón (UMSS). El humus líquido contiene humatos como los ácidos húmicos, fúlvicos y huminas, entre otros (Canellas et al. 2002, Casco & Iglesias, 2005), los que aplicados al suelo o a la planta actúan como racionalizante de fertilización, porque hace asimilables en todo su espectro a los macro y micro nutrientes (Mackowiak 2001).
Solución nutritiva utilizada. Para las dos fases se usó una solución nutritiva (tabla 1) elaborada en base a diferentes sales disponibles en el mercado en base a lo recomendado por Chang (2005).

Obtención de humus líquido. Se obtuvo lombricompost disponible en comercio loca con el que se preparó una solución con agua de pozo en una relación de 100 L por 25 kg de lombricompost, al cual se añadió 35 g de bicarbonato de sodio, si se requiere más debe llegar a un pH de 7.8, dependerá del tipo de material que se está utilizando, luego se agitó vigorosamente durante media hora y luego se dejó reposar por 48 h (Canellas et al. 2002). Después se tamizó, con ayuda de una malla No. 50 mesh, para disponer de una solución de color obscura, el cual fue utilizado para el ensayo.
El trabajo se realizó en dos fases, en la primera para evaluar la interacción entre el humus líquido y bioinoculantes, y en la segunda fase para optimizar la dosis del humus líquido en presencia del bioinoculantes resultante de la primera fase.
Fase I Selección de microorganismo en humus líquido. En esta fase evaluó el efecto de la combinación de humus líquido y bioinoculantes debido a que no se conoce este tipo de interacción para mejorar la producción hidropónica. Los tratamientos fueron:

Las variables evaluadas fueron altura de planta, peso de planta, número de hojas, peso de raíz, largo de raíz. Los datos fueron analizados con un diseño bloques completos al azar con tres repeticiones y para la comparación de medias la prueba de rango múltiple de Tukey (5%), previa verificación de la normalidad y homogeneidad de varianzas (Montgomery 2013). Para eso se utilizó el PROC MIXED del SAS (SAS 1999).
Fase II: Evaluación de optimización de la dosis de humus líquido. En esta Fase la dosis optima del humus líquido combinado con microorganismo que respondió en la Fase I, la micorriza. Para eso se utilizaron cuatro tratamientos más un testigo, donde varió solo el humus líquido y la micorriza a dosis constante, así tenemos:

La solución stock contiene todos los macro y micro nutrientes necesarios recomendados por Rodríguez (2005) para el cultivo de lechuga en hidroponía. Las micorrizas se aplicaron a una dosis de 40 g de producto formulado por 10 L de solución total a una concentración de 20 esporas/g.
Los cuatro tratamientos, más el testigo, fueron analizados mediante un diseño de bloques completos al azar, con tres repeticiones. La unidad experimental consistió de una bandeja de 0.54 m de ancho, 1.13 m de largo y 0.1 de alto, donde se trasplantaron las plántulas de lechuga.
En esta fase las variables evaluadas fueron altura de planta, peso de planta, número de hojas, peso de raíz, largo de raíz. Los datos de las variables de evaluación fueron evaluados, previa verificación de la normalidad y homogeneidad de varianzas, usando el PROC MIXED del SAS (SAS 1999) y para la comparación de medias se utilizó la prueba de rango múltiple Tukey (5%) (Montgomery 2013).
Resultados
Fase I Selección de microorganismo en humus líquido.
Altura de Planta. En la altura de planta se observaron diferencias significativas (p=0.0001) entre tratamientos, donde la altura en las plantas varió (13.54, 14.02 y 13.27) en relación al testigo (13.04) (Figura 4). El tratamiento humus más micorrizas mostró una mayor altura de planta respecto a los demás tratamientos.
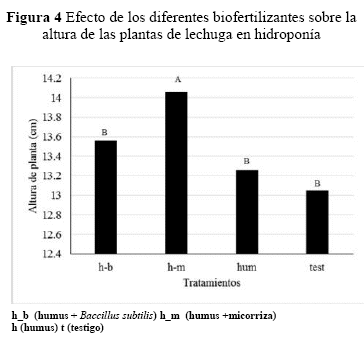
Se observaron diferencias significativas (p = 0.0001) a través del tiempo para la altura de planta, sin embargo, las diferencias no se observaron hasta la tercera evaluación, a partir del cual se observaron plantas más altas con humus más micorriza (Figura 5).
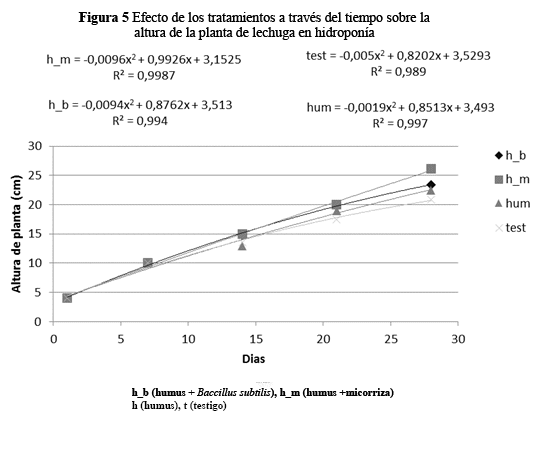
En la altura de planta las curvas reflejan que el tratamiento T3 incrementa en la altura de la planta con una tasa de 0.9877 cm por cada semana. El tratamiento T1 tiene una tasa más baja de 1.01.
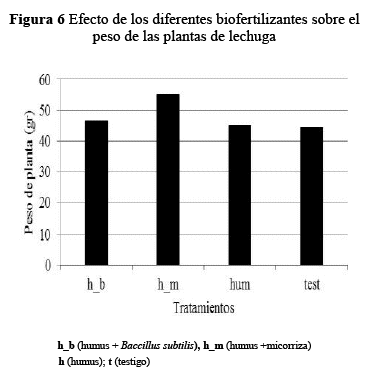
Peso de la planta. En el peso de la planta el tratamiento humus + micorriza (h_m) (56.02 g/planta) fue superior al resto (p=0.0001), seguido del tratamiento humus + bacteria (h_b) (48.22g/planta), siendo el más bajo el testigo (42.69g/planta). El humus líquido tuvo un efecto positivo sobre el incremento del peso de la planta.
Los tratamientos con sustancias húmicas (48.22, 56.02 y 44.17 g/planta) tuvieron mayor peso fresco de la planta en relación al testigo (42.69 g/planta). Las diferencias eran significativas (Figura 6) y se incrementaron a medida que avanzaron los días.
Hubo diferencias significativas de los tratamientos a través del tiempo. Las plantas con humus liquido más micorriza se incrementaron en peso a medida que la planta desarrollaba (p=0.0001) en (Figura 7).
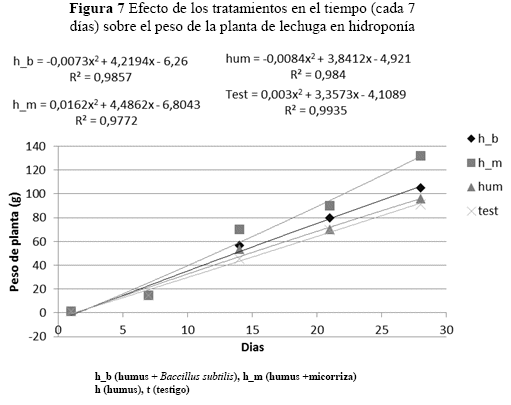
En la figura 7 se observa a los R2, de los cuatro análisis de tendencia, estos muestran un buen ajuste de los datos del peso de la planta al cuadrático. Realizando un análisis individual, el T3 (humus líquido + micorriza) incrementó el peso de la planta a una tasa de 5.2759 g por cada semana. El tratamiento T1 (test) tiene la tasa más baja (4.2139). Por lo tanto, en base al modelo cuadrático, el tratamiento h_m (T3) tiene mayor probabilidad de incrementar el peso de la planta hasta que cumpla su ciclo de producción.
Fase II Evaluación de dosis de humus líquido. En la primera fase se seleccionó a la micorriza como el microrganismo para estimular el crecimiento del cultivo, bajo las condiciones de estudio. Posteriormente estableció un segundo ensayo probando dosis progresivas de humus de lombriz con la adición de inóculo de micorriza a población constante.
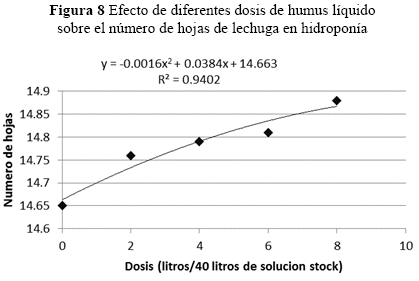
Se estimaron efectos significativos entre días por dosis sobre el número de hojas por planta (p = 0.0001), con las diferentes dosis de humus líquido. Pero no se observaron diferencias significativas entre las dosis de 2, 4, 6 y 8 l/platabanda (Figura 9).
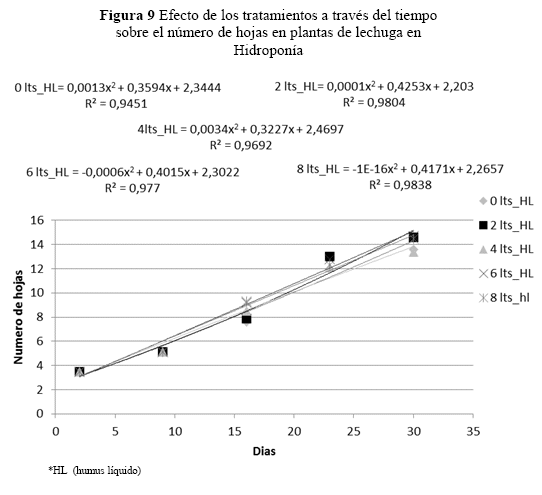
Observando los R2 de los cuatro análisis de tendencia, en el número de hojas se ajustó a un modelo cuadrático, pero los tratamientos no tienen diferencias significativas respecto al testigo ni entre los tratamientos.
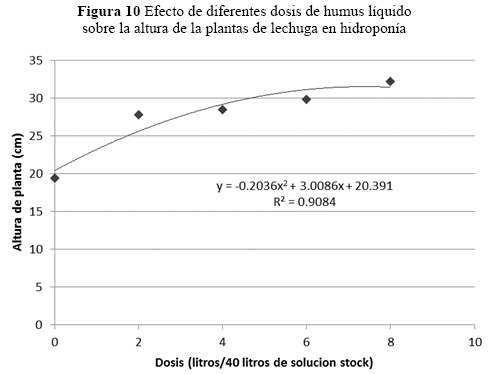
Altura de planta. En la altura de planta, se estimaron efectos significativos (p=0.0001) entre las dosis respecto al testigo, lo cual muestra claramente el efecto de las diferentes concentraciones de humus líquido sobre esta variable (Figuras 10 y 15).
También, se observaron diferencias entre las dosis (p = 0.0001), en la altura de planta observando hasta el noveno día (Figura 11), donde se inician las diferencias en el crecimiento respecto al testigo.
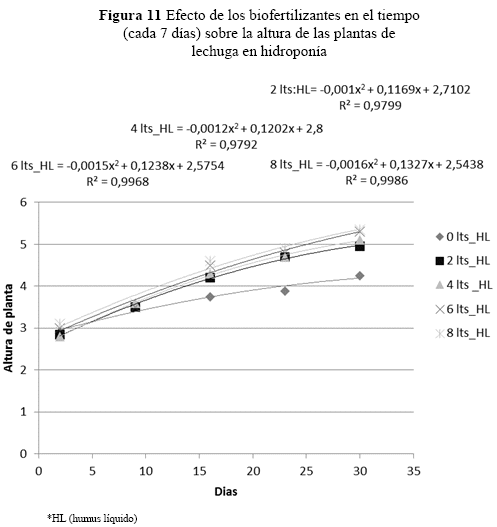
Los R2 de los cuatro tratamientos para la altura de planta, demuestran que el tratamiento T2 (8 L_HL) incrementa la altura de la planta a una tasa de 0.1 cm por semana. En cambio, el tratamiento T1 (testigo) tiene una tasa más baja 0.07. El tratamiento T2 tiene mayor probabilidad de aumentar en la altura de la planta hasta que cumpla su ciclo de producción por tratarse de un modelo cuadrático. La curva claramente muestra el efecto de usar humus líquido en estas condiciones y promover un mayor crecimiento en la altura de la planta.
Peso de la planta
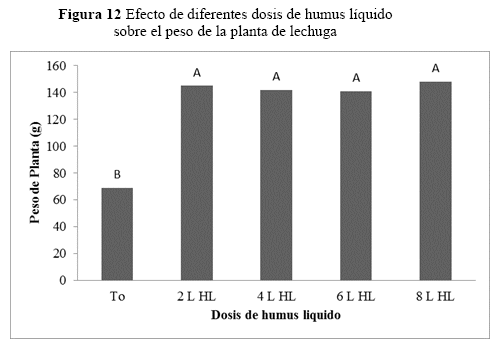
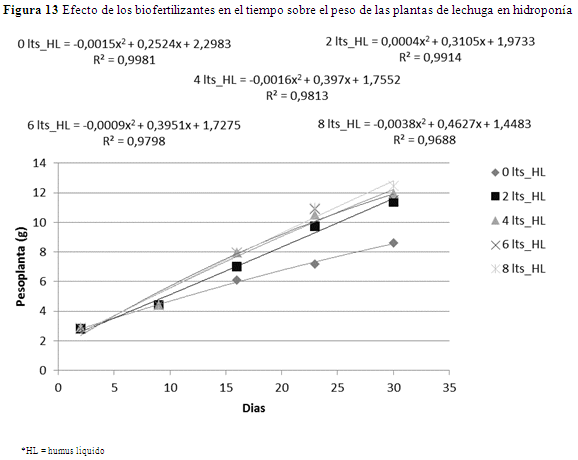
Realizando un análisis individual (Figura 13), el T2 (8 L_HL) incrementa el peso de la planta a una tasa de 0.3935 g por semana. El tratamiento T1 (test) tiene una tasa más baja, 0.2538. El tratamiento (T2) tiene mayor probabilidad de aumentar el peso de la planta hasta que cumpla su ciclo de producción. El humus líquido favorece al aumento de peso en la lechuga.
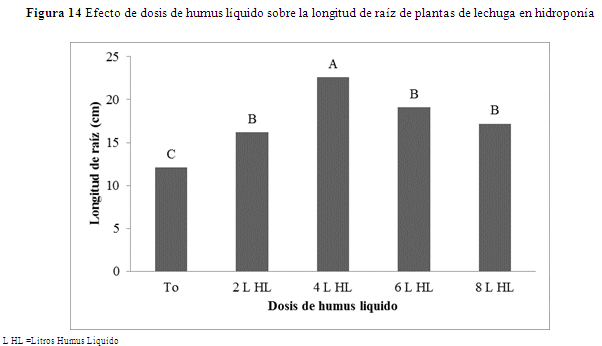
Longitud de la raíz

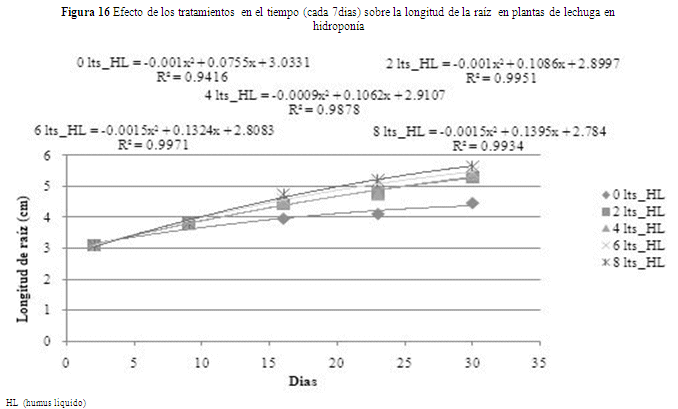
Discusión
Fase I Selección de microorganismo en humus líquido. En la Figura 2, el incremento periódico en el número de hojas es creciente para cada tratamiento, desde el inicio del cultivo, mostrándose una tendencia cuadrática, lo que demuestra que la variable número de hojas llegará a un punto máximo.
La figura 2 muestra a los cuatro modelos con similitud y no se muestran diferencias estadísticas en el desarrollo de la planta entre ellos. Pero cuando las plantas llegaron a los 40 días después del transplante, se comparó el número de hojas entre tratamientos y no se observaron diferencias significativas (Figura 3). Si bien las diferencias no fueron significativas, había variaciones en el tamaño de las hojas, que se podría evaluar en estudios posteriores. Sin embargo, Atiyeh et al. (2002), observaron incrementos en el área foliar del tomate y cucúrbitas cuando aplicaron soluciones húmicas.
Altura de Planta, se observaron diferencias significativas (p=0.0001) entre tratamientos, donde la altura en las plantas varió (13.54, 14.02 y 13.27) en relación al testigo (13.04) (Figura 4). El tratamiento humus más micorrizas mostró una mayor altura de planta respecto a los demás tratamientos.
Resultados similares obtuvieron Cimrin & Yilmaz (2005) en la lechuga. Casco & Iglesias (2005), donde hicieron aplicaciones foliares de extracto de humus de lombriz en maíz, superando estadísticamente en altura de planta y en peso de rastrojo, comparando con el producto comercial Bayfolan y al testigo sin aplicación. También demostraron acción directa de sustancias húmicas sobre el desarrollo de la planta por la influencia de procesos metabólicos, fisiológicos y biológicos tales como la respiración y síntesis de ácidos nucleicos. Por lo que las sustancias húmicas podrían ser importantes en la producción de los cultivos.
Cimrin & Yilmaz (2005), reportaron efectos significativos de ácidos húmicos sobre el peso en plantas de lechuga, porque el humus contribuye a solubilizar los nutrientes para una asimilación más efectiva por las plantas, por lo cual las soluciones húmicas son fuentes potenciales para mejorar la nutrición de la planta.
Hubo diferencias significativas de los tratamientos a través del tiempo. Las plantas con humus liquido más micorriza se incrementaron en peso a medida que la planta desarrollaba (p=0.0001) en (Figura 7).
Número de hojas, por planta no se identificaron diferencias significativas en las dosis (p=0.0698). Sin embargo, este factor (Figura 8) se incrementó a medida que pasa el tiempo, tanto en los tratamientos como en el testigo, pero sin mostrar diferencias significativas. Pero en otros estudios en tomate y cucúrbitas, Atiyeh et al. (2002) observaron incrementos en el área foliar del tomate y cucúrbitas, desde 50 a 500 mg/kg de materia seca, a media que se aumentó la dosis de ácidos húmicos.
Altura de planta, resultados similares fueron reportados en lechuga por Cimrin & Yilmaz (2005), también, Casco & Iglesias (2005), en el maíz observó que la aplicación de extracto de humus de lombriz superó en altura de planta al producto comercial Bayfolan y al testigo sin aplicación. Estos investigadores demostraron la acción directa de las sustancias húmicas sobre el desarrollo de la planta por la influencia de procesos metabólicos, fisiológicos y biológicos tales como la respiración y síntesis de ácidos nucleicos. Fernández-Zabala (2003), observó efectos de ácidos húmicos sobre el desarrollo temprano del trigo, que contribuye a solubilizar los nutrientes aumentando su disponibilidad para la planta y mejorando la nutrición del cultivo.
La altura de la planta aumenta a medida que incrementa la dosis de humus líquido. Su mayor altura es con la dosis de 5.78 L de humus líquido/plantaban da para 40 L de solución stock (Figura 10). Atiyeh et al. (2002) en tomate y cucúrbitas también reportaron el incremento en la altura de planta a medida que se aumentó la concentración de los ácidos húmicos entre 50 y 500 mg/kg de materia seca. Sin embargo, a partir del 500-1000 mg/kg las plantas decrecieron significativamente. Adani et al. (1998) encontraron plantas más altas con una concentración de extracto de humus de 50 mg/L en el cultivo del tomate.
Peso de la planta, hay diferencias significativas en el peso de la planta (p=0.0001) entre las dosis de humus de lombriz respecto al testigo, porque al incrementar el humus líquido se aumenta el peso en la planta, hasta cierto límite. Cimrin & Yilmaz (2005), reportaron efectos significativos de ácidos húmicos sobre el peso en la planta de lechuga, aplicando 300 kg/ha de ácido húmico con 120 kg/ha de fósforo. Si hay un incremento proporcional del peso de la planta por aumento de la dosis del humus líquido, es porque se está generando una solubilización de nutrientes para una asimilación más efectiva por la planta (Mackowiak 2001), encontrándose los pesos más altos con la dosis de 5.92 L de humus líquido para 40 L de solución stock (Figura 12), a partir del cual no se observan cambios significativos en el peso de las plantas. Estos datos son corroborados por estudios en tomate, donde hubo ganancia de peso fresco y húmedo entre 23% y 22% cuando se aplicó 50 mg/L de dos ácidos húmicos comerciales, también reportaron incrementos en el peso fresco en el maíz cuando aplicaron 84.4 g/L del ácido húmico (Adani et al. 1998).
Se estimaron efectos significativos (p=0.0001) en el tiempo sobre el peso en las plantas (p=0.0001), que al aumentar las dosis de humus líquido respecto al testigo. Se observa en figura 12, que el testigo llegó hasta 95 g/planta y los que contenían humus líquido de 144 a 163 g/planta, lo cual marca una notable diferencia por efecto de los tratamientos, pero este crecimiento tiene un límite porque tiende a tornarse constante una vez que se llega a la dosis de 6 L/platabanda. Hasta el noveno día no existieron diferencias significativas entre las dosis 2, 4, 6 y 8 L de humus/platabanda (Figura 13 y 15). Sin embargo, a partir del noveno día el peso en las plantas incrementa con las diferentes dosis en relación al testigo, aunque los pesos en las plantas en relación al tiempo fueron similares (Figura 13).
Ese efecto puede estar estimulado adicionalmente por las micorrizas las que actúan en colonias facilitando la asimilación de nutrientes, ya que esta formación implica todo un proceso que requiere tiempo para que las esporas esporulen para luego colonizar las zonas pilíferas de la raíz, una vez que sus hifas del hongo ingresan en las células epidérmicas de la raíz, forma una hifa especializada llamada apresorio que le sirve de sostén en la primera fase de penetración de la raíz (Hodge 2002). La hifa de penetración avanza longitudinalmente a través de los espacios intercelulares o ingresa directamente al interior de la célula donde finalmente se forman los arbúsculos y vesículas (Barea 1991, Hodge 2002), en condiciones adecuadas de temperatura y ambiente (Young & Chen 1997).
Longitud de la raíz, la dosis tuvo efectos significativos (p=0.0001) para la longitud de raíz. La diferencia está dada por los tratamientos con humus líquido+micorriza (17.3 a 22.4 cm) y el escaso crecimiento en el testigo (12.0 cm) (Figura 14 y 15). Esto muestra que existe una estimulación en el crecimiento del sistema radical y también incrementa la capacidad de absorción de nutrientes. Este hecho muestra el efecto marcado del humus líquido en el crecimiento de la raíz. Si bien el humus está combinado con las micorrizas, estas no ejercen un marcado efecto sobre el crecimiento de sus raíces sino más en la capacidad de absorción de agua y/o nutrientes.
Las raíces crecieron con las dosis de humus de 7.2 L hasta 40 L, a partir del cual no hubo cambios significativos en la longitud de la raíz. Resultados similares fueron reportados en dos especies de plantas ornamentales, se incrementó esta variable con las aplicaciones de ácidos húmicos (Adani et al. 1998), trabajando con tomate, reportaron ganancias de 18% y 16% sobre el testigo, cuando aplicaron 50 mg/L de ácido húmico comercial, en esta variable.
El incremento en la longitud de la raíz de la planta en lechuga muestra que la presencia de ácidos orgánicos en el sustrato condiciona a un mejor crecimiento de la planta al aumentar su superficie de absorción y así una mejor nutrición, porque es conocido que el humus ejerce una estabilidad en el pH del suelo y hace que los nutrientes estén más disponibles para la planta.
Analizando por dosis las tendencias, se observa que el testigo (O L_HL) tiene un menor crecimiento en la longitud de raíz (4.3 cm) y los tratados con humus líquido están en un rango de (5.2 a 5.7 cm) (figura 16). Ese desarrollo diferenciado concuerda con los estudios realizados por Canellas et al. (2002), quién reportó incrementos en el desarrollo radicular en maíz cuando incrementó la concentración del ácido húmico comercial.
Adicionalmente es posible que haya un efecto de las micorrizas porque el hongos germina para luego colonizar en simbiosis a las raíces de las planta, luego ayudando a la asimilación de nutrientes del sustrato. Hodge (2002), indica que el hongo coloniza la raíz, le proporciona nutrientes minerales y que extrae de la solución por medio de su red externa de hifas, mientras que la planta suministra al hongo sustratos energéticos y carbohidratos que elabora a través de la fotosíntesis.
En general, en la fase I, se estableció que el humus líquido más la micorriza (Glomus fasciculatum) aplicado al cultivo de lechuga, incrementó en el peso de la planta (30%) y altura (20%) respecto al testigo, pero no tuvieron efectos significativos sobre el número de hojas, en esta fase.
En la fase II, cuando se aplicó 8 L de humus líquido por 36 L de solución stock del cultivo hidropónico, las plantas tuvieron el mayor peso (40.7%), la mayor altura (39%) y la mayor longitud (42%), respecto al testigo. La dosis óptima de humus líquido más micorrizas es de 6 L por 36 L de solución stock, es la que estimuló un mayor crecimiento y peso de cultivo de lechuga en condiciones de hidroponía. Además el uso de humus líquido disminuyó el tiempo de producción de 60 a 52 días, lo cual baja los costos de producción y anticipa la llegada al mercado en una semana.
Ese hecho demuestra que al usar simultáneamente el humus líquido-micorrizas y teniendo la solución con macro y micronutrientes en balance adecuado se mejora la productividad del cultivo, pero no se debe entender que los ácidos húmicos son fertilizantes sino más bien actúan estabilizando el pH, tal como lo indica Fernández-Zabala M. 2003, creando mejores condiciones para la absorción de nutrientes y así la planta se nutre más eficientemente y pueda rendir mejor.
Conflictos de intereses
Los autores declaran que no existen conflictos de interés.
Agradecimientos
Nuestros agradecimientos al proyecto FONTAGRO-BID-BIOINSUMOS de la Fundación PROINPA y al proyecto CIUF de la Facultad de Ciencias Agrícolas y Pecuarias de la Universidad Mayor de San Simón (UMSS).
Literatura citada
Adani F, Genevini P, Zaccheo P, Zocchi G. The effect of commercial humic acid on tomato plant growth and mineral nutrition. J Plant Nutr. 1998; 21(3): 561-75. [ Links ]
Atiyeh RM, Lee S, Edwards CA, Arancon NQ, Metzger JD. The influence of humic acids derived from earthworm-processed organic was tes on plant growth. Bioresour Technol. 2002; 84(1): 7-14. [ Links ]
Barea JM. Morfología, anatomía y citología de las micorrizas va. En: Fijación y Movilización de Nutrientes. Madrid. 1991. Tomo II. p. 150-73.
Canellas LP, Olivares FL, Okorokova-Facanha AL, Façanha AR, Humic acids isolated from earth worm compost enhance root elongation, lateral root emergence, and plasma membrane H-ATPase activity in maize roots. Plant Physiol. 2002; 130(4): 1951-7. [ Links ]
Casco Ca, Iglesias MC. Producción de biofertilizantes líquidos a base de lombricompuesto. [Tesis licenciatura]. Universidad Nacional del Nordeste. Argentina. 2005. p. 87.
Castro ChG. Sistema de raíz flotante. En: Curso práctico Internacional de Hidroponía. Lima, Perú. Universidad Nacional Agraria La Molina. 2005; p. 14-5.
Chang M. Preparación de soluciones nutritivas. En: Curso práctico internacional de hidroponía. Universidad Nacional Agraria La Molina. Centro de Investigación de hidroponía y nutrición mineral. Lima, Perú. 2005; p. 43.
Cimrin KM, Yilmaz I. Humic acid applications to lettuce do not improve yield but do improve phosphorus availability. Acta Agr Scan B Soli Plant. 2005; 55; 58-63. [ Links ]
Cuesta-Mola I, Casadeus-Romero L. Importancia de la inoculación de Glomus mosseae-Bacillus subtilis y Glomus mosseae-Pseudomonas fluorescens sobre el crecimiento y micorrización de plántulas de Swietenia macrophyla x mahagoni en vivero. [Tesis de Maestria]. Universidad la Habana. Cuba. 2003; p. 68.
Fernández-Zabala M. Evaluación agronómica de sustancias húmicas derivadas de humus de lombriz. [Tesis Licenciatura]. Pontificia Universidad de Chile. Santiago, Chile. 2003; p. 82.
Hodge A. Microbial ecology of the arbuscular mycorrhiza. FEMS Microbiol Ecol. 2002; 32(2): 91-6. [ Links ]
Mackowiak CL, Grossl PR, Bugbee BG. Beneficial effects of humic acid on micronutrient availability to wheat. Soil Sci Soc Am J. 2001; 65(6): 1744-50. [ Links ]
Montgomery DC. Design and Analysis of Experiments (Eighth ed.). Wiley. Section 3.5.7. 2013.
Ortuño N, Castillo JA, Claros M, Navia O, Angulo M, Barja D, et al. 2013. Enhancing the Sustainability of Quinoa Production and Soil Resilience by Using Bioproducts Made with Native Microorganisms. Agronomy. 2013; 3(4): 732-46.
Rodriguez A. Soluciones nutritivas en hidroponía. CIHNM. Universidad Nacional Agraria La Molina. Lima, Perú. 2005; p. 100.
Rodriguez KR, Ortuño N. Evaluación de micorrizas arbusculares en interacción con abonos orgánicos como coadyuvantes del crecimiento en la producción hortícola del Valle Alto de Cochabamba-Bolivia. RevActaNova. 2007;3(4):31-7. [ Links ]
SAS. The SAS System for windows V8. SAS Institute Inc., Cary, N.C. USA. 1999.
Schisler DA, Slininger PJ, Behle RW, Jackson MA. Formulation of Bacillus spp. For biological control of plant diseases. Phytopathology. 2004; 94(11): 1267-71. [ Links ]
Young CC, Chen LF. Polyamines in humic acid and their effect on radical growth of lettuce seedlings. Plant Soil. 1997; 195(1):143-9. [ Links ]
____________________














