Introducción
La hipertensión arterial es una enfermedad multifactorial, cuyo tratamiento se basa en la inhibición farmacológica del sistema renina angiotensina en 3 puntos: enzima convertidora de angiotensina I (ECA), acción directa de la angiotensina II y renina, muchos medicamentos sintéticos son utilizados para inhibir la ECA1. Una alternativa actual es recurrir a los alimentos con propiedades funcionales. Los alimentos funcionales (AF) se definen como aquellos y sus componentes alimentarios que, tomados como parte de la dieta, proporcionan beneficios más allá de sus valores nutricionales tradicionales, mejorando una función en el organismo o reduciendo riesgo de enfermedad2.
Desde 1979, se describieron péptidos bioactivos con diferentes actividades biológicas, una de estas actividades fue obtenida por hidrolisis con mayor significancia, la antihipertensiva. Los AF que los contienen pueden representar una nueva estrategia para la prevención y/o el tratamiento de la hipertensión. Se aislaron péptidos antihipertensivos (PAH) a partir de proteínas de distintos alimentos de origen animal y vegetal3.
Bolivia, se caracteriza por poseer diferentes pisos ecológicos, con alta producción de granos andinos (GA) por tradición, particularmente el Altiplano andino. Los GA, quinua (Q), cañahua (C) y tarwi (T) (Chenopodium quinoa Willd, Chenopodium pallidicaule Aellen, Lupinus mutabilis Sweet), cultivos rústicos, con resistencia a sequía, helada y salinidad, considerados hoy como alimentos de alta calidad4.
La Q, se caracteriza por contener ácidos grasos insaturados y poliinsaturados, tipo omega 3 y omega 6, proteínas de alta calidad, minerales, vitaminas en mayor concentración que los cereales, fitoesteroles, compuestos fenólicos que le otorgan propiedades antioxidantes, betalaínas, betaína-glicina. Existen evidencias clínicas de sus beneficios en la salud, que revelan mejoras en el rendimiento de atletas, recomendadas para las personas con anemia, dislipidemias e intolerancia a la lactosa, así como para personas con enfermedad celíaca5.
De la C (C. pallidicaule), se reporta mayor contenido de fibra, proteínas en cantidad y calidad similar a la Q, contiene compuestos fenólicos con alta propiedad antioxidante, alto contenido de minerales6,7, alto contenido hierro y zinc8, bajo contenido de saponinas, que no le dan el sabor amargo característico9, siendo una alternativa de alta calidad alimentaria que no necesita ser procesada como la Q y el T.
Del T (L. mutabilis Sweet), lo más sobresaliente es el alto contenido de proteínas, inclusive en relación a subespecies lupinus, alto contenido de ácidos grasos esenciales10, presenta alto contenido de potasio, fosforo y hierro11.
Los PAH son los más estudiados de los AF, con actividad inhibitoria de la ECA, relacionada con la regulación de la presión arterial por modulación del sistema renina-angiotensina12.
La hipertensión arterial es una de las patologías con mayor prevalencia a nivel mundial, tratada con varios medicamentos sintéticos que suelen causar efectos secundarios, de ahí la búsqueda de compuestos naturales ha aumentado, existen varios péptidos que están en mercados de Europa, Norte América y Asia, diversos productos que contienen péptidos elucidados, tienen la capacidad de reducir la presión arterial13.
El objetivo del presente estudio fue evaluar la capacidad de inhibición, in vitro, de extractos fenólicos, hidrolizados proteicos, fracciones peptídicas y harinas hidrolizadas de GA, sobre la enzima convertidora de angiotensina I (ECA).
Materiales y métodos
Materia prima. Los GA, quinua Real blanca (QRB), quinua Real negra (QRN), cañahua (C) y tarwi (T) fueron proporcionados por la empresa de alimentos Irupana Andean S.A. Las variedades de quinua J’acha Grano (QJG), quinua Ajara (QA) silvestre, quinua Kurmi (QK) y quinua Phisanqalla (QP) del Altiplano de La Paz fueron donadas por la Asociación de Productores Quinueros Jurisdicción Umala (ASPROQUIJU). La QJG y QK son mejoradas genéticamente por hibridación, promisorias para exportación14.
Obtención extractos fenólicos (EF). Se pesaron 100 g de cada grano, Q, C, y T, se molió y desengrasó con éter de petróleo 2 veces por 1 h, se procedió a extraer los compuestos fenólicos con metanol/agua (85:15), seguidamente se roto-evaporó, se congelo y liofilizó, se procedió a una segunda extracción con n-butanol/agua (50:50), separación, líquido/líquido, la fase orgánica se secó en rota-evaporador Buchi.
Determinación de flavonoides totales (FT). Los FT (compuestos que contienen grupos ceto en C4, grupos hidroxilo C3 o C5, y grupos orto di-hidroxilos en el ciclo B, tales como flavonas y flavonoles) se determinaron utilizando el método colorimétrico de iones de aluminio15 usando quercetina (QE) como estándar. La absorbancia se midió a 510 nm en el espectrofotómetro Thermo Scientific genesys 10S UV/Visible y los resultados se expresaron en mg de equivalentes de QE por g de muestra, peso seco15.
Proteínas. Su cuantificación se realizó por el método AOAC establecida en la Norma Boliviana (N x 6.25)16.
Almidones. Su determinación se realizó por el método AOAC 996.1117, utilizando curva patrón de glucosa.
Obtención de proteínas. Se utilizó el método pH isoeléctrico, 50 g, de harina de cada grano (los granos se molieron en moledora Bosch y tamizado a 60-mesh), se desengraso en Soxhlet, la harina desengrasada se lavó con agua destilada a 200 mL para proceder a extraer con hidróxido de sodio 0.1 N hasta pH 9 para luego precipitar con ácido clorhídrico 0.1 N. Se centrifugo y seco el precipitado (proteínas) por liofilización.
Digestión enzimática in vitro de proteínas de GA. Los hidrolizados proteicos (HP) se obtuvieron por digestión enzimática, con alcalasa (ALC) en buffer borato (pH 8.0), con flavourzyme (FLA) y pancreatina (PAN) en buffer fosfato (pH 7.0), con pepsina (PEP) en buffer citrato (pH 3.0) de forma separada. En cada tratamiento, se reconstituyo 1.0 g de proteína (sustrato) con 50 mL de buffer correspondiente. Se trabajó a una relación enzima/sustrato (E/S) de 1.5 por 90 min en cada caso.
Grado de hidrolisis (GH). La proteína extraída de las variedades de QRB, QJG y QA, la primera refiere a la Q de exportación típica de la zona del salar, la segunda modificada por hibridación y la tercera silvestre, C y T, por el método de pH-stat18, se trabajó al 4 % a 50° C y pH de 8.5 con buffer borato para la enzima comercial ALC® 2.4 L y a pH de 7.0 a 50° C para FLA®, con buffer fosfato, a una relación E/S de 2.0, el seguimiento se realizó con un pH-meter Thermo Scientific Orion A112 utilizando hidróxido de sodio 0.1 N. Cada análisis se realizó por triplicado.
Utilizando la siguiente fórmula:
GH = Grado de hidrólisis en %, h = N° de enlaces peptídicos hidrolizados en mEq/g, htot = N° total de enlaces peptídicos presentes en la proteína en mEq/g.
Fraccionamiento de péptidos. Los HP se secaron en el liofilizador del laboratorio (Telstar). Para el fraccionamiento se utilizó cromatografía por exclusión Sephadex G-25, utilizando como eluyente metanol, se tomaron alícuotas de 5 mL, cada alícuota se secó en estufa a 37° C en placas Petri. Se realizó el seguimiento del fraccionamiento, utilizando cromatografía en capa fina (TLC) con eluyente, butanol:ácido acético:agua (3:1:1). Se revelo con ninhídrina para juntar las fracciones iguales.
Digestión in vitro de harina de GA amilasa/alcalasa (AMY/ALC) y amilasa/flavourzyme (AMY/FLA). La harina de cada grano se obtuvo en una moledora de granos Bosch, para luego ser tamizado en tamices 60 mesh de acero norma ASTME 1116, se preparó una suspensión con la harina de QRB, QA, C a una concentración de 10 % con agua hervida, sin modificar el pH, que en todos los casos estaba entre 5.5-6.0 de pH, adecuado para AMY.
Enzima Termamyl Sc. (AMY). A una relación E/S de 0.6 considerando el contenido de almidón en cada caso, a 82±1° C por 1 h en un biorreactor de agitación y temperatura regulable con pH-meter incorporado, previa ebullición por 5 min.
Enzima Alcalase ® 2.4 L (ALC). Post tratamiento con AMY, se acondiciono a 50° C acondicionando el pH a 8.5, con ALC en una relación E/S de 2.5, considerando el contenido de proteínas en cada caso con agitación continua por 6 h. Se llevó a ebullición para terminar la hidrolisis. En el caso de T fue tratado directamente con la proteasa previó desengrasado.
Enzima Flavourzyme ® (FLA). Post tratamiento con AMY, se acondiciono a 50° C acondicionando el pH a 7, con FLA en una relación E/S de 1.5, considerando el contenido de proteínas en cada caso, en agitación continua por 6 h. Se llevó a ebullición para terminar la hidrolisis. En el caso de T fue tratado directamente con la proteasa previó desengrasado por el alto contenido de grasa y casi nula presencia de almidón19.
Obtención de producto hidrosoluble y no hidrosoluble. Una vez obtenidos los hidrolizados de las harinas de QRB, QA, C y T, se filtraron en una filtro-centrifugadora canasta de acero inoxidable 304, soporte tipo tambor, con tela filtrante removible, con motor de 0.5 hp 220-380 VAC a 100 revoluciones por minuto (RPM) para obtener producto no hidrosoluble (PNHS) y producto hidrosoluble (PHS). Ambas se secaron por liofilización.
Actividad inhibitoria de la enzima convertidora de angiotensina I (ECA). Se midió de acuerdo con el método de Parris et al.20 con una ligera modificación. Se utilizó enalapril como control positivo, se prepararon soluciones de muestra, ECA y de hipuril-histidil-leucina (HHL) usando tampón de borato de sodio 0.1 M (pH 8.3) que contenía cloruro de sodio 0.1 M. La mezcla de reacción que contenía 200 µL de HHL 5.83 M, 80 µL de solución de muestra (2 mg/mL) y 20 µL de solución de ECA (50 mU/mL) se incubó a 37° C durante 60 min. La reacción se detuvo mediante la adición de 250 µl de ácido clorhídrico 1 M seguido de la adición de acetato de etilo. Después de agitar vigorosamente, la mezcla se centrifugó por 5 min a 3500 rpm, la capa superior se colocó en un tubo. Después de que el acetato de etilo se evaporó en estufa a 80° C, el residuo se disolvió en H2O destilada para de medir en un espectrofotómetro Thermo Scientific genesys 10S UV/Visible la absorbancia a 228 nm. La actividad de inhibición de la ECA se expresó como 100 (1-X/C) %, donde X y C fueron las absorbancias de la muestra y el control, respectivamente18. Para obtener el IC50 se prepararon muestras a diferentes concentraciones en relación a sus porcentajes de inhibición21.
En el caso de las harinas hidrolizadas (HH) de los pseudocereales (QRB, QA, C) se preparó la muestra a 0.75 mg/mL de proteína contenida en PHS y PNHS. Del T se preparó a 2.0 mg/mL de proteína contenida en PHS y PNHS.
Análisis estadístico. Cada análisis se realizó por triplicado y los resultados se expresan como media y desviación estándar (DE). Los datos se analizaron mediante análisis de varianza, y se utilizó la prueba de post hoc de Dunn22 (importancia de las diferencias p <0.05) para observar diferencias significativas entre los datos.
Resultados
Efecto de EF en la actividad inhibitoria de ECA. T y C revelaron una actividad alta, los EF de QRB, QRN, QJG, QA, QP y QK expusieron una actividad promedio de 24.3 % (Tabla 1), que representa una actividad moderada, según la prueba de Dunn no hay diferencias significativas entre sí (p<0.05).
Tabla 1 Flavonoides totales y actividad inhibitoria de ECA de extractos fenólicos de granos andinos
| Muestra | Flavonoides totales (mg QE/g) a | % de inhibición de ECA | Prueba post hoc de Dunn* |
|---|---|---|---|
| Enalapril | 91.20±3.1 | ||
| Tarwi | 91.25±0.8 | 54.25±2.2 | A |
| Cañahua | 42.78±1.2 | 56.38±2.2 | A |
| Quinua real blanca (QRB) | 91.75±0.8 | 26.75±1.8 | B |
| Quinua real negra (QRN) | 72.38±1.8 | 22.38±1.8 | B |
| Quinua J’acha Grano (QJG) | 84.8±1.2 | 24.8±1.2 | B |
| Quinua Ajara (QA) | 63.95±0.6 | 25.5±2.0 | B |
| Quinua Phisanqalla (QP) | 92.86±0.8 | 24.2±2.2 | B |
| Quinua Kurmi (QK) | 77.82±0.06 | 22.4±1.2 | B |
a Los valores son promedio de tres determinaciones. * Las letras similares no muestran diferencias significativas (p<0.05).
Tabla 2 Concentración de proteínas y almidones de granos andinos
| Análito | T a | C a | QRB a | QRN a | QJG a | QA a |
|---|---|---|---|---|---|---|
| Proteínas %* | 48.5±0.4B | 14.3±0.5A | 15.4±0.3A | 14.7±0.2A | 13.8±0.3A | 14.4±0.1A |
| Almidones %* | 1.8±0.2B | 54.3±0.3A | 53.1±0.4A | 50.7±0.6A | 55.3±0.8A | 53.5±0.2A |
a Los valores son promedio de 3 determinaciones. * Las letras similares no muestran diferencias significativas (p<0.05), T Tarwi, C Cañahua. QRB quinua real roja, QRN quinua real negra, QJG quinua J’acha grano, QA quinua Ajara.
Tabla 3 Grado de hidrolisis en % de proteínas de granos andinos
| Tratamiento enzimático | Grado de hidrolisis % | |||||
|---|---|---|---|---|---|---|
| QRB a | QRN a | QJG a | QA a | T a | C a | |
| ALC | 25.2±0.2 | 24.6±0.4 | 25.6±0.2 | 24.4±0.3 | 16.8±0.4 | 19.4±0.3 |
| FLA | 24.1±0.3 | 23.8±0.2 | 24.8±0.4 | 23.4±0.2 | 14.8±0.2 | 12.8±0.5 |
a. Los valores son promedio de tres determinaciones, ALC Alcalasa, FLA Flavourzyme, QRB quinua real roja, QRN quinua real negra, QJG quinua J’acha grano, QA quinua Ajara, T tarwi, C cañahua.
Tabla 4 Actividad antihipertensiva en % de hidrolizados proteicos de granos andinos con 4 enzimas proteolíticas, IC50 (mg/mL)
| Enzimas proteolíticas | Enalapril | QRB a | IC50 | QA a | IC50 | C a | IC50 |
|---|---|---|---|---|---|---|---|
| Pepsina | 91.2 ±3.1 | 43.7±1.8 | 1.52±0.08 | 33.4±3.1 | 2.06±0.12 | 46.2±1.6 | 1.82±0.08 |
| Pancreatina | 72.2±2.4 | .90±0.12 | 62.4±1.4 | 1.04±0.11 | 62.2±3.1 | 1.04±0.14 | |
| Alcalase | 67.2±2.1 | .74±0.04 | 83.4±1.6 | .68±0.08 | 49.3±1.1 | 1.42±0.08 | |
| Flavourzyme | 74.1±2.2 | .98±0.05 | 75.4±2.2 | .88±0.08 | 75.6±2.2 | .88±0.12 | |
| T a | IC50 | QRN a | IC50 | QJG a | IC50 | ||
| Pepsina | 54.6±2.2 | 1.72±0.02 | 34.9±2.5 | Nd | 29.4±2.6 | Nd | |
| Pancreatina | 64.3±3.2 | 1.40±0.08 | 61.5±2.1 | Nd | 63.3±2.4 | Nd | |
| Alcalasa | 64.7±2.1 | 1.34±0.12 | 61.2±2.2 | Nd | 60.9±1.1 | Nd | |
| Flavourzyme | 71.6±1.8 | 1.12±0.12 | 69.8±1.8 | Nd | 73.5±2.9 | Nd |
Análisis de proteínas y almidones. La concentración de proteínas y almidones de los GA se encuentra dentro de rangos esperados, similar en las 4 variedades QRB, QRN, QJG, QA y en la C.
GH de proteínas de GA. En todos los casos se obtuvo un GH mayor al 10 % (Tabla 3). Las diferentes variedades QRB, QRN, QJG, QA, por aplicación de ALC y FLA. De T y C se observa menor GH de proteínas.
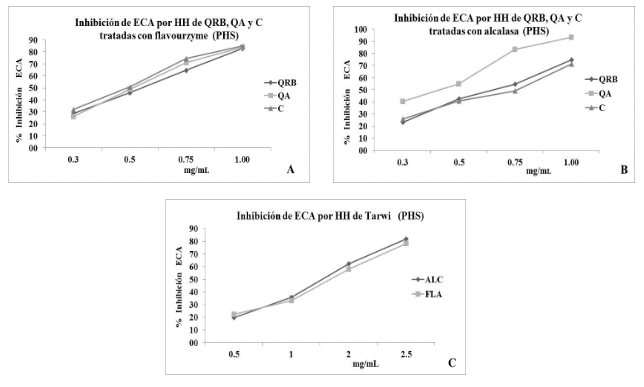
Actividad inhibitoria de ECA por hidrolizados proteicos de GA. El tratamiento de proteínas hidrolizadas con 4 sistemas enzimáticos: PEP, PAN, ALC y FLA en la actividad antihipertensiva de ECA, los hidrolizados tratados con ALC, FLA y PAN expusieron una actividad inhibitoria mayor al 60 %, en la mayoría de los casos (Tabla 4), los hidrolizados tratados con PEP fueron las de menor actividad inhibitoria (<54.6 %), la de mayor actividad fue el hidrolizado de la QA silvestre tratada con ALC (83.4 %).
Actividad inhibitoria de ECA por fracciones peptídicas de GA. De las fracciones peptídicas obtenidas por cromatografía de exclusión después de realizar hidrolisis de cada proteína obtenida de los GA (QRB, QJG, QA, T, C), con las enzimas (ALC, FLA, PAN y PEP), hasta la fracción 6 expusieron de moderada a alta actividad (Tabla 5), el seguimiento de obtención de fracciones peptídicas se realizó por TLC, como se observa en la Figura 1. Las fracciones peptídicas por aplicación de ALC y FLA fueron las que expusieron mayor actividad inhibitoria en ECA hasta la fracción 6, llegando a superar el 80 %. Los tratamientos con PEP, expusieron una actividad inhibitoria entre 50 y 70 % en ECA. El tratamiento con ALC en proteínas de las diferentes variedades QRB, QJG y QA expuso fracciones peptídicas de similar actividad inhibitoria en ECA.
Actividad inhibitoria de ECA por HH por AMY/ALC y AMY/FLA. De las harinas de QRB, QA, C y T tratadas con enzimas AMY/ALC y AMY/FLA de forma secuencial. Los PHS presentaron una actividad inhibitoria alta de ECA en relación a los PNHS, que presentaron una actividad considerablemente menor (Figura 2).
Como se puede observar en la Tabla 6, la mayor actividad antihipertensiva expuso el PHS de QA con el tratamiento AMY/ALC mostrando un IC50 de 0.38 mg/mL, en el tratamiento AMY/FLA los PHS que mostraron menor IC50 fueron QA y C con 0.49 y 0.48 mg/mL.
Como se puede observar en la Figura 3, de las HH de QRB, QA y C, el PHS obtenido por el tratamiento AMY/FLA expresa un proceso de actividad a diferentes concentraciones similares en todos los casos, para inhibir el 50 % de actividad inhibitoria de ECA con valores cercanos a 0.5 mg/mL. En el tratamiento con AMY/ALC se necesitó mayor concentración de los hidrolizados de QRB, y C (Tabla 6), resalta la actividad del hidrolizado de QA que presenta una concentración cercana a la mitad que presentaron QRB y C para inhibir el 50 % de actividad de ECA. En el caso de los hidrolizados de harina de T, se observa que se necesitó una concentración mayor para alcanzar el 50 % de actividad anti ECA.
Tabla 5 Actividad antihipertensiva de fracciones peptídicas de granos andinos obtenidas por cromatografía de exclusión
| Fracción | QRB | QJG* | QA* | T | C | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ALC | FLA | PAN | PEP | ALC | ALC | ALC | FLA | PAN | PEP | ALC | FLA | PAN | PEP | |
| F1 | 82.5±3.2 | 81.2±1.2 | 74.4±2.4 | 68.8±3.1 | 72.2±2.4 | 80.2±2.5 | 85.1±2.2 | 84.4±2.8 | 76.7±2.8 | 67.2±1.1 | 61.1±2.2 | 70.2±2.5 | 62.2±3.1 | 64.1±.3.4 |
| F2 | 80.4±3.4 | 76.6±.3.7 | 71.2±2.2 | 60.2±2.2 | 68.6±.4.1 | 78.0±2.2 | 82.2±3.2 | 81.2±3.2 | 72.0±2.2 | 65.4±2.2 | 72.2±1.8 | 61.1±2.1 | 61.7±2.8 | 66.7±3.1 |
| F3 | 70.8±3.8 | 78.6±2.6 | 73.2±1.6 | 61.1±1.8 | 70.6±2.6 | 75.6±1.6 | 78.4±2.4 | 82.7±3.4 | 68.4±3.4 | 70.4±3.2 | 58.3±2.1 | 78.5±2.4 | 66.2±2.1 | 52.4±2.2 |
| F4 | 72.6±4.2 | 75.4±4.1 | 70.2±1.2 | 54.6±1.2 | 57.4±4.5 | 78.8±3.2 | 77.1±3.2 | 73.2±2.4 | 70.1±2.8 | 58.2±4.1 | 71±4.2 | 70.2±1.8 | 58.0±4.0 | 55.2±2.6 |
| F5 | 70.4±4.2 | 64.3±3.5 | 67.4±1.8 | 26.8±.2.4 | 66.5±3.5 | 76.2±1.8 | 70.0±2.1 | 72.0±2.8 | 61.5±2.1 | 62.6±2.8 | 54±2.1 | 51.2±4.1 | 55.2±3.2 | 50.4±2.1 |
| F6 | 65.4±3.1 | 68.1±4.6 | 56.5±2.2 | 38.4±2.2 | 61.2±4.6 | 72.1±2.2 | 71.1±2.4 | 66.1±2.2 | 56.2±2.1 | 52.2±3.2 | 73±2.4 | 58.3±3.0 | 52.5±2.1 | 56.1±3.4 |
| F7 | 55.4±3.2 | 60.4±2.2 | 50.2±2.8 | 16.2±1.6 | 46.4±2.8 | 66.4±2.6 | 44.1±1.1 | 62.5±2.4 | 54.0±2.6 | 56.1±2.1 | 54±4.1 | 33.1±1.6 | 44.6±2.4 | 52.2±2.1 |
| F8 | 60.3±4.2 | 68.2±3.3 | 32.2±1.8 | 18.1±1.8 | 38.4±2.2 | 61.2±1.8 | 63.2±2.2 | 58.1±0.8 | 56.6±1.8 | 48.8±2.4 | 48±3.1 | 45.1±2.1 | 36.8±1.6 | 40.5±2..4 |
| F9 | 23.2±1.3 | 54.4±3.8 | 27.2±1.6 | 16.1±2.2 | 40.3±3.3 | 51.1±2.4 | 33.6±1.4 | 55.1±3.1 | 48.2±3.1 | 49.2±2.1 | 35±2.8 | 18.2±1.5 | 28.4±2.3 | 36.6±1.1 |
| F10 | 27.4±2.2 | 47.4±4.5 | 42.7±1.2 | 40.3±1.2 | 26.1±1.2 | 49.2±2.1 | 52.1±1.1 | 55.0±1.1 | 52.2±2.2 | 44.4±2.4 | 22±2.1 | 29.5±2.6 | 26.4±2.8 | 30.6±1.8 |
| F11 | 15.8±1.2 | 34.9±7.2 | 16.4±1.2 | 8.2±2.2 | 13.0±1.4 | 44.5±2.4 | 19.4±2.1 | 58.2±2.6 | 39.4±2.1 | 18.2±2.1 | 20±2.4 | 12.8±2.0 | 14.8±1.8 | 18.1±1.6 |
| F12 | 16.3±3.1 | 28.4±6.8 | 11.2±0.8 | 17.6±0.8 | - | 38.4±2.4 | 21.2±0.9 | 48.4±2.2 | 29.2±1.8 | 38.2±1.1 | 24±3.1 | 26.4±1.1 | 18.4±2.1 | 20.0±1.8 |
| F13 | 24.5±3.2 | 27.4±3.2 | 25.4±1.9 | 52.5±1.8 | - | 28.0±1.7 | 27.7±1.2 | 41.6±1.8 | 16.1±2.2 | 41.1±0.8 | 10±1.1 | 18.5±0.8 | 16.2±0.9 | 20.2±2.2 |
| F14 | 16.2±4.6 | 16.5±4.7 | 16.8±1.4 | 17.2±1.6 | - | - | 13.3±1.4 | 37.1±1.1 | 16.1±1.4 | 18.6±3.2 | 12±0.8 | 20.4±1.2 | 14.8±2.0 | 17.1±1.1 |
| F15 | 12.3±3.7 | 12.6±3.4 | 4.6±0.2 | 6.6±0.8 | - | - | 11.2±1.1 | 15.2±0.8 | 12.8±1.1 | 10.8±2.4 | 14±2.1 | 16.0±1.8 | 8.2±2.2 | 2.4±0.8 |
*tratadas solo con alcalasa, Los valores son promedio de tres determinaciones, ALC Alcalasa, FLA Flavourzyme, PAN Pancreatina, PEP Pepsina, QRB quinua real blanca, QJG quinua J’acha grano, QA quinua Ajara, T tarwi, C cañahua.
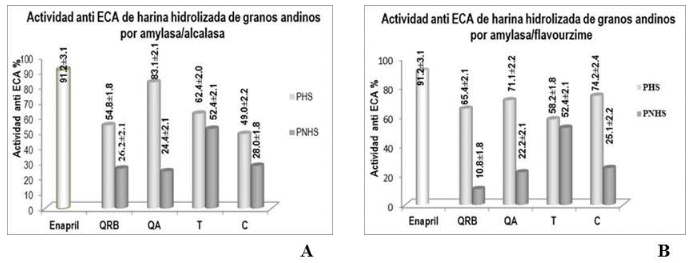
Figura 2 Actividad inhibitoria de ECA (%) por harinas hidrolizadas de granos andinos (n=3) a) AMY/ALC, b) AMY/FLA, PHS: producto hidrosoluble, PNHS: producto no hidrosoluble quinua Real blanca (QRB), quinua Ajara (QA), tarwi (T), cañahua (C)
Tabla 6 IC50 mg/mL de PHS de harinas hidrolizadas de granos andinos en actividad anti ECA
| QRB | QA | C | T | |||||
|---|---|---|---|---|---|---|---|---|
| IC50 (PHS) | ALC | FLA | ALC | FLA | ALC | FLA | ALC | FLA |
| .68±0.18 | .52±0.08 | .38±0.08 | .49±0.06 | .74±0.18 | .48±0.08 | .67±0.03 | .72±0.04 | |
Los valores son promedio de tres determinaciones, QRB quinua real blanca, QA quinua Ajara, ALC alcalasa, FLA flavourzyme, T tarwi, C cañahua.
Discusión
De los GA, quinua, C y T, el grano que obtuvo mayor referencia en sus cualidades funcionales fue la Q, que ha expuesto diferentes beneficios en la salud, como la enfermedad celíaca, pérdida de peso y/o parámetros metabólicos asociados con diabetes, obesidad, hipertensión, hiperlipidemia, trastornos posmenopausia, mejora de la forma física5, la quinua Real es la que tiene mayor difusión comercial por lo que es exportada a diferentes países, cuenta con diferentes eco tipos, QRB, QRN, QRR. Entre las quinuas del presente estudio, se consideraron también las quinuas mejoradas por hibridación, QJG y QK que son promisorias para exportación, en particular la QJG14, por ser resistente al mildiu y de corto periodo de producción. La QA es silvestre y no se la consume, se la utiliza en procesos antiinflamatorios como emplastos en la medicina tradicional23.
La Q, C, y T, se caracterizan en poseer compuestos bioactivos reconocidos como antioxidantes7,24,25 se atribuye esta actividad a los flavonoides, este tipo de compuestos, también reportaron actividad anti ECA en otras fuentes naturales26, Hettihewa et al.27 & Guerrero et al.28 identificaron varios tipos de flavonoides de fuentes naturales con actividad inhibitoria de la ECA27,28, varios flavonoides reportados, se encuentran también en la Q y C, se ratifica con el estudio reportado esta actividad se encuentran en GA, como kaempferol y QE que se encuentran en la Q29, compuestos fenólicos rutina, ácido clorogénico y ácido gálico en Q y C30.
Según el reporte de Repo-Carrasco-Valencia et al.31, el contenido de flavonoides de la Q, varía de 36.2 a 72.6 mg/100 g, de C de 24.2 a 41.9 mg/100 g31, en el presente estudio, todas las variedades, QRB, QRN, QJG, QA, QP, QK presentaron un contenido de flavonoides de 63.95 a 92.86 mg/100 g, siendo la QA silvestre la de menor contenido, de la C se obtuvo 42.78±1.2 mg/100 g. De lupinus mutabilis (T), un estudio reciente de 33 ecotipos obtuvieron el contenido de flavonoides totales de 30 a 135 mg/100g32, en nuestro estudio se obtuvo 91.2 mg/100 g.
Asao & Watanabe33 reportaron la actividad anti ECA de extracto ebullido y tratado con etanol de Q alta actividad antioxidante y una inhibición de ECA del 23.3 %33, nuestro grupo evaluó el EF ricos en flavonoides de las 6 variedades de Q que presentaron actividad inhibitoria de ECA con un promedio de 24.3±2.4 %. Los flavonoides detectados en la Q son glucosilados, 4 derivados del kaempferol y 2 derivados de QE34, esta característica de estos compuestos podría influir en la actividad inhibitoria de ECA. En el estudio realizado por Ranilla et al.35 de extractos obtenidos por ebullición de Q, C, y T, en actividad antihipertensiva, solo el T presento actividad anti ECA, con una actividad de 52 % de inhibición35, en el presente estudio, se trabajó con EF, obteniéndose actividad antihipertensiva del EF de C (56.4 %) y T (54.2 %) de actividad inhibitoria en ECA. El contenido de flavonoides no correlaciona con la actividad anti ECA (Tabla 1), lo que da lugar a 2 opciones i) la glucosilacion de los flavonoides interfiere en diferente grado a la actividad de ECA, ii) existen otros compuestos diferentes a flavonoides que presentan esta actividad.
Según Moreno-Limón & González-Luna36, las proteínas hidrolizadas de Q tratadas con ALC expusieron actividad inhibitoria de ECA mayor al 80 % con un GH de 32 %, y con FLA hasta 48 % de inhibición36, en el presente estudio, las variedades de QRN y QJG expusieron 61 % de inhibición, QRB (67 %) y QA (83 %) con ALC con un GH promedio de 25.0±0.6, datos similares a los referidos, con FLA las proteínas hidrolizadas de todos los granos presentaron de 70 a 75 % de actividad inhibitoria de ECA con un GH de 24.1±0.7, las proteínas tratadas con PAN y PEP presentaron también una actividad inhibitoria de ECA alta como se observa en la Tabla 4, lo que indica la probabilidad de que existen secuencias peptídicas de diferentes tamaños en las proteínas de GA con esta actividad, lo que coincide con lo reportado por Alexaindre et al.3. El trabajo de Shi et al.37 reportó alta actividad inhibitoria de hidrolizados proteicos de Q en ECA, tratados por 120 min con PEP con un IC50 de 0.78 mg/mL37, en nuestro estudio, el hidrolizado proteico por PEP fue por 90 min con un IC50 de 1.52±0.08 mg/mL, lo que indica, a mayor hidrolisis con PEP mayor actividad anti ECA.
Los hidrolizados proteicos de C, obtenidas por tratamiento secuencial con las enzimas Neutrasa/ALC por 180 min a 50° C, presento una actividad anti ECA de 69.8 % según lo reportado por Chirinos et al.38, nuestro grupo obtuvo 44.3±1.1% de actividad inhibitoria del hidrolizado proteico de C con el tratamiento de ALC. En relación a los tratamientos con FLA, PAN y PEP nuestros resultados señalan mayor o igual % de inhibición a los tratamientos con ALC.
De T, nuestro estudio refiere una actividad inhibitoria de ECA mayor al 50 % de los hidrolizados proteicos por la aplicación enzimática de las 4 enzimas (ALC, FLA, PAN y PEP), como se observa en la Tabla 4.
De las fracciones peptídicas obtenidas por cromatografía de exclusión y unidas por TLC, en los casos tratados con ALC, FLA y PAN hasta la fracción 6 con alta actividad anti ECA, incluso llegando al 80 % de actividad inhibitoria de ECA de QRB, QJG, QA, C y T, estudios similares señalan que péptidos entre 1 y 5 kDa tienen mayor actividad que los de 10 kDa36,39. Del T se han identificado péptidos purificados de gamma - conglutin que tienen referencias con actividad inhibitoria de ECA39. En suma, se han reportado péptidos con esta actividad en otras especies de lupino, proponiéndose su uso clínico en hipertensión40.
Las enzimas ALC y FLA son las que se utilizan usualmente para obtener hidrolizados proteicos en la determinación de actividad inhibitoria de ECA, principalmente en proteínas aisladas de granos vegetales, cereales y pseudocereales41,42, nuestro grupo no solo trabajo con ALC y FLA, en adición, se utilizó también con pepsina y pancreatina, obteniendo en cada caso actividad anti ECA de alta significancia.
Los PHS de HH de QRB, QA, C, T obtenidos por ALC y FLA presentaron en todos los casos mayor actividad inhibitoria (˃50 %) de ECA en relación a los PNHS. Los PNH presentaron menor actividad, entre 24 y 28 % para los pseudocereales (QRB, QA, C), la excepción fue el T que presento una actividad de 52 %, sin embargo, debemos considerar que el contenido de proteínas en la harina de T fue mayor por lo que los IC50 de los PHS del T por ALC y FLA fueron los más altos de 1.49 y 1.52 mg/mL correspondiente.
Se ratificó una mayor actividad antihipertensiva de la HH tratada con ALC de QA (83.1 % IC50 0.38 mg/mL), que correlaciona con la actividad de hidrolizados proteicos (83.4 % IC50 0.68 mg/mL), considerando que el contenido de proteínas en las muestras de HH sometidas a actividad anti ECA fue menor, por lo que se podría atribuir mayor actividad de los PHS a la presencia de compuestos fenólicos glucosilados junto a los péptidos obtenidos por hidrolisis enzimática.
Los EF ricos en compuestos flavonoides, hidrolizados proteicos y fracciones peptídicas de diferentes ecotipos de Q, C (pseudocereales) y T (leguminosa), presentaron una actividad inhibitoria en ECA de moderada a alta. Los hidrolizados proteicos, fracciones peptídicas obtenidas por tratamiento con ALC, FLA, PAN y PEP, así como los productos hidrosolubles de las HH por AMY/ALC y AMY/FLA expusieron alta actividad inhibitoria de ECA. El presente trabajo propone desarrollar estudios clínicos y estrategias dietéticas para controlar la hipertensión a partir de hidrolizados de Q, C y T como una alternativa natural.











 texto en
texto en 
 uBio
uBio