Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Journal of the Selva Andina Research Society
versión impresa ISSN 2072-9294versión On-line ISSN 2072-9308
J. Selva Andina Res. Soc. v.3 n.1 La Paz 2012
ARTÍCULO ORIGINAL
Evaluación de Trichoderma spp. y Acibenzolar-S-Metil (Bion®) como inductores de resistencia a la pudrición blanca Sclerotium cepivorum Berk. en ajo (Allium sativum L.) bajo Condiciones de campo
Evaluation of Trichoderma spp. and Acibenzolar-S-Methyl (Bion®) as resistance inducers in garlic (Allium sativum L.) agains white rot Sclerotium cepivorum Berk. under field conditions
Jiménez María A.1*, Asdrubal Arcia2, Ulacio Dilcia1, Hernandéz Alexander1
1Universidad Centroccidental Lisandro Alvarado, Laboratorio de Fitopatología, Estado Lara. Venezuela.
2Universidad Central de Venezuela. Estado Aragua, Venezuela. Laboratorio de Biología Molecular de la UCLA – Apartado 400 3001 Lara. Venezuela Telf. (0251) 259.2490 – 259.2493. Fax. (0251) 259.2571
arcia.asdrubal@gmail.com
dilciau@ucla.edu.ve
ahernandez@ucla.edu.ve
*Dirección de contacto:
Laboratorio de Fitopatología. Universidad Centroccidental Lisandro Alvarado, Apartado 400 3001 Lara. Venezuela Telf. (0251) 259.2490 – 259.2493. Fax. (0251) 259.2571.
María Auxiliadora Jiménez.
E-mail address: mjimeneztamayo@gmail.com.
Historial del artículo
Recibido Febrero, 2012.
Devuelto Abril 2012
Aceptado Junio, 2012.
Disponible en línea, Agosto, 2012.
Resumen
Los inductores de resistencia bióticos y abióticos surgen como alternativa para el manejo de la pudrición blanca en ajo causada por el hongo Sclerotium cepivorum Berk. Para evaluar el efecto de dichos inductores sobre las variables rendimiento del cultivo, incidencia final de la enfermedad (IE), el área bajo la curva del progreso de la enfermedad (ABCPE) y las variables asociadas a crecimiento y producción en plantas de ajo, se incorporaron los hongos Trichoderma harzianum y T. koningiopsis con Bion® bajo condiciones de campo, en un diseño de bloques al azar con ocho tratamientos y cuatro repeticiones. Los tratamientos quedaron conformados de la siguiente forma: Testigo, Trichoderma harzianum bajo las formulas comerciales Tricobiol® (Tri), Subiol® (S), T. koningiopsis (Tk), Bion® (B), T. koningiopsis + Bion (Tk+B), Subiol+Bion (S+B) y Tricobiol + Bion (Tri+B). Los mayores rendimientos y variables de crecimiento corresponden a aquellas plantas tratadas con el tratamiento Tk + B y coincidió con unas de las menores ABCPE. La menor IE fue observada cuando se aplicó Tk, T.k + B y Tri. Estos resultados indicaron que la mayor protección frente a la enfermedad se logró con la combinación del antagonista con el compuesto químico reflejado en un descenso del ABCPE y un retraso en los picos de infección. El rendimiento total del ajo, aumentó en los tratamientos donde se combinaron ambos inductores ya que estimularon la productividad de la planta y por ende el desarrollo y la defensa de las mismas.
Palabras clave:
Resistencia inducida, incidencia final de la enfermedad, área bajo la curva del progreso de la enfermedad.
Abstract
Inducers of biotic and abiotic resistance emerge as an alternative for the management of garlic white rot caused by the fungus Sclerotium cepivorum Berk. To evaluate the effect of these inducers on crop yield variables, final disease incidence (DI), the area under the curve of disease progress (AUDPC) and variables associated with plant growth and yield of garlic, and experiment was set, using the fungi Trichoderma harzianum and T. koningiopsis with Bion® under field conditions in a randomized block design with eight treatments and four replications were incorporated. The treatments were conformed as follows: control, Trichoderma harzianum under commercial formulas Tricobiol® (Tri), Subiol® (S), T. koningiopsis (Tk), Bion® (B), T. koningiopsis + Bion (Tk+ B), Subiol Bion (S+B) and Bion +Tricobiol (Tri+ B). The higher yields and growth variables correspond to those plants treated with Tk+ B treatment and coincided with some of the lowest AUDPC. The lower (DI) was observed when applied Tk, Tk +B and Tri. These results indicated that the greatest protection against the disease was achieved with the combination of the antagonist with the chemical reflected in a decrease of AUDPC and a delay in the peak of infection. The total yield of garlic increased in the treatments in which both inducers and that stimulated plant productivity and thus the development and defense.
Key words:
Induced resistance, final disease incidence, area under the curve of disease progress.
Introducción
La pudrición blanca en ajo (Allium sativum L.) causada por el hongo Sclerotium cepivorum Berk, es una de las enfermedades más importantes de este cultivo en los estados Táchira, Mérida, Trujillo, Miranda y Lara, principales zonas productoras de este rubro en Venezuela (San Román & Núñez 2008). Este hongo afecta sólo a los bulbos de las plantas pertenecientes al género Allium, ocasionando graves pérdidas económicas a los productores (Moreno & Acevedo 2002).
El control de S. cepivorum es difícil porque forma abundantes esclerocios con elevada capacidad para sobrevivir, permaneciendo latentes en el suelo durante muchos años (Coley-Smith et al 1990, Crowe et al 1993). A pesar de ello se ha logrado reducir la enfermedad mediante la utilización de diferentes prácticas agronómicas, donde se destaca la utilización de Trichoderma harzianum y Trichoderma koningii que han permitido controlar al patógeno y reducir el nivel de inoculo en el suelo (McLean & Stewart 2000, Ulacio et al 2003, 2006). Este microorganismo benéfico, es capaz de colonizar raíces, promover el crecimiento e inducir la activación de los mecanismos de defensas naturales de la planta, mejorando la resistencia de los cultivos a las enfermedades (Segarra et al 2007), debido a su capacidad para sintetizar e inducir enzimas, potenciar la expresión de los genes de defensa cuando se produce un ataque posterior por parte de un patógeno (Pozo et al 2004).
Por otra parte, la utilización de inductores de resistencia, origen químico como el Acibenzolar-S-Metil (Bion®) provocando en las plantas tratadas la capacidad para responder eficientemente y más rápido ante el ataque de patógenos, representa también una nueva oportunidad de manejar enfermedades ya que asociado con otras prácticas agronómicas protegen cultivos hasta el final del ciclo de vida de las plantas (Resende et al 2002, 2006).
El conocimiento de los efectos del inductor químico, el antagonista, en el proceso de protección, originando adicionalmente variaciones sobre el crecimiento y vigor de las plantas, así como sobre la incidencia, y el progreso de las enfermedades, por tanto el conocimiento de estas variables y las relacionadas con el crecimiento de los cultivos constituyen un instrumento para evaluar el efecto de dichos inductores sobre los diferentes procesos fisiológicos de la planta, su resistencia en campo, que permitirían fomentar el desarrollo de nuevas destrezas en el manejo de la enfermedad.
Con base a las razones anteriormente expuestas, el objetivo planteado para la siguiente investigación fue, evaluar el efecto de la incorporación de Trichoderma harzianum, T. koningiopsis y Bion® como inductores de resistencia a la pudrición blanca en ajo (Allium sativum L.) producida por Sclerotium cepivorum, bajo condiciones de campo.
Materiales y métodos
Localización del lugar de estudio. El presente estudio se llevó a cabo en el fundo Cacho de Venado, ubicado en la zona productora de Agua Negra perteneciente al Municipio Jiménez del Estado Lara, se realizó en un área ubicada sobre un piso actitudinal de 1.500 msnm, la zona presenta temperaturas medias que oscilan entre 17 a 21 °C (López 1996).
La investigación se llevó a cabo de noviembre de 2009 a mayo de 2010, el ensayo se estableció sobre una superficie de 128 m2 (densidad de inoculo inicial promedio 18,2 esclerocios viables de S. cepivorum por kg de suelo).
Determinación de la Densidad y Viabilidad de los esclerocios de Sclerotium cepivorum: La determinación de la densidad y viabilidad de los esclerocios del patógeno presentes en el lote donde se estableció el ensayo, se realizó a partir de muestras de suelo tomadas al momento de la siembra. El muestreo se realizó de manera sistemática en zig-zag, tomando la capa de suelo de 0 a 10 cm de profundidad. Cada unidad experimental colectada presenta 5 sub-muestras de 70 g aproximadamente, luego se mezcla para obtener una muestra compuesta. El suelo de cada muestra se secó a temperatura ambiente bajo condiciones de laboratorio, (con una temperatura promedio de ±28ºC y una Humedad Relativa de ±65%) tomando de cada unas tres alícuotas de 30 g para la extracción de los esclerocios con los tamices Nº 20 y 100 µm, mediante la técnica de tamizado húmedo (Adams 1979). El número de esclerocios de cada alícuota se cuantificó y se estimó la densidad de inoculo por unidad experimental (Ulacio 2003).
Para determinar la viabilidad de los esclerocios, se tomaron 20 esclerocios de cada repetición, desinfestándolos con etanol alcohol al 90% por un minuto y enjuagándolos con agua destilada estéril, realizando tres pases. Una vez secos en la cámara de flujo laminar a temperatura ambiente se aplastaron con la ayuda de una pinza y colocaron hundiéndolos en discos de agar-agua (AA) de 5 mm de diámetro, en cajas Petri de 9 cm de diámetro esterilizadas en autoclave durante 20 minutos a 15 libras de presión ( 121°C) incubándolas por 9 a 10 días a 15º C. El desarrollo de micelio blanco con formación de fialosporas a los 8 o 9 días, confirmó la viabilidad del esclerocio (Crowe et al 1980).
Unidad experimental. Se sembraron semillas-diente de ajo, de apariencia sana, sin manchas, decoloraciones o lesiones sobre su superficie provenientes de un ensayo de campo. En cada unidad experimental (UE) se sembraron cuatro surcos con una separación de 0,50 m, con 25 semillas por surco, para una densidad final de 100 semillas/UE.
Obtención del inductor de resistencia biótico. Se aplicó una cepa de T. koningiopsis obtenida de la zona en estudio, cultivada y multiplicada en frascos de vidrio transparentes de 500 300 mL de capacidad 18 cm de alto 5 cm de diámetro tapados con gasa esterilizada utilizando 300 mL de Agar Para Dextrosa (PDA) más acido láctico crecido por un lapso de 15 días bajo condiciones de laboratorio descritas, con una concentración aproximada de 105 unidades formadoras de colonias (ufc.mL-1). El producto comercial Subiol® (Insubiol C.A) fue incorporado a una concentración de 2 g. 10 L-1 de agua (1x 106 conidias mL-1) mientras que el producto comercial Tricobiol® (Agrobica C.A) se aplicó a una concentración de 1,7 g .10 L-1 de agua (1x 106 conidias / mL-1. Todos los tratamientos con Trichoderma spp. fueron aplicados al momento de la siembra y a 15, 30, 60, 75, 90 y 110 días después de la siembra (dds) en igual dosis a la inicial. La aplicación del producto comercial Bion® (Acibenzolar-S-methyl, WG. 500 Syngenta Crop Protection Pty Ltd ) se hizo sobre el cuello de la planta a una dosis de 0,06 g. 8 L-1 de agua a los 22, 70 y 106 (dds) en igual dosis.
Las UE´s se dispusieron en un diseño en bloques al azar, para un total de ocho tratamientos con cuatro repeticiones por tratamiento. La pudrición blanca (pb) se registró cada 7 días hasta la cosecha.
Incidencia de la pudrición blanca en ajo. En cada evaluación se midió la incidencia de la enfermedad (IE). Los datos obtenidos se usaron para calcular la incidencia acumulada (IA) en el tiempo. La cosecha del ajo se realizó a los 122 días para determinar y comparar el efecto de los tratamientos sobre la pb, se determinó el área bajo la curva del progreso de la enfermedad (ABCPE) por el método de integración trapezoidal (Campbell & Madden 1990). El rendimiento del cultivo (REN) se evaluó al momento de la cosecha, en los dos surcos centrales de cada unidad experimental, evitando los efectos de bordura. Se registró además el peso fresco promedio de los bulbos (PFB) así como el peso seco promedio de los bulbos (PSB) en cada repetición.
Las variables relacionadas con el crecimiento del cultivo evaluadas en el ensayo fueron los descriptores de porte de planta: largo y ancho de la lámina foliar (LL y AL) respectivamente, tomados de la tercera hoja verde; peso fresco y peso seco aéreo (PFA y PSA); altura de la planta (AP) tomada desde el suelo hasta el ápice de la hoja más larga y los descriptores de bulbo: ancho del cuello o diámetro del pseudotallo (AC), altura y diámetro del bulbo (AB y DB).La determinación del índice o contenido de clorofila (CC) en las hojas se realizó por medio del medidor de clorofila Minolta SPAD tomando para cada medición la tercera hoja verde. Todas las variables fueron determinadas al momento de la cosecha en 20 plantas procedentes de las repeticiones de cada tratamiento.
Análisis estadístico. Los resultados obtenidos para cada caso, se sometieron a un análisis de varianza (P≤0,05); se realizó la prueba de comparación múltiple de Tukey, para ello se utilizó el programa estadístico STATISTIX versión 8.0. Así mismo los datos se sometieron a un Análisis de Componentes Principales (ACP), usando el programa NTSYS-pc, versión 1.70, con el fin de determinar dentro del conjunto de datos, la interrelación entre las variables seleccionadas con los tratamientos.
Resultados
La tabla 1 muestra el efecto de los tratamientos sobre la incidencia (IE) de la pudrición blanca el tiempo de inicio de la enfermedad (To) y el área bajo la curva del progreso de la enfermedad (ABCPE), donde se pudo observar que la pb se inició a los 84 dds en el testigo (Tes) en el tratamiento Subiol (Sub) y en aquellos donde se aplicó sólo Bion combinado con las fórmulas comerciales Subiol® y Trichobiol® (Sub+B y Tri+B respectivamente). La enfermedad se observó a los a los 91 (dds) en los tratamientos Tricobiol® y en la mezcla Trichoderma koningiopsis y Bion (Tri y T.k +B). El mayor To se evidenció en el tratamiento donde se aplicó solo T. koningiopsis (Tk), observándose por primera vez a los 106 dds. De esta manera la pb se retrasó de 7 a 28 días en estas últimas alternativas, al compararlas con el testigo y con el resto de los tratamientos.
| Tabla 1. Efecto de los tratamientos aplicados a las plantas de ajo (Allium sativum) sobre tiempo de inicio de la enfermedad (To), la incidencia de la pudrición blanca (IE) y el área bajo la curva del progreso de la enfermedad (ABCPE) en un ensayo en Agua Negra Municipio Jiménez, estado Lara (Ciclo noviembre 2009-mayo 2010) |
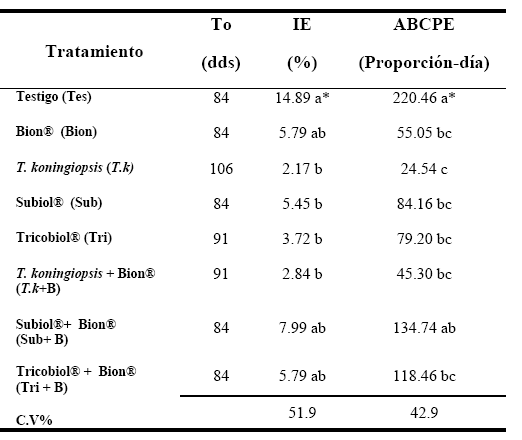 |
| (*)Valores con la misma letra, indican que los tratamientos son estadísticamente iguales, de acuerdo con la prueba de Tukey (P<0,05). |
La mayor IE se observó en Tes y las menores se evidenciaron en los tratamientos Tk (disminuyendo la pb en 83,70%), seguido por T.k +B; Tri y Sub. El análisis del área bajo la curva del progreso de la enfermedad (ABCPE) determinó que la mayor correspondió al Tes seguida por Sub+B, aunque el área se redujo cuando se aplicó el resto de las alternativas (coincidiendo en parte con la menor IE registrada) el tratamiento Tk mostró la menor área con un descenso de más de 88,8%. La Figura 1 muestra la incidencia acumulada (IA) de la pb en los diferentes tratamientos aplicados a las plantas de ajo, donde se evidenció el comportamiento policíclico y ascendente de la curvas del progreso de la enfermedad. No obstante se presentó una modificación en el comportamiento de la enfermedad con la aplicación de las alternativas de manejo al compararlas con el testigo.
| Fig 1. Incidencia acumulada (IA) de la pudrición blanca (Sclerotium cepivorum) en los diferentes tratamientos aplicados a las plantas de ajo (Allium sativum L.) en un ensayo en Agua Negra Municipio Jiménez, estado Lara (Ciclo noviembre 2009-mayo 2010) |
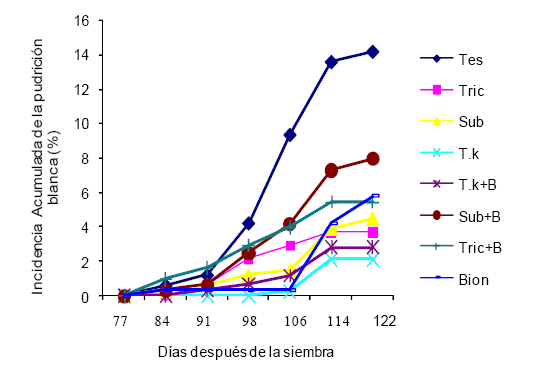 |
| (*)Valores con la misma letra, indican que los tratamientos son estadísticamente iguales, de acuerdo con la prueba de Tukey (P<0,05). El coeficiente de variabilidad indicó una variación relativamente baja para condiciones de campo. |
Los porcentajes de IA aumentaron desde los 84 hasta los 122 dds en los tratamientos Tes y Sub+B. Inicialmente todas las curvas de los tratamientos se mantuvieron hasta los 91 dds, a partir de este momento la enfermedad inició su ascenso de forma abrupta hasta los 122 días, cuando se realizó el último registro de plantas enfermas.
El efecto contrario fue observado en el tratamiento Sub disminuyó su rendimiento cuando se combinó con Bion® indicando que pudo ocurrir una interacción mutuamente antagónica entre el inductor químico y el biológico. Aunque las curvas sufrieron modificaciones y mostraron su carácter policíclico se mantuvieron hasta los 106 dds. Posteriormente, la pb inició su ascenso sostenido logrando acumular sólo el 4,95 % de intensidad de daño. Durante el desarrollo del cultivo, la etapa de mayor predisposición ocurrió a los 114 dds, donde se observó el mayor pico de infección. No obstante en el tratamiento donde se aplicó Bion® se evidenció un retraso importante de la enfermedad hasta el día 106 con respecto al testigo para luego mostrar un cambio drástico en el comportamiento de la curva. Los tratamientos T.k, T.k+B y Tri produjeron un retraso en los picos de infección ejerciendo un gran efecto sobre la IA de la pudrición blanca cuando se les comparó con el resto de los tratamientos.
La tabla 2 muestra el efecto de los diferentes tratamientos aplicados sobre las variables peso fresco del bulbo (PFB), peso seco del bulbo (PSB) y rendimiento (REN) de las plantas de ajo. Aunque la prueba de Tukey no detectó las diferencias entre ellos, la tendencia indicó que todos los tratamientos superaron al testigo. Los mayores rendimientos se evidenciaron en los tratamientos Tk + B y Tri + B coincidiendo con unas de las menores ABCPE cuando se les comparó con el resto de las alternativas, mientras que cuando fueron aplicados sin el inductor químico mostraron rendimientos inferiores indicando el efecto aditivo sobre las variables al combinar al microorganismo benéfico con el inductor químico.
| Tabla 2. Efecto de los diferentes tratamientos aplicados sobre las variables peso fresco del bulbo (PFB), peso seco del bulbo (PSB) y rendimiento (REN) de las plantas de ajo (Allium sativum L.) en un ensayo en Agua Negra Municipio Jiménez, estado Lara (Ciclo noviembre 2009-mayo 2010) |
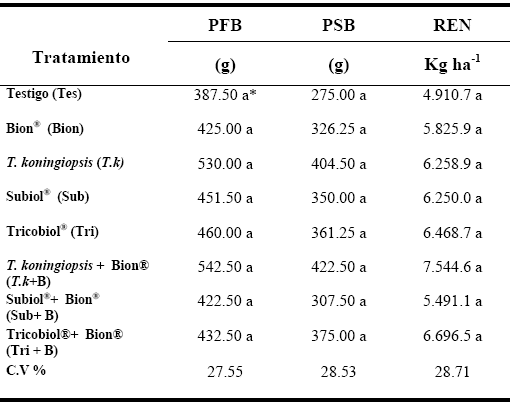 |
| (*)Valores con la misma letra, indican que los tratamientos son estadísticamente iguales, de acuerdo con la prueba de Tukey (P<0,05). El coeficiente de variabilidad indicó una variación relativamente baja para condiciones de campo. |
Vale resaltar que aun cuando Tk fue el tratamiento que obtuvo la menor ABCPE y uno de los mayores PFB no mostró el mayor rendimiento, probablemente porque los bulbos resultantes perdieron peso debido a que la madurez fisiológica del cultivo se retrasó.
La Figura 2 muestra la representación gráfica del análisis de componentes principales (ACP) de los datos obtenidos y que permitió evidenciar la interrelación entre las variables seleccionadas y los tratamientos aplicados a las plantas de ajo. En ella se observó que los componentes principales uno y dos (CP1 y CP2), explicaron en conjunto el 53,9% de la variabilidad total de los datos, afirmando que existió correlación entre las variables seleccionadas y los tratamientos. El coeficiente de correlación cofenética alcanzó un valor de 0,809 (cercano a 1) evidenciando la calidad de la reducción de la dimensionalidad lograda con el empleo del análisis.
| Fig 2. Análisis de componentes principales (ACP) con la interrelación entre las variables seleccionadas y los tratamientos.) de las plantas de ajo (Allium sativum L.) en un ensayo en Agua Negra Municipio Jiménez, estado Lara (Ciclo noviembre 2009-mayo 2010) |
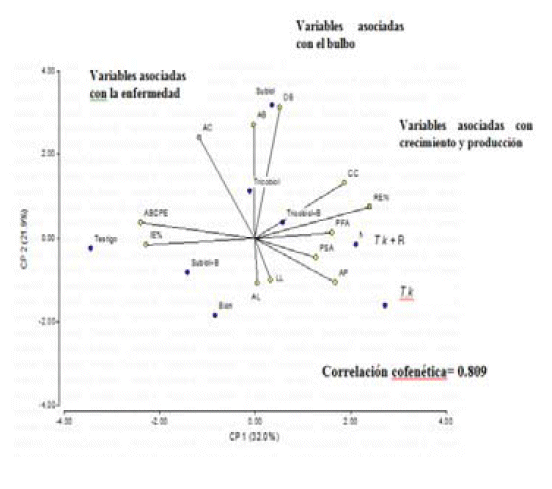 |
El análisis multivariado, permitió establecer que a medida que se hace un desplazamiento hacia la derecha sobre el eje horizontal (CP1) incrementa la variable REN mostrando el efecto de los diferentes tratamientos aplicados sobre las variables agronómicas relacionadas con el crecimiento, desarrollo del bulbo y contenido de clorofila de las plantas de ajo. Las plantas tratadas con el inductor biológico Tk sólo o combinado con Bion® mostraron que esos tratamientos promovieron el metabolismo y el crecimiento de las plantas acción que se observó al evaluar las variables: LL, CC, AP y PFA. Adicionalmente, se evidenció, una interconexión entre la estimulación del crecimiento y el aumento en la concentración de clorofila.
Los mayores rendimientos corresponden a aquellas plantas tratadas con el tratamiento T.k + B que mostraron además los mayores CC, PFA, PSA y AP indicando el efecto aditivo y a largo plazo de la resistencia inducida. Asociados con los mayores DB y AB se observaron los tratamientos Sub y Tri, sugiriendo que T. harzianum ejerció un efecto positivo de sobre dichas variables al compararlo con el resto de las alternativas.
Resultados totalmente inversos al primero se observaron en las plantas testigo y en aquellas que fueron tratadas con la combinación Sub + B ya que se relacionaron con las mayores IE y ABCPE demostrando que la combinación de ambos inductores no creó situaciones efectivas para reducir la incidencia de pb. El tratamiento Bion® se observó separado del resto de los grupos, mostrando los mayores LL y AL, sugiriendo que el inductor químico afectó de forma positiva el desarrollo de la planta.
Las plantas tratadas con Bion® aunque mostraron las mayores AL (indicando el efecto positivo del inductor sobre dicha variable) presentaron el menor CC probablemente porque mostraron deterioro de la lámina foliar causado por un fuerte ataque de ácaros pertenecientes a la especie Eriophyes tulipae Keifer. que produjo amarillamiento de la lámina foliar; realizaron menor actividad fotosintética, afectando el crecimiento, reduciendo la calidad del bulbo y productividad.
El efecto positivo de T. harzianum, se observó al obtener los mayores DB y AB, contrariamente, los bulbos resultantes de los tratamientos con T.k y T.k+B aunque presentaron un diámetro superior, no tenían los dientes divididos denotando inmadurez fisiológica. Si bien cuando se aplicaron estas alternativas, aumentó la capacidad fotosintética y el suministro de fotoasimilados hacia los bulbos, esto se produjo tardíamente y en consecuencia se cosecharon bulbos en formación.
Discusión
El número de esclerocios de Sclerotium cepivorum viables presentes en el lote donde se estableció el ensayo de acuerdo con Crowe et al (1980) fue capaz de de inducir una alta incidencia de la enfermedad, no obstante si bien la densidad de inoculo no fue elevada la IE debido las estrategias aplicadas a las diferentes unidades experimentales fue menor cuando se les comparó con el testigo.
Todas las variables evaluadas mostraron que las plantas tratadas con los inductor biológico Tk y Tri sólos o combinados con Bion® promovieron el metabolismo y el crecimiento. El aumento en la concentración de clorofila, evidenció una interconexión entre la estimulación del crecimiento, el desarrollo y la defensa de las plantas. Todas estas alteraciones o cambios bioquímicos y fisiológicos están asociadas con la inducción de resistencia demostrando que ambos procesos crecimiento y defensa pueden activarse como consecuencia de la aplicación del inductor biótico permitieron un aumento moderado de la resistencia a la pudrición blanca y plantas más sanas y desarrolladas.
La combinación del antagonista T. koningiopsis, Tricobiol® (T. harzianum) con el compuesto químico Bion®, generó condiciones que favorecieron la reducción de la incidencia de la enfermedad o impidieron el desarrollo del patógeno. Se puede sugerir entonces, de acuerdo con los resultados, que la resistencia sistémica adquirida (RSA) por las plantas mediante la aplicación del inductor químico y la resistencia sistémica inducida (RSI) por el hongo fueron compatibles, como resultado se obtuvo un efecto aditivo sobre el nivel de protección inducida, demostrando que se promovió la activación paralela de ambas respuestas de defensa, con efectos complementarios. Por otra parte, durante la integración de la RSI con la RSA puede ocurrir un efecto de sensibilización o priming de la planta que genera un mayor crecimiento en las mismas debido a necesidades de energía requiriendo de mayor frecuencia respiratoria y un aumento de la actividad fotosintética para apoyar dicha frecuencia (Ton et al 2002).
Los resultados de la presente investigación permiten señalar que para mejorar la eficacia del control biológico contra este patógeno con origen en el suelo, se debe aplicar mezclas de microorganismos antagonistas con diferentes mecanismos de acción y combinarlos con activadores químicos, pues dicha mezcla puede proteger a la planta e incluso puede resultar en un nivel aditivo de protección.
Estudios previos señalan el efecto aditivo de dichas aplicaciones y que los resultados dependen del tiempo de activación de señales, de la cepa del hongo inductor empleada y de la persistencia de las mismas sobre las plantas (Perazzolli et al 2008). De igual modo, la combinación de la RSI por microorganismos benéficos con la RSA por químicos, da como resultado una mayor coherencia entre las rutas metabólicas (Abo-Elyousr et al 2009).
El conocimiento generado por las curvas del progreso de la enfermedad indicó que la pb aumenta después de los 95 dds, por lo tanto se pueden tratar las semillas con ambos antagonistas al momento de la siembra y posteriormente aplicarlos a las plantas a los 50, 75 95 y 105 dds mientras que el inductor químico se aplicaría a los 70, 85, 100 110 dds.
Por otra parte, la combinación Bion® y la fórmula comercial Subiol® expusieron el que puede ocurrir antagonismo entre la RSI y la RSA y afectar la producción del cultivo, probablemente al interferir en la translocación de fotoasimilados hacia el bulbo, impedir o mermar el desarrollo, actividad y/o adaptación al suelo por parte del antagonista demostrando que esta estrategia también tiene sus inconvenientes por "conflictos de señalización" o bien "compensaciones" entre las respuestas inducidas contra patógenos; por lo tanto, no se puede considerar sólo el efecto beneficioso sino también el costo metabólico que pudo generar un efecto adverso. Esta situación refleja lo señalado por Corné et al (1998), Van Wees et al (2000, 2008) en cuanto a que la acción simultánea de la resistencia inducida por químicos y microorganismos benéficos, pueden conferir resistencia al mismo patógeno; sin embargo, puede ocurrir el efecto adverso, sugiriendo que existe una relación antagónica entre ambos procesos aumentando la susceptibilidad hacia los patógenos al final del ciclo de cultivo.
Así que para aplicar inductores de resistencia bióticos o abióticos se debe considerar: la cepa a emplear, el momento y frecuencia de aplicación, la dosis, de manera tal que la misma, estimule los mecanismos de defensa en la planta y provoque un aumento en el rendimiento y en el caso del antagonista se establezca, suponer que adicionalmente existe efecto directo sobre el patógeno cuando la planta disminuya sus recursos hacia la defensa como resultado de un proceso de asimilación.
Bion® ejerció acción directa sobre la biomasa y los mecanismos de defensa de la planta, posiblemente por competencia entre los procesos metabólicos implicados en el crecimiento y la síntesis de compuestos defensivos, por la asignación de recursos a la protección en lugar de concederlos al crecimiento y desarrollo de las plantas. Por ello, la aplicación del producto debe realizarse con un adecuado régimen de fertilización. Van Wees et al 2000, Romero et al 2001, observaron que en algunos casos la RSA generada por inductores químicos sintéticos puede conducir a un costo energético produciendo individuos y productos de menor tamaño, peso y en consecuencia un menor rendimiento probablemente debido a la continua expresión de resistencia que mantiene a la planta en una situación de mayor estrés
La supresión de los mecanismos de defensa, podrían estar aumentando la susceptibilidad de la planta frente al ácaro y al disponer de una menor proporción de follaje como fuente de fotoasimilados ya que experiencias previas señalaron que la inducción química disminuye la capacidad de las plantas para expresar defensa frente a heridas o daños provocados por invertebrados masticadores, ya que puede suprimir la expresión de genes de defensa que son dependientes de la vía de señalización del JA y que normalmente se activan por dichos factores (Durrant & Dong 2004).
La demora en la maduración del bulbo, podría relacionarse con la liberación de metabolitos por parte de T. koningiopsis, durante las primeras etapas del cultivo, de allí que la dosis que debe aplicarse del inductor biótico sea la adecuada, ya que en el estudio se usaron filtrados fúngicos, conidias y micelio lo que provocó que la emergencia de las plántulas fuera inferior al resto de los tratamientos que durante las primeras etapas del cultivo.
Una alternativa sería cosechar más tarde estas plantas, para obtener bulbos más grandes, por ende con mayor peso y se debería observar la división de los dientes. Por otra parte, para mejorar la calidad del bulbo, también se podría aplicar T.k combinado con Tri, para equilibrar estas diferencias, ya que para mercado interno interesa más el rendimiento.
En la presente investigación, se demostró que al tratar a las plantas de ajo con cepa nativa T. koningiopsis se logró un efecto superior en todas las variables, dada su mejor adaptación a las condiciones climáticas y edáficas de la zona agroecológica donde se realizó el ensayo. Por otra parte, es probable que la especie posea mecanismos bioquímicos y fisiológicos más compatibles y duraderos con las plantas y/o con el inductor químico. De esta manera, para obtener resultados exitosos en la inducción de resistencia frente a la pb, debe considerarse el uso de los antagonistas más idóneos que logre establecer una estrecha relación con el cultivo, capaz de estimular los mecanismos de defensa en las plantas de ajo y consiga adaptarse a las condiciones medioambientales de la zona.
Adicionalmente, se comprobó que se puede lograr incrementos en el rendimiento del cultivo de ajo y una reducción significativa de la pb manejando a la planta hospedante y su microambiente aportándole condiciones que le permitan expresar su potencial metabólico y fisiológico para lograr reducir la incidencia de la enfermedad o impedir el desarrollo del patógeno.
De acuerdo con el objetivo planteado y los resultados obtenidos en la investigación realizada se llegó a las siguientes conclusiones.
La combinación de Tricobiol®, el antagonista T. koningiopsis con el compuesto químico Bion, generó condiciones que favorecieron la reducción de la incidencia de la enfermedad, debido a la compatibilidad entre el biocontrolador con la planta y entre éste y el inductor químico, logrando inducir las respuestas de defensa a largo plazo.
La mayor protección frente a la pudrición blanca en ajo se logró con los tratamientos T.k, T.k + B y Tri reflejado en un descenso del ABCPE y un retraso en los picos de infección, como resultado de un efecto aditivo de protección por parte del microorganismo benéfico y el inductor químico, permitiendo que las plantas se mantuviesen protegidas durante mayor tiempo.
El rendimiento total del ajo, aumentó en todos los tratamientos, demostrando que la incorporación de T. koningopsis combinado con Bion estimularon la productividad de la planta y por ende el desarrollo y la defensa de las mismas.
Conflictos de interés
Esta investigación recibió financiamiento total CDCHT /UCLA Lara, Venezuela, y no presenta conflictos de interés.
Agradecimientos
Los autores agradecen al Consejo De Desarrollo Científico Humanístico y Tecnológico (CDCHT) de la Universidad Centroccidental Lisandro Alvarado por financiamiento de la presente investigación bajo el código 020 AG-2008.
Literatura citada
Abo-Elyousr KA, Hashemb M, Alib EH. Integrated control of cotton root rot disease by mixing fungal biocontrol agents and resistance inducers Crop Protection 2009; 28(4):295-301. [ Links ]
Adams P. A rapid method for quantitative isolation of sclerotia of Sclerotinia minor and Sclerotium cepivorum from soil. Plant Disease Reporter. 1979; (63):349-351. [ Links ]
Campbell C, Madden L. Introduction to Plant Disease Epidemiology. John Willey and Sons -Interscience, New York. USA. 1990. 532 pp. [ Links ]
Coley-Smith JR, Mitchell CM, Sansford CE. Long-term survival of sclerotia of Sclerotium cepivorum and Stromatinia gladioli. Plant Pathology. 1990; 39:58-69. [ Links ]
Crowe FJ, Hall DH. Vertical distribution of sclerotia of Sclerotium cepivorum and host root systems relative to white rot of onion and garlic. Phytopathology. 1980; (70):70-3. [ Links ]
Crowe F, Darnell T, Thornton M, Davies M, McGrath D, Koepsell P, et al. White rot control studies show promise of better future. Onion World. 1993; (9):22-25. [ Links ]
Corné M, Pieterse J, Van Wees S, Van Pelt J, Knoester M, Laan R. et al. A Novel Signaling Pathway Controlling Induced Systemic Resistance in Arabidopsis. Plant Cell.1998; (10): 1571-1580. [ Links ]
Durrant WE, Dong X. Systemic acquired resistance. Annual Review Phytopathology. 2004;(42):185-209. [ Links ]
López J. Caracterización Climática de la zona sur del estado Lara. Universidad Centroccidental Lisandro Alvarado. Barquisimeto. Venezuela. 1996.70 pp. [ Links ]
Moreno B, Acevedo R. Caracterización patogénica y estudio de los grupos de compatibilidad micelial en Sclerotium cepivorum Berk. Revista Iberoamericana de Micología. 2002; (19): 115-119. [ Links ]
McLean K, Stewart HE. Application strategies for control of onion white rot by fungal antagonists. New Zealand Journal of Crop and Horticultural Science. 2000; (28):115-122. [ Links ]
Perazzolli M, Dagostin S, Ferrar A, Elad I, Pertot I. Induction of systemic resistance against Plasmopara viticola in grapevine by Trichoderma harzianum T39 and Benzothiadiazole. Biological Control. 2008; 47:228-234. [ Links ]
Pozo MJ, Van Loon LC, Pieterse CMJ. Jasmonatessignals in plant-microbe interactions. Journal Plant Growth Regulation. 2004; 23:211-222. [ Links ]
Resende MLV, Barreti PB, Dias WP. Percepção, transdução e tradução de sinais para respostas de defesa contra patógenos em plantas. In: I Simpósio de biologia molecular da resistência de plantas a patógenos: aplicações no manejo integrado de fitodoenças. Lavras MG. 2002:9-35pp.
Resende MLV, Araujo DV, Costa JCV, Deuner CC, Ferreira JB, Muniz MFS et al. Produtos comerciais à base de bioindutores de resistência em plantas. Revisão Anual de Patologia de Plantas. 2006; (14):361-380.
Romero AM, Kousik CS, Ritchie DF. Resistance to bacterial spot in bell pepper induced by acibenzolar-S-methyl. Plant Disease. 2001;(85):189-194. [ Links ]
San Román M, Núñez M. 2008. Mérida. Revista Digital INIA HOY Nº2, URL: http://www.inia.gov.ve/index.php?option=com_content&task=view&id=460 (Consultado el 20/05 /10). [ Links ]
Segarra G, Casanova E, Bellido D, Odena M.A, Oliveira E, Trillas I. Proteome, salicylic acid, and jasmonic acid changes incucumber plants inoculated with Trichoderma asperellum strain T34. Proteomics. 2007; (7):3943-52. [ Links ]
Statistix for Windows version 8.0. Users Manual. Analytical Software. Tallahassee, FL, USA. Statistix 2003. [ Links ]
Ton J, Van Pelt J, Van Loon L, Pieterse C. Differential effectiveness of salicylate-dependent and jasmonate/ethylene-dependent induced resistance in Arabidopsis. Molecular Plant-Microbe Interactios. 2002;(15):27-34. [ Links ]
Ulacio D, Zavaleta E, García R, Delgadillo F, Pedroza A, Martínez A. Materia orgánica y antagonistas como estrategias de manejo de Sclerotium cepivorum Berk. y su impacto en el progreso de la pudrición blanca en ajo (Allium sativum L.). Revista Mexicana de Fitopatologia. 2003; (21):346-354. [ Links ]
Ulacio D, Zavaleta E, Martínez A, Pedroza A. Strategies for management of Sclerotium cepivorum Berk. in garlic. Journal Plant Pathology 2006; (88):253-261. [ Links ]
Van Wees SCM, De Swart EAM, Van Pelt JA, Van Loon LC, Pieterse CMJ. Enhancement of induced disease resistance by simultaneous activation of salicylate- and jasmonate-dependent defense pathways in Arabidopsis thaliana. Proceeding Natural Academic. Science. 2000; (97): 8711-8716. [ Links ]
Van Wees SCM, Van Der Ent S, Corné M, Pieterse CMJ. Plant immune responses triggered by beneficial microbes. Current Opinion in Plant Biology. 2008; (11):443-448. [ Links ]












 uBio
uBio 

