Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Revista Científica Ciencia Médica
versión impresa ISSN 1817-7433versión On-line ISSN 2220-2234
Rev Cient Cienc Méd v.15 n.2 Cochabamba 2012
ARTÍCULO ESPECIAL
Tumor del estroma gastrointestinal, un reto diagnóstico desde la perspectiva clínico-quirúrgica, histopatológica e inmunohistoquímica. Aclaración de conflictos cognitivos.
Gastrointestinal stromal tumor a diagnostic challenge from a clinical-surgical perspective, histopathological and immunohistochemistry. Disclaimer of cognitive conflicts.
Dr. Jaime Claudio Villarroel Salinas1, Naya Alejandra Canedo García2
1Médico Patólogo, Sub. Inmunohistoquímica - Jefe del servicio de Patología Quirúrgica I.G.B.J. - Asesor científico Sociedad Científica de estudiantes de Medicina FAC-MED U.M.S.S. - Docente de la cátedra de Anatomía Patológica FAC-MED U.M.S.S. - Miembro del Colegio Americano de Patólogos. - Miembro del Consejo Mexicano de Patología.
2 Médico Patóloga - Médico patóloga del servicio de Patología Quirúrgica I.G.B.J. - Docente de la cátedra de Anatomía Patológica FAC-MED U.M.S.S.
Correspondencia a: Andrjaimeclaudiovillarroelsalinas@hotmail.com
Procedencia y arbitraje: comisionado, no sometido a arbitraje.
Recibido para publicación: 24 de noviembre de 2012
Aceptado para publicación: 14 de diciembre de 2012
Citar como: Rev Cient Cienc Med 2012; 15(2): 30-36
Abreviaturas utilizadas en este Artículo
GIST= Tumor de Estroma Gastrointestinal
IHQ= Inmunohistoquímica
TAC= Tomografía Axial Computarizada
RMN= Resonancia Magnética
HE= Hematoxilina/Eosina
DX= Diagnóstico
QT= Quimioterapia
RT= Radioterapia
CAP= College of American Pathologists
BX= Biopsia
RESUMEN
Los tumores del estroma gastrointestinal "GIST", son neoplasias con potencial de invasión y metástasis; constituyen un reto diagnostico tanto clínico-quirúrgico como histopatológico e inmunohistoquimico, debido a que la presentación clínica, características histológicas e inmunofenotipo, pueden no ser patognomónicas, lo que nos lleva a plantearnos una serie de diagnósticos diferenciales que no solo involucran la estirpe mesenquimatosa sino también epitelial; por lo cual el diagnostico definitivo debe ser multidisciplinario . Los términos usados en el diagnostico histopatológico como: Tumor del Estroma Gastrointestinal, comúnmente crean conflictos cognitivos y las preguntas obvias ¿Son benignos o malignos?, ¿Tienen capacidad de invasión y/o metástasis?, por lo cual es pertinente la aclaración de las definiciones de los conceptos de manera precisa y concisa para aplicarlos significativamente en el diagnostico precoz y tratamiento oportuno del paciente con GIST.
Palabras claves: GIST, conflictos cognitivos, Gastrointestinal estromal Tumor.
ABSTRACT
The gastrointestinal stromal tumor "GIST, are neoplasias with invasión and methastasis potential; they represent a diagnostic challenge as a clinical-surgical; histopathologic and inmunohistochemistral matter, because of it's characteristic type of presentation that can be no pathonomonic, making making us think about diferencial diagnosis involring mesenquimatosis species and also epitelial; because of this the final diagnosis must be multidisiplinary. The terms used for histophatological diagnose like: Gastrointestinal stromal tumor, frecuently generate cognitive conflicts and the obvius questions: Are they benign or malign?. Do they have invasien and/or methastasis potencial?, because of this a correct, concise and precise definition of the concepts is important apply in the concise early diagnose and treatment on GIST patients.
Keywords: cognitive conflicts, Gastrointestinal Stromal Tumor
INTRODUCCIÓN
El Tumor de Estroma Gastrointestinal (GIST por sus siglas en ingles), es una neoplasia de estirpe mesenquimatosa y de origen aparentemente en las células de Cajal (marcapasos del tracto gastrointestinal que coordinan el peristaltismo). Se caracterizan por la expresión de un receptor de membrana mutante con actividad tirosina quinasa (c-kit), que se evidencia por Inmunohistoquímica (IHQ) con el anticuerpo CD-117, que define una proliferación celular no regulada 1,5,15. Comúnmente el término de tumor crea conflicto de tipo cognitivo en médicos en formación e incluso profesionales especialistas debido a que genera la pregunta obvia: ¿Este tumor es benigno o es maligno?; estirpe, origen y localización son términos usados de manera inapropiada de forma común desde la perspectiva oncológica; creando así aun más conflictos cognitivos. La nomenclatura en los tumores neoplásicos de manera tradicional los clasifica según: la estirpe, por el origen y por la capacidad o no de invasión y/o metástasis (benigno o maligno).
Según La estirpe: epitelial o mesenquimatosa, se entiende como la raíz y /o tronco de una familia o linaje de tejidos; a la familia mesenquimatosa pertenecen los tejidos de sostén: músculo, cartílago, tejido adiposo, tejido óseo, etc.; y a la familia epitelial pertenecen todos los tejidos que cuentan con una membrana basal y por ende se organizan en epitelios que generalmente están suprayacentes al tejido de sostén "Epi=arriba, telio= tejido"2,3. El origen celular se refiere específicamente a la célula de la cual procede o surgió el tumor en cuestión. La localización es el sitio anatómico en el que se encuentra el tumor de ahí que no es sinónimo de origen. Cuando se clasifican a las neoplásias en malignas debemos usar como prefijos o sufijos los términos "Carcinoma" para la estirpe epitelial y "Sarcoma" para la estirpe mesenquimatosa3,5.
Esta entidad pertenece a la familia mesenquimatosa, peso es clasificada como TUMOR no especificando si es un sarcoma o no, cuando se usa este término hacemos alusión a que no se puede determinar categóricamente por histopatológica la evolución clínica de la neoplasia, es decir si tiene capacidad o no de invasión y metástasis. Un GIST pertenece entonces a la familia mesenquimatosa; el origen celular se cree, que es las células intersticiales de Cajal y las localizaciones más frecuentes son las paredes que rodean el lumen del tracto gastrointestinal3,5; aunque actualmente se han reportado a estos tumores en localizaciones extra Gastrointestinales6; el potencial de invasión y metástasis siempre está latente en estas lesiones, por datos histopatológicos en particular en esta neoplasia se han desarrollado clasificaciones y protocolos que nos permiten sugerir el potencial de invasión y metástasis (8002C9).
La consideración de este tumor neoplásico como entidad con curso clínico, pronóstico y de tratamiento especifico ha ido cambiando en el tiempo y en correlación con los avances tecnológicos diagnósticos y de terapias blanco-moleculares 7, inicialmente confundidos por su histología similar a células musculares lisas con leiomiomas, no ganaron relevancia hasta que estudios clínicos evidenciaron en estos tumores la capacidad de invasión y metástasis, lo que llevo a hipótesis erróneas de que estos tumores tenían la capacidad de malignización, es decir la progresión desde un leiomioma a un leiomiosarcoma, sin embargo actualmente sabemos que esta progresión es poco frecuente, y que no son leiomiosarcomas4,8, fue con el advenimiento de técnicas de Inmunohistoquímica y biología molecular, que se considero definitivamente como una entidad clínica e histopatológica independiente; a través de numerosos estudios se ha demostrado que por lo menos entre el 40 al 72% de los tumores GIST fueron diagnosticados y clasificados como otras lesiones fusocelulares: leiomioblastomas , leiomiosarcomas , tumores fibrosos solitarios, neurofibromas, etc., estos estudios revelaron que uno de los factores que contribuyen a diagnósticos erróneos es la variabilidad de criterios diagnósticos y nomenclatura de esta manera se demostró que la incidencia de GIST es mayor a las descritas 4,10.
PRESENTACIÓN CLÍNICA Y EPIDEMIOLOGÍA
Los tumores del estroma gastrointestinal corresponden al grupo más frecuente de neoplasias mesenquimatosas malignas del tubo digestivo11,12. Estas lesiones son poco frecuentes y parecerían no tener importancia al momento del diagnóstico, pero sí la tienen sobre todo cuando quienes los padecen preguntan sobre la benignidad y/o malignidad .Estos tumores representan 0.1 a 3 % de todos los cánceres GI, 80% de los sarcomas son de tipo GIST en el sistema GI4 y un 5% de todos los sarcomas de tejido blando, todos estos diagnosticados en pacientes de 58 años, un 10 a 30 % de estos son malignos con metástasis a hígado y peritoneo11.
La edad de presentación va de 40 a 80 años con una media de 58 años, no muestra predilección de género. Clínica y patológicamente los GIST son un espectro amplio de lesiones que implican tanto tumores benignos como malignos, la evaluación del potencial maligno puede ser estimada con el uso de protocolos histopatológicos donde se toman en cuenta datos como: localización, número de mitosis y tamaño tumoral, aunque actualmente la Inmunohisto química (IHQ) ha aportado más precisión al tomar en cuenta otros parámetros como el índice de proliferación evaluado con el uso del Ki-67, además de factores de crecimiento y la respuesta inflamatoria en relación al tumor9,11,12.
Es un tumor en general asintomático sobre todo cuando aun es pequeño y la sintomatología tiende a aumentar con respecto al tamaño, entre los signos y síntomas están dolor abdominal difuso, hemorragia gastrointestinal, anemia, anorexia, pérdida de peso, fatiga y otros síntomas gastrointestinales, ocasionalmente sangrado intraperitoneal o perforación4. La sintomatología es inespecífica en un 90%, puede debutar con hemorragia en un 50%, metástasis a hígado, peritoneo, ganglios en un 47% en esta etapa considerada ya como enfermedad no resecable con una progresión de 2 meses. Dolor abdominal 20 a 50%, cuadros obstructivos en un 10% y pueden ser asintomáticos en un 20%1.
La localización anatómica puede ser en cualquier parte del tracto gastrointestinal pero es más frecuente en estómago 50-70%1, seguida de intestino delgado 25%3,4, 10% en colon4, el resto serán de recto, esófago y sitios extra intestinales posibles sin mesenterio y retroperitoneo4,14. Tienen un perfil inmunofenotípico y genético que los hace distintos de otras lesiones mesenquimatosas del tracto GI15.
METODOLOGÍA DIAGNÓSTICA
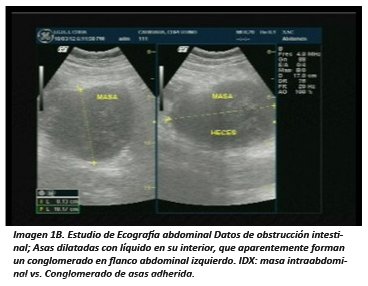
La Tomografía Axial Computada (TAC), representa la técnica de elección para evaluar una masa abdominal, definiendo extensión y presencia de metástasis. El aspecto característico de los GIST es el de: masa sólida que capta contraste. En el caso de grandes tumores puede mostrar una apariencia compleja dada por focos de necrosis, hemorragia o componentes degenerativos. En una serie publicada por Sandra Segaran y cols., de 31 GIST estudiados con TAC y Resonancia Magnética (RMN), los tumores primarios fueron típicamente exofíticos (79%), mayores de 5 cm (84%), y captación heterogénea (84%). Las metástasis fueron más frecuentemente mesentéricas (26%) o hepáticas (32%). Dentro de los hallazgos infrecuentes se encuentra ascitis (7%) y "torta" omental (3%). Las metástasis hepáticas fueron hipervasculares en 92% de los casos y se hicieron rápidamente quísticas tras recibir terapia con IMATINIB mesilato. La RMN fue mejor que la TAC para evaluar metástasis hepáticas, mientras que la TAC fue más sensible para metástasis mesentéricas 17.
La Endoscopía Digestiva Alta suele mostrar el aspecto clásico de una lesión elevada de tipo submucoso, siendo infrecuente la existencia de ulceraciones. Las biopsias endoscópicas convencionales generalmente no consiguen obtener material adecuado para establecer el diagnóstico de GIST14,15.
La Endosonografía, durante los últimos años, ha permitido avanzar en el diagnóstico diferencial de estas lesiones, tiene la capacidad de detectar incluso lesiones pequeñas, y sugerir la localización en relación con las capas de la pared gastrointestinal. Aproximadamente 50% de los tumores intramurales hipoecogénicos resecados corresponderían a GIST, de acuerdo a series publicadas anteriormente14,15,18. Los GIST se presentan como lesiones típicamente redondas u ovaladas, hipoecogénicas con aspecto tipo "vidrio esmerilado", y con origen en la cuarta capa ecográfica de la pared (muscular propia)14,15. Se han propuesto como criterios sugerentes de malignidad: tamaño > 4 cm, forma no oval, y bordes irregulares o mal definidos. La hipoecogenicidad y/o hiperecogenicidad focal tiene menor valor dado la variabilidad interobservador a la que está sujeto 20. La obtención de material para diagnóstico anatomopatológico es otra faceta relevante de la endosonografía en la evaluación de tumores submucosos14,15,19.
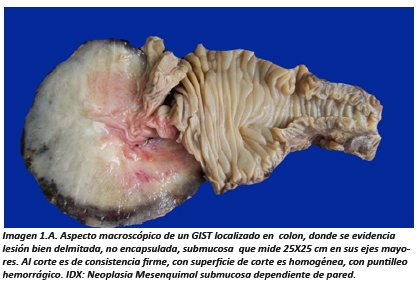
El diagnóstico Anátomo-Patológico definitivo se da con el estudio morfológico tanto macroscópico como microscópico. La macroscopía revela lesiones bien delimitadas no encapsuladas de crecimiento submucoso, en la pared, el tamaño es variables pueden llegar a medir hasta 30 cm 14 al corte la lesión es color gris blanquecina de consistencia aumentada con respecto al tejido adyacente puede mostrar focos de necrosis y hemorragia esto sobre todo en lesiones de mayor tamaño y lesiones de crecimiento rápido (Imagen 1).
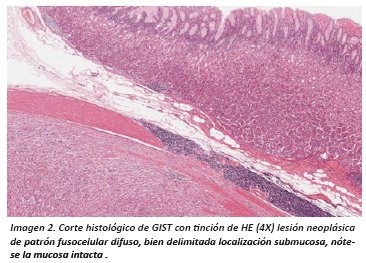
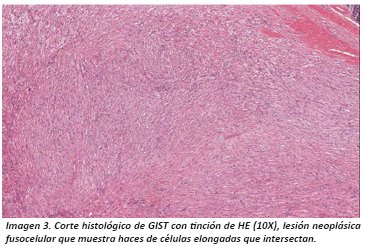
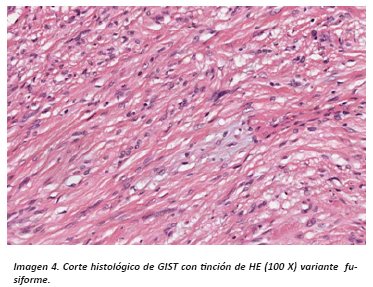
El análisis histopatológico con tinción de Hematoxilina/Eosina (HE) nos sugiere estirpe mesenquimal al evidenciar patrón difuso con células fusiformes de núcleos alargados sin plegamiento ni terminaciones romas; pueden mostrar tres patrones histológicos, los más frecuentes son fusiformes y epitelioides estos patrones son los que se presentan en otros sarcomas del sistema GI, por ello se confunde el diagnóstico de esta lesión.
El diagnóstico será: Tumor del Estroma Gastrointestinal, sin especificación de benignidad ni malignidad, sin embargo, en el diagnóstico (DX) adicionalmente estarán incluidos datos como: conteo mitósico, tamaño del tumor mismo que se correlacionaran esencialmente con la localización del tumor teniendo como resultado una interpretación del potencial de invasión y metástasis de la neoplasia4,15. (Imagen 1/ tabla 1).
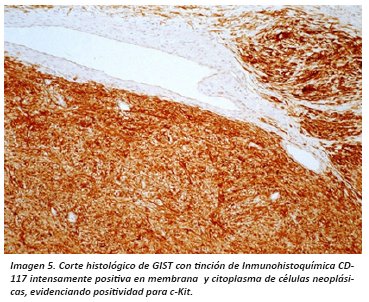
La inmunofenotipificación, una vez sospechado el diagnóstico de GIST debe enviarse para confirmar estirpe y origen a estudio de IHQ; el resultado esperado de el estudio de IHQ debe de tomar en cuenta el contexto diagnostico para seleccionar los anticuerpos reactantes sobre el tejido tomando en cuenta marcadores esperados positivo y negativos: respectivamente CD177(+), CD34(+), S-100 (+) en 1-2%; desmina(-), S-100 (-), laminina(-) ; posteriormente tendrá que correlacionarse con la localización y se planteara el tratamiento quirúrgico y/o posibilidad de terapia blanco-molecular. (Imagen 5)
La utilidad de la genotipificación por métodos de biología celular y molecular es útil en la confirmación del diagnostico, determinación del pronostico y contribuir al desarrollo de nuevas alternativas terapéuticas para pacientes con alto riesgo de falla en el tratamiento con imatinib: los mutantes en el exón 11 responden mejor (85% de respuesta parcial) las mutaciones del exón 9 tienen respuesta intermedia (46% de respuesta parcial) y las mutaciones en la PDGFRA-D842V tienen la respuesta más baja (8% de respuesta parcial).
OPCIONES DE TRATAMIENTO
Tanto la quimioterapia (QT) y radioterapia (RT) estándar no han sido muy efectivas en el tratamiento de sarcomas en general con una tasa de respuesta limitada 5%, un tiempo de progresión tumoral promedio 3 a 4 meses y sin impacto en la sobrevida. Este tumor tiende a ser recurrente y a dar metástasis por lo que se recomienda el tratamiento multidisciplinario4,14,15
Cuando es un tumor recurrente y/o metastásico reciben el mismo manejo y solo requerirán de cirugía siempre y cuando sea viable. Es importante saber que un 75% de los tumores son extirpables al momento de diagnostico, si esto no ocurre y ya existen metástasis la sobrevida es de menos de un año, otros puntos que afectan en la sobrevida de los pacientes son: tamaño del tumor ya que en mayores de 10 cm a 5 años el 27% y uno de menos de 5 cm sobrevive 82% a 5 años, el índice mitótico (un índice alto indica alta probabilidad de recurrencia).
Después de la cirugía, la recurrencia es generalmente común 54% de pacientes de alto riesgo muestran recurrencia, el tiempo promedio de recurrencia es de 7 meses a 2 años y solo un 10% de pacientes queda libre de enfermedad alargo plazo4,14.
La cirugía es la única modalidad terapéutica efectiva, siempre y cuando se reseque la totalidad del tumor, un 0 a 5% responden a QT tradicional para sarcomas con rápida progresión y sobrevida de menos de un año.1,14.
La terapia blanco-molecular, con IMATINIB que es un sustrato y a la vez un inhibidor competitivo de varias enzimas del citocromo P-450; es un medicamento usado inicialmente en leucemias mielocíticas crónicas , actualmente también en tumores que sobre-expresen c-KIT y el PDGF algunos gliomas, cáncer de próstata, sarcomas, cáncer pulmonar, neuroblastomas, cáncer de mama, tumores testiculares, mieloma múltiples; esta lista continuará su modificación aumentándose el número de tumores sólidos que pueden beneficiarse con este tratamiento, de todos los efectos adversos de esta terapia blanco, es el dato de toxicidad más importante es la sobrecarga hídrica 1,4.
DISCUSIÓN Y CONCLUSIONES
El evaluar metacognitivamente los conflictos cognitivos planteados en este artículo , que pueden presentarse en médicos en formación y en ocasiones en médicos formados, puede repercutir directamente sobre el proceso de razonamiento clínico en la correcta integración de los datos; es por eso que es imprescindible tener claras, concisas y precisas las definiciones de conceptos tales como : Estirpe, origen, localización y tumor neoplásico; lo cual nos llevara consecuentemente a un conocimiento significativo del GIST lo que repercutirá en el diagnostico precoz y un tratamiento oportuno de calidad y calidez hacia el paciente ."Los ojos no pueden ver lo que la mente no sabe, David Herbert Richards Lawrence".
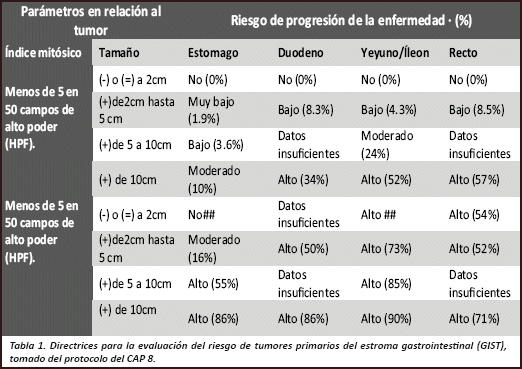
Es importante el contar con protocolos de diagnostico; que sean revalidados ya que la medicina basada en evidencia en otros países no necesariamente es la misma en nuestro medio; los protocolos publicados del CAP (College of American Pathologists9 deben de ser reproducibles en relación al potencial maligno de los GIST, este está basado en número de mitosis( se cuentan las mismas en 50 campos de alto poder HPF),tamaño del tumor (menos de 2cm, entre 2-5cm , entre 5-10cm y más de 10cm)13, la localización anatómica, este nos ayuda a determinar el potencial de recurrencia, invasión y metástasis, esto evidencia claramente que los de mejor pronóstico son los encontrados en estómago en comparación con los de yeyuno que son los de peor pronóstico1,9, (ver tabla 1). El determinar el potencial maligno es útil ya que las lesiones más agresivas son capaces de generar recurrencia y metástasis a hígado además de diseminación transcelómica9,14. Más del 50% de los GIST de alto riesgo cursan con recurrencia o metástasis dentro de un plazo de 10 años, mientras que los tumores de bajo riesgo rara vez tienen progresión de la enfermedad (< 5%) 15.
Dentro de los métodos diagnósticos que se utilizan en nuestro medio, esta la endoscopia, al ser una neo-plasia que frecuentemente se encuentra en la pared del tracto gastrointestinal y que macroscópicamente se podría visualizar por endoscópica como una masa protruyente en el lumen; muchas veces la toma de biopsia (BX)por endoscopía es reportada como lesiones reactivas sin evidencia de células neoplásicas, lo que genera un conflicto al gastroenterólogo ya que el evidencia macroscópicamente el tumor de gran tamaño y la histología es negativa, este dato podría ser mal interpretado como un diagnostico erróneo por parte del Patólogo y viceversa una mala toma de BX por parte del gastroenterólogo que realizó la endoscopia; en este caso cuando las biopsias son superficiales y no concluyentes para emitir un diagnóstico; sin embargo estos datos deben ser interpretados con un razonamiento clínico que involucre datos positivos y negativos concluyendo como hipótesis diagnóstica un tumor sub-mucoso originado en la capa muscular y que consecuentemente empuja la mucosa hacia el lumen del tracto, por lo que sería necesario la técnica de biopsia sobre biopsia por endoscopía y/o estudios de extensión macroscópica como la TAC, y finalmente de ser necesario biopsias a través de laparoscopia o laparotomías exploradoras con toma de muestras múltiples evitando focos ulcerados o necróticos.
Es por todo lo antes mencionado que el GIST es un reto diagnóstico, desde el punto de vista clínico como el histopatológico e inmunohistoquímico. La histopatología en estos casos puede no llegar a un diagnostico categórico y quedarse con un diagnóstico descriptivo Ejemplo: neoplasiafusocelular, tumor neoplásico de estirpe mesenquimatosa con patrones fusiformes, etc. creando un vacio diagnóstico en relación al origen y el comportamiento clínico de ese tumor ¿Es benigno o maligno? La interpretación histopatológica adecuada de este grupo heterogéneo de neoplasias son dependientes de un manejo adecuado del espécimen, desde un pronto envió, fijación inmediata y extenso muestreo (manejar la muestra como si se tratara de un sarcoma un corte por cm de tumor)14.
El estudio histológico debe de estar acompañado de un perfil IHQ contextualizado al caso, es decir que no es correcto entender que la IHQ es una máquina a la cual le introducimos la muestra y que nos da el resultado automático en relación a si es benigno o maligno ,etc. Si no que los marcadores deben de ser requeridos en relación e integración a todos los datos del caso "No disparemos la escopeta al aire a ver que cae; Cuanto más piezas del rompecabezas tenemos mejor podemos buscarlas piezas que nos faltan" .El panel se basa en CD-117, c- KIT positivo en más del 95%, CD34 entre el 30-40% , y SMA, DESMINA y Proteína S-100 frecuentemente negativos; .los estudios de citogenética y biología molecular serán determinantes para comprender la biología y mecanismo genético de esta neoplasia además de ayudar a comprenderla y dar tratamientos específicos. Un 95% de estas lesiones son positivas a CD-11714 esto significa que estas lesiones reconocen al receptor KIT que pertenece al grupo de receptores cinasa de tirosina III y esta codificada por el proto-oncogén c-kit que se halla en el cromosoma 4p, mismo que muestra mutaciones puntuales al estudio molecular. En el caso de los CD-117 negativos se ha visto que muestra alteración del receptor del factor de crecimiento derivado de plaquetas, que también forma parte de los receptores cinasa de tirosina III en este suelen tener una histología de tipo epitelio de y no fuso celular.
Debemos de tener en cuenta que estos tumores muestran diferenciación a musculo liso y diferenciación neurogénica 14, lo que no obliga a tomar en cuenta como diagnósticos (DXs) diferenciales a la familia de estirpe mesenquimal: como fibromatosis, tumor fibroso solitario, neoplasia de musculo liso y vaina nerviosa periférica y ocasionalmente carcinomas y linfomas14. Se evidencia mutación activa del c-KIT en un 90% y mutación activa en PDGFRA (receptor alfa de factor de crecimiento derivado de plaquetas)en un 30%1; lo que en pocas palabras quiere decir que si encontramos un tumor dependiente de la pared del tracto GI con histología sugestiva de estirpe mesenquimatosa (patrón fusiforme), lo que nos plantea una hipótesis diagnostica de GIST, tomando en cuenta DXs diferenciales , pero que después la inmunofenotipificación el resultado es negativo para CD117 , CD34 , S-100, Desmina y citoqueratinas, no necesariamente la IHQ nos descarta el DX de GIST, y nos plantea la posibilidad de la utilización de métodos diagnósticos que involucran la biología molecular ya que si confirmamos por este método el DX, este estudio nos aportará adicionalmente datos predictivos sobre el uso inútil del IMATINIB y la posibilidad de otro blanco terapéutico que involucra el PDGFRA.
Si bien es cierto que en Bolivia se desconoce el dato exacto de casos , es importante llamar a la reflexión y poder generar a futuro un trabajo multidisciplinario que concentre la información adecuada en cuanto a frecuencia, edad, género, manifestaciones clínicas, tratamiento, factores pronósticos, factores predictivos y seguimiento ya que según criterios internacionales esta patología debe ser abordada por un equipo multidisciplinario, con el objetivo de un manejo interdisciplinario en el cual participe el endoscopista, patólogo, onco-cirujano, onco-médico de esta forma y en trabajo de equipo se valore al paciente y se ofrezcan las terapéuticas más adecuadas con una menor morbi-mortalidad para estos pacientes 1,4.
REFERENCIAS
1. Dra Erazo Valle Aura-reto diagnostico y opciones terapéuticas, Gaceta Mexicana de Oncología; vol-4 suplemento 1,2005.
2. Alan Stevens James Lowe; Histología Humana; Elsevier 3ra edición 2006, [ Links ]
3. Cotran, Kumar, Robbins, Patologia estructural y funcional, Elsevier 8va edición 2009 [ Links ]
4. Shreyaskumar R. Patel, MD -la era de la terapia molecular redefiniendo el tratamiento de los tumores del estroma gastrointestinal -vol-4 suplemento 1,2005
5. Fletcher, et al Diagnostic Histopathology of tumors; Churchill Livingston; segunda edicion 2000 313;410. [ Links ]
6. Dimitris Fagkrezos, Zisis Touloumis, Maria Giannila, Charalampos Penlidis; Extra-gastrointestinal stromal tumor of the omentum: a rare case report and review of the literature, Rare Tumors 2012; volume 4:e44.
7. Gurpreet Lamba, Samir Ambrale, Byung Lee, Ridhi Gupta, Shamudheen M Rafiyath ; Recent advances and novel agents for gastrointestinal stromal tumor (GIST). Hematol Oncol. 2012; 5: 21. Published online 2012 May 8.
8. Brian P. Rubin, MD, PhD, FCAP, Charles D. Blanke, MD, FACP, George D. Demetri, MD; Protocol for the Examination of Specimens From Patients With Gastrointestinal Stromal Tumor (GIST), Based on AJCC/UICC TNM, 7th edition, Protocol web posting date: June 2012.
9. Robert B. West, Christopher L. Corless, Xin Chen, Brian P. Rubin, Subbaya Subramanian; The Novel Marker, DOG1, Is Expressed Ubiquitously in Gastrointestinal Stromal Tumors Irrespective of KIT or PDGFRA Mutation Status. Am J Pathol. 2004 July; 165(1): 107-113.
10.Sveinung W Sorbye, Thomas K Kilvaer, Andrej Valkov, Tom Donnem, Eivind Smeland, Khalid Al-Shibli, Roy M Bremnes, Lill-Tove Busund BMC ;Prognostic impact of CD57, CD68, MCSF, CSF-1R, Ki67 and TGF-beta in soft tissue sarcomas, Clin Pathol. 2012; 12:7.
11. Francisco Javier Ochoa Carrillo; Tumores del estroma gastrointestinal, reto diagnostico y nueva esperanza terapéutica; Gaceta Mexicana de Oncología ;vol-4 suplemento 1,2005
12. Dra. Aura Erazo Valle, Tumores del estroma gastrointestinal; Gaceta Mexicana de Oncología -vol-4 suplemento 1,2005.
13. Cristián Muñoz T., Samuel Sabah T., Alex Navarro R., Marcela Planzer del C., Clarisa Silva A. y Ricardo Santander D., Tumores del estroma gastrointestinal (GIST): Revisión de la literatura, Gastr Latinoam 2006; Vol 17, N» 1: 43-51
14. Lee S, Ha H, Byun J, et al. Radiological features of leiom yomatous tumors of the colon and rectum. J Comput Assist Tomogr 2000; 24:407-13. [ Links ]
15. Sandra Segaran K, Rajesh A, Rushing D, etal. Gastrointestinal stromal tumors: CT and MRI findings. Eur Radiol 2005; 15: 1407-14.
16. Nickl N, Gress F, Mc Clave S, et al. Hypoechoic intramural tumor study: final report. Gastrointest, Endosc 2002; 55: AB98.. [ Links ]
17. Wieczorek T, Faquin W, Rubin B, Cibas E. Cytologic diagnosis of gastrointestinal stromal tumor with emphasis on the diíferential diagnosis with leiomyosarcoma. Cancer 2001; 93: 276-87. [ Links ]














