Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Científica Ciencia Médica
versión impresa ISSN 1817-7433versión On-line ISSN 2220-2234
Rev Cient Cienc Méd v.15 n.2 Cochabamba 2012
ARTÍCULO ORIGINAL
Dexmedetomidina en infusion continua para cirugía neurofuncional de estimulación profunda en la enfermedad de Parkinson
Dexmedetomidine in continuous infusion for neurofunctional deep stimulation surgery in Parkinson's disease
José Manuel Portela Ortiz1, Mónica Tatiana Salazar Leaño2
1Médico Internista, Anestesiólogo e Intensivista, Profesor adjunto de Anestesiología Hospital Ángeles del Pedregal, ex jefe del servicio de Anestesiología Hospital de Nutrición Salvador Subirán, México.
2Anestesióloga e Intensivista Hospital Ángeles del Pedregal, México.
Correspondencia a: Mónica Tatiana Salazar Leaño nonitaty@hotmail.com
Procedencia y arbitraje: no comisionado, sometido a arbitraje externo.
Recibido para publicación: 28 de agosto de 2012
Aceptado para publicación: 11 de diciembre de 2012
Citar como: Rev Cient Cienc Med 2012;15(2): 6-11
Abreviaturas utilizadas en este artículo:
ECP= Técnica de Estimulación Cerebral Profunda
GABA= Ácido gamma amino-butírico
IMAO= Inhibidores de la monoaminooxidasa
BIS= Índice Biespectral
HAS= Hipertensión arterial sistemica
DM2= Diabetes Mellitus tipo 2
EVA = Escala visual análoga
RESUMEN
La cirugía de estimulación cerebral profunda se utiliza para corregir la actividad eléctrica anormal del cerebro que causa trastornos neurológicos del movimiento, entre ellos, la enfermedad de Parkinson, el manejo anestésico incluye varias técnicas de sedación consciente y anestesia local.
Se presenta a continuación un estudio transversal, descriptivo, de una serie de casos. Se incluyeron 6 pacientes de sexo masculino, programados para cirugía de estimulación profunda, cuyas edades oscilaron de 72 a 80 años, con enfermedad de Parkinson, Diabetes Mellitus tipo 2 e Hipertensión Arterial Sistémica. Como técnica anestésica se optó por la sedación consciente con dexmedetomidina a dosis de infusión de 0.1 a 0.3 mg/Kg/hora. Se visualizó la cara del paciente, para valoración del habla, así, como para identificar la eventualidad de respuestas motoras faciales durante el mapeo de la región motora. Resultados: los seis pacientes no modificaron los trazos electrofisiológicos durante el transanestésico, con buen grado de sedación consciente medido por índice biespectral BIS 50-60 y colaboran con el procedimiento quirúrgico, obedeciendo órdenes a) Movimientos dedo-nariz b) Mímica y expresión facial c) Repetir números y palabras cortas d) Movimiento de los dedos y las piernas, ninguno de los pacientes presentó depresión respiratoria, brinda analgesia, sin causar molestias en el paciente. Es una excelente opción anestésica para pacientes mayores de 70 años de edad y con comorbilidades, además es una técnica de sedación sencilla.
Palabras claves: Parkinson, sedación consciente dexmedetomidina
ABSTRACT
The deep brain stimulation surgery is used to correct abnormal electrical activity of the brain causing neurological movement disorders, including Parkinson's disease; anesthetic management includes various techniques of conscious sedation and local anesthesia.The following study is a cross-sectional, descriptive cases series. We included six male patients scheduled for surgery of deep stimulation, whose ages ranged from 72 to 80 years with Parkinson's disease, type 2 diabetes mellitus and hypertension.The anesthetic technique was conscious sedation with dexmedetomidine infusion at doses of 0,1 to 0,3 mg / kg / hour. The face of the patient's was visualized, for assessment of speech, so as to identify the event of facial motor responses during the mapping of the motor region.The results of six patients did not change during the electrophysiological transanestésic traces, with good degree of conscious sedation measured by bispectral index BIS 50-60 and collaborating with the surgical procedure, obeying the following orders a)Nose fingers-movements b) Mimic and facial expression c) Repeating numbers and short words d) Fingers and legs movements, none of the patients had respiratory depression, provides analgesia without causing discomfort to the patient.Anesthetic is an excellent option for patients over 70 years of age with comorbidities, sedation is a simple technique.
Keywords: Parkinson, conscious sedation dexmedetomidine
INTRODUCCIÓN
La enfermedad de Parkinson se caracteriza por una pérdida de neuronas dopaminérgicas en la sustancia negra del ganglio basal y una disminución en la producción de dopamina. El tratamiento se basa en restitución medicamentosa, actualmente se realiza la colocación de electrodos intracerebrales con sedación endovenosa con dexmedetomidina. La Técnica de Estimulación Cerebral Profunda (ECP) se utiliza para corregir la actividad eléctrica anormal del cerebro que causa trastornos neurológicos del movimiento, entre ellos, la enfermedad de Parkinson, la distonía (caracterizada por espasmos musculares) y el temblor esencial (caracterizado por movimientos incontrolables), como también para la Epilepsia de origen temporal. En pacientes que tienen síntomas que no se controlan sólo con medicamentos, la ECP resulta más segura y efectiva que las antiguas intervenciones quirúrgicas para trastornos del movimiento, que dejaban lesiones en el cerebro. Los pacientes que tienen las afecciones que se mencionaron anteriormente han logrado beneficios significativos con el uso de la ECP1,2,3.
El déficit de dopamina asociado con la actividad incrementada del núcleo inhibitorio en el ganglio basal usando el neurotransmisor ácido gamma aminobutírico (GABA), eventualmente lleva a inhibición excesiva y al cese del núcleo talámico y tronco encefálico que recibe el flujo del ganglio basal; la inhibición talámica excesiva resulta en supresión del sistema motor cortical con acinesia, rigidez y tremor, mientras la inhibición de las áreas locomotoras del tronco encefálico pueden contribuir a anormalidades de postura y la marcha1.
La enfermedad de Parkinson es secundaria a la escasez de células pigmentadas en la sustancia negra de la columna ventrolateral, con gliosis de reemplazo y cuantificación de 425 000 a 200 000 a los 80 años de edad, en esta patología hay depleción marcada de células (menos de 100 000) se añade la disminución de tirosina beta hidroxilasa, el patrón de la pérdida de células negras difiere de lo que ocurre con el envejecimiento2. Sin embargo la etiología es desconocida, la neurodegeneración es inducida por trastornos genéticos medioambientales infecciosos. La edad es el factor de riesgo más consistente y ha sido estimado que el riesgo en el estilo de vida es acumulativo para el desarrollo de Parkinson, la historia familiar es el predictor más fuerte de un riesgo incrementado de desarrollo de la enfermedad aunque el papel de un medio ambiente común debería ser considerado. La mayoría de la evidencia disponible sugiere una herencia Autosómica Dominante, pero muchos pacientes no muestran este patrón de herencia. Esto podría reflejar el hecho de que la causa genética tiene baja influencia o que la enfermedad es multifactorial3. El descubrimiento de dos mutaciones distintas en el gen a-sinuclein localizado en el cromosoma 4q parece ser una mejor explicación. El alfa-sinuclein es conservado en grandes cantidades, 140 abundantes aminoácidos de una proteína de función desconocida es expresada en las terminales del nervio presináptico en el cerebro esto parece ser un componente importante de los cuerpos de Lewy (cuerpos de inclusión eosi-nofílica) en el espacio intracitoplásmico y sus relaciones en la enfermedad de Parkinson sugieren que esta enfermedad también incumbe aquellas condiciones como el Alzheimer atribuible a la agregación de una proteína toxica4.
Mutaciones en α-sinuclein fueron reportados en un número no cuantificado de familias con antecedentes de Parkinson, se intenta implicar a las enzimas destoxificantes, debrisoquina 4-hidroxilasa ó N-ace-tiltransferasa2. La patogénesis de la enfermedad está caracterizada por la muerte progresiva de neuronas seleccionadas pero heterogéneas incluyendo aquellas neuronas dopaminérgicas de la sustancia negra5. Los mecanismos precisos responsables de la muerte celular son aún desconocidos y podrían estar combinados en disfunción mitocondrial, estrés oxidativo, las acciones de excitotoxinas con la formación en exceso de oxido nítrico, apoyo neurotrófico deficiente y mecanismos inmunes. La vía final común parece ser la inducción de apoptosis en neuronas negras dopaminérgicas6.
El diagnóstico y las características clínicas de la enfermedad de Parkinson son: una tríada clásica de tremor de reposo, rigidez muscular, bradicinecia, y pérdida de reflejos posturales. Los signos clínicos pueden persistir sorpresivamente unilaterales hasta que la enfermedad avance. La dificultad del diagnóstico radica en que las características están sutilmente subclínicas al inicio de la enfermedad y los diagnósticos alternativos como la artritis o la depresión pueden ser consideradas hasta la progresión de esta enfermedad7.
Algunos pacientes presentan desórdenes rígido/ acinéticos de carácter simétrico, que están relacionados con enfermedades neurodegenerativas que afectan al cuerpo estriado tales como la parálisis supranuclear progresiva, atrofia de múltiples sistemas, degeneración corticobasal, etc.; en las que existen otras manifestaciones (movimientos oculares anormales, cerebelosas, corticoespinales, etc.). Que ayudan a caracterizar estos desordenes. Estos procesos neurodegenerativos se conocen como síndromes parkinsonianos atípicos o parkinsonismos-plus. Un síndrome parkinsoniano también puede ser secundario a lesiones del sistema nervioso de carácter adquirido, tales como infecciones, traumatismos, tóxicos, desórdenes metabólicos, procesos vasculares, hidrocefalia o tumores; denominándose parkinsonismos secundarios4,5,,6,7.
El tratamiento de la enfermedad de Parkinson incluye el uso de L-DOPA ó agonistas de los receptores de dopamina. Inhibidores de la monoamino-oxidasa de tipo B, inhibidor oxidasa selegiline prolonga la acción de la dopamina. Se sugiere añadir Deprenyl y Tocoferol Terapia Antioxidativa de Parkinson DATATOP, retarda la progresión de la enfermedad independiente de los efectos de la sintomatología y del efecto neuroprotector8.
Los medicamentos para la enfermedad de Parkinson comprenden tres categorías. La primera categoría comprende medicamentos que funcionan directa o indirectamente para aumentar el nivel de dopamina en el cerebro. Son precursores de la dopamina, sustancias como levodopa que cruzan la barrera hematoencefálica. Otros medicamentos imitan a la dopamina, previenen o retrasan su descomposición. La segunda categoría afecta a otros neurotransmisores corporales con el fin de aliviar algunos síntomas de la enfermedad. Por ejemplo, los medicamentos anticolinérgicos interfieren con la producción o la captación del neurotransmisor acetilcolina. Estos medicamentos ayudan a reducir el temblor y la rigidez muscular, que pueden deberse a tener más acetilcolina que dopamina. La tercera categoría comprende medicamentos que ayudan a controlar los síntomas no motores de la enfermedad, por ejemplo, antidepresivos a las personas con depresión relacionada con la enfermedad.
Implicaciones en el perioperatorio de medicamentos antiparkinson: La supresión brusca de algunos fármacos puede provocar la reaparición de la patología de base, o bien el síndrome de la retirada. En estos casos, el estrés producido por la cirugía sé superpone a la patología de base sin su soporte farmacológico habitual por lo que algunos pacientes son más sensibles a dicho efecto. Ello puede dificultar la realización de la cirugía en condiciones óptimas, empeorando el estado del paciente que queda sometido a más riesgos, posiblemente innecesarios. Algunos ejemplos de fármacos que producen este efecto son los bloqueantes b-adrenérgicos, los agonistas a-adrenérgicos, los antidepresivos inhibidores de la monoaminooxidasa (IMAO), los antidepresivos tri-cíclicos, las benzodiacepinas, los antiepilépticos y los antiparkinsonianos. En general las complicaciones se resuelven reintroduciendo la medicación habitual16.
El tratamiento quirúrgico es otra alternativa para el Parkinson9.
Candidatos a la terapia de Colocación de electrodos profundos intracerebrales (ECP): los candidatos a este procedimiento quirúrgico son: A.- Paciente con enfermedad de Parkinson de difícil control medicamentoso. B.- Paciente con comorbilidades controladas. C.- Paciente con Parkinson solicite este tipo de procedimiento.
Técnicas anestésicas utilizadas.
Anestesia general ventajas y desventajas: Es un tipo de anestesia invasiva con control de la vía aérea, lo que es una ventaja, sin embargo, no se lograla colaboración del paciente al estimularlos puntos cerebrales, lo que involucra una gran desventaja.
Técnica anestesiado despierto anestesiado: el paciente bajo sedación con infusión endovenosa de inductor de sueño, participa del procedimiento quirúrgico y colabora con el cirujano.
Técnica de sedación mas anestesia regional: además de lo anterior con adecuada colaboración del paciente no presenta dolor al administrar un anestésico local para la piel.
Cirugía de Parkinson: Colocación de electrodos profundos intracerebrales.
Los requisitos que un cirujano necesita para realizar este tipo de cirugías son:
- Que el paciente colabore cuando se le requiera e indique.
- Que el paciente pueda contar de forma ascendente o descendente de una escala numérica usada que, por ejemplo, será 10,9,8,7,6,5,4, etc... o 1,2,3,4,5,6, etc., cuando se le solicite.
- Que movilice las cuatro extremidades, una por una y al momento que se le indique.
- Que el paciente coordine los movimientos y entiendalas órdenes de forma precisa.
- Que el paciente colabore ante la exploración de temblor distal.
- Que el paciente coopere en cuanto a la valoración de la rigidez de las extremidades.
Requisitos para los registros neurofisiológicos
Se necesita la colaboración del paciente durante el mapeo neurofisiológico en busca de los puntos de descarga (temblor distal), por lo que el paciente debe teneruna técnica anestésica óptima con fármacos que no modifiquen los registros electrofisiológicos siendo contraindicadas las benzodiacepinas, o elpropofol entre otros.
Los procedimientos quirúrgicos comprenden la estimulación cerebral profunda, lesiones ablativas y trasplante de células10. La ventaja de la estimulación cerebral es que es reversible y ajustable, enfocado a la disminución de la sintomatología. Bajo sedación consciente con varias técnicas como ser: 1.- Técnica con paciente despierto 2.- Técnica con paciente anestesiado-despierto-anestesiado. 3.- Técnica con paciente despierto-anestesia.
Para la técnica con paciente despierto se necesita la total colaboración del mismo porlo que es muy complicado y solo se utiliza en algunos casos, esta se realiza con anestesia local y el paciente debe estar alerta y seguir a las indicaciones del cirujano. Segunda técnica con paciente anestesiado despierto anestesiado el paciente debe estar bajo un grado mayor de inconciencia para lo cual se utilizan anestésicos, inductores ,ansiolíticos (benzodiacepinas, N2O y Propofol entre otros, que alteran los registros hemofisiologicos aun en dosis bajas), siendo mas complicada la colaboración del paciente al momento que se requieran valorar la motricidad o el seguir ordenes en general debido a la influencia de fármacos que provocaran una serie de cambios y que además podrían causar depresión respiratoria entre otras complicaciones. En la tercera técnica, con paciente despierto anestesiado, esta se realiza con medicamentos como la Dexmedetomidina cuyo objetivo es que al ser infundidos a dosis de mantenimiento provoca un grado de sedación mínimo, siendo que los pacientes colaboran ante ordenes requeridas por el cirujano como por ejemplo levantar la mano y con el dedo tocar la punta de la nariz, o repetir palabras o contar números en forma ascendente o descendente, con un grado casi nulo de depresión respiratoria y manteniendo al paciente hemodinámicamente estable11.
Es por eso que el objetivo general es describir las ventajas hemodinámicas de la sedación consciente usando como único fármaco endovenoso la dexmedetomidina, en pacientes sometidos a cirugía de Parkinson.
Como objetivos específicos determinarlas características de la función respiratoria con el uso de sedación consciente usando dexmedetomidina. Indicar que la infusión endovenosa con dexmedetomidina mantiene a los pacientes con una sedación adecuada monitoreada por Índice Biespectral. (BIS) Mencionar que la infusión endovenosa con dexmedetomidina permite la colaboración del paciente sometido a cirugía de Parkinson.
MATERIALES Y MÉTODOS
El presente estudio es de tipo Estudio descriptivo, transversal. Serie de casos. Se incluyeron seis pacientes masculinos de 72 a 80 años de edad, diagnosticados de Enfermedad de Parkinson, en el lapso de 2 años que ingresaron al Hospital Ángeles del Pedregal de la ciudad de México Distrito Federal, de los cuales 2 pacientes con Hipertensión Arterial Sistémica (HAS) controlada en tratamiento a base de Enalapril y 2 pacientes con DM controlada con Metformina. Clasificados como ASA 2 A (6 pacientes)
Se usó la Técnica de Sedación Consciente (paciente dormido-conciente-dormido) Y la Técnica de Anestesia local (paciente despierto con anestesia local) referimos seis casos con Dexmedetomidina como único agente de sedación.
Se realiza la valoración preanestésica a cada uno de los seis pacientes. Sin contraindicaciones para el procedimiento. Paciente con canalización periférica permeable con catéter número 22. En el quirófano se posiciona al paciente en decúbito dorsal. Se monitoriza con monitoreo no invasivo con los siguientes parámetros: presión arterial no invasiva, frecuencia cardiaca, frecuencia respiratoria, saturación por oximetría de pulso, Índice biespectral, temperatura y presión de anhídrido carbónico eliminado. Apoyo ventilatorio por puntas nasales con O2 a razón de 3litros x min. Se inicio la infusión de Dexmedetomidina sin dosis de carga, en todos los pacientes. 400mcg en 250ml de solución salina al 0.9%. Dosis de infusión de dexmedetomidina endovenosa de 0.1 a 0.3 mg/ Kg/hora. Se visualizó la cara del paciente, para valoración del habla, así, como para identificar la eventualidad de respuestas motoras faciales durante el mapeo de la región motora.
RESULTADOS
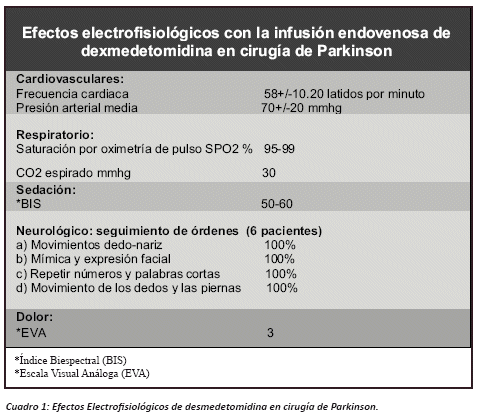
Se incluyeron 6 (seis) pacientes de sexo masculino, cuyas edades oscilaron de 72 a 80 años, el 100% de los cuales recibieron apoyo no invasivo de la ventilación con oxigeno por puntas nasales, el tiempo quirúrgico fue de 4+/- 2horas, las comorbilidades de los pacientes fueron PARKINSON + HAS (2 pacientes) y PARKINSON + DM2 en (2 pacientes), enfermedad de PARKINSON (2 pacientes) total 6 pacientes. El promedio de la infusión de dexmedetomidina fue de 2 a 4 horas (ver cuadro 1 y 2).


Los efectos cardiovasculares encontrados: la frecuencia cardiaca basal fue de 58+/-10.20 latidos por minuto. La presión arterial media inicial fue de 70mmhg +/-20mmhg, los cuales no presentaron depresión respiratoria. No modificaron los trazos electrofisiológicos durante el transanestésico, ni la frecuencia respiratoria. Sin alterar la SPO2 ni la PET-CO2. Todos los pacientes se encontraban con buen grado de sedación conciente BIS 50-60 y colaboraban con el procedimiento quirúrgico, los seis pacientes, obedeciendo órdenes a)Movimientos dedo-nariz b) Mímica y expresión facial c)Repetir números y palabras cortas d)Movimiento de los dedos y las piernas. Se valoró el dolor con la escala visual análoga (EVA 3), que no requirió de analgesia adicional bien tolerada por los pacientes (Ver cuadro 3). No se registraron efectos colaterales con el uso de la dexmedetomidina, no se requirió de dosis de impregnación.
DISCUSIÓN
En estudios anteriores en 2000, se uso dexmedetomidina para sedación en la colocación de electrodos profundos intracerebrales que no interfirieron con el mapeo electrofisiológico y además mantuvo Hemo-dinámicamente estable a los pacientes12.
En otro estudio para la colocación de electrodos intracerebrales utilizando una infusión con propofol se demostró que las constantes electrofisiológicas se modificaron además se demostró que la edad de los pacientes ancianos en su mayoría, fue un factor de riesgo independiente de complicaciones como mayor depresión respiratoria, el propofol aminoraba el temblor o causaba rigidez lo que interfería con el mapeo cerebral y la implantación de electrodos intracerebrales13. Según el estudio de Fogarty y colaboradores de 2004 el presento 13 pacientes para Colocación de electrodos intracerebrales y en tres casos con el uso de dexmedetomidina observó las siguientes complicaciones: depresión respiratoria mínima, agitación y disnea por lo cual se cambio la técnica anestésica en los tres casos. Además requirió una infusión de dexmedetomidina de 0.3 a 0.6 mcgkgh mayor a la que se utilizo en el presente estudio 14. Estudios recientes (2009) han incluido a pacientes quirúrgicos, sometidos a cirugía neurológica en quienes además de la sedación refuerza el efecto analgésico permitiendo una fácil interacción y excitación del paciente para su evaluación neurológica15.
Se concluye que la Sedación consciente con Dexmedetomidina tiene una serie de beneficios como son: 1.- El grado de sedación es adecuado 2.- Permite al paciente seguir órdenes como ser: a)Movimientos dedo-nariz b)Mímica y expresión facial c)Repetir números y palabras cortas d)Movimiento de los dedos y las piernas, 3.- No existe depresión respiratoria ni otro tipo de complicaciones, 4.- además nos brinda Analgesia, sin causar molestias en el paciente.
Es una excelente opción anestésica para pacientes mayores de 70 años de edad y con comorbilidades, además es una técnica de sedación sencilla.
Se necesitan estudios con mayor población de pacientes, sin embargo, este trabajo puede servir de base para posteriores investigaciones.
REFERENCIAS
1. Khatib, Reem, Ebrahim, Zeyd, Rezai, Ali, Cata, Juan, Boulis, Nicolas, John Doyle, D., MD, PhD, Schurigyn, Tamara, CRNA, MSN, Farag, Ehab, MD, FRCA Perioperative Events During Deep BrainStimulation: The Experience at Cleveland Clinic. Journal of Neurosurgical Anesthesiology January 2008:20:1.
2. Rozet I, Muangman S, Vavilala MS, Lee LA, Souter MJ, Domino KJ, et al. Clinical experience with dexmedetomidine for implantation of deep brain stimulators in parkinson's disease. Anesth Analg. 2006; 103:1224-8. [ Links ]
3. Binder DK, Rau GF, Starr PA. Risk factors for hemorrhage during microelectrodeguided deep brain stimulator implantation for movement disorders. Neurosurgery 2005;56:722-32. [ Links ]
4. Alkhani A, Lozano AM. Pallidotomy for Parkinson disease: A review of contemporary literature. J Neurosurg 2001;94:43-9. [ Links ]
5. Krack P, Batir A, Van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson's disease. N Engl J Med 2003;349:1925-34.
6. Gorgulho A, De Salles AAF, Frighetto L, Behnke E. Incidence of hemorrhage associated with electrophysiological studies performed using macroelectrodes and microelectrodes in functional neurosurgery. J Neurosurg 2005; 102:888 -96.
7. Hsu YW, Cortinez LI, Robertson KM, et al. Part I: Dexmedetomidine pharmacodynamics. Anesthesiology 2004;101:1066 -76. [ Links ]
8. Chernik DA, Gillings D, Lane H, et al. Validity and reliability of the observer's assessment of alertness/sedation scale: Study with intravenous midazolam. J Clin Psychopharmacol 1990; 10: 244-51. [ Links ]
9. Ebert TJ, Hall JE, Barney JA, Uhrich TD, Colinco MD. The effects of increasing plasma concentrations of dexmedetomidine in humans. Anesthesiology 2000;93:382-94. [ Links ]
10. Ard J, Doyle W, Bekker A. Awake craniotomy with dexmedetomidine in pediatric patients. J Neurosurg Anesthesiol 2003; 15: 263-6. [ Links ]
11. Ard J, Doyle W, Bekker A. Dexmedetomidine in awake craniotomy: A technical note. Surg Neurol 2005;63:114 -7. [ Links ]
12. Bekker A, Kaufman B, Samir H, Doyle W. The use of dexmedetomidine infusion for awake craniotomy. Anesth Analg 2001;92:1251-3. [ Links ]
13. Fogarty-Mack P, Perrine K, Kobylarz E, et al. Dexmedetomidine and neurocognitive testing in awake craniotomy. J Neurosurg Anesthesiol 2004; 16:20 -5. [ Links ]
14. Ramsey MA, Luterman DL. Dexmedetomidine as a total intravenous anesthestic agent. Anesthesiology 2004; 101:787-90. [ Links ]
15. Ebert TJ, Hall JE, Barney JA, Uhrich TD, Colinco MD. The effects of increasing plasma concentrations of dexmedetomidina in humans. Anesthesiology 2000;93:382-94. [ Links ]
16. R. Juvany Roig y colbs. Manejo perioperatorio de la medicación crónica no relacionada con la cirugía 293- 294 AN. MED. INTERNA Vol. 21, N.» 6, 2004 (Madrid)














