INTRODUCCIÓN
El metaanálisis es una técnica estadística que combina y resume los resultados de varios estudios individuales para lograr sintetizar sus resultados. Por tanto, se utiliza el termino para describir la técnica estadística. En medicina clínica lo que resume es la diferencia de efecto entre dos intervenciones médicas, generalmente algún tratamiento reciente y potencialmente útil frente a otro tratamiento ya contrastado y asentado en la práctica médica habitual. Un buen metaanálisis ocupa el escalón más elevado en la Medicina basada en la evidencia.1
En otros términos, el metaanálisis es una técnica estadística que permite sintetizar la evidencia procedente de estudios disponibles sobre un tema de interés o pregunta de investigación concreta en el marco de una revisión sistemática previa.2,3 La revisión sistemática y el metaanálisis se han consolidado durante las últimas décadas como una herramienta fundamental para la práctica asistencial y la salud pública basada en la evidencia, pero uno de sus principales inconvenientes es que generalmente no permite comparar más de dos tratamientos alternativos a la vez.
En ámbitos de la práctica clínica en los que existen múltiples alternativas de tratamiento que compiten entre sí el metaanálisis tradicional no puede proporcionar información sobre los efectos relativos de todos los tratamientos disponibles de una manera simultánea.4,5,6 La razón fundamental para hacer un metaanálisis dada por Mulrow es “aumentar el poder y la precisión a la hora de valorar los efectos de un tratamiento y los riesgos a su exposición”.
Las revisiones sistemáticas son herramientas fundamentales de la medicina basada en evidencias (MBE). Como se sabe, dos de los pasos principales de la MBE se refieren a la búsqueda y la lectura crítica de los estudios que apoyarán las decisiones médicas sobre aspectos relacionados principalmente con el diagnóstico, tratamiento o pronóstico. La ventaja de leer este tipo de investigación es que los lectores en lugar de varios estudios originales sobre un mismo tema tienen la posibilidad de leer solamente uno, donde se compilan, analizan críticamente y se sintetizan los hallazgos de esas investigaciones.7
El termino metaanálisis no es sinónimo de revisión sistemática, es solo una parte de la revisión. Metaanálisis es una técnica estadística que combina los resultados de diversos estudios individuales para lograr sintetizar sus resultados y dar una estimación global. Algunas publicaciones llamadas metaanálisis no son revisiones sistemáticas. Una revisión sistemática, a menudo, se llama “revisión”. David Sackett (Tabla 1) hace una distinción entre revisión sistemática, revisión y metaanálisis. Se utiliza el término “revisión sistemática” para el proceso entero y el de “metaanálisis” para la técnica estadística específica que combina los resultados.8
| Revisión | “el término general para todo intento que sintetice los resultados y las conclusiones de dos o más publicaciones relacionadas con un tema dado”. |
| Sistemática | “cuando una revisión se esfuerza en la identificación exhaustiva, a través de toda la literatura de un tema dado, valorando su calidad y sintetizando sus resultados” |
| Metaanálisis | “cuando una revisión sistemática incorpora una estrategia estadística específica para reunir los resultados de varios estudios en una sola estimación” |
Fuente: Sackett, D et al. Clinical Epidemiology: A basic science for clinical medicine 2nd ed. Little, Brown & Company, 1991
Es un conjunto de herramientas estadísticas, que son útiles para sintetizar los datos de una colección de estudios. El metaanálisis se inicia recopilando estimaciones de un cierto efecto (expresado en un índice de tamaño del efecto, como la diferencia de medias tipificada, la razón de riesgo, o la correlación) de cada estudio.2 Lo que permite valorar estos efectos en contexto: si el tamaño del efecto es consistente, el efecto del tratamiento puede ser considerado como fuerte y el tamaño del efecto se estima con mayor precisión que con un solo estudio. Si el tamaño del efecto varía, esa variación puede ser descrita y, potencialmente explicada9
En otros términos, el Metaanálisis es una técnica estadística que combina datos de múltiples estudios de un tópico particular. Por lo tanto, los metaanálisis desempeñan un rol fundamental en la práctica de la medicina basada en evidencia. Comparado con otros diseños de estudios (como ensayos aleatorizados controlados o estudios de cohorte), el metaanálisis se sitúa en la cima de la pirámide de los «niveles de evidencia de la medicina basada en evidencia”.10
Los meta-análisis comenzaron a aparecer como una importante parte de la investigación a finales de los años 70. Desde entonces, se han vuelto una forma común de sintetizar evidencia y resumir resultados de estudios individuales.
OBJETIVOS
En la investigación clínica, el objetivo principal del metaanálisis es llegar a una conclusión general; por ejemplo, determinar cuán efectiva es una terapéutica para tratar una enfermedad. Casi cualquier interrogante clínico o cualquier controversia puede someterse a metaanálisis. Es importante que los objetivos del metaanálisis se especifiquen claramente antes de realizar el análisis. Como en cualquier trabajo de investigación, el desarrollo de un protocolo de trabajo formaliza las decisiones tomadas durante la fase de diseño para conseguir los objetivos.
Dichos objetivos pueden sintetizarse de la siguiente forma: a) Estimar de manera más precisa el tamaño del efecto de un tratamiento específico, b) Comparar y contrastar los resultados divergentes de la literatura, c) Responder preguntas nuevas que los estudios originales no habían planteado, o no podían responder (por ejemplo, análisis según subgrupos clínicos), d) Orientar trabajos futuros, generando nuevas hipótesis de trabajo. e) Replicación de resultados, f) Generalización de resultados, g) Predicción de futuros resultados.
Mediante metaanálisis se han estudiado temas básicos de la investigación clínica como los progresos en cirugía y anestesia, la efectividad de la profilaxis antibiótica en cirugía del colon o los resultados terapéuticos, en la nefritis del lupus, de los inmunosupresores con prednisona comparados con la prednisona sola. Para cada objetivo general, los investigadores pueden plantearse objetivos secundarios, por ejemplo, determinar a qué edades puede ser más efectivo el tratamiento.
En la evaluación de fármacos para la nefritis lúpica, los objetivos secundarios fueron determinar los efectos relativos de los dos regímenes terapéuticos respecto a varios posibles resultados finales: deterioro renal, fallecimiento por nefropatía, muerte de origen extrarrenal y mortalidad global. El metaanálisis también se usó para determinar el tamaño muestral necesario para futuros ensayos clínicos sobre la nefritis lúpica. También se han publicado modelos económicos en los que los resultados del metaanálisis se usan para planificar futuros ensayos clínicos.
CÓMO PLANEAR UN METAANÁLISIS 11
El primer paso para realizar un MA es definir la variable desenlace que se analizará y que tiene que encontrarse en todos los EC seleccionados. Después se pueden incluir otras variables que son llamadas variables secundarias y que tienen la posibilidad de no ser consideradas en cada uno de los artículos a analizar. El proceso general para la elaboración de un MA se resume en la siguiente figura.
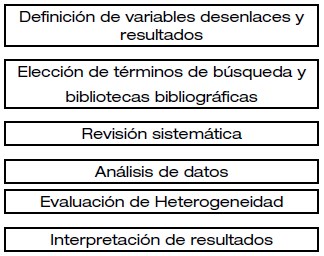
Fuente: Bolaños-Díaz R, María Calderón- Cahua M. Rev. gastroenterol. Perú vol.34 no.1 Lima ene. 2014
¿Por qué llevar a cabo y usar el meta-análisis? 12
Para realizar una decisión válida acerca de utilizar una intervención, idealmente, no debemos de confiar únicamente en los resultados obtenidos en estudios individuales, esto es porque los resultados pueden variar de un estudio a otro por diferentes razones, incluyendo factores confusores y diferentes muestras utilizadas.
Mediante la combinación de estudios individuales, y utilizando más datos, la precisión y la exactitud de los datos estimados en estudios individuales pueden mejorarse. Adicionalmente, si los estudios individuales tenían poca potencia, mediante su combinación en un meta-análisis, se puede incrementar su poder estadístico global para detectar un efecto.
¿Cómo se realiza un meta- análisis?
Identificar/formular un problema (ej. una pregunta que va a contestarse por ejemplo determinar la efectividad del ejercicio en la depresión en comparación a la ausencia de tratamiento y los tratamientos de comparación).
Hacer una revisión bibliográfica: Esto involucra probablemente una búsqueda en múltiples bases de datos de artículos indexados que sean confiables y revisadas por pares como: PubMed, Scorpus, Web de ciencia, Embase, etc.
Decidir en la selección/criterios de inclusión: Se debe utilizar criterios de inclusión y exclusión que asegure una evidencia de alta calidad, o de relevancia directa para la investigación propia, se incluye. Por esta razón, tendemos mayormente a incluir estudios aleatorios controlados (excluyendo los estudios observacionales). Idealmente, deberíamos también de incluir estudios aún no publicados para evitar el sesgo de publicación. (Si fallamos en incluir todos los estudios relevantes, los criterios de inclusión podrían estar erróneos). Específicamente, podríamos sobreestimar el beneficio de un tratamiento (por ejemplo), debido a que estudios que fallan en encontrar resultados significativos son menos probables de ser publicados que aquellos que no encuentran un efecto significativo.
Extracción de datos: se debe extraer los datos de tus resultados de interés para que se junten (combinen) en el análisis final del set. Y
Hacer lo básico en el metaanálisis: Una revisión o metaanálisis de calidad debería contestar con facilidad a las siguientes preguntas: 1. ¿La revisión fue enfocada hacia una pregunta clínica concreta?, 2. ¿Fueron apropiados los criterios utilizados para la selección e inclusión de artículos?, 3. ¿Es probable que se hayan perdido relevantes o importantes estudios?, 4. ¿Se valoró la validez y calidad de los estudios incluidos?, 5. ¿Son reproducibles las valoraciones de los estudios?, 6. ¿Son similares los resultados, entre unos y otros trabajos, en esta revisión sistemática?
FASES DE UN META-ANÁLISIS13
Las fases que se va a señalar no tienen que por qué realizarse de una forma estrictamente secuencial, de forma que cada una solo comience cuando haya terminado la anterior. Más bien, la experiencia nos dice que hay que estar dispuesto a volver a las fases anteriores a la vista de lo que se va obteniendo en cada una. Hay que tomarlas de una forma flexible. Aun así, estas fases se refieren a lo que podríamos llamar un MA típico, que se realiza con el objetivo de sintetizar la evidencia sobre una determinada pregunta. Las fases en un MA son las siguientes:
a) Formulación del problema. La pregunta habitual en un MA típico se refiere a la asociación entre dos variables. Se trata de responder a la pregunta de si dichas variables están relacionadas y, en caso de estarlo, cuál es la magnitud de dicha asociación.
b) Búsqueda de los estudios. Una vez planteada la pregunta se puede proceder a localizar y reunir las fuentes de evidencia. Esta suele ser la fase más tediosa, sobre todo si hay abundante investigación sobre la cuestión planteada. Se suelen especificar unos criterios de inclusión y exclusión de los estudios en el MA, cuyo objetivo no es otro que conseguir una base de datos suficientemente homogénea como para permitir una generalización razonable.
c) Codificación de los estudios. Es la fase de codificación de las características de los estudios primarios y su registro en la base de datos. Este proceso comienza con frecuencia con un listado de características y termina con otro, ya que al avanzar en este proceso se advierte la importancia de características no consideradas al principio o se decide redefinir las categorías o las formas de valorarlas.
d) Análisis estadístico e interpretación. Para empezar, se calcula la estimación o estimaciones independientes que aporta cada estudio del TE que refleja el efecto estudiado. Como ya hemos visto anteriormente en algunos ejemplos, con estos valores se obtendrá una estimación combinada y un intervalo de confianza. Con la estimación combinada, basada en todos los estudios, más su intervalo de confianza, ya se puede responder a las dos preguntas mencionadas más arriba. Si el intervalo incluye el valor de no efecto del índice de TE que se esté empleando (ya sea 0 o 1, dependiendo del índice elegido) se debe concluir que las variables no están asociadas.
e) Publicación. El informe meta- analítico tiene algunas peculiaridades, propias de sus características especiales. Existen guías y recomendaciones (Botella y Gambara, 2006; Clarke, 2009; Rosenthal, 1995). Como norma general, un buen informe meta- analítico será el que permita una más fiel replicabilidad del estudio.
FORTALEZAS Y DEBILIDADES DEL METAANÁLISIS
Una ventaja importante de un metaanálisis es que produce una estimación precisa del tamaño del efecto con un poder estadístico considerablemente mayor, lo que es especialmente importante cuando el poder del estudio primario es limitado debido al pequeño tamaño de la muestra. Un metaanálisis también analiza la variación en los resultados de diferentes estudios y cuantifica la inconsistencia de los resultados (heterogeneidad) entre los estudios. También es un método objetivo y cuantitativo que proporciona una estimación menos sesgada sobre un tema específico.14
La principal crítica del metaanálisis es que combina diferentes tipos de estudios (“mezcla de manzanas y naranjas”). No obstante, este problema puede superarse evaluando la heterogeneidad en los estudios y realizando análisis de subgrupos. Sin embargo, si los estudios son demasiado heterogéneos para ser comparables, se debe evitar un metaanálisis, ya que el resultado del metaanálisis puede carecer de significado y cualquier efecto verdadero puede quedar oculto. La otra limitación del metaanálisis es “la basura entra, la basura sale”, lo que significa que, si un metaanálisis incluye estudios de baja calidad con sesgo, los resultados del metaanálisis estarán sesgados e incorrectos. Como tal, los resultados del metaanálisis dependen de la calidad de la investigación primaria. Por lo tanto, cualquier metaanálisis debe incluir estudios seleccionados sobre la base de estrictos criterios de inclusión.
Finamente, cabe señalar los metaanálisis y las revisiones sistemáticas son necesarios, ya que no existe otra alternativa seria para combatir y domesticar esa “jungla” en la que se ha convertido el complicado y vasto mundo de la información científico-médica. Además, para que los profesionales de la salud puedan aprovechar el gran esfuerzo que la MBE está haciendo para ayudarles en su toma de decisiones.15,16