INTRODUCCIÓN
Las enfermedades neurodegenerativas se caracterizan por presentar degeneración y pérdida neuronal manifestándose en trastornos de disfunción cognitiva y sensoriomotora, tales como la enfermedad de Alzheimer (EA), enfermedad de Huntington (EH), atrofia multisistémica (AMS), esclerosis lateral amiotrófica (ELA), esclerosis múltiple (EM) y la enfermedad de Párkinson (EP). En estas, algunas células específicas como las neuronas dopaminérgicas, motoras o colinérgicas pierden de forma gradual su estructura, función y número desencadenando la enfermedad. A pesar del avance de las terapias y la tecnología, hasta la fecha no tienen una cura1-3. Las más frecuentes dentro de este grupo de enfermedades son el Alzheimer, la esclerosis y el Parkinson; estas últimas dos incumben al presente estudio.
La Esclerosis Múltiple (EM) es una enfermedad desmielinizante, autoinmune y progresiva, asociada a diversos factores genéticos y medioambientales. Según la OMS, afecta a 1 de cada 3000 personas, con una representatividad del 69% en mujeres y promedio de edad de 39 años4. Es la enfermedad con etiología desconocida más discapacitante en adultos jóvenes y su prevalencia es más elevada en países desarrollados, pero asociada con áreas geográficas en latitudes elevadas5. Su manifestación clínica es variada y coincide con la afectación del tracto nervioso, conlleva alteración motora, sensitiva y cerebelosa; afectación de pares craneales, y alteraciones autonómicas y psíquicas. Puede evolucionar de distintas maneras, brotes y remisiones (EMRR) entre los más frecuentes, pasando a la forma progresiva de la enfermedad.5
La enfermedad de Párkinson (EP), por su parte, es la segunda enfermedad degenerativa (disfunción motora) más frecuente después de la EA. Se estima que, alrededor de 17 millones se verán afectados para el año 2040, convirtiéndola en una de las enfermedades de más rápido crecimiento a nivel mundial6. Su etiología está relacionada con el envejecimiento, el rango de edad prevalente oscila entre los 85 y 89 años; además, es frecuentemente observado el sexo masculino con una relación hombre mujer de 1/4. Alberga diversas manifestaciones clínicas relacionadas con el compromiso de múltiples sistemas de neurotransmisores, principalmente motores por la presencia de bradicinesia, temblor de reposo y rigidez. Una vez los síntomas motores aparecen, se considera entre el 50 y 80 % de pérdida de neuronas dopaminérgicas pars compacta de la sustancia negra7.
Ahora bien, en los últimos años, se ha recurrido a la terapia celular en este tipo de enfermedades, misma que ha reflejado resultados prometedores. Esta terapia ha conllevado el empleo de las células madre mesenquimales (MSC, del inglés Mesenchymal Stem Cells), células progenitoras con la capacidad de autorrenovarse y diferenciarse en una variedad de tipos de células como las del sistema nervioso, la piel, músculos y cartílagos entre otros. Su fácil obtención a partir de la médula ósea las hace potencialmente beneficiosas en terapia celular e ingeniería de tejidos 8,9; según su definición estándar, las MSC son células clonales que expresan marcadores de diferenciación (CD) tales como los marcadores CD73, CD90 y CD105, observables y analizables mediante citometría de flujo10,11.
Las MSC tienen ventajas únicas en la aplicación clínica. Como un tipo de células madre pluripotentes, las MSC pueden diferenciarse en células derivadas de endodermo y ectodermo, como la glía y las neuronas, lo que proporciona un enfoque nuevo para la terapia de reemplazo celular en enfermedades neurodegenerativas12,13. Debido a sus características únicas que comprenden la autorrenovación, la multipotencia y la disponibilidad, la terapia basada en MSC ha atraído una atención creciente en el contexto de la terapia de enfermedades neurodegenerativas1. Recientemente, la terapia celular en modelos animales destinada al tratamiento de la EP ha demostrado cierto éxito14.
Es de esta manera que, con el propósito de plantear la aplicabilidad de la terapia celular como una opción terapéutica innovadora para el manejo de las enfermedades neurodegenerativas en nuestro medio, se describe la utilidad de la terapia con células madre mesenquimales en pacientes con EM y EP como tratamiento coadyuvante.
MATERIAL Y MÉTODOS
Estudio longitudinal prospectivo que consideró pacientes con enfermedad neurodegenerativa (n=4), 2 con Esclerosis Múltiple y 2 con enfermedad de Parkinson, mismos que recibieron terapia celular como tratamiento coadyuvante. Todos los pacientes con radicatoria en la ciudad de La Paz, Bolivia, (3650 m.s.n.m.).
Previo a la consideración del procedimiento con terapia celular, los pacientes fueron valorados por el servicio de neurología según lo correspondiente. La severidad de la enfermedad para los pacientes con Esclerosis Múltiple fue realizada según la Escala Expandida del Estado de Discapacidad (EDSS) 15,16, así mismo, la severidad para Enfermedad de Parkinson conforme a la Escala Unificada de Valoración de la Enfermedad de Parkinson (UPDRS)17,18. (Cuadro 1).
Se consideró procedimiento terapéutico con terapia celular mediante trasplante autólogo de médula ósea de acuerdo a protocolo institucional, con especial atención en la aplicabilidad de células madre mesenquimales 19-21. Previo consentimiento informado, se programó sesiones de reinfusión de MSC autólogas de médula ósea vía sangre venosa períferica, con el respectivo seguimiento y evaluación periódica (Cuadro 1). Las células madre mesenquimales fueron caracterizadas y cuantificadas por citometría de flujo (FACS Canto II, BD) utilizando los anticuerpos CD45, CD90, CD73 y CD 105 (BD Stemflow™ Human MSC Analysis Kit) 22,23.
Cuadro 1. Datos clínicos de pacientes que recibieron terapia celular
| Edad | Sexo | Diagnóstico | Severidad | Reinfusión MSC |
|---|---|---|---|---|
| 42 | F | Esclerosis Mútiple | EDSS 6 | 2 sesiones |
| 19 | F | Esclerosis Mútiple | EDSS 2 | 2 sesiones |
| 68 | M | Enfermedad Parkinson | UPDRS 2 | 3 sesiones |
| 76 | M | Enfermedad Parkinson | UPDRS 3 | 1 sesión |
EDSS: Escala Expandida del Estado de Discapacidad de Esclerosis múltiple
UPDRS: Escala Unificada de Valoración de la Enfermedad de Parkinson
MSC: Células Madre Mesenquimales
RESULTADOS
Se observó que, cada paciente tuvo una evolución distinta o particular según la severidad de la enfermedad, los ciclos de terapia celular y el seguimiento. Datos descritos en Tabla 2. Sin embargo, la mejoría posterior al procedimiento realizado fue favorable, cada caso alcanzó respectivamente scores EDSS y grados UPDRS mejorados y positivamente representativos (Tabla 2). Así mismo, la identificación de células madre mesenquimales por inmunofenotipo, fue evidenciable y cuantificable (Figura 1).
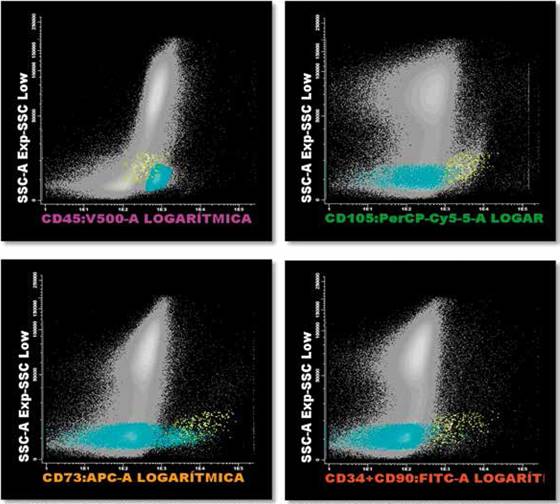
Las Células Madre Mesenquimales (MSC) son positivas para CD1G5, CD73 y CD90. Los puntos amarillos corresponden a MSC: 0.001%
Figura 1. Identificación de células madres mesenquimales en médula ósea.
Tabla 2. Seguimiento de pacientes y su evolución al tratamiento con terapia celular
| Paciente MRL, femenino, 42 años | |
|---|---|
| Diagnóstico | Esclerosis Múltiple Remitente - Recurrente. Evolución de 5 años |
| Clínica | Neuritis óptica, piramidalismo bilateral. Deterioro cognitivo. EDSS 6 |
| Tratamiento | Recibió interferón beta por 2 años. Actualmente fingolimod. |
| RMI | RMI encefálico con múltiples lesiones periventricular y subcortical. |
| Control post terapia celular |
1er. Control a la semana: Recuperación inmediata con EDSS 5. RMI encefálico reducción de lesiones desmielinizantes 2do. Control a los 3 meses: sin recaídas manteniendo EDSS 5. 3er. Control a los 6 meses. Asintomática. EDSS 5 |
| Paciente AA, femenino, 19 años | |
| Diagnóstico | Esclerosis Múltiple Remitente - Recurrente. Evolución de 2 años |
| Clínica | Diplopía y neuritis óptica. EDSS 2 |
| Tratamiento | Recibió interferón beta por 2 años. Actualmente con fingolimod |
| RMI | RMI encefálico con lesiones aisladas subcortical |
| Control post terapia celular |
1er. Control a la semana: Recuperación inmediata. EDSS 0. 2do. Control a los 3 meses. Asintomática. RMI cerebral sin lesiones. 3er. Control a los 6 meses: Asintomática. EDSS 0 |
| Paciente RSE, masculino, 68 años | |
| Diagnóstico | Enfermedad de Parkinson, grado 2. Evolución de 5 años |
| Clínica | Temblor de reposo en mano izquierda, rigidez y bradicinesia. UPDRS de off I=2, II=20, III=35, IV=9 |
| Tratamiento | Levodopa Carbidopa 200/50 mg 1½ comp. al día. Biperideno 4 mg al día Pramipexol 0.75 mg cada 12 horas |
| RMI | RMI cerebral sin alteraciones |
| Control post terapia celular |
1er. Control a la semana: mayor movilidad. UPDRS de off I=0, II=7, III=17, IV=3 2do. Control a los 3 meses UPDRS de off I=0, II=15, III=20, IV=3 |
| Paciente VJ, masculino, 76 años | |
| Diagnóstico | Enfermedad de Parkinson grado 3. Evolución 12 años |
| Clínica | Temblor de reposo mayor en lado derecho, rigidez, bradicinesia. UPDRS de off I=6, II=30, III=39, IV=8 |
| Tratamiento | Levodopa carbidopa 200/50 mg 2 comp al día Pramipexol 0.75 mg ½ comp cada 12 horas Pregabalina 50 mg cada noche |
| RMI | No realizado |
| Control post terapia celular | 1er. Control a la semana: sin rigidez con mayor movilidad. UPDRS de off I=4, II=20, III=35, IV=6 |
DISCUSIÓN
Las enfermedades neurodegenerativas, causadas por un deterioro de neuronas en el sistema nervioso, conllevan dificultades terapéuticas porque la reparación de las células nerviosas es limitada, lo que también repercutiría en el fracaso de los tratamientos
convencionales, constituyéndose estos factores en obstáculos importantes para el manejo de las enfermedades neurodegenerativas 24,25.
Ahora bien, el potencial regenerativo de las células madre mesenquimales (MSC) atrajo la atención de los investigadores hacia la terapia basada en células para el tratamiento de enfermedades neurodegenerativas 24,26. La aplicabilidad clínica de las células madre puede ayudar a sustituir nuevas células y superar la incapacidad del sistema de reparación endógeno para reparar las neuronas dañadas. En ello, se alude la característica de Homing que refiere a la capacidad de las MSC para migrar espontáneamente a la región lesionada cuando el tejido está dañado, característica importante de las MSC que puede utilizarse ampliamente en el tratamiento de enfermedades 27,28.
En este trabajo, se pudo evidenciar que el tratamiento de 4 pacientes con enfermedades neurodegenerativas (EP, EM) que recibieron células madres mesenquimales de médula ósea con técnica de trasplante autólogo obtuvieron resultados prometedores. Se observó que, posterior a la terapia celular, los pacientes con esclerosis múltiple y enfermedad de Parkinson presentaron una mejoría que no habían tenido con los medicamentos, esto probablemente por un conveniente reemplazo de células neuronales y el aumento de la capacidad de reparación de la mielina endógena. Esto concordante con varios estudios preclínicos al respecto que reportaron la capacidad de las células madre mesenquimales de reparar las neuronas lesionadas y recuperar déficits neurológicos funcionales 29,30. De manera que, concerniente a los resultados observados, la terapia celular podría ser una herramienta terapéutica clave para encaminar una efectiva neurorestauración 31.
En conclusión, considerando los resultados de este trabajo, la terapia celular con células madre mesenquimales autólogas de médula ósea, administrados vía venosa periférica a los pacientes, se podría constituir en una opción factible para el tratamiento de enfermedades neurodegenerativas.














