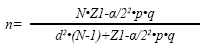INTRODUCCIÓN:
La epidemia de Covid-19 constituye una urgencia de salud pública sin precedentes que llegó a Latinoamérica el 26 de febrero de 2020. El regreso a la normalidad depende cada vez más del éxito de las vacunas para prevenir enfermedades y se espera limitar la propagación de la infección.1,2,24 por lo tanto es muy importante conocer los Eventos Supuestamente Atribuidos a la Vacunación y/o Inmunización y los Eventos Adversos de Especial Interés (ESAVIS Y AESI), La mayoría de los eventos adversos observados fueron en general más leves y se notificaron con menor frecuencia en adultos mayores (≥65 años). Es necesario conocer en la población andina cuales son los eventos adversos y su prevalencia, para decisiones futuras. Su adecuada implementación constituye el desafío de vacunación más importante de las últimas décadas para nuestro país.
La vacuna es una sustancia compuesta por una suspensión de microorganismos atenuados o muertos que se introduce en el organismo para prevenir y tratar determinadas enfermedades infecciosas; estimula la formación de anticuerpos con lo que se consigue una inmunización, que previene la enfermedad contra la que está dirigida, inducen una respuesta inmune de menor intensidad y duración puede ser virus, bacterias o sus componentes y toxinas.3 La vacunación es una forma sencilla, inocua y eficaz de protegernos contra enfermedades dañinas antes de entrar en contacto con ellas.4 La inmunización es acción de conferir inmunidad mediante administración de antígenos (inmunización activa) o mediante la administración de anticuerpos específicos (inmunización pasiva). La inmunidad, se refiere a la protección de un individuo contra enfermedades infecciosas o sea la capacidad del organismo para resistir y sobreponerse a una infección.3
El proceso de desarrollo de una vacuna suele durar una década, pero la enfermedad por COVID-19 acelera la producción por ser una urgencia mundial.5,23 las vacunas pasan por ensayos de fase 1, en fase 2 en fase 3, e incluso fases tras comercialización 6 A principios de mayo de 2021, las vacunas de Sinopharm, BBIBP-Cor V (desarrollada a partir de la cepa WIV04 evaluada en esta investigación) fue aprobada por la OMS para su uso de emergencia en mayores de 18 años de edad, lo que posibilita su distribución a través de la iniciativa COVAX en países con escasos recursos para acceder a la vacunación.7 Las vacunas inactivadas se utilizan ampliamente para la prevención de enfermedades infecciosas emergentes.8 la vacuna Sinopharm se desarrollaron a partir del aislamiento de dos cepas de SARS-CoV-2 (WIV04 y HB02) de dos pacientes en el Hospital Jinyintan, Wuhan - China.9 La vacuna Sinopharm proporciona protección parcial contra la infección por SARS COV-2. Podría deberse a la falta de su potencial para detectar variaciones recientes en la estructura proteica de la proteína o el virus de la espiga (S) 10 Inmunogenicidad y seguridad de la vacuna inactivada contra el SARS COV- 2 (BBIBP-CORV) en pacientes con neoplasia maligna presentaron dolor en el lugar de la inyección y la fiebre fueron los efectos secundarios locales y sistémicos más frecuentes.11
Los ESAVI, término operativo que no supone en sí mismo una categoría diagnóstica, se refieren a “cualquier situación de salud no esperada (signo no favorable. o no intencionado, hallazgo anormal de laboratorio, síntoma o enfermedad) que ocurre con posterioridad a la vacunación y que no necesariamente tiene una relación causal con la vacunación o con el producto biológico” 9
Los ESAVI leves y moderados son registrados en el sistema de Registro Nominal de Vacunaciones Electrónico (RNVe) y los ESAVI graves son registrados tanto en el RNVe como en el Formulario 030 de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización (ESAVI). El Form.030 se encuentra disponible en la página web de Agencia Estatal de Medicamentos y Tecnología en Salud (AGEMED), en el siguiente enlace externo: https://misa.agemed.gob.bo/. En este boletín, se incluye los resultados estadísticos de la información correspondiente a las notificaciones de ESAVI asociados a la vacuna contra la COVID-19, recibidas durante el periodo del 29 de enero de 2021 al 01 de mayo de 2021.12
Objetivo del trabajo: Describir los Eventos Adversos (ESAVIS) de la vacuna Sinopharm administrada en personas adultas en el punto de vacunación masivo de la Red de salud N°4 ESTE de la ciudad de La Paz, meses de abril a octubre gestión 2021.
MATERIAL Y MÉTODOS:
Se realiza un Estudio Epidemiológico el cual busca la objetividad de los resultados en términos cuantitativos, con el objeto de generar conocimientos sobre las causas13 Diseño de investigación no experimental retrospectivo, los datos serán recolectados de las fichas ESAVI gestión 2021, instrumento otorgado por el Ministerio de Salud y Deportes, y transversal los datos recolectados fueron tomados en un tiempo determinado sin realizar seguimiento, por último descriptivo. 14
La población está constituida por personas adultas mayores15 de 18 años, que acudieron al punto de vacunación masivo (en ambientes de la Universidad Mayor de San Andrés de la facultad de medicina), en la ciudad de La Paz de la Red de Salud N° 4 ESTE gestión 2021, durante 7 meses, con un total de 28.520 personas vacunas, de primera y segunda dosis de la vacuna Sinopharm. En dicha gestión se presentaron 61 ESAVIs de ambas dosis.
Tamaño de la muestra para la estimación de frecuencias (Marco Muestral Conocido-MMC)
Tipo de muestra: Probabilístico aleatorio simple16
Criterios de inclusión: Adultos mayores de 18 años que acudan al punto de vacunación masivo de la Red de salud N°4 ESTE de la ciudad de La Paz, ambos sexos con administración de 2 dosis de la vacuna Sinopharm, con antecedentes de patologías diagnosticadas y controladas, antecedente de alergias a medicamentos y a otras vacunas resueltas sin complicaciones, que presenten una clasificación de ESAVIS posterior a la vacunación.
Criterios de exclusión: Adultos que no pertenezcan a la RED de Salud N°4 ESTE, que recibieron la 1ra dosis de vacuna Sinopharm en otro punto de vacunación, con enfermedades patológicas descompensadas, descontroladas o con desconocimiento de padecer alguna patología.
El instrumento 17 utilizado: Fichas ESAVIs del Ministerio de Salud y Deportes, 2021. Son ordenadas en una planilla de Excel, que conformará la base de datos.
ANÁLISIS ESTADÍSTICO. Para el análisis estadístico se usa estadística descriptiva: Como el índice de tendencia central y de dispersión, para las variables cuantitativas se emplea la media aritmética. Para las variables categóricas se emplea las frecuencias absolutas y relativas porcentuales. Todas las variables son dicotómicas con un intervalo de confianza al 95%. Se usa representaciones gráficas para variables categóricas y tablas para variables numéricas. Para el análisis de datos se utilizará el paquete estadístico SPSS versión 22 para la elaboración de las tablas y gráficos donde se analizará las variables de la investigación. Se utiliza una laptop TOSHIBA AMD 6ta generación y Excel 2016.
RESULTADOS
Descripción: Del total de los Eventos Adversos “ESAVIS” tras la administración de las vacunas Sinopharm, el 78,3% (47) corresponde al sexo femenino, con respecto al sexo masculino 21,7% (13).
Cuadro 1. Estadístico descriptivo de la edad en personas adultas que recibieron la vacuna Sinopharm, del punto de vacunación masiva de la Red de salud N° ESTE de la ciudad de La Paz, 2021.
| ESTADÍSTICA | VALOR | |
|---|---|---|
| Media | 44,27 | |
| Error estándar de la media | 1,573 | |
| Mediana | 45 | |
| Moda | 51 | |
| Desviación estándar | 12,182 | |
| Varianza | 148,402 | |
| Asimetría | -0,156 | |
| Error estándar de simetría | 0,309 | |
| Curtosis | -0,829 | |
| Error estándar de curtosis | 0,608 | |
| Rango | 47 | |
| Mínimo | 21 | |
| Máximo | 68 | |
| Suma | 2656 | |
| Percentiles | 25 | 33,25 |
| 50 | 45 | |
| 75 | 52,75 | |
Fuente: Datos recolectados de las fichas ESAVIS Red de salud N° 4 ESTE, 2021
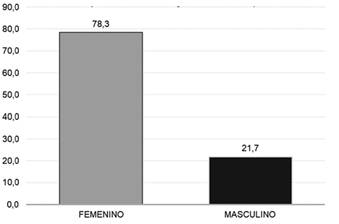
Fuente: Datos recolectados de las fichas ESAVIS Red de salud N° 4 ESTE, 2021.
Figura 1. Frecuencia relativa del sexo en personas adultas que recibieron la vacuna Sinopharm, en el punto de vacunación masivo de la Red de salud N° 4 ESTE de la ciudad de La Paz, 2021.
Descripción: En el estudio llevado a cabo con un tamaño de muestra calculado mediante fórmula matemática (n=60) se tiene: la media aritmética de la edad de adultos que presentaron Eventos adversos “ESAVIS” tras la administración de la vacuna Sinopharm es de 44,27 años, el promedio las medias muéstrales están dispersas de la media poblacional en 1,57 puntos, 50% de las edades están por encima de 45 años y el restante por debajo de este valor, el promedio final más frecuente es 51 años, en promedio las edades están dispersos de 44,27 (media) en ±12,18 (Desviación Típica.) años. La distribución de los datos tiene una asimetría negativa izquierda y la curtosis es negativa platicurtica. El promedio final mínimo es de 21 años y el máximo de 68 años, con un rango de distribución de 47. El 25% (1/4parte) de las edades de la población vacunada con Sinopharm son menores de 33.24 años, el 50% (mitad) de las edades de la población vacunada con Sinopharm son menores de 45 años, el 75% (% parte) de las edades de la población vacunada con Sinopharm son menores de 52,75 años.
Fuente: Datos recolectados de las fichas ESAVIS Red de salud N° 4 ESTE, 2021.
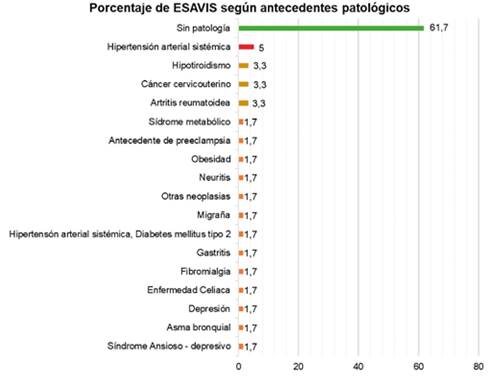
Figura 2. Frecuencia relativa de antecedentes patológicos en personas que se administró la vacuna Sinopharm adultas que recibieron la vacuna Sinopharm, del punto de vacunación masiva de la Red de salud N° 4 este de la ciudad de La Paz, 2021.
Descripción: Del total de 60 casos que presentaron Eventos Adversos “ESAVIS” tras la administración de las vacunas Sinopharm, más del 60%7 de la población estudiada no presentan enfermedades, solo el 38,3%23 presentaron patologías como ser: el 5%3 presenta Hipertensión Arterial Sistèmica, el 3,3%2 presentan hipotiroidismo, cáncer uterino y artritis reumatoidea, por último 1,7%1) Síndrome Metabólico, Obesidad, Neuritis, Diabetes Mellitus tipo 2, Gastritis, Fibromialgia, Enfermedad Celiaca, Asma Bronquial, Síndrome Ansioso Depresivo, y antecedentes de otras neoplasias.
Fuente: Datos recolectados de las fichas ESAVIS Red de salud N° 4 ESTE, 2021.
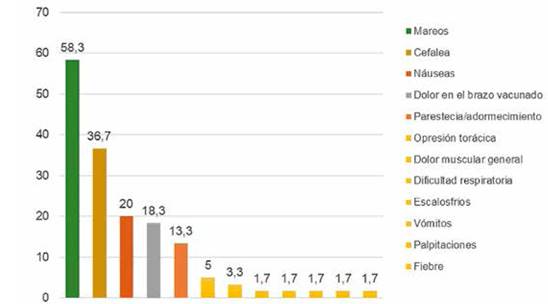
Figura 3. Frecuencia relativa de los signos y síntomas que presentaron las personas tras la administración de la vacuna Sinopharm en personas que acudieron al punto de vacunación masiva de la Red de salud N° 4 ESTE de la ciudad de La Paz, 2021.
Descripción: Del total de la población estudiada el 58,3% (35) presentaron síntomas de Mareos, el 36,7% (22) presentaron cefalea, el 20%(12) presentaron náuseas y el 18,3% (11) presentaron dolor de brazo en el brazo vacunado, el 13.3% (8) parestesia/adormecimiento, el 5% (3) opresión torácica y en el 1,7% (1) dificultad respiratoria, escalofríos, vómitos, palpitaciones y fiebre posterior a la administración de las vacunas Sinopharm.
Fuente: Datos recolectados de las fichas ESAVIS Red de salud N° 4 ESTE, 2021.
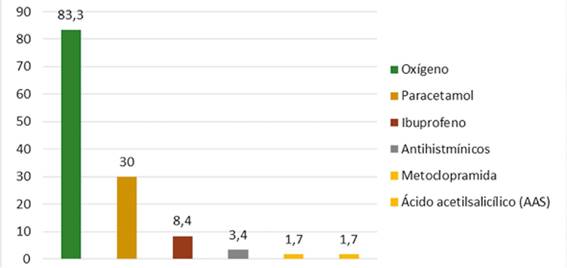
Figura 4 Frecuencia relativa de los medicamentos que se administraron a las personas tras la inoculación de la vacuna Sinopharm en personas que acudieron al punto de vacunación masiva de la Red de salud N° 4 ESTE de la ciudad de La Paz, 2021
Descripción: El medicamento de mayor administración “tratamiento” presenta una frecuencia del 83,3% (50) es el oxígeno, en comparación medicamentos como ser: paracetamol en un 30% (18), ibuprofeno 8,4% (4), antihistamínicos 3,4% (2), metoclopramida y ácido acetilsalicilico “aspirina” en un 1,7% (1) posterior a que presentaron Eventos Adversos “ESAVIS” tras la administración de las vacunas Sinopharm.
Cuadro 2. Frecuencia absoluta y relativa de la clasificación de eventos adversos (ESAVIS) que presentaron las personas tras la administración de la vacuna Sinopharm de la Red de salud N°4 este de la ciudad de La Paz, 2021.
| Eventos Adversos | Mayores de 18 años (n=60) | ||
|---|---|---|---|
| Frecuencia (n) | Porcentaje (%) | ||
| ESAVIS | Leves | 59 | 98,3 |
| Moderado | 1 | 1,7 | |
Fuente: En base a Datos recolectados de las fichas ESAVIS Red de salud N° 4 ESTE, 2021.
Descripción: La frecuencia los Eventos Adversos “ESAVIS” Leves es del 98,3% (59) del total de la población estudiada y solo el 1,7% (1) presento Eventos adversos “ESAVIS” Moderado posterior a la administración de las vacunas Sinopharm.
DISCUSIÓN
Las personas que presentaron Eventos Adversos (ESAVIS) posterior a la administración de la vacuna Sinopharm con el 78,3% corresponde al sexo femenino en comparación al sexo masculino con un 21,7%. Con respecto a la edad el promedio es de 44,27 años estos resultados son comparables con el estudio Saeed B. et al que son más comunes en los participantes de edad avanzada >49 años, los efectos secundarios posteriores a la vacunación para la primera y la segunda dosis fueron leves y predecibles.18 y solo se realizó una transferencia hospitalaria por una ESAVIS moderado.
El antecedente patológico de mayor relevancia que presentan los pacientes antes de la vacunación es la Hipertensión Arterial Sistémica en un 5%. Tras la administración de la vacuna Sinopharm los Signos y Síntomas que presentaron son los Mareos 58,3% y el 36,7% presento cefalea estos resultados que son comparables en el estudio Xia, Zhang et al. y en poblaciones de Medio Oriente inmunizadas con Sinopharm.19,20,21
Posterior al diagnóstico de ESAVI se administraron medicamentos (tratamiento ambulatorio en un consultorio designado) como ser el oxígeno 83,3% el cual tuvo una excelente respuesta disminuyendo los síntomas. Según la clasificación de Eventos Adversos “ESAVIS” el 98,3% son Leves.
Estos resultados son respaldados 18,22 En tal sentido se debería esta relación porque las poblaciones son similares o bien el tipo de vacuna.
El manejo y control de un Evento Adverso (ESAVIS) tras la administración de la vacuna Sinopharm es importante para el personal de salud y control del paciente, si bien no se presentaron ESAVIS moderados o graves en el estudio, es representativo los signos, síntomas y el tratamiento que se administró, con el objetivo de informar a la población sobre los efectos adversos, para evitar la mala información. Actualmente la vacunación seguirá hasta concluir con la pandemia, y probablemente la vacuna anticovid ingresará al Programa Ampliado de Inmunización en nuestro país. Esta información es importante para los Organismos Internacionales quienes apoyan con la adquisición de las vacunas y para el Ministerio de Salud y Deportes por ser el ente Rector Nacional.
Reforzar el sistema de farmacovigilancia para ESAVI para realizar análisis e identificar posibles nuevas reacciones adversas que deben someterse a una evaluación más amplia y profunda para tener la confirmación de que son ocasionadas por la vacuna.