Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Médica La Paz
versión On-line ISSN 1726-8958
Rev. Méd. La Paz vol.24 no.1 La Paz 2018
ACTUALIZACIÓN
INSUFICIENCIA CARDIACA EN PEDIATRÍA
Burgoa-Varga J.*, Cruz-Arias R.*, Herrera-Cusicanqui J.**, Patiño-Aguilar L.***
* Cardiólogo Pediatra. Departamento Cardiología Pediátrica. Hospital Materno Infantil. CNS. La Paz - Bolivia
** Cardiólogo Pediatra Departamento de Cardiología Pediátrica. Hospital del Niño. La Paz - Bolivia.
*** Residente de Pediatría. Departamento de Cardiología Pediátrica. Hospital Materno Infantil.
INTRODUCCIÓN
La insuficiencia cardiaca (IC) en la edad pediátrica difiere en gran manera a la población adulta, tanto en etiología, historia natural, como en tratamiento, sin embargo los conceptos principales coinciden en múltiples aspectos.1,2 El plantear definiciones, conocer la fisiopatología básica, recurrir a las bases moleculares y utilizar avances tecnológicos en el diagnóstico ha permitido mejorar la sobrevida de niños con IC. Aún existe controversia en foros y consensos acerca de los principios que llevan a la IC, aún más en pediatría. Presentamos una revisión de los principales conceptos, bases moleculares, fisiopatología, evaluación de la función en el corazón bi y univentricular, y la evidencia actual de tratamiento en pacientes pediátricos con IC. La disfunción diastólica precisa de una descripción separada a ésta publicación dado que conlleva un contexto distinto a la IC sistólica.
CONCEPTOS Y DEFINICIONES
Existe mucha controversia acerca de las definiciones cabales que permitan acercarnos a un diagnóstico justo, dado que la complejidad de la fisiopatología así lo exige. Las principales referencias bibliográficas en pediatría coinciden en que la IC consiste en la incapacidad del corazón como bomba para satisfacer las demandas tisulares periféricas1,3,4-9. Sin embargo consideramos que a la luz de la evaluación de la función cardiaca dicha definición no se ajusta a la realidad ya que una vez instalada la IC los mecanismos compensadores incrementan el índice cardiaco de forma tal que la demanda tisular se satisface aún en IC6. De igual modo la literatura describe a la IC como un estado de bajo gasto o bajo débito3-5,8; sin embargo los mecanismos compensadores restablecen y sostienen un volumen minuto normal o hasta elevado (según la etiología de la IC) pese a tener fracción de eyección deprimida6,9.
A continuación postulamos las definiciones que deben mantenerse presentes ante todo paciente que tenga sospecha clínica de IC.
PRECARGA
Comúnmente se considera a la pre-carga como sinónimo del volumen de llenado díastólico, entendiendo el mismo como la volemia que regresa al corazón, sin embargo la definición que impulsamos en la siguiente: Es la longitud que alcanza la miofibrilla en reposo inmediatamente antes de la contracción ventricular, en el corazón intacto está dada por el estrés diastólico.6 Por lo tanto la concepción de que la precarga se refiere al volumen no es completamente cierta, si bien está relacionada la precarga se trata específicamente de la longitud miofibrilar en un momento determinado del ciclo cardiaco, cuantificada por el diámetro diastólico.
POSTCARGA
Es la fuerza por unidad de área sectorial que se opone a la contracción ventricular durante el vaciamiento del corazón a los grandes vasos, representada por la ley de Laplace, por lo que se cuantifica mediante el estrés parietal sistólico.6 El estrés parietal sistólico puede deducirse de la ley de Laplace, esta ley indica que el estrés parietal (S) es directamente proporcional a la presión intraventricular (P) y al radio de la cavidad (r) e inversamente proporcional a dos veces el grosor de la pared (2h)6,8.
Si bien se infiere una relación directa entre postcarga y resistencias vasculares, no siempre es así, por ejemplo en la insuficiencia mitral la presión intraventricular esta disminuida por la fuga que existe hacia la aurícula izquierda durante la sístole ventricular por lo tanto la postcarga también estará disminuida sin tomar en cuenta la resistencia vascular sistémica, por lo que se debe tener en claro que la postcarga se refiere a una propiedad del corazón en sí, independiente de las resistencias vasculares.
CONTRACTILIDAD
Es la capacidad intrínseca de la miofibrilla para acortar su longitud independiente de la pre-carga y la post-carga.6
En la práctica clínica la contractilidad es difícil de cuantificar de forma aislada, dado que siempre está relacionada con la precarga y la postcarga, se puede estimar mediante el volumen sistólico final a distintos valores de postcarga es decir que a menor volumen sistólico final a postcargas crecientes mayor contractilidad, ésta estimación se denomina elastansa máxima (Emax). Cabe señalar que la contractilidad no es sinónimo de función ventricular, ya que como veremos más adelante tan solo es uno de los componentes al momento de conceptualizar la IC.
Insuficiencia cardiaca sistólica
Las guías de IC de la AHA la definen como un síndrome clínico complejo que resulta del daño estructural o funcional del ventrículo comprometiendo la eyección o llenado de sangre7. Dado que el llenado ventricular corresponde a la disfunción diastólica considerando conceptos de distensibilidad, rigidez, etc, la IC sistólica se define como sigue:
Es una condición en la que el daño funcional o estructural difuso de la miofibrilla o bien una sobrecarga hemodinámica excesiva, provoca disminución de la fuerza contráctil del corazón (por lo tanto de la fracción de expulsión); y consecuentemente aumentan los volúmenes ventriculares con o sin disminución del gasto cardiaco.6
Insuficiencia cardiaca compensada
La IC una vez desencadenados todos los mecanismos compensadores se restablece el índice cardiaco alcanzando la normalidad. La compensación puede tener una traducción clínica conformándose en la IC compensada sintomática, sin que esto signifique que el paciente se encuentre en choque cardiogénico, es decir que la presencia de síntomas no es sinónimo de IC descompensada; por otra parte si los mecanismos compensadores no promueven una signo sintomatología manifiesta hablamos de IC compensada asintomática6.
Choque cardiogénico
Cuando los mecanismos compensadores no son suficientes para normalizar el índice cardiaco hablamos de IC descompensada, que conlleva hipoperfusión tisular que tiene como consecuencia el compromiso de la microcirculación (unidad fisiopatológica del estado de choque) es decir choque cardiogénico1-6.
Bases moleculares.
Las miocardiopatías, ya sean hipertrófica o dilatada, constituyen una de las principales causas de IC en pediatría, se han establecido rutas que parten de genopatías y que alcanzan explicaciones moleculares traducidas en el "fenotipo" del corazón insuficiente; las cardiopatías congénitas por su parte pueden generar sobrecarga sistólica o diastólica que determina en cualquier caso el inicio de una serie de señales con un fin molecular; a continuación describiremos de forma resumida las principales hipótesis moleculares de la IC10,11.
El equilibrio oxido-reducción juega un papel preponderante en el sentido de que el corazón es un órgano aerobio estricto con consumo alto que puede incrementarse hasta en 4 veces su basal durante el ejercicio. En la IC el incremento en el consumo de oxigeno puede desencadenar en dos vías. Por un lado las especies reactivas de oxigeno que originando ion superoxido lesionan directamente las capas lipídicas celulares de los miocitos al igual que activar señales intracelulares que modifican la concentración de calcio promoviendo apoptosis y fibrosis así como desnaturalización de proteínas contráctiles. Por otro lado el oxido nítrico (ON) que tiene una correlación directa con el metabolismo aerobio miocárdico, en equilibrio cabal genera un efecto protector con la regulación de la apoptosis, maximiza la biodisponibilidad del calcio intracelular, genera vasodilatación capilar a nivel local, es antitrombotico y antiproliferativo. La mantención del equilibrio entre estas vías supone una ventaja en la IC, y su pérdida acentuará la condición insuficiente10,12.
La alteración en las señales de traducción se basan en que una vez que los receptores adrenérgicos (beta 1) se activan se inician una serie de eventos encadenados que a partir de la proteinquinasa C activa a la fosfolipasa C que vía trifosfato de inositol y diacilglicerol promueven salida de calcio del retículo sarcoplásmico activando a la calcineurina, ésta última estimula al factor transcripcional que actuará sobre el núcleo para iniciar la respuesta hipertrófica patológica10,11.
Las alteraciones en el metabolismo del calcio, siendo éste el ion "contráctil" principal, requieren un manejo estricto para balancear de forma exacta el nivel citosólico. Está comprobado que durante la IC el canal membranal L de calcio al igual que el receptor de la rianodina presente en la membrana del retículo sarcoplásmico son disfuncionales, así también el transportador-secuestrador de calcio SERCA-2 que promueve el regreso de calcio del sarcoplasma al retículo sarcoplásmico se inhibe teniendo como resultado un balance neto positivo para éste ion, con escape de calcio durante la diástole alterando la fase de relajación quedando menos calcio en el retículo sarcoplásmico para la siguiente fase sistólica, además de generar un sustrato para arritmias ventriculares malignas por mecanismo de actividad desencadenada10,11.
La función mitocondrial tanto de oxidación de acidos grasos (principal sustrato energético del músculo cardiaco) como del ciclo de acidos tricarboxílicos está alterada teniendo como resultado un déficit de ATP, los agentes promotores de la remodelación ventricular como la angiotensina, la endotelina y la aldosterona entre otros "rotan" el sustrato energético durante la IC haciendo de la glucosa el principal promotor de acetil-CoA para la generación de ATP que comparativamente con los ácidos grasos se encuentra en desventaja10,11,13.
La hipertrofia inadaptativa patológica es la condición previa a la IC, se dice que constituye un prerrequisito para su instalación, siendo la transición entre la hipertrofia fisiológica a la patológica la fase clave que lleva a IC. Se conocen múltiples nexos entre el estrés mecánico y señales intracelulares, entre ellos las integrinas, la proteína B1, el complejo distrofina-distroglucano y el componente MLP de la línea Z, entre otros. Las vías intracelulares que generan hipertrofia adaptativa fisiológica están mediadas por el factor de crecimiento IFG-1 y la hormona del crecimiento a través de la vía PI3K/Akt; por otro lado la hipertrofia inadaptaiva patológica presente en estados mórbidos previos al establecimiento de la IC están mediados por la fosfolipasa C, tomando como vía a la de las proteinkinasas alterando el calcio intracelular por la calcineurina10,11. Sin embargo la vía PI3K/ Akt también ha sido identificada como precursora de hipertrofia patológica en pacientes pediátricos con enfermedad renal crónica14.
Mecanismos compensadores
Una vez que la noxa genera disminución de la fracción de eyección se activan una serie de eventos neurohumorales que tienen como objetivo garantizar un índice cardiaco aceptable pese a la condición de IC. Entre los principales tenemos a los péptidos natriuréticos, el sistema renina-angiotensina-aldosterona y promoción de las reservas sistólica y diastólica. Se han descripto al menos 6 péptidos natriuréticos, sin embargo los más relevantes por su accionar fisiológico son el A, el B y el C. Dado que son promovidos por una función autocrina la importancia está en que son los primeros en activarse ante un volumen diastólico final aumentado e inician su efecto cardiovascular en etapas tempranas de la IC6,15. Las acciones fisiológicas de los péptidos natriuréticos se manifiestan a distintos niveles: renal con incremento del filtrado glomerular y disminución de la reabsorción de sodio, vascular disminuyendo el tono arterial y venoso así como antiproliferativo, cardiaco como lusitrópico y antifibrotico, y sobre sistema nervioso autónomo aumentando el tono vagal y disminuyendo la actividad del sistema renina-angiotensina15. La vida media del péptido natriurético B (BNP) en su forma pro-BNP es suficientemente aceptable para su detección y ser un marcador de falla ventricular izquierda, por lo que independiente de su acción fisiológica contribuye al diagnóstico paraclínico, seguimiento e incluso pronóstico de pacientes con IC de diferentes etiologías15.
La IC clásicamente tiene como manifestación clínica a la descarga neurohumoral, la que básicamente está representada bajo el mecanismo del eje renina-angiotensina-aldosterona. Si bien es un mecanismo compensatorio promueve un círculo vicioso que decrementa progresivamente la fracción de eyección. Una vez que se ajusta el flujo renal se libera renina para incrementar el filtrado glomerular corrigiendo el disbalance de presión glomerular pre y poscapilar, a su vez se estimula la secreción hepática de angiotensina I a partir del precursor angiotensinógeno, la angiotensina I alcanza la circulación pulmonar donde a través de la enzima convertidora se obtiene angiotensina II, quién es el metabolito activo con acción vascular directa; así mismo la liberación de aldosterona por la corteza suprarrenal modifica la absorción tubular distal de agua obteniendo un balance hídrico positivo con lo que los volúmenes de llenado ventricular se incrementan asegurando la reserva diastólica. Tanto la angiotensina II como la aldosterona son actores fundamentales en el remodelamiento cardiaco mencionado anteriormente6,8,9,11,15.
La reserva cardiaca diastólica está fundamentada en el mecanismo de Frank-Starling, mismo que se constituye en el principal mecanismo compensador heterométrico. El mecanismo se basa en que el corazón expele el volumen que recibe, siendo el edema pulmonar el límite de éste mecanismo. Durante el incremento del volumen diastólico final la maquinaria contráctil genera un engrane actina/miosina más estable por lo que la fuerza de contracción es mayor. Éste mecanismo se activa ante la sobrecarga diastólica que puede originarse por valvulopatía principalmente aórtica o mitral, o una disminución de la contractilidad, que tiene como fin común la disminución de la fracción de eyección (insuficiencia cardiaca)6,8,9.
La reserva sistólica tiene varios mecanismos compensadores, entre ellos el incremento de la frecuencia cardiaca (reserva cronotrópica) mediada por el estímulo adrenérgico acentuado secundario de la IC, con lo que aumenta el volumen latido por unidad de tiempo; vale la pena resaltar el efecto Bowditch, mismo que se explica por como el incremento de la frecuencia cardiaca acorta el tiempo de repolarización tardia del potencial de acción limitando el aflujo de ion potasio contrarregulando secundariamente la concentración de ion calcio intracelular mejorando la biodisponibilidad del mismo para su utilización en el proceso exitación-contracción6,16,17.
En las últimas décadas se ha preconizado un efecto inotrópico que se activa de forma aguda y que puede mantenerse presente a largo plazo, es el efecto Anrep. Dicho efecto está dado por un incremento agudo de la postcarga, resultando en dos posibles explicaciones del aumento de la fuerza contráctil, la primera mediada por el sistema de integrinas que ante el estrés parietal desencadenan la señalización molecular intracelular teniendo como resultado mayor liberación de calcio por el retículo sarcoplásmico en sístole, por otro lado el incremento agudo de la postcarga deriva en un estado de insuficiencia coronaria subendocárdica relativa promoviendo la liberación de sustancias endógenas vasodilatadoras como la adenosina generando un incremento del flujo local teniendo como consecuencia mayor fuerza contráctil miocárdica18.
La liberación adrenal de hormonas simpaticomiméticas, en especial la noradrenalina, es uno de los principales mecanismos compensadores durante la disminución de la fracción de eyección (deletéreos a largo plazo), por medio de la vìa Gs/fosfolipasa C a nivel cardiaco1,6,8,9,15.
Etiología
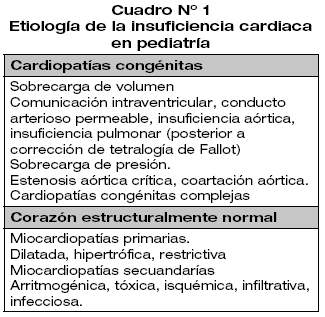
Las causas de IC en pediatría son diferentes a las de los adultos. Las publicaciones de IC en población adulta consignan como principales etiologías a la cardiopatía isquémica, obesidad, diabetes mellitus, síndrome metabólico claramente infrecuentes en la edad pediátrica7. En orden de frecuencia las dos principales causas de IC son las cardiopatías congénitas y las miocardiopatías en especial la dilatada1,3-5,8,9,19,20.
Manifestaciones clínicas
Se debe realizar una interrogación pormenorizada de antecedentes (familiares) así como de la historia de la enfermedad actual, edad de inicio, cardiopatía congénita, medicación reciente, co-morbilidades, etc2.
Cada cardiopatía congénita en su contexto clínico específico tendrá manifestaciones características. Los signos y síntomas están relacionados con la actividad neurohormonal que se desencadena como mecanismo compensatorio6.
Los síntomas respiratorios son habitualmente los que se manifiestan desde un inicio, la disnea/taquipnea son el reflejo de hiperflujo pulmonar en el caso de cardiopatías congénitas con cortocircuito de izquierda a derecha, o de hipertensión venocapilar secundaria a volúmenes de llenado mayores de las cavidades izquierdas propias de la IC (fracción de eyección disminuida) y de la activación del sistema renina-angiotensina-aldosterona, en ambos casos se debe a incremento del estrés diastólico2-5.
La taquicardia y la diaforesis son traducción de la descarga adrenérgica que se presenta durante la fase aguda de la IC. Oliguria puede estar presente como efecto de la activación del sistema renina-angiotensina-aldosterona o como consecuencia de bajo gasto cardiaco2-6.
Si bien en pediatría se sugieren criterios clínicos mayores y menores para el diagnóstico de la IC los avances en el entendimiento de la fisiopatología y respetando definiciones y conceptos antes mencionados, el diagnóstico definitivo debe realizarse en tercer nivel de atención mediante estudios paraclínicos que cuantifiquen la fracción de eyección ventricular ya sea izquierda, derecha, bi o univentricular2-8.

Está claro que la sola cardiomegalia evaluada por rayos X, asociada a dificultad respiratoria, por ejemplo, no necesariamente significa que el paciente se encuentre en IC, aún integrando el diagnóstico clínico y paraclínico de insuficiencia cardiaca según los criterios mencionados, por lo que la fracción de eyección disminuida debe ser documentada por cualquiera de los métodos diagnósticos auxiliares. Por lo tanto los criterios para el diagnóstico de IC en pediatría son una guía para la referencia de un paciente con sospecha de IC a un centro de tercer nivel para confirmar o descartar el diagnóstico1,2,6,8, es decir que la sospecha es clínica y la confirmación se realiza por medios auxiliares de diagnóstico que cuantifiquen la fracción de expulsión.
Es importante realizar un estadiaje de la clase funcional, bajo las directrices de la New York Heart Association (NYHA) para pacientes mayores de 2 años, o la escala modificada de Ross para lactantes (Cuadro 3)1,8,21.
Insuficiencia cardiaca en el recién nacido.
Los recién nacidos con IC representan un grupo especial en cuanto a las manifestaciones clínicas, eventos fisiopatológicos, y respuesta al tratamiento.
Desde luego son más lábiles ya que en caso de cardiopatías congénitas que generan sobrecarga ventricular importante el neonato tiene menor tiempo para llevar a cabo medidas compensadoras, considerando que durante la etapa fetal el gasto ventricular es combinado, esto significa que ambos ventrículos se apoyan ante una determinada sobrecarga debido a que la circulación normal del feto es en paralelo y no en serie. Desde el punto de vista fisiológico el recién nacido se encuentra expuesto a escenarios adversos cuando sobreviene la IC independientemente de la causa; los principales motivos son los siguientes: menor número de unidades contráctiles por superficie corporal, menor masa contráctil (30% en comparación a 70% de la población adulta), disposición desalineada de las sarcómeras, dependencia de aflujo transmembrana para mantener concentraciones adecuadas de calcio (retículo sarcoplásmico inmaduro), pobre respuesta a inotrópicos exógenos por baja biodisponibilidad de receptores adrenérgicos, y la generación de energía a partir de glucosa que es un sustrato que aporta menor número de ATP comparada con los ácidos grasos, mismos que son la fuente principal en edades posteriores1-5,8,9. De hecho la expresión fenotípica "fetal" en el corazón insuficiente de niños en edades mayores o adultos es una hipótesis ampliamente aceptada.
Evaluación de la fracción de eyección.
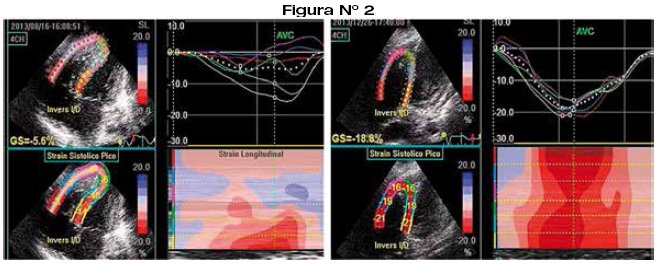
La evaluación de la función ventricular debe individualizarse en cada paciente, ya que debe tenerse en cuenta que varios factores, principalmente la presencia de cardiopatía congénita, pueden modificar la geometría ventricular dificultando la interpretación real de la fracción de eyección ya sea del ventrículo izquierdo, del ventrículo derecho o del univentriculo7-9,22,23. El ecocardiograma es la herramienta incruenta más útil para evaluar la función del ventrículo izquierdo tanto en proyección apical de cuatro cámaras como en el eje paraesternal largo (aplicando modo-M), solo con algunas limitaciones relacionadas con la alteración de la geometría de dicho ventrículo como la edad menor de 5 días (septo interventricular rectificado por patrón fetal residual), movimiento paradójico del septo interventricular, perdida de la movilidad parietal o septal. Sin embargo existen otros parámetros ecocardiograficos que permiten la evaluación como el índice de Tei izquierdo o la excursión del anillo mitral (MAPSE)22. La evaluación dirigida de la función sistólica del ventrículo derecho aún es un desafío por su compleja morfología24. Por ello, es importante la evaluación del ventrículo derecho desde varias proyecciones25-27. Se evalúan la fracción de acortamiento del área del ventrículo derecho28, la excursión sistólica del anillo tricuspídeo (TAPSE)29, el Doppler pulsado tisular del anillo tricuspídeo e índice de performance miocárdico (índice de Tei)29,30.
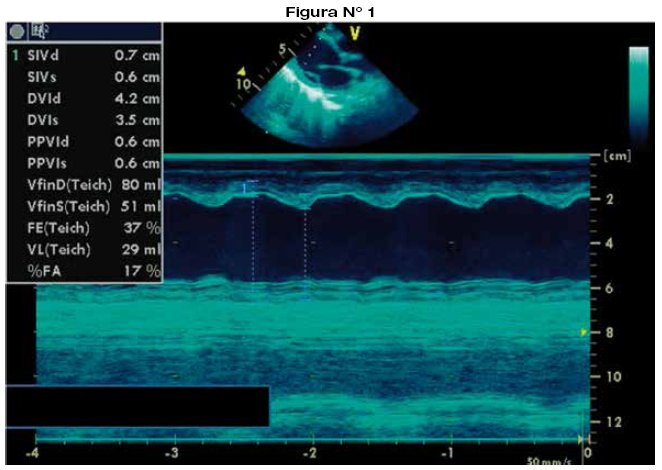
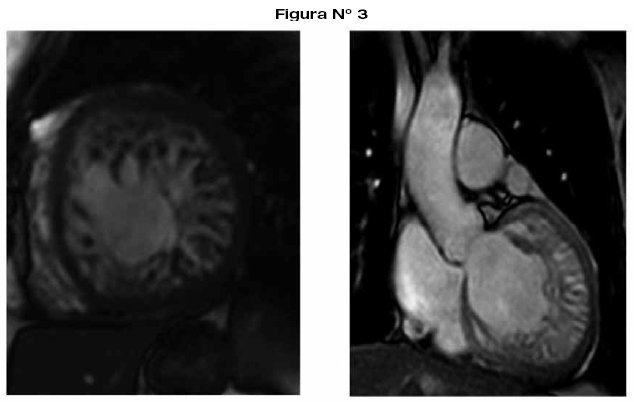
La angiotomografía cardiaca es ideal para la evaluación anatómica en cardiopatías congénitas complejas, y para mejorar el planteamiento quirúrgico y pronóstico24,25,31-33.
La resonancia nuclear magnética es el mejor método para evaluar el volumen del ventrículo derecho, evalúa con precisión el tamaño, la masa, la morfología, y la función, así como flujos valvulares, calculando con el débito, los cortocircuitos y la regurgitación24,25,33
Terapéutica actual de la IC en pediatría.
El tratamiento de la insuficiencia cardiaca en la población pediátrica se centra en la corrección de la causa, del evento precipitante y de la congestión sistémica o pulmonar, buscando mejorar la perfusión tisular34. En la IC crónica el tratamiento el disminuir la congestión pulmonar y/o sistémica, mejora los síntomas, e incrementa la supervivencia.
Terapia farmacológica.
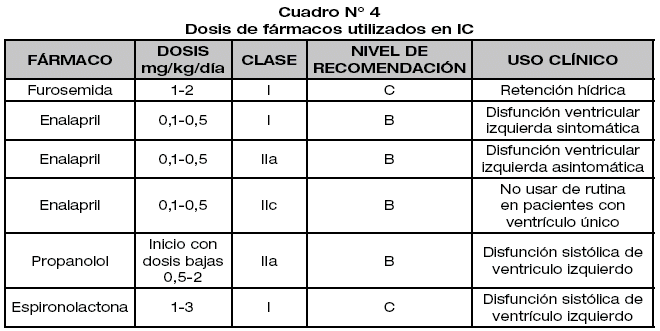
Se utilizan fármacos para reducir la congestión pulmonar y sistémica (diuréticos), aumentar la contractilidad (inotrópicos), reducir la postcarga con vasodilatadores y minimizar el remodelamiento ventricular (beta-bloqueantes, inhibidores de la enzima convertidora de angiotensina). De manera rutinaria se utilizan diuréticos, inhibidores de la enzima convertidora de angiotensina (IECA), beta-bloqueantes e inotrópicos.34
Los diuréticos son agentes de primera línea, están dirigidos a reducir la congestión pulmonar y sistémica, los diuréticos de asa son los de preferencia en el tratamiento de la insuficiencia cardiaca, en situaciones en las que no responden a esta medida se benefician de la adición de una tiazida34,35. Clase I Nivel de evidencia C.23,34
Los digitálicos en adultos se ha demostrado que su uso en la insuficiencia cardiaca disminuye la tasa de hospitalización y mejora la calidad de vida, pero no mejora la supervivencia35. En pediatría es ampliamente usada a pesar de falta de evidencia. Tiene una pequeña ventana de seguridad y no debería usarse en bebes prematuros, aquellos con falla renal o miocarditis aguda34. No está recomendada en niños con disfunción ventricular sistémica asintomática ya que no mejora la probabilidad de supervivencia. Clase I nivel de evidencia C23,36
Los inhibidores de la enzima convertidora de angiotensina actúan como vasodilatadores sistémicos, incrementan la capacitancia venosa, reducen la postcarga y la precarga y mejoran el gasto cardiaco35. Reducen los ingresos hospitalarios y mejora la supervivencia37. Clase I nivel de evidencia B23,34. Se debe considerar que en los pacientes con un solo ventrículo no debe ser de uso rutinario, debiéndose usar en casos específicos como regurgitación valvular o disfunción ventricular. Clase IIb nivel de evidencia B.23
Los antagonistas del receptor de angiotensina II tienen su uso reservado a pacientes con disfunción sistólica ventricular sistémica intolerantes a inhibidores de la enzima convertidora de angiotensina. Clase IIa nivel de evidencia C.23
Los antagonistas de la aldosterona disminuyen la mortalidad en pacientes con falla cardiaca sistólica, su uso es razonable en falla cardiaca crónica sistólica y disfunción sistólica de ventrículo izquierdo en niños asintomáticos. Clase I nivel de evidencia C.23
Los betabloqeuantes, la evidencia no está bien establecida en la población pediátrica, inhiben el remodelado ventricular, tienen efecto antiarrítmico y son vasodilatadores coronarios35. Se considera su uso en niños con moderada a severa disfunción sistólica del ventrículo sistémico, particularmente si el ventrículo sistémico tiene morfología de ventrículo izquierdo23. Los inotrópicos incrementan la contractilidad cardiaca, los más usados, catecolaminérgicos como dopamina, dobutamina, o inhibidores de la fosfodiesterasa como la milrinona o amrinona. La epinefrina y la norepinefrina incrementan la demanda de oxígeno, la milrinona actúa como inotrópico y vasodilatador previniendo bajo gasto cardiaco, debiendo ser usada con precaución en pacientes hipotensos.34 Otro inotrópico prometedor es el levosimendan con acción inotrópica y vasodilatadora, sin efecto beta y sin incremento del consumo de oxígeno.23,34
En el caso de los antiarrítmicos son usados en casos de arritmias que persisten después de la normalización de disturbios electrolíticos o metabólicos y arritmias poco toleradas. Clase IIb nivel de evidencia C.23
El trasplante cardiaco indicado en pacientes en fase final de falla cardiaca, con refractariedad a tratamiento médico o sin opción quirúrgica34. Se ha visto que mejora de la supervivencia a los 5 años (70%) con buena calidad de vida pese a la inmunosupresión.35
REFERENCIAS
1. Hsu D, Pearson G. Heart Failure in Children, Part I: History, Etiology, and Pathophysiology. Circ Heart Fail. 2009;2:63-70. [ Links ]
2. Hsu D, Pearson G. Heart Failure in Children, Part II: Diagnosis, Treatment, and Future Directions. Circ Heart Fail. 2009;2:490-498. [ Links ]
3. Kliegman R, Behrman RE. Tratado de Pediatría de Nelson. Vol 2. 19ª edición. Madrid: Elsevier; 2013.
4. París Mancilla E, Sánchez I, Beltramino D, Copto García A. Meneghello Pediatría. Tomo 1. 6ª edición.Editorial médica Panamericana: Ciudad de México; 2013.
5. Moro Serrano M, Málaga Guerrero S, Madero López L. Cruz Tratado de Pediatría. Tomo 2. 11ª edición. Editorial médica Panamericana: Madrid; 2014.
6. Guadalajara JF. Entendiendo la insuficiencia cardiaca. Arch Cardiol Mex 2006; 76: 431-447. [ Links ]
7. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Drazner MH et al. 2013 ACCF/AHA Guideline for the Management of Heart Failure. JACC. 2013;62:147-239.
8. Kreutzer E. Cardiología y cirugía cardiovascular infantil. Editorial Doyma: Buenos Aires; 1993.
9. Attie F, Calderón J, Zabal C, Buendía A. Cardiología Pediátrica. 2ª edición. Ciudad de México: Editorial médica Panamericana; 2013. [ Links ]
10. Rodriguez-Perez JM, Gallardo GJ, Vargas-Alarcón G. Bases moleculares de la insuficiencia cardiaca. Arch Cardiol Mex 2006;76: 10-17. [ Links ]
11. Eng-Ceceña L. Biología molecular de la insuficiencia cardiaca. Arch Cardiol Mex 2007; 77: 94-105. [ Links ]
12. Cotton JM, Kearney MT, Shah AM. Nitric oxide and myocardial function in heart failure: friend or foe?.Heart.2002; 88: 564-566. [ Links ]
13. Rosca M, Hoppel C. Mitochondrial dysfunction in heart failure. Heart Fail Rev. 2013; 18: 1-25. [ Links ]
14. Alhaj E, Alhaj N, Rahman I, Niazi T, Berkowitz R, Klapholz M. Uremic Cardiomyopathy: An Underdiagnosed Disease. Congest Heart Fail. 2013;19: 40-45. [ Links ]
15. Pandit K, Mukhopadhyay P, Ghosh S, Chowdhury S. Natriuretic petides: Diagnostic and therapeutic use. Indian J Endocrinol Metab. 2011;15:345-353. [ Links ]
16. Lakatta EG. Beyond Bowditch: the convergence of cardiac chronotropy an inotropy. Cell Calcium.2004;35:629-42. [ Links ]
17. Ker J, Akad L. From Bowditch to beta-blockers: evolution of the understanding of the importance of heart rate and myocardial energetics in cardiomyopathy. Cardiovasc J Afr. 2009;20: 37-38. [ Links ]
18. Lupi-Herrera E, Santos-Martínez L, Figueroa-Solano J, Sandoval-Zárate J. La autoregulación homeométrica. El efecto Anrep. Su posible importancia en la patofisiología en los aumentos de la postcarga del ventrículo derecho. Arch Cardiol Mex. 2007; 77: 330-348. [ Links ]
19. Cruz R, Herrera J, Burgoa J, Vargas C. Coartación aórtica crítica: aortoplastía percutánea con balón. Reporte de un caso. Rev Soc Bol Ped. 2015;54:10-3. [ Links ]
20. Burgoa J, Patiño E, Trujeque AL, Herrera J. Flutter auricular atípico en un niño con corazón estructuralmente sano. Rev Soc Bol Ped. 2014;53:71-4. [ Links ]
21. Rosenthal D, Chrisant MR, Edens E, Mahony L, Canter C, Colan S, et al. International Society for Heart and Lung Transplantation: practice guidelines for management of heart failure in children. J Heart Lung Transplant. 2004;23:1313-33. [ Links ]
22. Diaz Gongora G. Cardiología pediátrica. Ciudad de México: Editorial McGraw Hill; 2003. [ Links ]
23. Kirk R; Dipchand AI; Rosenthal DN; Addonizio L; Burch M; Chrisant M et al. The International Society of Heart and Lung Transplantation Guidelines for the management of pediatric heart failure: Executive summary. J Heart Lung Transplant. 2014; 33(9):888-909.
24. Herrera J, Burgoa J, Mijangos R, Cruz R, Sanchez C. Evaluación de la función ventricular derecha con técnicas avanzadas previa y posterior a la corrección quirúrgica de la tetralogía de Fallot. Rev Pac Cardiol. 2011; 7: 13-23. [ Links ]
25. Herrera J, Burgoa J, Cruz R, Mijangos R, Buendía A, Calderón J. Ventrículo no compacto en cardiopatía congénita, Instituto Nacional de Cardiología (enero 200 a diciembre del 2012) revisión de 36 casos. Rev Pac Cardiol. 2011; 7: 32-47. [ Links ]
26. Davlouros PA, Niwa P, Webb G, Gatzoulis MA. The right ventricle in congenital heart disease. Heart. 2006; 92:27-38. [ Links ]
27. Murata I, Sonoda M, Morita T, Nakamura F, Takenaka K, Nagai R. The clinical significance of reversed flow in the main pulmonary artery detected by doppler color flow imaging. Chest. 2000;118:336–41.
28. Anavekar NS, Gerson D, Skali H, Kwong RY, Yucel EK, Solomon SD. Two-dimensional assessment of right ventricular function: an Echocardiographic-MRI correlative study. Echocardiography.2007;24:452-6. [ Links ]
29. Mor-Avi V, Lang RM, Badano LP, Belohlavek M, Cardim NM, Derumeaux G, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography. Eur J Echocardiogr. 2011;12:167-205. [ Links ]
30. Ueti OM, Camargo EE, Ueti Ade A, de Lima-Filho EC, Nogueira EA. Assessment of right ventricular function with Doppler echocardiographic indices derived from tricuspid annular motion: comparison with radionuclide angiography. Heart. 2002; 88: 244-8. [ Links ]
31. Tei C. New non-invasive index for combined systolic and diastolic ventricular function. J Cardiol. 1995;26:135-6. [ Links ]
32. Tei C, Nishimura RA, Seward JB, Tajik AJ. Noninvasive Doppler-derived myocardial performance index: Correlation with simultaneous measurement of cardiac catheterization measurements. J Am Soc Echocardiogr. 1997;10:169-78. [ Links ]
33. Calderón J. Métodos diagnósticos en las cardiopatías congénitas. Arch Cardiol Mex. 2006;76:152-56. [ Links ]
34. Jayaprasad N. Heart failure in children. Heart Views 2016;17:92-9. [ Links ]
35. Gómez E, Tejero MA, Pérez JL. Tratamiento actual de la insuficiencia cardiaca pediátrica. Cardiocore. 2013;4 8(1):12–16.
36. Shaddy RE, Boucek M, Hsu D, Boucek RJ, Canter CE, Mahony L, et al. Carvedilol for Children and Adolescents With Heart Failure. A Randomized Controlled Trial. JAMA. 2007;298(10):1171-1179.
37. Dickstein K, Cohen-Solal A, Filippatos G, McMurray J, Ponikowski P, Poole-Wilson PA, et al. Guía de práctica clínica de la Sociedad Europea de Cardiología (ESC) para el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica. Rev Esp Cardiol. 2008;61(12):1329.















