Services on Demand
Journal
Article
Indicators
-
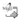 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
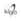 Similars in
SciELO
Similars in
SciELO
Share
Revista Médica La Paz
On-line version ISSN 1726-8958
Rev. Méd. La Paz vol.20 no.2 La Paz 2014
CASO CLÍNICO
DIAGNÓSTICO PRENATAL INTEGRAL DE SÍNDROME DE DOWN EN LA PAZ- BOLIVIA, CORRELACIÓN SÉRICA, ECOGRÁFICA, CITOGENÉTICA Y MOLECULAR
A PROPÓSITO DE UN CASO
INTEGRAL PRENATAL DIAGNOSIS OF DOWN SYNDROME IN LA PAZ - BOLIVIA, SERUM, ULTRASOUND, CYTOGENETIC AND MOLECULAR CORRELATION
Dra. Beatriz Luna Barrón(i), Dr. Gonzalo Taboada López(ii), Dra. Ana Rada Tarifa(iii), Dra. Erika Lafuente Álvarez(vi), Dr. José Liders Burgos Zuleta(v), Lic. Ruddy Luna Barrón(vi), Dra. Carmiña Heidy García Rodríguez(vii), Dra. Daneyba Lourdes Calderón Guzmán (viii), Lic. Emma Tórrez Tola(vi), MSc. Karina Salazar(vi).
(i) Médico Genetista. Docente Investigador. Instituto de Genética. Universidad Mayor de San Andrés.
(ii) Médico Genetista. Docente Investigador Emérito. Instituto de Genética. Universidad Mayor de San Andrés
(iii) Bioquímica Farmacéutica. Asistente Investigación I. Instituto de Genética. Universidad Mayor San Andrés.
(vi) Bioquímica Genetista. Asistente de Investigación I. Instituto de Genética. Universidad Mayor de San Andrés
(v) Médico Imagenólogo. Caja de Salud de la Banca Privada. Centro de Imagen Médica Avanzada.
(vi) Investigador. Instituto de Investigaciones Técnico Científicas de la Universidad Policial.
(vii) Docente-Investigador, Responsable laboratorio. Instituto SELADIS. Universidad Mayor de San Andrés
(viii) Bioquímica - Asistente Laboratorio. Instituto SELADIS. Universidad Mayor de San Andrés
Correspondencia: Dra. Beatriz Luna Barrón. E_mail: blunab3@gmail.com
RESUMEN.
El Síndrome de Down es una enfermedad genética causada por trisomía del par 21. Actualmente existe la posibilidad de ofrecer diagnóstico prenatal de esta entidad mediante procedimientos no invasivos como la medición de hormonas maternas específicas durante el 1er y 2do trimestre de gestación y el estudio ecográfico del feto en busca de malformaciones, así como a través de procedimientos invasivos (amniocentesis) para cariotipo fetal o pruebas moleculares dirigidas. El diagnóstico prenatal se basa en la utilización conjunta de estos marcadores más la edad materna para evaluar el riesgo en un feto de tener anomalías congénitas (síndrome de Down y otros). La presente investigación describe la utilidad de la correlación sérica, ecográfica, citogenética y molecular de los marcadores prenatales de síndrome de Down. Se trata de una paciente de 21 años primigesta (16 semanas de gestación) con datos séricos y ecográficos compatibles con una cromosomopatía, la amniocentesis diagnóstica permitió obtener material genético del feto para análisis citogenético y caracterización molecular, con un cariotipo 47,XY,+21. De manera que se ilustra la relevancia de la evaluación integral en el diagnóstico prenatal, así como el enfoque multidisciplinario.
Palabras clave: Síndrome de Down, Diagnóstico prenatal.
ABSTRACT
Down syndrome (DS) is a genetic disease caused by 21 chromosome, we have now the possibility to offer prenatal diagnosis by non-invasive procedures such as: serum measurement of maternal hormones during the first and second trimester of pregnancy and the fetus ultrasound study searching for malformations, and by invasive procedures like amniocentesis for fetal karyotype or directed molecular test. Prenatal diagnosis is based on combined use of these markers to assess the risk of having fetus with congenital abnormalities (Down syndrome and others). We describe the utility of serum, ultrasound, cytogenetic and molecular correlation like markers of prenatal Down syndrome. The case of a 21 year old female primigravida with 16 weeks pregnancy and serum plus ultrasound data consistent with a chromosomal abnormality. Diagnostic amniocentesis was performed also to obtain fetal genetic for cytogenetic study and molecular characterization), with a fetal karyotype 47,XY,+21. Therefore, importance of comprehensive assessment in prenatal diagnosis and the multidisciplinary approach.
Keywords: Down syndrome, prenatal diagnosis.
INTRODUCCIÓN
El Síndrome de Down (SD), descrito desde 1966 es una entidad genética debida a la presencia de tres cromosomas del par 21 (Trisomía 21). Su frecuencia es de 1 en 600-800 recién nacidos vivos(1). Los signos clínicos más frecuentes son: hipotonía al nacimiento (80%), piel redundante en cuello (80%), facies achatada (90%), fisuras palpebrales oblicuas hacia arriba (80%), pabellones auriculares de baja implantación, y/o displásicos (60%) (13), pliegue palmar único transverso, cardiopatía congénita (40-50%) tipo CIA o CIV, retraso del desarrollo psicomotor y retraso mental.
Aproximadamente 15% de los pacientes institucionalizados por deficiencia mental presentan SD. La mayor parte de las trisomías 21 acaban en aborto espontáneo, por lo que los casos de SD observados son los que llegan a término(1). Idealmente debe diagnosticarse en los primeros días de nacido(a) por correlación fenotípica aunada a cariotipo en sangre periférica con la intención de esclarecer su mecanismo de producción como ser: Trisomía libre (94%), translocación (3-4%) y mosaícismo (2-2.5%)(2,13). Hoy en día se realiza diagnóstico prenatal (DPN) de SD. El DPN, inicia con el cálculo de riesgo en base a edad materna y puede ser modificado por antecedentes maternos, búsqueda intencionada de marcadores ecográficos sugestivos de cromosomopatía y el análisis de los marcadores bioquímicos de 1er y 2do trimestre, siendo el cariotipo el que proporciona el diagnóstico definitivo(15). Entre las semanas 11 a 13.6 de gestación, la medición de translucencia nucal (TN) es un indicador precoz de SD con una sensibilidad del 69-72%(4) ya que se encuentra incrementada en 20 a 45% de fetos con SD(17), junto a otros marcadores como la hipoplasia o ausencia de huesos propios de la nariz (65% de fetos con SD(17)) , por su parte la cuantificación de valores séricos maternos de Proteína A asociada al embarazo (PAPP-A) y de fracción beta de gonadotrofina coriónica (B-HCG), muestra un patrón característico en gestaciones con SD (cuadro N° 1), con una sensibilidad de 65-68% si se evalúan juntos(4,17) y tasa de falsos positivos del 4,6%(4,17). La evaluación integral de edad materna, TN, PAPP-A y la B-HCG tiene una sensibilidad de 90-95%(4,17) y tasa de falsos positivos del 5% (semana 9 a 11). Durante las semanas 14 a 20 de gestación la cuantificación de valores séricos de alfafetoproteína (AFP), Gonadotrofina coriónica (HCG) y Estriol no conjugado (uE3) permiten una detección del 85%(4), sumados otros marcadores ecográficos de aneuploidias (cardiopatía, intestino hiperecogénico, fémur corto, etc.) llevan a una sensibilidad de 90%(4). El DPN con métodos invasivos como la Amniocentesis diagnóstica se realiza para obtener células fetales y realizar un cariotipo y/o estudios moleculares. Estos estudios son confirmatorios de una cromosomopatía específica, siendo más sensible y específico el cariotipo, mientras que la caracterización molecular de regiones altamente polimórficas del ADN (repeticiones cortas en tandem STR's) es más rápida. Un diagnóstico precoz de SD permite la orientación a la familia sobre el estado de salud fetal.
MATERIAL Y MÉTODOS
a) Ecografía (Ultrasonido): Marcadores ecográficos de 1er Trimestre
Fundamento: Procedimiento no invasivo basado en la emisión de ondas de ultrasonido y respuesta de ecos que muestran al producto en una imagen en tiempo real y bidimensional o tridimensional.
Procedimiento: Se obtiene imagen en eje longitudinal para medir la longitud craneo-caudal (LCC). Se realiza acercamiento (zoom) hasta posicionar la cabeza, cuello y el tercio superior del tórax. Se mide la TN desde el borde interno posterior al borde interno anterior. El hueso propio de la nariz debe seguir desde la región frontal inferior hasta la boca como imagen ecogénica continua. La medición del ductos venoso con Doppler color observando la sístole, la onda "a" positiva, ausente o negativa y la diástole de características normales, la muesca del Doppler pulsado debe medir 0.5-1mm.
b) Estudios séricos maternos: Marcadores Séricos
Proteína Asociada a Embarazo (PAPP-A). Glicoproteína de alto peso molecular. Producida el trofoblasto. Los niveles de PAPP-Aen el suero materno se elevan en forma constante con la edad gestacional.
Gonadotrofina Coriónica Humana fracción (B-HCG). Glicoproteina de dos cadenas: alfa y beta. La subunidad beta es específica y le confiere su actividad biológica.
Alfa Feto Proteina (AFP): Cadena glicoproteíca de 70000 Dalton, su concentración decrece rápidamente después del nacimiento. La medición de sus concentraciones es clínicamente valiosa para detectar DTN fetal abierto y otras anomalías fetales(12).
Gonadotrofina Coriónica Humana (HCG). Hormona glicoproteica. Se encuentra en la sangre y orina durante el embarazo. Alcanza niveles de 2000 mUI/ml un mes después de la concepción. En el 3er mes alcanza un pico de 100 000 mUI/ml, produciéndose luego un decaimiento gradual.
Estriol no Conjugado (uE3). Hormona esteroidea cuya producción aumenta, casi triplicándose en el último trimestre. Con una subida alrededor de la 6ta semana.
Procedimiento: Obtención de sangre materna por venipuntura, separación del suero por centrifugación. Determinación por quimioluminiscencia (ensayo enzimático inmunometrico), en fase sólida, recubierta de anticuerpos monoclonales o policlonales reconocidos por los reactivos que contienen antígenos monoclonales o policlonales. La enzima reacciona con el sustrato quimioluminiscente para obtener la cuantificación.
c) Amniocentesis Diagnóstica.
Fundamento. Procedimiento invasivo de DPN basado en la obtención de líquido amniótico (LA) mediante punción guiada por ecografía en semana 16 para estudios en las células fetales (cariotipo, estudios moleculares).
Procedimiento. Previa ecografía de control pre-aminocentesis, paciente en decúbito dorsal pasivo, antisepsia de región abdominopélvica, colocación de campos estériles, marcaje de región de punción, con guía ultrasonográfica se introduce aguja de amniocentesis hasta cavidad amniótica, aspiración 20 a 27 mL de LA en jeringas estériles identificadas.
d) Cariotipo en liquido amniótico: Estudio Citogenético
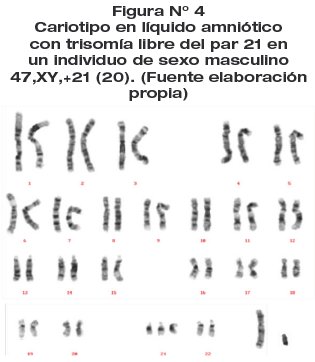
Fundamento. El cariotipo es la constitución cromosómica de un individuo, correspondiente al análisis en número y estructura de los cromosomas. La carga cromosómica normal para humanos es 46,XX en mujeres y 46,XY en varones.
Procedimiento. Obtenida la muestra de LA, es sembrada en medio de cultivo comercial, a los 9 a 20 días de cultivo las células se detienen en metafase, se tratan con solución hipotónica para liberar los cromosomas. Luego estos son fijados y extendidos en un portaobjetos para someterlos a tinción con bandas CTG, para su posterior análisis.(6)
e) Caracterización Molecular de Trisomía 21: Prueba Molecular.
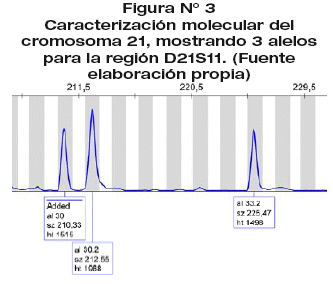
Fundamento. La heterogeneidad del marcador D21S11 permite determinar el número de copias. Una muestra diploide normal tiene dos de cada cromosoma somático, los dos alelos del marcador D21S11 son determinados por electroforesis capilar como dos picos en una razón 1:1. La observación de un alelo de STR extra (tres picos) en una razón 1:1:1 o 2:1 o 1:2 (2 picos) indica una secuencia adicional, como en la trisomía 21.
Procedimiento. La muestra de LA fue sometida a extracción química de ADN total por precipitación salina y deshidratación. Los extractos se verificaron por electroforesis en agarosa y cuantificados por espectrofotometría UV. Aislamiento y caracterización del marcador D21S11 por amplificación enzimática multiplex bajo estringencia controlada por temperatura (PCR). Los productos resultantes se caracterizaron por su peso molecular mediante electroforesis capilar y detección de fluoróforos por láser.
DESCRIPCIÓN DEL CASO
Primigesta de 21 años, en 1er trimestre de gestación, sin antecedentes familiares, ni antecedentes patológicos, sin datos de exposición a teratógenos. Se realizó ecografía obstétrica que reportó: Producto único vivo, reactivo con movimientos espontáneos, fetocardia 162 latidos por minuto. LCC de 81 mm (13,4 semanas de gestación acordes a FUM), TN de 4,3 mm aumentada de tamaño (a 3.10 Múltiplos de la mediana "MoM", > p95), hueso nasal hipoplásico y ductus con onda "a" invertida (fig.1 y 2).
Datos altamente sugestivos de patología cromosómica tipo SD. Los marcadores séricos (PAPP-A y B-HCG) mostraron patrón de SD. (Cuadro N° 1).

Estos datos sumados a la edad y otros antecedentes antropométricos reportaron una probabilidad de trisomia 21 mayor a 1:50 (análisis estadístico software PR 5.0), al igual que para trisomia 13 y trisomia 18 mayor a 1:50 (software PR 5.0), datos por encima del punto de corte (1:255). Se decidió continuar con DPN integrado, se realizaron marcadores de cromosomopatía de 2do trimestre (AFP,uE3 y HCG) que evidenciaron patrón para SD. Mostrando una probabilidad de trisomía 21 de 1:190 (alto) (punto de corte 1:255), riesgo de trisomia 18 y13 a 1:1535, y riesgo bajo para DTN (software PR 5.0).

Previo asesoramiento genético y consentimiento informado se realizó amniocentesis en semana 16 de gestación. Se obtuvo 27 mL de LA, 20 mL se utilizaron para cariotipo y 5 mL para prueba de caracterización molecular del cromosoma 21, (2 mL iniciales descartados para reducir riesgo de contaminación feto-materna).
La prueba molecular a las 72 hrs de estudio mostró la presencia de los alelos 30, 30.2 y 33.2 para el marcador D21S11 con una altura umbral de 1515, 1968 y 1498 rfu, presentando una proporción 1:1:1, correspondientes a 3 STR's distintos para la región D21S11, evidenciando la presencia de tres cromosomas 21 (Trisomía 21). (Figura 3).
El cariotipo con bandeo CTG (Fig. 4) en células de LA (a los 15 días de estudio) fue: 47,XY,+21[20], revelando la presencia de tres cromosomas del par 21 en 20 células metafásicas cuantificadas, correspondiente a una trisomía libre del cromosoma 21 en un producto de sexo masculino. Confirmando el diagnóstico SD por trisomía libre in útero (18 semanas de gestación).
CONCLUSIÓN
Este caso corresponde a un individuo (in útero) de sexo masculino con trisomía libre del par 21 de 18 SDG (probablemente producida por no disyunción cromosómica del par 21) en una madre gestante joven (21 años). Los datos aportados por los marcadores no invasivos de SD son importantes para orientar hacia la necesidad de realizar amniocentesis, sobre todo en aquellos grupos de mujeres gestantes que no se consideran de riesgo como la paciente.
La realización de diagnóstico prenatal de SD requiere la evaluación conjunta de manera que podamos precautelar el estado de salud materno - fetal, existiendo una correlación importante entre los métodos de diagnóstico.
DISCUSIÓN
El SD es la causa genética más frecuente de retraso mental en la población en general, en Bolivia se constituye el 10.45% de los casos con discapacidad intelectual(5), por lo que la realización de un diagnóstico precoz permite prevenir complicaciones asociadas y/o reducir el impacto de ellas al dar la atención necesaria desde las primeras etapas de vida al individuo con trisomía 21.
Como se vio en este caso el SD no es una entidad exclusiva de madres añosas, puede presentarse tanto en una gestante de 15 años como en una gestante de 48 años, ya que existen otros factores de riesgo como la deficiencia de folatos, la presencia de genes vinculados a la no disyunción cromosómica en la meiosis materna(16). Sin embargo se ha observado una mayor frecuencia en madres mayores de 35 años, incrementando de manera importante el riesgo por quinquenios maternos(4,6,16).
El marcador más precoz y con mayor poder de detección es la medición ecográfica de TN que se presenta por encima de 2 MoM en el 65% de los casos de fetos con SD(4) (como en este caso que fue el indicador inicial para la sospecha diagnóstica) y orienta además hacia otras patologías como malformaciones cardiovasculares, anomalías cromosómicas y otras malformaciones congénitas (onfalocele, displasias óseas, errores innatos del metabolismo), por lo que su correcta medición en semana 11 a 13.6 de gestación es muy importante. Por su parte los marcadores séricos constituyen otro pilar fundamental en DPN y deben ser parte del apoyo diagnóstico.
La realización de DPN invasivo debe reservarse para aquellos casos en los que las pruebas no invasivas muestren un riesgo alto de cromosomopatía. La caracterización molecular del cromosoma 21 es un método diagnóstico altamente sensible y reduce tiempo de entrega de resultados (48 a 72 hrs), sin embargo no descarta otras anomalías cromosómicas (numéricas o estructurales) o malformaciones congénitas y no esclarece el mecanismo de producción, por lo tanto debe realizarse junto al cariotipo en amniocitos para tener un diagnóstico completo.
El DPN de SD debe ser INTEGRADO, involucrando la participación de un equipo multidisciplinario y la realización sistematizada de pruebas pertinentes en cada caso, es importante recomendar que todas las mujeres embarazadas (independientemente de su edad) durante la primera mitad del embarazo tengan acceso a una prueba de tamiz prenatal(14) y hay que considerar que toda mujer con menos de 18 SDG debe recibir Asesoramiento Genético adecuado respecto a ventajas y limitaciones de las pruebas de DPN, así como la disponibilidad de métodos invasivos(14), ya que, el DPN tiene una relevancia importante para la detección y manejo oportunos de un feto con algún problema para contribuir a mejorar su supervivencia y calidad de vida postnatal, así como ofrecer una adecuada preparación psicológica a la familia (17).
REFERENCIAS
1. Delgado A, Galán E, Lapunzina PD, Guillén-Navarro E, Penchaszadeh VB, Romeo CM, et al. Asesoramiento Genético en la Práctica Médica. Madrid: Ed. Médica Panamericana. 2012; 211-237.
2. kolgecl S, Kolgecl J, Mehmedall A, Shala-Beqira R, Gashi Z, Sopjani M. Cytogenetic study in children with Down syndrome among Kosova Albanian population between 2000 and 2010. 2013; 25(2): 131-135.
3. Van Gutetal. Prenatal Medicine. Ed. Taylor y Francis. 2006
4. Nicolaides et al. Ultrasonido de 11-13+6 semana. Fetal medicine fondation. 2004. 7-74
5. Taboada N, Licea MA, Acosta O. Caracterización clínico genética del síndrome Down en el Estado Plurinacional de Bolivia. Revista cubana de Genética Comunitaria. Vol. 5 No. 3 Septiembre-Diciembre 2011
6. Nussbaum R, Mclnnes R, Williard H., Genética en Medicina. 5a ed . Barcelona. España: Masson;2004. p. 143-146.
7. Henning B. Boldt,, Cheryl A. Conover. Characterization of four human pregnancy-associated plasma proteins. Am J Obstet Gynecol 1974; 118:223-236. [ Links ]
8. Norman RJ, Buck RH, De Medeiros SF. Measurement of human chorionic gonadotropin indications and techniques for the clinical laboratory 1990; 27:183-94.
9. Crandall BF. Alpha-fetoprotein: a review. CRC Crit Rev Clin Lab Sci 1981: Sept: 127-85; Snd Report of the Collaborative Study on Alpha-Fetoprotein in Relation to Neural Tube defects. Ammniotic fluid alpha-fetoprotein measurement in antenatal diagnosis of an encephaly and open spina bifida in early pregnancy. Lancet 1979:351.38 [ Links ] [ Links ]
10. Gauthier RJ. Griego BD Goebelsmann U. Estriol in pregnancy VII Unconjugated plasma estriol in prolonged gestation. Amer Obstetgynecol 1981;139:382-89. [ Links ]
11. Distler W, et al Estriol in pregnacy; Unconjugated and total plasma estriol in the management of pregnant diabetic patients Amer Obstet gynecol1978;130:424-31
12. Haddow JE, et al. Fetal Disorders associated with elevated MSAFP values. Foundation Blood Res 1990:1.
13. Jones KL. Smith's Recognizable Patterns of Human Malformation. 6ta ed. Elsevier. 2006.
14. Mayen DG. Grether P. Aguinaga M. Tamiz genético prenatal: marcadores bioquímicos de primer y segundo trimestre. Colegio Mexicano de Especialistas en Ginecología y Obstetricia.. Guía de práctica clínica. 2008, 41-58. [ Links ]
15. SOGC Clinical Practice guideline. Summers Anne. North York ON Silvie Langlois. Et al. Prenatal Screening for fetal aneuploidy. Feb 2007. No 187. 147-161.
16. Taboada G., Lafuente E., Rada A. Estudios Bolivianos, Instituto de Estudios Bolivianos. : Síndrome de Down y edad materna: Estudio de corte transversal realizado en La Paz. 2014. 134-141.
17. Diagnóstico prenatal de síndrome de Down. México: Secretaria de Salud, 2011.














