Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Nova
On-line version ISSN 1683-0789
RevActaNova. vol.10 no.1 Cochabamba Mar. 2021
Artículo Científico
Acetato de celulosa a partir de Viguiera tucumanensis
Cellulose acetate from Viguiera tucumanensis
Carolina Herrera Huiza, David Amurrio Derpic
CICEI, Universidad Católica Boliviana, Unidad Académica de Cochabamba, c Márquez s/n esq. Plaza Trigo.
Recibido: 24 de enero 2021
Aceptado: 23 de febrero 2021
Resumen: Acetato de celulosa fue sintetizada a partir de celulosa extraída de la especie endémica V. Tucumanensis. Los reactivos necesarios para la acetalización como SOCl2, SO3 fueron sintetizados a partir de sustancias obtenidas localmente. El acetato de celulosa fue formulado ajustándolo con diferentes proporciones de glicerina, obteniéndose finalmente un plástico flexible, con una densidad de 1.05 ± 0.1 g/cm3, humedad de 6.19 ± 0.24%, absorción de agua de 8.26 ± 0.2%, elongación de 2.25% (bajo una fuerza de 0.147 N durante 6 dias a 20°C, correspondiendo a un módulo de elasticidad de 0.0075 kg/cm2), y una biodegradabilidad por composteo correspondiendo a una pérdida en peso del 8.71% al cabo de 5 días.
Palabras clave: acetato de celulosa, síntesis cloruro de tionilo, Viguiera tucumanensis
Abstract: Cellulose acetate was synthesized from cellulose extracted from an endemic species, V. Tucumanensis, Reagents required for the acetalization like SOCl2, SO3 were synthesized starling from common over the counter substances. The resulting product was formulated with different proportions of glycerin until a flexible product was obtained and characterized as having 1.05 ± 0.1 g/cm3 density, 6.19 ± 0.24% humidity, 8.26 ± 0.2% water absorption, 2.25% elongation (under 0.147 N at 20°C for 6 days, equivalent to a 0.0075 kg/cm2 elasticity modulus), and 8.71% weight loss biodegradability under composting conditions.
Keywords: Cellulose acetate, thionyl chloride synthesis, Viguiera tucumanensis
1 Introducción
La producción mundial de plástico en 2018 casi alcanzó las 360 106 toneladas (plasticseurope 2018) muy cerca por lo tanto del millón de toneladas diarias. El impacto ambiental relacionado con la limitada reciclabilidad, larga persistencia, generación de micro-plásticos y el eventual incremento de CO2 han sido objeto de numerosos estudios. En contraparte, se estima que la naturaleza sintetizó 238.4 109 toneladas de celulosa/año (662 veces más que los plásticos), equivalente a 104.9 Pg carbono/año con un aporte neto nulo al CO2 del aire puesto que forman parte de un ciclo natural.
La mayor producción de celulosa corresponde a la zona de los trópicos con un equivalente de 0.9 kg de celulosa/m2/año (Field et al. 1998, Duchesne et al. 1989) con obvias variaciones locales relacionadas a cantidad de lluvia, disponibilidad de micronutrientes y otros factores. Debido a la acumulación de gases de efecto invernadero se estima que en el futuro no muy lejano abandonaremos la matriz petróleo por una matriz bioorgánica para obtener la sustancias que la sociedad requiere. El desafío que enfrentamos a presente entonces consiste en aprovechar la mayor cantidad de biomasa, sin afectar negativamente las áreas de cultivo para alimentos ni incidir sobre la vida silvestre para identificar y generar de manera eficiente, los compuestos básicos necesarios para sintetizar la extensa gama de productos que la sociedad requiere. Existe una muy grande y rica literatura científica sobre la celulosa, sus derivados y aplicaciones (Klemm et al. 2005, Kontturi et al. 2006, Marcì et al. 2006, Liebert et al. 2007, Roy et al. 2009, Moon et al. 2011, Heinze et al. 2001, Crpy et al. 2009, Habibi et al. 2010,Jedvert et al. 2017, Abdul Khalil et al. 2012). Para el presente trabajo, nos limitamos al acetato de celulosa.
La zona donde se desarrolló el presente trabajo corresponde a los valles interandinos que, aunque incluido en la zona de los trópicos, se caracterizan por ser relativamente áridos y con tierras relativamente pobres. Se encontró en la zona que una de las especies preponderantes es Viguiera tucumanensis, una planta anual que puede llegar a 2.5 m de altura de la familia Asteraceae. Esta planta crece en terrenos abandonados, rocosos y no aptos para el cultivo y no existen a nuestro conocimiento estudios sobre la conveniencia de emplearla como fuente de celulosa. Un problema adicional que se enfrentó fue la dificultad de adquirir cloruro de tionilo (SOCl2), un reactivo común, pero con problemas de transporte puesto que reacciona con agua para liberar SO2 y HCl, razón por la cual no puede ser transportada por vía aérea. En este trabajo evaluamos diversas estrategias sintéticas para obtener SOCl2.
2 Síntesis de SOCl2
A pesar de ser un reactivo bastante común, la mayor parte de la información concerniente a su preparación está consignada en patentes industriales, a menudo en fase gaseosa, y por ende de limitada utilidad práctica. Opciones para su síntesis a escala de laboratorio han sido discutidas sobre todo en diversos foros virtuales (Versuchschemie.de, sciencemadness.org, chemicalforums.com), las mismas que han sido recopiladas en algunas publicaciones (i.e. Lerner 2011). Una revisión de la literatura técnica y científica revela 6 grandes vías sintéticas para preparar cloruro de tionilo, descritas a continuación:
2.1 Reacción entre SO3 y SCl2
![]()
Típicamente en fase gaseosa y publicado bajo forma de patentes (Edwards 1944, Jonas et al. 1956, Salzenberg et al 1947).
Según la patente considerada, las diferentes especies químicas son introducidas bajo forma de precursores (p. ej. ácido sulfúrico humeante H2SO4/SO3 que genera SO3, etc.) y consideran el uso de un exceso de cloro para oxidar el SO2 en SO3 y así incrementar el rendimiento.
![]()
Variaciones patentadas de la reacción básica consideran el uso de precursores a los reactivos básicos o realizan combinaciones lineales de reacciones que generan los mismos y aprovechan condiciones de equilibrio como en los casos de Jonas et al (1956), Edwards (1944) y Beanblossom (1930):
Jonas:

Edwards (70% oleum SO3):
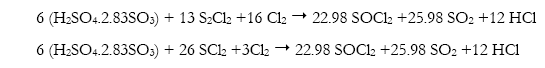
Beanblossom :
![]()
2.2 Reacción entre óxidos de azufre y cloruros de fósforo
El carácter fuertemente oxofílico del fósforo empuja reacciones como:
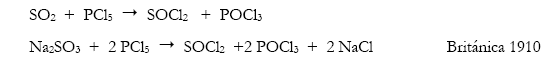
La reacción entre PCl3 y SO2Cl2 también produce cloruruo de tionilo pero también se encontraron problemas en la separación de los productos razón por la cual no fue considerada (Hill 1996).
2.3 Óxidos de cloro y azufre elemental
Wurtz (1866) observó que la reacción entre monóxido de cloro y azufre elemental producía cloruro de tionilo pero la reacción era violenta y explosiva. El monóxido de cloro era generado catalíticamente al reaccionar cloro elemental sobre óxido de mercurio en CCl4 y la reacción principal se realizaba a -12°C. Una dificultad adicional fue que SOCl2 y CCl4 tenían un mismo punto de ebullición y su separación por destilación era incompleta. Se buscó también atenuar la reacción empleando una mezcla de azufre elemental con S2Cl2 pero la reacción se volvía demasiada lenta (De Mellor 1930).
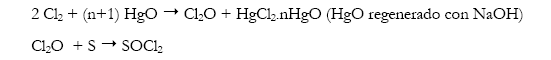
Esta línea sintética tiene probablemente su origen en los estudios de Balard (1834) quién reaccionó CS2 con Cl2O y encontró también una reacción explosiva y una diversidad de productos:
![]()
2.4 Reacción de organoclorados con SO2
La reacción entre ciclos aromáticos y SO2 a temperaturas elevadas (150°C) para producir cloruro de tionilo fue descrito inicialmente en una patente por Kyrides (1934) empleando un ácido de Lewis como catalizador y ciclos aromáticos desactivados para reducir productos secundarios procedentes de una condensación de Friedel-Crafts:
![]()
Variantes a esta reacción fueron descritas ulteriormente en base a diferentes catalizadores: Rondestvedt (1976) con SbCl5, Burk et al (1968) con FeX3, Hallowell et al. (1946) con AlCl3, empleando CHCl3 y CCl4:
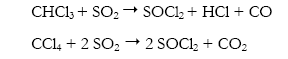
2.5 Oxidación directa de cloruros de azufre
La reacción de oxidación de SCl2 fue estudiada por Evans (1947), encontrándose que se trataba de una reacción irreversible que producía SO2Cl2 seguida por una reacción reversible de equilibrio entre SO2Cl2 y cloruro de tionilo SOCl2. Realizada en fase gaseosa a 193°C sobre un catalizador de carbono se encontraron las mejores condiciones con un rendimiento de 73% de SO2Cl2
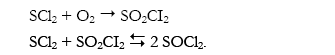
Otra variante es la de Burk (1968):
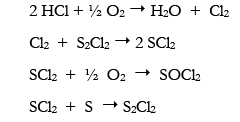
3 Resultados
Estudios preliminares mostraron que no se podía digerir los tallos de V. tucumanensis apropiadamente por el método del sulfito, razón por la cual se adaptó el método del sulfuro (proceso Kraft). La pasta formada podía separarse en 2 fracciones, una parte de fibra larga, moldeable a la mano y con buenas propiedades mecánicas cuando se formaba papel. El rendimiento de esta fracción era del 33.4% (masa seca). La otra fracción estaba constituida probablemente por fibras más cortas, no eran moldeables y su retención en un tamiz era dificultosa y con mucha retención de humedad. Para este trabajo esta segunda fracción fue desechada.
Para sintetizar el cloruro de tionilo se empleó un producto comercial normalmente destinado a clorar el agua de piscina, el TCCA .(ácido tricloroisocianúrico) La adición de ácido clorhídrico bajo arrastre de nitrógeno y posterior secado por burbujeo en ácido sulfúrico permitió preparar cloro seco de manera cuantitativa y a voluntad:
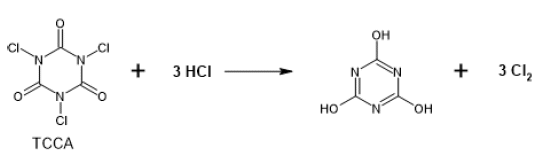
El cloro fue dirigido hacia un segundo balón con azufre finamente pulverizado, generando asi el monocloruro de azufre en caliente, un líquido naranja de manera cuantitativa:
![]()
En un segundo tiempo, se añadió más cloro a S2Cl2 pero en frio esta vez, para obtener un líquido rojo oscuro, el cloruro de azufre:
![]()
En paralelo se preparó SO3 a partir de la descomposición del peróxido de azufre, el mismo que fue sintetizado por electrólisis del sulfato ácido de potasio.
La reacción entre SO3 disuelto en ácido sulfúrico con SCl2 permitió obtener el cloruro de tionilo SOCl2. Finalmente se preparó el cloruro de acetilo CH3COCl reaccionado el cloruro de tionilo SOCL2 con ácido acético glacial. El cloruro de acetilo reacciona rápidamente con la celulosa para dar el acetato de celulosa, objetivo del presente trabajo.
4 Parte experimental
4.1 Celulosa de V. Tucumanensis
Una preparación típica corresponde a la disolución de 30 g de NaOH en 750 ml de agua seguido por la adición de 3.7 g de Na2S y 250 g de tallos secos de V. Tucumanensis. La mezcla es cocida a fuego lento por unas 3 horas, decantado y la bio masa lavada con agua hasta pH neutro, molida aplicando fuerzas de cizalla para separar las fibras en sus elementos más simples y luego secada. Se obtuvo típicamente un rendimiento de 33.4% de fibras de color beige que al ser suspendidas en agua y extrayéndolas con un tamiz formaban fácilmente papel con buenas propiedades mecánicas.
4.2 Preparación de monocloruro de azufre (S2Cl2)
Cloro gaseoso fue generado en un balón de 250 ml que contenía 200 g de TCCA (ácido triscloroisocianúrico molido) por adición gota a gota de HCl al 15% proveniente de un embudo de adición. El cloro generado fue arrastrado por una corriente de N2 a través de un frasco lavador cargado con ácido sulfúrico para eliminar trazas de agua.
![]()
El cloro seco fue arrastrado por N2 hacia un balón de 2 cuellos de 250 ml cargado con azufre previamente molido finamente y luego derretido, descargando el cloro a pocos milímetros del fondo. El balón estaba siendo calentado por una manta calefactora y el otro cuello estaba conectado a un condensador Liebig que descargaba los condensados en otro balón de 250 ml. Todo el sistema estaba bajo nitrógeno y protegido del ingreso de humedad por frascos lavadores con ácido sulfúrico. Después de un tiempo de inducción se puede observar la condensación de gotas color naranja de S2Cl2. La temperatura en el reactor incrementa hasta aproximadamente 200°C. El rendimiento es prácticamente cuantitativo.
4.3 Preparación de dicloruro de azufre (SCl2)
Se cargaron unos 200 g de S2Cl2 en un balón de 2 cuellos de 1 litro. El balón estaba inmerso en un baño de agua con hielo y uno de sus cuellos estaba copado por un condensador de doble pared enfriado por agua helada. Por el otro cuello ingresaba cloro, conducido por un tubo delgado que descargaba en el fondo del reactor, por debajo de la superficie de S2Cl2. El cloro se preparaba de la misma manera que descrita anteriormente. Todo el sistema estaba bajo un flujo constante de nitrógeno y protegido de la humedad por frascos lavadores con ácido sulfúrico. Para acelerar la reacción se añadió una pequeña cantidad (0.1 gr) de lana de acero. Después de añadir un pequeño exceso de cloro, se obtiene prácticamente 100% de SCl2 bajo la forma de un líquido rojo profundo.
4.4 Preparación de SO3
Persulfato de potasio K2S2O8 fue preparado por electrólisis de una solución saturada de sulfato ácido de potasio (KHSO4) en ácido sulfúrico diluido. La celda de electrólisis constaba de 2 electrodos de platino de 1cm2 de superficie alimentados por una fuente de poder que aseguraba una corriente de 0.5 amperios. La celda estaba inmersa en un baño helado mantenido entre 0 y 7°C. La electrólisis duró varios días con intermitencias, formándose un precipitado cristalino fino de persulfato de potasio. El persulfato fue transformado en pirosulfato K2S2O7 por calentamiento y luego calentado en ácido sulfúrico concentrado, generando SO3 en ácido sulfúrico
4.5 Preparación de cloruro de tionilo (SOCl2)
Un balón cargado con H2SO4/SO3 es calentado de manera que el SO3 liberado pasa a un segundo balón que contiene SCl2 en un baño frio. El sistema está aislado de la humedad del aire y bajo un flujo de nitrógeno que arrastra el SO3 liberado. El producto de la reacción, el cloruro de tionilo es luego recuperado y purificado por destilación entre 65 y 80°C, con un rendimiento de 23.6%.
4.6 Preparación del acetato de cellulosa
Se preparó cloruro de acetilo por reacción entre ácido acético glacial (8gr, moles) y cloruro de tionilo (8 gr, moles) a temperatura ambiente en un balón previamente secado en horno y bajo atmósfera de nitrógeno. El cloruro de acilo fue empleado para acilar la celulosa previamente extraída y secada de V. tucumanensis. El producto obtenido fue extraído con acetona y caracterizado por IR, obteniéndose el acetato de celulosa con un rendimiento de 86.2%.
4.7 Formulación y propiedades del acetato de celulosa
La formulación del acetato de celulosa fue realizada añadiendo 50, 75 y 100% de glicerina. La formulación en la que se mezclan cantidades iguales de glicerina y acetato de celulosa resultó tener mayor flexibilidad y mayor resistencia a la ruptura. Las propiedades de esta última formulación fueron evaluadas por triplicado, encontrándose una solubilidad del 4.52 ± 0.46%, densidad de 1.05 ± 0.1 g/cm3, humedad de 6.19 ± 0.24%, absorción de agua de 8.26 ± 0.2%, elongación de 2.25% (bajo una fuerza de 0.147N durante 6 dias a 20°C, correspondiendo a un módulo de elasticidad de 0.0075 kg/cm2). Finalmente, se evaluó la biodegradabilidad por el método de composteo, registrando diariamente la pérdida en peso durante 5 días, al cabo de los cuales se determinó que esta correspondía a 8.71% al cabo de 5 días.
5 Conclusiones
Se logró sintetizar acetato de celulosa, un material plástico conocido y biodegradable a partir de materia prima renovable, obtenida localmente y con la ayuda de insumos químicos también sintetizados a partir de precursores localmente disponibles.
Referencias
[1] Abdul Khalil, H. P. S.; Bhat, A. H.; Ireana Yusra, A. F. 2012. Green composites from sustainable cellulose nanofibrils: A review Carbohydrate Polymers 87, 963–979
[2] Balard, J. 1834. Recherches sur la nature des combinaisons décolorantes du chlore. Ann. Chim. Phys., Ser. 2, 57, 225 [ Links ]
[3] Beanblossom W. S. Process for the production of thionyl chloride U. S. Patent 443,247 1930 [ Links ]
[4] Buess, Charles M ; Kharasch, Norman ; Langford, Robert B. INORGANIC SULFUR REAGENTS. 1. THE THIONYL HALIDES. Office of Scientific Research, United States Air Force, Contract No. AF 49-638-718 https://docplayer.net/90013953-Los-angeles-7-california-thionyl-chloride.html (11.2019) [ Links ]
[5] Burk, E. H.; Turnquest, B. W. (1968). U.S. Patent 3,411,886. Production of thionyl halide and aromatic acyl halides [ Links ]
[6] Crpy, L.; Chaveriat, L.; Banoub, J.; Martin, P.; Joly, N. 2009,Synthesis of Cellulose Fatty Esters as Plastics—Influence of the Degree of Substitution and the Fatty Chain Length on Mechanical Properties. ChemSusChem 2, 165–170
[7] De Mellor: Comprehensive treatise on inorganic chemistry 1930 Vol 10 Longmans, Green and Co. Ltd. London (C. A. Wurtz, Bull. Soc. Chim., (2), 5. 243, 1866??) [ Links ]
[8] DuchesneL. C.; Larson, D. W. 1989 Cellulose and the Evolution of Plant Life BioScience Vol. 39, No. 4, 238-241
[9] Edwards, J. P. 1944. Process for production of thionylchloride U.S. Patent 2,362,057, Nov. 7, 1944 [ Links ]
[10] Evans, A. G.; Meadow, G. W.; The catalytic oxidation of Sulphur dichloride by oxygen. Trans. Faraday Soc., 1947,43, 667-674
[11] Field C. B., Behrenfeld, M. J.; Randerson, J. T.; Falkowski, P. 1998 Primary Production of the Biosphere: Integrating Terrestrial and Oceanic Components SCIENCE Vol. 281, 10 July, 237-240:
[12] Habibi, Y.; Lucia, L. A.; Rojas, O. J. 2010, Cellulose Nanocrystals: Chemistry, Self-Assembly, and Applications, Chem. Rev. 110, 3479–3500
[13] Hallowell, a. T.; Vaala, G. T. 1946. Process for the preparation of thionyl chloride U.S. Patent. US2393247 Jan. 22, 1946 [ Links ]
[14] Heinze, T.; Liebert, T. 2001. Unconventional methods in cellulose functionalization. Prog. Polm. Sci. 26, 1689-1762 [ Links ]
[15] Hill, J. E. Preparation of thionyl chloride and phosphorous oxychloride from sulfur dioxide. U.S. Patent 5,498,400, 1996
[16] Jedvert, K. Heinze, T. Cellulose modification and shaping – a review. 2017 J. Polymer Eng. 37, 9 845-860.
[17] Jonas, H.; Lueg, P. Verfahren zur Herstellung von Thionylchlorid Ger. Patent 939,571, Feb. 23, 1956
[18] Klemm, D.; Heublein, B.; Fink, H.-P.; Bohn, A. 2005. Cellulose: Fascinating Biopolymer and Sustainable Raw Material. Angew. Chem. Int. Ed., 44, 3358 – 3393
[19] Kontturi, E.; Tammelin, T.; Österberg, M. 2006, Cellulose—model films and the fundamental approach. Chem. Soc. Rev., 35, 1287–1304
[20] Kyrides, L. O. (1934) U.S.Patent 1,951,364. Manufacture of dicarboxylic acid chlorides. [ Links ]
[21] Kyrides, L. O. (1937) Phthalyl chloride. J. Am. Chem. Soc., 59(1), pp 206–208
[22] Lerner, L. 2011. Small-scale synthesis of laboratory reagents with reaction modelling. CRC press. Boca Raton
[23] Liebert, T. F.; Heinze, T. 2005, Tailored Cellulose Esters: Synthesis and Structure Determination. Biomacromolecules 6, 333-340 [ Links ]
[24] Marcì, G.; Mele, G.; Palmisano, L.; Pulitob, P.; Sannino, A. 2006, Environmentally sustainable production of cellulose-based superabsorbent hydrogels. Green Chem., 8, 439–444
[25] Moon, R. J.; Martini, A.; Nairn, J.; Simonsenf, J.; Youngblood, J. 2011, Cellulose nanomaterials review: structure, properties and nanocomposites. Chem. Soc. Rev., 40, 3941–3994
[26] Plasticseurope 2018, Plastics – the Facts 2019 https://www.plasticseurope.org/en/resources/market-data (acceso 11.2019)
[27] Roy, D.; Semsarilar, M.; Guthriea, J. T.; Perrier, S. 2009,Cellulose modification by polymer grafting: a review Chem. Soc. Rev., 38, 2046-2064 [ Links ]
[28] Salzenberg, W. H.; Sveda, M. U.S. Patent 2,420,623, May 13, 1947 [ Links ]
[29] Wurtz, A. 1866. Synthese du chlorure de thionyle. C. R. Acad. Sci., 62, 460. [ Links ]
[30] Wurtz, A. 1866. Sur la synthese du chlorure de thionyle. Bull. Soc. Chim., (2), 5. 243. [ Links ]














