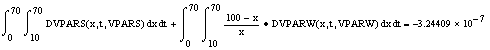Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Nova
versión On-line ISSN 1683-0789
RevActaNova. v.5 n.1 Cochabamba mar. 2011
Preparación de jarabes de sacarosa mediante mediciones volumétricas
Rónanth Zavaleta Mercado
Departamento de Ingeniería Química, Facultad de Ciencias Exactas e Ingeniería, Universidad Católica Boliviana San Pablo, Av. 14 de Septiembre 4807, Obrajes-Zona Sur, La Paz - Bolivia
Resumen: Se estudia el problema de la preparación de jarabes de sacarosa de volúmenes y composiciones másicas determinadas a partir de mediciones volumétricas, problema común en muchas industrias especialmente del sector de bebidas y alimentos. En estas se imponen condiciones de concentraciones másicas determinadas y volúmenes que son difíciles de preparar a partir de jarabes pre existentes, debido al comportamiento no ideal de las soluciones sacarosa-agua, que hace que los volúmenes no sean aditivos, con la característica adicional de que en la industria se dispone principalmente de sistemas de medida volumétricos (niveles de tanques, bombas, medidores de caudal, caudales), y no másicos.
Se deriva una ecuación para la densidad de soluciones binarias sacarosa-agua en función de concentraciones másicas porcentuales y la temperatura a partir de una ecuación de la densidad dependiente de la concentración volumétrica y la temperatura, disponible en la literatura técnica. Esta ecuación, que se basa en datos de medidas de densidades de soluciones sacarosa-agua de alta calidad, es transformada con escaso error en otra que utiliza variables másicas y que se ajusta mejor a su aplicación en la industria. La extensa transformación requerida se maneja de una manera adecuada utilizando paquetes de algebra por computadoras y computadores digitales, obteniéndose ecuaciones relativamente sencillas, consistentes desde un punto de vista termodinámico y fáciles de montarse en aplicaciones sencillas y amigables destinadas a su utilización en planta.
Palabras clave: Soluciones sacarosa-agua, grados Brix (ºBx), densidad de jarabes de azúcar, consistencia termodinámica.
Abstract: We study the problem of preparation of sucrose syrups másicas volumes and compositions determined from volumetric measurements, common problem in many industries especially the food and beverage industry. Under these conditions are imposed certain mass concentrations and volumes that are difficult to prepare from preexisting syrups, due to nonideal behavior of the sucrose-water solution, which causes the volumes are not additives, with the additional feature that industry mainly provides volumetric measurement systems (tank levels, pumps, flow meters, flow), and no mass.
An equation for the density of sucrose-water binary solutions is derived based on percentage mass concentrations and temperature from an equation of density volumetric concentration dependent and temperature available in the technical literature. This equation, which is based on measurement data densities sucrose-water solutions of high quality, with little error is transformed into one that uses másicas variables that best fits their application in industry. The extensive processing required is handled in a suitable manner by using computer algebra packages and digital computers, yielding relatively simple equations consisting from a thermodynamic point of view and easily mounted and friendly simple applications intended for use in plants.
Keywords: sucrose-water solutions, degrees Brix (° Bx), density of sugar syrup, thermodynamic consistency.
1 Introducción
La industria de alimentos y bebidas hace uso extenso de jarabes de sacarosa en diversos procesos productivos. Estos jarabes son preparados utilizando azúcar refinada y agua tratada y con frecuencia deben cumplir estándares rigurosos entre los cuales se incluye la concentración. Una medida de amplio utiliza los grados Brix (ºBx) que se refieren al contenido másico porcentual de azucares habiéndose desarrollado instrumentación dedicada a su determinación (brixómetros). El problema que se contempla sin embargo es que las soluciones de sacarosa no presentan un comportamiento ideal, y por lo tanto los volúmenes de solvente (agua) y soluciones de diferente concentración no son aditivos. La practica general consiste en la preparación de jarabes de sacarosa de alto contenido (60 ºBx o más) y diluciones posteriores para alcanzar gradaciones de uso comercial (alrededor de 10 a 11 ºBx). El problema radica en el hecho que los dispositivos de producción en las instalaciones industrial son de naturaleza volumétrica (bombas centrifugas, tanques, tuberías de transporte, llenadores), siendo másicos los requerimientos de control de calidad en lo que se refiere a la concentración. La satisfacción de requerimientos estrictos de ºBx deviene entonces en un problema importante, que muchas veces se solventa simplemente en base a la experiencia de los operadores, lo que en circunstancias dadas puede traducirse en requerimientos adicionales de tratamiento o aun en desecho de jarabes que no cumplen especificaciones.
El problema anterior no es uno menor si se toma en cuenta las dimensiones de las empresas que operan con jarabes de sacarosa y por lo tanto el advenimiento de procedimientos que lo mitiguen se constituiría en un importante aporte.
En el presente trabajo se utiliza información experimental sobre densidades de soluciones sacarosa-agua, aplicaciones de termodinámica de soluciones, algoritmos numéricos, "software" de algebra por computadoras y computadores digitales de alto desempeño para generar métodos prácticos de aplicación industrial que permitan paliar el problema.
2 Conceptuación
Las soluciones ideales se caracterizan por volúmenes que resultan en combinaciones lineales de las fracciones molares o másicas y los volúmenes específicos
![]()
Esta combinación lineal donde xi es la fracción másica o molar del componente i en solución, ![]() el volumen especifico del componente i y
el volumen especifico del componente i y ![]() el volumen especifico de la solución, no se cumple en el caso de soluciones no ideales. Sin embargo esta sencilla descripción del comportamiento de los volúmenes específicos de mezclas puede ser extendidas a soluciones no ideales al utilizar las propiedades parciales, que para el caso del volumen resulta en
el volumen especifico de la solución, no se cumple en el caso de soluciones no ideales. Sin embargo esta sencilla descripción del comportamiento de los volúmenes específicos de mezclas puede ser extendidas a soluciones no ideales al utilizar las propiedades parciales, que para el caso del volumen resulta en
![]()
y por lo tanto
![]()
La dificultad estriba por lo tanto en la determinación de las propiedades parciales de soluto y solvente, ya que la Ecuación [3] proporciona la relación entre fracciones másicas y volúmenes específicos, que es la que se busca y que en principio resolvería el problema. Como se verá, esta determinación es posible con base en información experimental de la dependencia de la densidad de soluciones con la concentración y temperatura.
Los datos que se utilice y las relaciones derivadas deben cumplir necesariamente criterios de consistencia termodinámica, y en especial la Ecuación de Gibbs-Duhem, que a presión y temperatura constante estipula para los volúmenes parciales la imposibilidad de variación independiente en el seno de una solución
![]()
Con base en lo anterior es posible determinar otras aproximaciones a la descripción del departir del comportamiento ideal, tal como las propiedades de exceso, como se verá posteriormente, así como metodologías de cálculo sencillas para la preparación de soluciones que cumplan criterios de concentración másica a partir de medidas y equipamiento volumétricos.
3 Metodología
3.1 Determinación de una ecuación (Bx,T)
Para la consecución de los objetivos del presente trabajo se hace imprescindible la determinación de una ecuación que relacione en forma explícita la densidad de las soluciones con la concentración másica porcentual (Bx) y la temperatura. A partir de ella se podrá entonces determinar las propiedades termodinámicas correspondientes que conduzcan a la solución del problema.
La siguiente ecuación fue ajustada a datos experimentales de densidades de soluciones acuosas de diferentes sustancias orgánicas e inorgánicas obtenidas mediante un densitómetro de tubo oscilante (Anton-Par DMA58) en un rango de temperaturas de 0 a 60˚C a varias concentraciones [1]
![]()
donde ρ = densidad de la solución (g/cm3), S = concentración de soluto (g soluto/100 mL de solución), T = Temperatura en ˚C, ai, bi, ci son los coeficientes de ajuste numérico, los cuales aparecen consignados en la siguiente Tabla para soluciones de sacarosa:

La anterior ecuación puede disponerse en una forma compacta y eficiente con fines computacionales, como sigue
![]()
Donde co es la matriz de coeficientes de la Tabla 1.
Para la industria que utiliza jarabes de sacarosa y otros, la unidad de medida de concentración de azúcar se expresa en grados Brix, ˚Br, el porcentaje de masa de sacarosa presente en la solución. Por lo tanto:
![]()
Al introducir la Ecuación [6] en la Ecuación [5] se obtiene una ecuación implícita en la densidad, que la correlaciona con la concentración másica (Br) y la temperatura, la que dispuesta en forma estándar resulta en
![]()
la que puede disponerse de una manera compacta y computacionalmente eficiente como sigue
![]()
Esta ecuación puede ser resuelta numéricamente para determinar las densidades en función de la concentración másica y la temperatura, y al menos en principio, desarrollar una correlación explicita en la densidad que permitiría el cálculo de los volúmenes parciales de soluto y solvente. Se desarrolla a continuación esta aproximación a la resolución del problema.
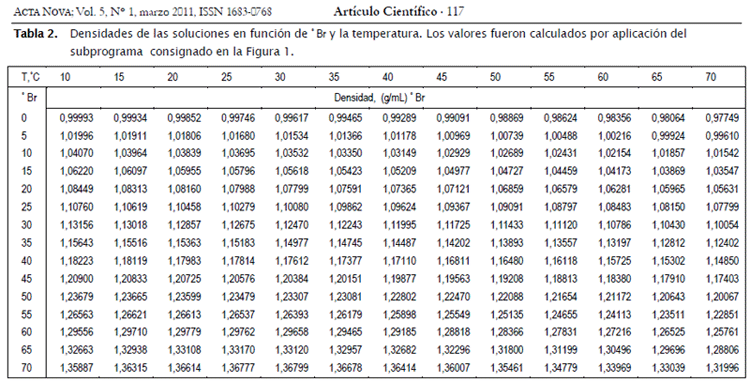
Con base en la Ecuación [9] y [2] y en los subprogramas de algebra por computadoras Mathcad v. 15® del Subprograma 1se calcula la Tabla 2 en la que se presenta las densidades de las soluciones sacarosa-agua en función de la concentración másica porcentual y la temperatura. La transpuesta de esta matriz se utiliza como base para los cálculos siguientes tendentes a la determinación de los volúmenes parciales. El rango de temperaturas considerado es de 10 a 70 ºC con incrementos de 5ºC, lo que forma un vector fila de 13 elementos, mientras que para la concentración másica porcentual el rango es de 0 a 70 ºBx con incrementos de 5ºBx, formando un vector columna de 15 elementos.
Los datos de la matriz transpuesta de la Tabla 2 son correlacionados utilizando polinomios cúbicos, uno para cada temperatura (trece en total) utilizando el Subprograma 2.La matriz de coeficientes obtenida (Tabla 3) es posteriormente procesada mediante el subprograma sbrcoe contenido en el Subprograma 3 para obtener la dependencia de la temperatura para cada columna, correspondiente a los coeficientes de los términos de grado 0 a 4. Se tuvo que recurrir a polinomios de grado cuarto para obtener una correlación adecuada de los datos, cuidando de no tener un comportamiento oscilante proveniente del elevado grado del polinomio requerido. Este no es el caso, como puede apreciarse en la Figura 1.
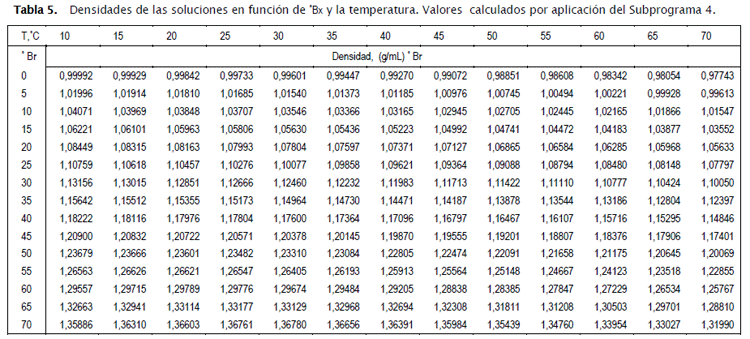
Con los coeficientes de la Tabla 5, se completa finalmente la ecuación explicita de la densidad de las soluciones de sacarosa-agua, en función de ºBx y la temperatura, que queda descrita por las siguientes ecuaciones, donde co es el arreglo bidimensional de la matriz de coeficientes:
![]()

Subprograma 1: La matriz de coeficientes de la Ec. [5] aparece en la parte superior. En segunda instancia, la misma ecuación es dispuesta en forma compacta adecuada para aplicaciones computacionales. En la tercera línea se ha despejado S de la Ec. [6] y se la ha remplazado en la Ec. [5], disponiéndola en forma estándar como una función implícita de ρ. El subprograma en la parte inferior calcula la densidad a partir de la ecuación implícita anterior para un arreglo bidimensional n x t grados Brix- temperatura.

Subprograma 2: Subprograma que calcula los coeficientes de ajuste con polinomios cúbicos de la densidad con la concentración másica porcentual para las trece temperaturas del dominio de la temperatura. Se calcula también el coeficiente de correlación de Pearson para cada ajuste. Los argumentos son los vectores columna de grados Brix y de densidades. Ambos vectores deben tener el mismo número de elementos.

Subprograma 3: Subprograma que calcula los coeficientes de ajuste con polinomios cúbicos de la densidad con la concentración másica porcentual para las trece temperaturas del dominio de la temperatura. Se calcula también el coeficiente de correlación de Pearson para cada ajuste. Los argumentos son los vectores columna de grados Brix y de densidades. Ambos vectores deben tener el mismo número de elementos

Queda ahora por comprobar la calidad de cálculo de la ecuación deducida, para lo que se deberá cotejar los valores de las densidades calculadas contra aquellas de la Tabla1, determinadas con base a la ecuación deducida por los autores [2]. Los valores calculados con la nueva ecuación son consignados en la Tabla 6, y los errores relativos en la Tabla 7. A este fin se utilizó el Subprograma 4. El error porcentual máximo en que se incurre es inferior a 0.019%, lo que avala la utilización de la nueva ecuación.
4 Propiedades Termodinámicas Parciales
La Ecuación [10] permite derivar las propiedades termodinámicas de soluciones necesarias para resolver el problema, pero antes debe desarrollarse algunas relaciones termodinámicas. En el caso de una solución binaria, la Ecuación [1] escrita para el volumen V de la solución resulta en
![]()
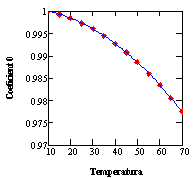
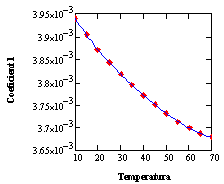
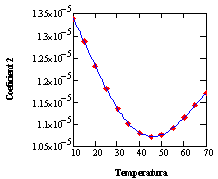
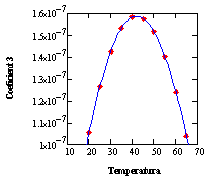
Figura 1: Ajuste de los coeficientes de la ecuación de la densidad de las soluciones, explicita en la concentración másica porcentual y la temperatura. Como se puede apreciar, no existen problemas con la interpolación entre datos calculados para ninguno de los coeficientes.
Esta ecuación puede expresarse en términos de la composición másica porcentual, grados Brix (Br) para obtener
![]()
Donde el subíndice s se refiere a la sacarosa y a al agua. Por diferenciación se obtiene
![]()
La Ecuación de Gibbs-Duhem establece que
![]()
Al sustituir la anterior ecuación en la Ecuación [13] se obtiene
![]()
Eliminando alternativamente los volúmenes parciales con ayuda de la Ecuación [12]
![]()
![]()
Estas ecuaciones permiten el cálculo de los volúmenes parciales de una manera sencilla, lo que se realiza en el Subprograma 5.


Subprograma 4: El programa de la parte superior que calcula las densidades de soluciones sacarosa-agua utilizando la Ecuación (10) que, como se mencionó anteriormente, es explicita y es función de ˚Bx y T. El programa de la parte inferior permite calcular los datos de la Tabla 6.

Subprograma 5: Subprogramas que calculan el volumen parcial de la sacarosa y del agua en solución, así como el volumen específico de la solución. Los argumentos son los grados Brix (˚Bx), la temperatura y la ecuación RHO en todos los casos.
En la Figura 2 se presenta los volúmenes parciales para sacarosa y agua calculados para una temperatura de 40˚C. Nótese la característica interdependencia de las pendientes (signos contrarios) predicha por la Ecuación de Gibbs-Duhem. En las figuras 3 y 4 se presenta los volúmenes parciales para sacarosa y agua como funciones de la concentración másica porcentual para diferentes temperaturas. El comportamiento no ideal es evidente, siendo menor las desviaciones para la isoterma de 20˚C. En general las deflexiones respecto al comportamiento ideal disminuyen con la temperatura. La consistencia termodinámica de estos resultados será investigada posteriormente.
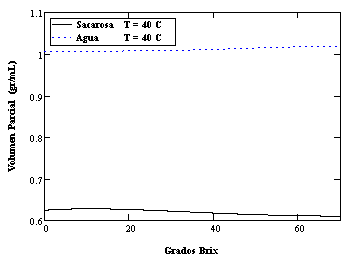
Figura 2: Volúmenes parciales para sacarosa y agua a 40 ˚C. Nótese el cambio de signo de las pendientes en correspondencia con la Ecuación de Gibbs-Duhem.
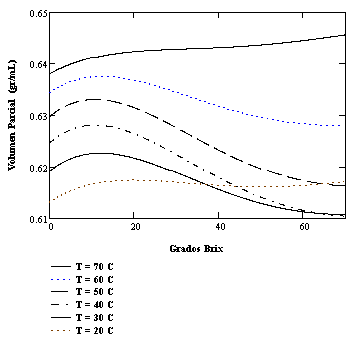
Figura 3: Volúmenes parciales de sacarosa en solución binaria con agua a diferentes temperaturas. Obsérvese el comportamiento no ideal.
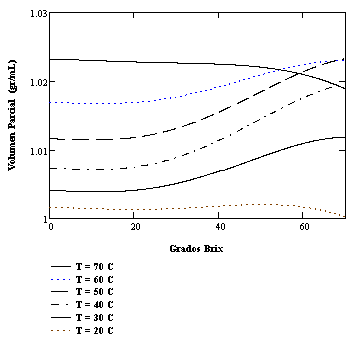
Figura 4: Volúmenes parciales de agua en soluciones binarias con sacarosa a diferentes temperaturas. Obsérvese el comportamiento no ideal.
5 Propiedades de exceso
El comportamiento de las soluciones-sacarosa agua queda descrito por la Ecuación [10], que cumple el postulado de Duhem del estado para el caso de soluciones binarias isobáricas. Por lo tanto las propiedades de exceso pueden ser determinadas directamente cuantificando la diferencia entre el comportamiento real de las propiedades de las soluciones y la de una solución ideal hipotética de una propiedad extensiva. Para el caso del volumen
![]()
Para el trabajo presente, el rango de interés de composiciones de sacarosa es de 0 a 70˚Bx, que cubre probablemente la totalidad de concentraciones utilizadas comúnmente en la industria. El comportamiento ideal se describe por lo tanto por las combinaciones lineales de los volúmenes de concentraciones de 0 y 70˚Bx
![]()
El volumen V correspondiente al comportamiento no ideal de la solución se calcula por aplicación de la Ecuación [10].Los programas computacionales para el cálculo de las propiedades de exceso aparecen en el Subprograma 6.
Las propiedades muestran desviaciones tanto positivas como negativas, dependiendo de la temperatura. Por debajo de 20˚C se observa desviaciones negativas, mientras que por encima las desviaciones son positivas. La isoterma correspondiente a 20 ˚C muestra un comportamiento oscilante, con desviaciones positivas y negativas dependiendo de la concentración, tal como se aprecia en la Figura 6.
6 Soluciones de Brix pre-determinado a partir de mediciones volumétricas
El comportamiento de las soluciones-sacarosa agua queda descrito por la Ecuación [10], que cumple el postulado de Duhem del estado para el caso de soluciones binarias sometidas a presión constante. Por lo tanto y en torno a ella se puede determinar los volúmenes de soluciones de concentraciones másicas conocidas que se requieren para obtener soluciones de volúmenes y concentraciones prefijadas. Para este caso dos aproximaciones son posibles. La primera consiste en utilizar balances de materia total y parcial conjuntamente con la Ecuación [12], mientras que la segunda utiliza simplemente balances globales y parciales. Ambas aproximaciones son descritas matemáticamente y utilizadas para obtener los
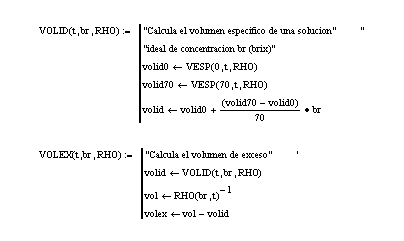
Subprograma 6: Programas que calculan los volúmenes ideales y de exceso de soluciones sacarosa- agua.
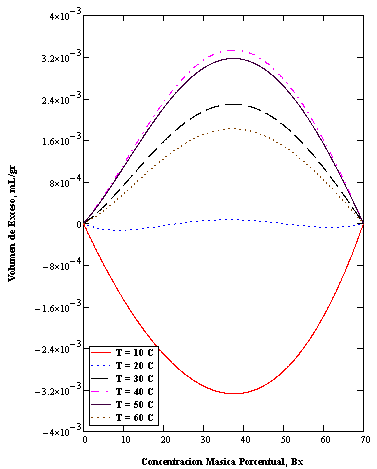
Figura 5: Volúmenes de exceso para soluciones binarias de sacarosa-agua a diferentes temperaturas. Obsérvese el comportamiento no ideal.
volúmenes de corrientes de concentración másica conocida que se requieren para preparar un jarabe de volumen y concentración predeterminados. El problema queda explicitado en la Figura 7.
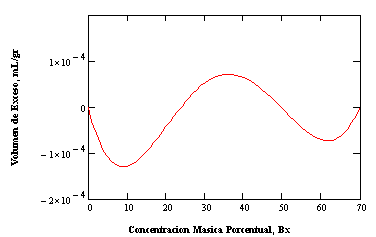
Figura 6: Volumen de exceso de la solución binaria sacarosa-agua. Comportamiento oscilante de la isoterma a 20 ˚C, mostrando desviaciones positivas y negativas dependiendo de la concentración másica porcentual.
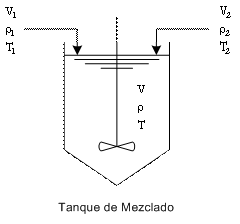
Figura 7: Esquema demostrativo del proceso de mezclado. El volumen de las corrientes se refiere como V, su temperatura, T y su densidad ρ. Los subíndices 1 y 2 se refieren a las corrientes a mezclarse. Las propiedades de la mezcla final no presentan subíndices.
La matemática para el caso de utilizar volúmenes parciales es:
![]()
![]()
Las dos ecuaciones anteriores forman un conjunto determinado del cual se puede calcular V1 y V2 a condición de conocer el resto de los parámetros. Las densidades son calculadas a partir de la Ecuación [10] a condición de conocer sus propiedades Bx y T. Estos cálculos son realizados por el programa presentado en Subprograma 7.
La segunda modalidad de cálculo incluye la Ecuación [20] y además el siguiente balance parcial para sacarosa
![]()

Subprograma 7: Programa que calcula los volúmenes de soluciones sacarosa -agua de Bx y T conocidos que deben mezclarse para obtener un volumen V de una solución de Bx predeterminado. Utiliza volúmenes parciales.
Esta solución queda implementada en el Subprograma 7, y permite obtener los mismos resultados.
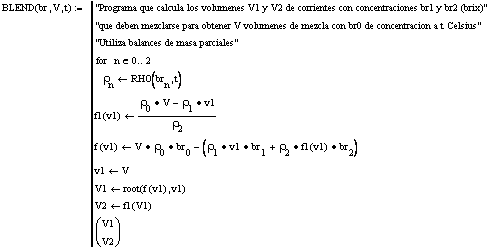
Subprograma 8: Programa que calcula los volúmenes de soluciones sacarosa -agua de Bx y T conocidos que deben mezclarse para obtener un volumen V de una solución de Bx predeterminado. Utiliza balances parciales de masa.
Los dos últimos subprogramas resuelven en esencia la problemática planteada en el presente trabajo y pueden implementarse con interfaces amigables para su utilización en planta.
Como un ejemplo rápido del potencial de aplicación de las ecuaciones derivadas se presenta los gráficos de la Figura 8, en los que se presenta los requerimientos a) de jarabes de sacarosa y de agua pura y b) de jarabes de sacarosa con concentraciones superiores a 10 ˚Bx y de jarabe de 5 ˚Bx, requeridos para obtener 1000 L de solución final de 10˚Bx, concentración típica de la industria de bebidas gaseosas. Obsérvese el comportamiento no lineal y el cumplimiento de la condición limite cuando la concentración de la solución concentrada tiende a 10˚Bx.


Figura 8: Requerimientos de jarabe concentrado para preparar 1000 L de solución de sacarosa de 10 ˚Bx. En el grafico de la izquierda se utiliza agua pura como diluyente, mientras que en el de la derecha se emplea una solución de 5 ˚Bx como diluyente.
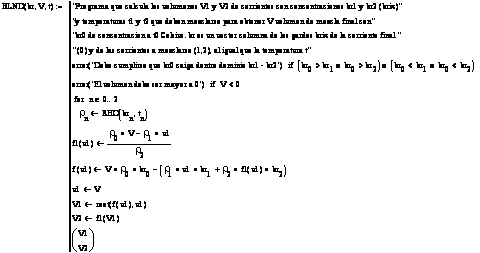
Subprograma 9: Programa que calcula los volúmenes de soluciones sacarosa -agua de Bx y T conocidos que deben mezclarse para obtener un volumen V de una solución de Bx predeterminado. Se ha incorporado un vector de temperaturas de las corrientes en la lista de argumentos de la función. Se ha incluido también prevenciones para impedir el planteo de soluciones no factibles.
En el Subprograma 8 se ha incluido la posibilidad de mezclar corrientes de diferentes temperaturas, así como prevenciones para que el usuario no caiga en planteamientos no permitidos por las leyes físicas
7 Consistencia Termodinámica
Los datos derivados deben obedecer la Ecuación de Gibbs-Duhem (Ecuación [14], a P y T constantes), si es que son consistentes en términos de la termodinámica. Esta ecuación puede disponerse de la siguiente forma para el presente caso
![]()
Pero a efectos de incorporar la totalidad de las concentraciones y temperatura estudiadas, la anterior ecuación puede disponerse de la siguiente manera
![]()
aproximación que correspondería al método integral de verificación de la consistencia termodinámica. La complicada integral doble puede realizarse de una manera eficiente recurriendo a técnicas numéricas.
El cálculo de la Ecuación [24] requiere de la derivación de programas que calculen la derivada de los volúmenes parciales de sacarosa y agua respecto a la concentración másica porcentual. Esto se consigue con base a los programas contenidos en el Subprograma 8.


Subprograma 10: Programa que calcula las derivadas respecto a Bx de los volúmenes parciales de soluciones sacarosa –agua en función de Bx y T. Debe incluirse en la hoja de cálculo referencia a los archivos que contienen los subprogramas VPARS y VPRAW de cálculo de los volúmenes parciales de sacarosa y agua respectivamente.
Entonces la integral doble de la Ecuación [24] procede directamente, permitiendo obtener
que es un valor suficientemente próximo a cero y que por lo tanto proporciona una buena indicación respecto a la consistencia termodinámica de la Ecuación [ 10]. En la Figura 8 se grafica los dos términos de la Ecuación [23], los cuales subtienden áreas parecidas por encima y por debajo del eje de las abscisas, que en esencia se cancelan de acuerdo al resultado anterior, permitiendo una apreciación visual del cumplimiento de la Ecuación de Gibbs-Duhem, prueba de consistencia termodinámica.
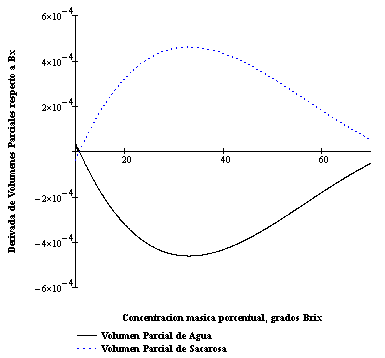
Figura 9: Volúmenes molares parciales de sacarosa y agua (multiplicada esta ultima por el cociente (100-Bx)/Bx, de acuerdo a la Ecuación [23]). Nótese las áreas subtendidas aproximadamente iguales por encima y debajo de la abscisa.
8 Resultados y discusión
Las soluciones sacarosa-agua presentan un comportamiento no ideal que impide la preparación de jarabes de sacarosa de volumen y concentración másica porcentual determinados, a partir de medidas volumétricas. Este problema deviene del incumplimiento de la Ley de Amagat, ya que los volúmenes de las soluciones no se adicionan. La ecuación planteada por los autores citados expresada en términos de concentraciones volumétricas no resuelve tampoco el problema de una manera directa.
La reexpresión de la Ecuación [5] en términos de la concentración másica porcentual (˚Bx) y la temperatura permite derivar ecuaciones que se adaptan mejor a los requerimientos industriales y al mismo tiempo obtener una serie de algoritmos matemático-computacionales que proporcionan la posibilidad de generar menús sencillos en interfaces amigables para su utilización directa en planta. De esta manera se puede preparar soluciones de Brix y volumen conocidos utilizando medidas volumétricas características de planta (caudales, medidores de caudal, bombas, niveles, etc.), satisfaciendo los requerimientos de concentración másica utilizados ampliamente en la industria, y resolviendo el problema vigente, que se abordó en le presente trabajo.
La ecuación derivada reproduce los datos calculados con la Ecuación [5] con un error máximo inferior a 0.019%, que debería ser aceptable para cualquier propósito práctico, siendo además consistente desde un punto de vista termodinámico, al obedecer la Ecuación de Gibbs-Duhem en todo el rango de interés y de estudio.
9 Conclusiones
Se ha derivado una ecuación para la densidad de soluciones binarias de sacarosa-agua en función de la concentración másica porcentual (Bx) y la temperatura, que es termodinámicamente consistente y que permite obtener una solución determinada en volumen y concentración másica a partir de medidas volumétricas de soluciones conocidas, resolviendo de esta manera el problema abordado y común en plantas industriales.
Esta ecuación, que es consistente desde un punto de vista termodinámico, fue determinada con base a medidas experimentales disponibles en la literatura técnica y ajustada a ecuaciones de grado superior por sus autores, como dependientes de las concentraciones volumétricas.
Notación
a, b, c = vectores columna de coeficientes de la Ecuación [5]
Bx, Br = grados Brix
co= matriz de coeficientes de la Ecuación [10]
m= masa
P = Presión
S = Concentración volumétrica de sacarosa
T = Temperatura
![]() = Volumen especifico
= Volumen especifico
![]() = Volumen parcial
= Volumen parcial
x = fracción másica
Letras griegas
ρ= densidad de las soluciones
φ = función definida por la Ecuación [8]
Subíndices
a = se refiere al agua
i = se refiere al componente i
j = se refiere a todos los componentes menos el i
s = se refiere a la sacarosa
Superíndices
E = se refiere al una propiedad de exceso
id = se refiere al comportamiento ideal
Citas Bibliográficas
[1] Darros - Barbosa, R., Balaban, M. O. y Teixeira A. A., ”Temperature and Concentration Dependence of Density of Model Liquid Foods”, International Journal of Food Properties, Vol. 6, No. 2, pp 195-214, 2003 [ Links ]
[3] Ibid
[4] Prausnitz, J.M, Lichtenthaler, R. N and E. Gomes de Azevedo, “Molecular Thermodynamics of Fluid-Phase Equilibria”, 3rd Ed, Prentice Hall International Series in the Physical and Chemical Engineering Sciences, pp 245-247. [ Links ]