Cuadernos Hospital de Clínicas
versión impresa ISSN 1562-6776
Cuad. - Hosp. Clín. vol.54 no.1 La Paz 2009
ARTÍCULOS ORIGINALES
Evaluación de la eficacia de la cloroquina para el
tratamiento de la malaria por Plasmodium vivax en
Yacuiba, Tarija, Bolivia
Eddy Martínez1, Wigberto Omar Yucra2, Victorina Castro2, Ruth Vilma Figueroa2, Lidia De la Cruz2,
Ceferino Téllez2, Juan Carlos Avila3, René Mollinedo4, José Pablo Escobar5, Pamela Duran6
1. Unidad de Parasitología, Medicina Tropical y Medio Ambiente, Instituto de Investigación en Salud y Desarrollo (IINSAD); Cátedra de Parasitología, Facultad de Medicina, Universidad Mayor de San Andrés, La Paz, Bolivia; 2. Centro de Salud Palmar Chico, Yacuiba; Servicio Departamental de Salud de Tarija (SEDES Tarija), Bolivia; 3. Programa Regional de Malaria, Guayaramerín, Beni, Bolivia; 4. Servicio Departamental de Salud de Salud de Oruro (SEDES Oruro), Bolivia; 5. Consultor Organización Panamericana de la Salud (OPS/OMS); 6. Instituto Nacional de Laboratorios de Salud (INLASA)
Correspondencia: Eddy.Martinez.A@gmail.com
RESUMEN
Se realizó una evaluación in vivo de la eficacia de la cloroquina para el tratamiento de la malaria por Plasmodium vivax, en el sitio centinela de Palmar Chico, Municipio de Yacuiba, Provincia Gran Chaco, Departamento de Tarija al Sur de Bolivia. Fueron incluidos en el estudio 61 pacientes entre 5 y 59 años de edad que presentaban monoinfección por P. vivax. Todos los pacientes recibieron una dosis total de cloroquina de 25 mg/Kg en 3 días (10mg/Kg el primer día; 7,5 mg/Kg el segundo y tercer días). De acuerdo al protocolo estandarizado de la OPS/OMS, todos los pacientes fueron seguidos por 28 días (controles clínicos y parasitológicos). Se completó el seguimiento de 60 pacientes, ninguno de los pacientes tuvo recurrencias de la parasitemia o presentó manifestaciones clínicas después del tercer día de tratamiento. Este estudio mostró 100% de sensibilidad de P. vivax a la cloroquina, lo que justifica su permanencia en la política de medicamentos antimaláricos como la droga más adecuada para el tratamiento de las infecciones por P. vivax en el Sur de Bolivia.
PALABRAS CLAVE: Plasmodium vivax, malaria, drogas antimaláricas, resistencia a los antimaláricos, cloroquina, Bolivia.
ABSTRACT
We carried out an evaluation in vivo of the chloroquine efficacy for the treatment of malaria by Plasmodium vivax, in the sentinel site of Palmar Chico, Municipality of Yacuiba, Province Gran Chaco, Department of Tarija to the South of Bolivia. Sixty one patients aged between 5 and 59 years that presented monoinfection by P. vivax were included in the study. All patient received under supervision a total dose of chloroquine 25mg/kg over three days (10mg/kg on the first day; 7.5 mg/kg on the second and third days). According the standardized protocol of the PAHO/WHO, all patients were followed-up for 28 days (clinical and parasitological controls). Sixty patients completed the follow-up, none of the patients had recurrences of parasitemia or presented clinical manifestations after third day of treatment. This study showed 100% of sensibility from P. vivax to chloroquine, what justifies their permanency in the antimalarial drug policy as the most adequate drug for the treatment of the P. vivax infections in the South of Bolivia.
KEYWORDS: Plasmodium vivax, malaria, antimalarial drugs, antimalarial-resistance, chloroquine, Bolivia.
Cómo citar este artículo: Martínez E, Yucra WO, Castro V, Figueroa RV, De la Cruz L, Téllez C, Avila JC, Mollinedo R, Escóbar JP, Durán P. Evaluación de la eficacia de la cloroquina para el tratamiento de la malaria por Plasmodium vivax en Yacuiba, Tarija, Bolivia. Cuad Hosp Clín 2009;54:27-33
INTRODUCCIÓN
La malaria es un problema prioritario en la salud pública de Bolivia, que afecta a ocho de los nueve Departamentos del país. Las zonas de mayor transmisión se encuentran en la Amazonia (Departamento de Pando y norte de los Departamentos de Beni, La Paz y Santa Cruz) endémica en Plasmodium vivax y Plasmodium falciparum. En las demás zonas circula solamente P. vivax, las zonas más endémicas en malaria por esta especie se encuentran en la región del Chaco del Departamento de Tarija. En Bolivia más del 90% de los casos corresponden a infecciones por P. vivax las cuales son tratadas con cloroquina y primaquina desde hace aproximadamente 50 años. No existe evidencia documentada de resistencia de esta especie a la cloroquina, sin embargo muchos estudios en otros países han identificado resistencia de P. vivax a la cloroquina.
El año 1998 se presentó la última epidemia de gran magnitud con 74.350 casos y 24 muertes, la incidencia parasitaria anual (IPA) fue de 28 casos por cada mil habitantes. Desde entonces se registró una reducción sostenida en la transmisión (Ministerio de Salud y Deportes 2008). Esto se manifiesta principalmente en una baja transmisión de P. falciparum, que entre otras cosas puede ser atribuible al fortalecimiento de la vigilancia epidemiológica y control de la malaria en la Amazonia, particularmente en lo que respecta a la introducción de la terapia combinada en base a mefloquina (MQ) más artesunato (AS) después de los resultados de una investigación desarrollada el año 2001, que mostraba 100% de sensibilidad de P. falciparum a la monoterapia con artesunato o combinado con mefloquina.1
A pesar de la disminución de la incidencia de la malaria en la Amazonia, aun persisten zonas fuera de este territorio donde existe importante transmisión de P. vivax y no se han llevado a cabo estudios sobre la eficacia de la cloroquina contra P. vivax. Este punto amerita una consideración especial, porque es la droga que se utiliza en Bolivia por muchas décadas y aunque no hay evidencia de resistencia en este país, preocupa que existan varias publicaciones de cloroquinoresistencia de P. vivax, tanto en el Viejo Mundo, como en América,2-19 existen reportes de resistencia en países vecinos, específicamente Brasil y Perú.4-6,16,18-20
Es así que como parte de las políticas de vigilancia de la resistencia a los antimaláricos, se ha desarrollado una red de vigilancia de la resistencia en los países amazónicos AMI/RAVREDA (Amazon Malaria Initiative/Red Amazónica para la Vigilancia de la Resistencia a las Drogas Antimaláricas),21 que compromete a todos los países a revisar su política de medicamentos antimaláricos tomando como base la evidencia científica producto de la evaluación de la eficacia de los distintos esquemas que los diferentes países utilizan para el tratamiento de la malaria. En ese marco, se han elaborado protocolos estandarizados y normalizados para la evaluación de los diferentes esquemas terapéuticos.22 En cada país se establecieron sitios centinela estratégicamente ubicados, y en el caso de Bolivia existen sitios centinela en la Amazonia y en el extremo sur del país, este sitio centinela del sur, es particularmente interesante, porque corresponde a una zona de transmisión estacional donde solamente circula P. vivax y es el sitio centinela ubicado más al sur del Subcontinente Sudamericano, considerando que la especie predominante en América es P. vivax.
En el marco de esa iniciativa subregional, se han priorizado los protocolos de evaluación in vivo de la resistencia a los antimaláricos, situación sobre todo útil para P. vivax, porque o se conoce poco o no se han identificado plenamente marcadores moleculares de resistencia; por otra parte, la posibilidad de explorar la eficacia/resistencia in vitro no es factible para esta especie, porque cultivar P. vivax es extremadamente difícil y prácticamente imposible. Contrastando con esta situación, la evaluación de resistencia de P. falciparum a los antimaláricos es posible mediante la identificación de marcadores moleculares de resistencia ampliamente conocidos o mediante pruebas in vitro con parásitos cultivados. Los protocolos más usados en las Américas, siguen los lineamientos de la OMS/OPS, que fueron revisados y adecuados para los estudios de eficacia de los medicamentos contra P. vivax.22
La cloroquina (CQ), es la droga utilizada en toda América para el tratamiento de la malaria por P. vivax, es una 4-aminoquinolina de acción esquizonticida marcada y rápida contra las infecciones por P. vivax, Plasmodium malariae y Plasmodium ovale.18 Si bien en varios países existe resistencia de P. falciparum a este antimalárico, todavía hay lugares donde la cloroquina es eficaz contra esta especie, por ejemplo Centroamérica.18,20 Una de las ventajas adicionales de la cloroquina es su eficacia contra las formas sexuadas (gametocitos), aunque no tiene ninguna eficacia sobre los hipnozoitos.18
Lamentablemente, ya existen muchos reportes de resistencia de P. vivax a la CQ, los primeros casos fueron reportados en Papua Nueva Guinea en 1989 y posteriormente en Indonesia y Myamar.18,23 Existen algunos lugares de Indonesia y Papua Nueva Guinea donde 20-30% de los pacientes infectados por P. vivax y tratados con CQ (25 mg base/Kg de peso) tienen parasitemia recurrente una a tres semanas después.18,23 Un estudio realizado en 1995, en Irian Java en Indonesia mostró resistencia de P. vivax a la cloroquina en por lo menos 44 % de los casos.13,14
Cada vez hay más evidencia de resistencia a la cloroquina por P. vivax en el mundo. El año 1996 un estudio reportó en Guyana tres pacientes en los cuales el esquema habitual de 25mg/kg de CQ fracasó en eliminar la parasitemia a pesar de que los niveles de la droga en sangre eran adecuados.11 En la región amazónica de Brasil, se reportó el año 1999 el caso de una niña con parasitemia persistente por P. vivax luego de recibir un esquema supervisado de CQ a la dosis de 10 mg/kg, el primer día y 7,5 mg/kg el segundo y tercer días.16 Asimismo, se reportaron tres casos de P. vivax resistente a la CQ en Colombia.17 Sin embargo, en estas últimas publicaciones, no se midieron las concentraciones del antimalárico en sangre, por lo que lamentablemente, no se pudo conocer si la concentración del producto era la adecuada para alcanzar los niveles terapéuticos. Contrariamente, un estudio en el Perú, realizado entre 1996-2001, reportó RI tardía al tratamiento de P. vivax con CQ 25 mg/kg en el 3% (2 pacientes) en Iquitos y de 4.6% (2 pacientes) en Coballococha; en dos de estos casos los niveles de CQ y su metabolito principal desetilcloroquina eran ³ 100 ng/ml, un nivel que se considera suficiente para eliminar todos los parásitos en sangre.19
Otros informes sobre infecciones por P. vivax resistentes a la CQ en las Américas son menos convincentes, ya que las parasitemias recurrentes ocurrieron después de 28 días de tratamiento y por lo tanto, probablemente fueron debidas a recidivas o reinfecciones. Es extremadamente difícil definir la situación de resistencia en las infecciones por P. vivax, porque en esta especie existen hipnozoitos, a diferencia de P. falciparum. En consecuencia, una parasitemia recurrente pudiese ser producto de la recidiva de una infección anterior a partir de los hipnozoitos, o en zonas de alta transmisión, pudiese tratarse de una reinfección.
En Bolivia las evaluaciones de la resistencia a los antimaláricos han sido realizadas sobre P. falcíparum en la zona Amazónica. Aunque actualmente no se tiene evidencia concluyente de casos de resistencia de P. vivax a la CQ en Bolivia, el Ministerio de Salud y Deportes (MSyD) con apoyo de la OPS/OMS y USAID-PROSIN, realizaron el presente estudio para disponer de una línea base bien documentada de la eficacia de la CQ en el tratamiento de la malaria por P. vivax, como parte de su esfuerzo por fortalecer la política nacional de medicamentos antimaláricos.
MATERIALES Y MÉTODOS
Sitio de Estudio
Para la ejecución del estudio se definió como sitio centinela al Centro de Salud de Palmar Chico, Municipio de Yacuiba, Departamento de Tarija, localizada en la Región del Chaco boliviano en la frontera con Argentina (Figura 1).
El Municipio de Yacuiba, provincia Gran Chaco, presenta transmisión estacional solo de P. vivax; durante el 2003, se registraron 1.228 casos de malaria, con una IPA de 19 por 1.000 habitantes (Ministerio de Salud y Deportes, 2004).
El estudio fue realizado durante el primer semestre de 2003. El equipo de investigación estuvo conformado por un médico, 2 auxiliares de enfermería y 2 técnicos microscopistas. Para garantizar el adecuado cumplimiento del protocolo se realizó capacitación al equipo del sitio centinela y supervisiones durante los primeros días y al menos cada 4 semanas.
Se siguió la metodología estandarizada OPS/OMS, y para el análisis e interpretación de los resultados se utilizó la clasificación en fracaso terapéutico y respuesta clínica adecuada.22 El protocolo de investigación fue aprobado por el Comité Nacional de Ética y Bioética.
Criterios de inclusión
Edad entre 5 y 60 años, fiebre documentada (temperatura axilar ³37,5ºC) ó antecedente de fiebre durante las 48 horas anteriores; infección por P. vivax confirmada por microscopía; densidad parasitaria entre 250 y 100.000 parásitos asexuados por μl; voluntad del paciente para asistir al seguimiento de 28 días; consentimiento informado del paciente mayor de edad ó de su padre/tutor (en caso de niños), aceptación del menor (de 8 a 17 años).
Criterios de exclusión
Presencia de señales de peligro: vómitos más de 2 veces en las 24 h precedentes, convulsiones en 24 h anteriores, conciencia afectada, no poder sentarse ni mantenerse de pie, mujeres gestantes, presencia de enfermedades concomitantes, antecedente de hipersensibilidad a la CQ, señales de malaria grave (criterios de OMS) y antecedente reciente de uso de antimaláricos.
El tamaño de muestra se calculó con base al protocolo OPS/OMS, teniendo en cuenta una proporción de falla terapéutica menor del 5%, un nivel de confianza del 95% y una precisión del 10%; considerando un porcentaje de pérdida del 10%, se determinó estudiar 60 pacientes enfermos con malaria por P. vivax. El análisis de la información fue realizado con la ayuda del programa Epi-Info 2002.
El esquema de tratamiento de la malaria por P. vivax en Bolivia, se basa en la administración de CQ 25 mg base por Kg de peso, asociado a la Primaquina (PQ).24 Para evaluar la eficacia de la cloroquina, se administró solamente CQ en forma estrictamente supervisada a la dosis mencionada (que en la época se dividía en 10 mg/Kg el día 1 y 7,5 mg/Kg los días 2 y 3) y se hizo un seguimiento de la parasitemia y evaluación clínica durante 28 días. Luego de terminado el seguimiento se administró la primaquina a las dosis recomendadas, para la cura radical, porque actúa contra los gametocitos y contra los hipnozoitos.
Los medicamentos fueron adquiridos por el MSyD a través de OPS/OMS (Lote 0004059, Laboratorio Southwest N2 Farmaceutical, Factory Chong Quin, China); presentación tabletas de 150 mg CQ base, expiración 04, 2004).
Los pacientes incorporados en el estudio fueron detectados de forma pasiva y mediante detección activa. Se aplicó un seguimiento de 28 días, con evaluaciones clínicas y control de la parasitemia los días 0, 1, 2, 3, 7, 14, 21 y 28; se tomaron muestras de sangre para medir los niveles de cloroquina en sangre y en papel filtro para estudios moleculares (pruebas a realizar si se presentaban casos sospechosos de resistencia).
La toma de muestras, coloración de las láminas con Giemsa 1/10 y lectura de las gotas gruesas y frotis (doble ejemplar) se realizó siguiendo los procedimientos recomendados por el MSyD. Se realizó el diagnóstico y la cuantificación de la parasitemia a doble ciego por 2 microscopistas. La cuantificación por μl de sangre, se realizó con la siguiente fórmula:

En caso de discordancia, se recurrió a un tercer lector; se hizo supervisión mensual in situ y el control de calidad externo de las muestras fue realizado en el Instituto Nacional de Salud (INS) de Lima, Perú.
RESULTADOS
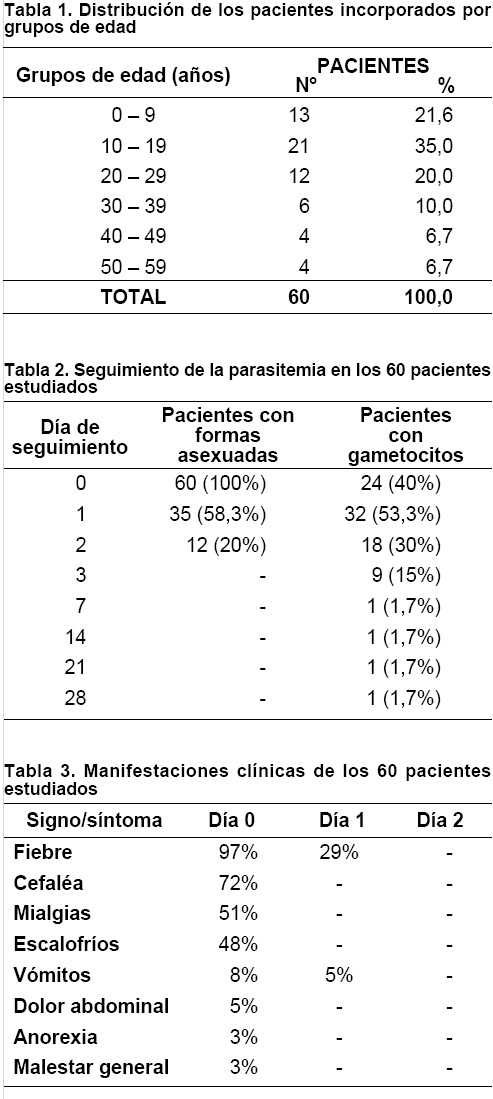
El estudio se realizó entre marzo y julio del 2003; en ese lapso fueron atendidos por sospecha de malaria 542 pacientes, de los cuales 189 se confirmaron positivos para P. vivax y 61 fueron incluidos en el estudio. De los 61 pacientes incorporados, 60 completaron el estudio (Tabla 1) (18 mujeres = 30% y 42 hombres = 70%) y 1 abandonó en el día 7 porque tuvo que trasladarse a otra zona.
Las densidades parasitarias del día 0 oscilaron entre 315 a 57.210 parásitos por microlitro. La parasitemia en los pacientes puede observarse en la Tabla 2. Todos fueron negativos para parásitos asexuados el tercer día de tratamiento y ninguno presentó parasitemia recurrente hasta el día 28 de seguimiento. Asimismo se observaron gametocitos, con una densidad parasitaria en el rango de 12 a 276 formas sexuadas por μl de sangre (Tabla 2).
Las manifestaciones clínicas son detalladas en la Tabla 3, de acuerdo a su frecuencia. El día 2 cuando se administró la última dosis de CQ ningún paciente presentaba signos o síntomas de la enfermedad y tampoco hubo recurrencia clínica durante el tiempo de seguimiento.
Un paciente presentó prurito luego de la primera dosis de CQ, 10 pacientes luego de la segunda y 7 pacientes luego de la tercera dosis, 2 de los cuales permanecieron con esta manifestación clínica hasta un día después de terminado el tratamiento.
DISCUSIÓN
El presente estudio pone en evidencia 100% de eficacia de la CQ para el tratamiento de la malaria por P. vivax en las zonas endémicas del sur de Bolivia, sustentado así la actual política de medicamentos antimaláricos, que se basa en la administración de CQ a la dosis total de 25mg/Kg, más primaquina.18,20,25 La eficacia de la primaquina como gametociticida y como hipnozoiticida debe ser explorada para completar los estudios de eficacia del tratamiento antimalárico.
Los resultados obtenidos pueden ser útiles para inferir una situación similar en las zonas fronterizas endémicas en malaria de Argentina y Paraguay. Asimismo, la información nos permite suponer que la eficacia de la CQ es adecuada en el resto de las zonas endémicas del país en P. vivax, excepto en la Amazonia, porque debido a su elevada transmisión y particularidades epidemiológicas, la evaluación de la eficacia de la CQ para el tratamiento debe ser producto de un estudio específico en sitios centinela de esa zona.
Los resultados muestran asimismo la eficacia complementaria de la CQ sobre las formas sexuadas (gametocitos).18
Los efectos colaterales de la CQ también se pusieron en evidencia, por la presencia de prurito, aspecto bien conocido para esta droga,18,24,25 que no complica su utilización como antimalárico.
El estudio realizado en el sitio centinela de Palmar Chico, fue calificado como exitoso y felicitado por el CDC.
El año 2004, se realizó un ajuste en el esquema de tratamiento con cloroquina manteniendo la dosis total de 25mg/Kg de peso, actualmente la administración es de 10mg/Kg de peso los días 1 y 2 y 5 mg/Kg de peso el tercer día. Este ajuste se debió a recomendaciones de la OPS/OMS y a la experiencia documentada de varios países, basada en el hecho de que la administración de 10mg/Kg los 2 primeros días permite mantener mayores concentraciones estos días con la consecuente mayor eficacia contra los parásitos. Por otra parte se realizó también un ajuste en la dosis de primaquina, de 0,25mg/Kg peso día durante 14 días a 0,5 mg/Kg por 7 días, manteniendo la dosis total, lo que implicó doblar la dosis día y disminuir el tiempo de tratamiento a la mitad, para aumentar la adherencia al tratamiento. Existen estudios que muestran una mayor adherencia sin incremento significativo de los efectos colaterales. En resumen, el esquema de tratamiento actual de la malaria por P. vivax en Bolivia es CQ 10mg/Kg peso los días 1 y 2, 5 mg/Kg de peso el día 3; asociado a la primaquina 0,5mg/Kg de peso durante 7 días.
Según las normas establecidas, es recomendado realizar periódicamente, estudios para el monitoreo de la eficacia de los antimaláricos que sustenten las políticas de medicamentos antimaláricos, en los sitios centinela establecidos en cada país. Para Bolivia los sitios centinela están definidos en Tarija para el monitoreo de la sensibilidad/resistencia de las zonas subtropicales endémicas en malaria por P. vivax al Sur y en Beni para el monitoreo de las zonas coendémicas en P. vivax y P. falciparum en la Amazonia.
AGRADECIMIENTOS
A las autoridades del nivel central del Ministerio de Salud y Deportes, quienes facilitaron la realización del estudio. Al Dr. Trenton Ruebush del Centro de Control de Enfermedades (CDC), Atlanta, Estados Unidos, por el apoyo técnico y la supervisión para la adecuada conducción del estudio; al Dr. Roberto Montoya, Coordinador Regional de la Red Amazónica de Vigilancia de Resistencia a las Drogas Antimaláricas, OPS/OMS, por su asesoría para la realización y supervisión del estudio. A los funcionarios de los niveles departamentales y locales del Ministerio de Salud y Deportes, que apoyaron la realización del estudio: Dr. Renán Justiniano, Director Servicio Departamental de Salud (SEDES), Tarija; Lic. Olga Poma, Gerente de Red de Servicios de Salud, Yacuiba; Dr. Angel Canaviri, Centro de .Salud El Palmar, Yacuiba; Tec. Sabino Velásquez, Supervisor Malaria, Yacuiba; Dr. Ivar Bejarano, Jefe Vectores, SEDES, Tarija; Tec. José Luis Marín, Jefe Malaria, SEDES Tarija; Lic. Dolores Rengel, Laboratorio de Salud Pública, SEDES, Tarija; Tec. Alberto Encinas y Tec. Hector Torrejón, Yacuiba. Al Instituto Nacional de Salud (INS) de Lima, Perú, por apoyar con el control de calidad externo de las láminas (frotis y gota gruesa) para el diagnóstico de malaria.
REFERENCIAS
1. Avila, JC, Villarroel, R, Marquiño, W, Zegarra, J, Mollinedo, R, Ruebush, T. Efficacy of mefloquine and mefloquineartesunato for the treatment of uncomplicated Plasmodium falciparum malaria in the Amazon region of Bolivia. Trop Med Int Health 2004;9(2):217-221. [ Links ]
2. Arias AE, Corredor A. Low response of Colombian strains of Plasmodium vivax to classical antimalarial therapy. Trop Med Parasitol 1989;40(1):21-23.
3. Sckwartz IK, Lackritz EM, Patchen LC. Chloroquine-resistant Plasmodium vivax from Indonesia. N Engl J Med 1991;324(13):927.
4. Bada JL, Cabezos J. Chloroquine-resistant Plasmodium vivax in Brazil. Trans R Soc Trop Med Hyg 1992;86(5):570.
5. Garavelli PL, Corti E. Chloroquine resistance in Plasmodium vivax: the first case in Brazil. Trans R Soc Trop Med Hyg 1992;86(2):128.
6. Loyola EG, Rodriguez MH. Chloroquine-resistant Plasmodium vivax in Brazil. Trans R Soc Trop Med Hyg 1992;86(5):570.
7. Schuurkamp GJ, Spicer PE, Kereu RK, Bulungol PK, Rieckman KH. Chloroquine-resistant Plasmodium vivax in Papua New Guinea. Trans R Soc Trop Med Hyg 1992;86(2):121-122.
8. Myat-Phone-Kyaw, Myint-Oo, Myint-Lwin, Thaw-Zin, Kyin- Hla-Aye, Mwe-New-Yin. Emergence of chloroquine-resistant Plasmodium vivax in Myanmar (Burma). Trans R Soc Trop Med Hyg 1993;87(6):687.
9. Marlar-Than, Myat-Phone-Kyaw, Aye-Yu-Soe, Khaing-Gyi, Ma-Sabai, Myint-Oo. Development of resistance to chloroquine by Plasmodium vivax in Myanmar. Trans R Soc Trop Med Hyg 1995;89(3):307-308.
10. Garg M, Gopinathan N, Bodhe P, Kshirsagar NA. Vivax malaria resistant to chloroquine: case reports from Bombay. Trans R Soc Trop Med Hyg 1995;89(6):656-657.
11. Phillips EJ, Keystone JS; Kain KC. Failure of combined chloroquine and high-dose primaquine therapy for Plasmodium vivax malaria acquired in Guyana, South America. Clin Infect Dis 1996;23(5):1171-1173.
12. Dua VK, kar PK, Sharma VP. Chloroquine resistant Plasmodium vivax malaria in India. Trop Med Int Health 1996;1(6):816-819.
13. Baird JK, Leksana B, Msbar S, Fryauff DJ, Sutanihardja MA, Suradi, Wignall FS, Hoffman SL. Diagnosis of resistance to chloroquine by Plasmodium vivax: timing of recurrence and whole blood chloroquine levels. Am J Trop Med Hyg 1997a;56(6):621-626.
14. Baird JK, Wiady I, Fryauff DJ, Sutanihardja MA, Leksana B, Widjaya H, Kysdamaranto, Subianto B. In vivo resistance to chloroquine by Plasmodium vivax and Plasmodium falciparum at Nabire, Irian Jaya, Indonesia. Am J Trop Med Hyg 1997b;56(6):627-631.
15. Fryauff DJ, Tuti S, Mardi A, Masbar S, Patipelohi R, Leksana B, Kain KC, Bangs MJ, Richie TL, Baird JK. Chloroquineresistant Plasmodium vivax in transmigration settlements of West Kalimantan, Indonesia. Am J Trop Med Hyg 1998;59(4):513-518.
16. Alecrim MC, Alecrim W, Macedo V. Plasmodium vivax resistance to chloroquine (R2) and mefloquine (R3) in Brazilian Amazon Region. Revista da Sociedade Brasileira de Medicina Tropical 1999;32(1):67-68.
17. Soto J, Toledo J, Gutierrez P, Luzz M, Llinas N, Cedeno N, Dunne M, Berman J. Plasmodium vivax clinically resistant to chloroquine in Colombia. Am J Trop Med Hyg 2001;65(2):90-93.
18. World Health Organization. The use of Antimalarial Drugs. Report of a WHO Informal Consultation. WHO/CDS/RBM/2001.33. WHO Geneva, 2001. 141p.
19. Ruebush T, Zegarra J, Cairo J, Andersen EM, Green M, Pillai DR, Marquiño W, Huilca M, Arevalo E, Garcia C.












 uBio
uBio 

