Services on Demand
Journal
Article
Indicators
Related links
Share
Cuadernos Hospital de Clínicas
Print version ISSN 1562-6776
Cuad. - Hosp. Clín. vol.53 no.1 La Paz 2008
ARTICULO ORIGINAL
Asociación de los genes implicados en la codificación de proteina de unión a la penicilina 2a (pbp2a) con la expresión fenotípica de resistencia a la meticilina en cepas De staphylococcus spp.
Msc. Aneth Vasquez Michel * Msc. Giovanni García Radai ** Dr. Milton Lobo Ozuna***
RESUMEN
OBJETIVO
Determinar si existe asociación entre genes implicados en la codificación de PBP2a con la expresión fenotípica de resistencia a meticilina en cepas de Staphylococcus spp.
DISEÑO
Descriptivo Transversal
METODOLOGIA
Se determinó la resistencia y sensibilidad de 67 aislamientos, mediante pruebas fenotípicas (difusión en disco, concentración inhibitoria mínima CIM, producción de PBP2a y pruebas genotípicas para detectar los genes mecA y sus reguladores mecR1 y mecI por Reacción en Cadena de la Polimerasa (PCR).
RESULTADOS
De 9 cepas de S. aureus resistentes por difusión en disco solo 1 fue sensible por CIM. De 7 cepas resistentes por CIM, fueron sensibles por difusión en disco. Por el contrario las 7 cepas de Staphylococcus coagulasa negativo sensibles por difusión en disco fueron resistentes por CIM. En cuanto a la prueba de producción de PBP2a, los resultados fueron discordantes con la prueba de difusión en disco en 20 % y con CIM en 34% . El genotipo, reveló: 60 cepas de S. aureus 10(17%), y 7 cepas de Staphylococcus coagulasa negativo, 4 (57%) son portadoras del gen mecA. De las 10 cepas de S. aureus mecA positivo, 5 portan el gen mecR1 y 7 portan el gen mecI. De las 4 cepas de Staphylococcus coagulasa negativo mecA positivo 2 portan el gen mecR1 y 2 portan el gen mecI.
CONCLUSION
No existe asociación entre fenotipo y genotipo en cepas de Staphylococcus spp. resistentes a meticilina. ya que la resistencia obedece a múltiples factores que las pruebas fenotípicas clásicas no engloban.
PALABRAS CLAVE:
Rev. Cuadernos 2008, Vol. 53 No.1(Pags.31 - 37) Staphylococccus meticilina resistentes (MRS), Staphylococcus aureus, ,Staphylococcus coagulasa negativo, Proteínas de unión a la Penicilina 2a (PBP2a), genotipo, fenotipo, meticilina.
ABSTRACT
OBJECTIVE
Determining the association between genes involved in the codification of Penicillin Binding Proteins 2A (PBP2A) with the phenotypic expression of methicillin resistance in Staphylococcus spp. strains
DESIGN
Descriptive cross sectional
METHODOLOGY
The sensitivity of 67 isolates was determined by means of a phenotypic test (disk diffusion, minimum inhibitory concentration CIM, production of PBP2a) and genotype tests to detect the mecA gene and its regulatory mecR1 and mecI by Polymerase Chain Reaction (PCR).
RESULTS
From 9 S. aureus resistant strains by disk diffusion 1 was sensitive by CIM, 7 CIM resistant strains were sensitive by disk diffusion. The 7 coagulase negative (CNS) sensitive strains by disk diffusion were resistant by CIM. By production of PBP2a, the results were discordant with the disk diffusion test in 20% and 34%with CIM.
The genotype, reveals that, from 60 S.aureus strains 10(17%), and 7 S. coagulase negative strains 4 (57%) carry the mecA gene. From 10 S. aureus mecA positive strains, 5 carry the mecR1 gene and 7 carry the mecI gene. Of the 4 strains of S.coagulase negative mecA positive 2 carry the mecR1 and 2 carry the mecI gene.
CONCLUSION
There is no association between genotype and phenotype in Staphylococcus spp. methicillin resistant strains, since, the resistance is due to many factors that the classical phenotypic test does not include.
KEYWORDS
Rev. Cuadernos 2008, Vol. 53 No.1(Pags.31 - 37) Staphylococcus aureus, coagulase-negative staphylococci , methicillin resistant Staphylococccus (MRS), Penicillin binding Protein 2a (PBP2a), genotype, phenotype,methicillin.
INTRODUCCIÓN
Las cepas de Staphylococcus meticilina - resistentes (MRSA) fueron identificadas en 19611 cuando se introdujeron las primeras Isoxazolilpenicilinas (meticilinas) en la práctica clínica. Esta resistencia fue denominada “intrínseca” ya que no se debía a la destrucción del antibiótico por la β-lactamasa. Datos epidemiológicos muestran que MRSA es una de las principales causas de infecciones nosocomiales mundial y ocurre en más del 40 % de todas las infecciones por Staphylococcus 2,3 En Bolivia, los registros epidemiológicos del programa de Vigilancia Epidemiológica de Resistencia a los Antimicrobianos (VERA) revelan que el año 1999 MRSA intrahospitalario tuvo una frecuencia del 3%. El año 2004 la frecuencia reportada fue del 38% (3) .Este incremento podría obedecer a fallas de diagnóstico en MRSA en años previos, que fue mejorando con el tiempo; otra probable razón puede ser la diseminación de estas cepas. Las formas prevalentes de resistencia a meticilina están caracterizadas por una proteína de unión a la penicilina (PBP) ligeramente diferente, denominada PBP2a (o PBP2’) que es inducible y está codificada por el gen mecA, que es parte de un cassette cromosómico: mec (SCCmec) del cual existen 4 tipos estructuralmente diferentes encontrados en cepas resistentes pero no en cepas sensibles1,2,4. Sin embargo la sola presencia del gen mecA no es suficiente para la expresión óptima de resistencia a meticilina, siendo crucial la presencia de los genes mecR1 y mecI, que codifican proteínas reguladoras tanto de expresión como de supresión de este gen. Por otro lado existen cepas que expresan fenotipicamente distintos tipos de resistencia a meticilina, entre las que podemos citar, cepas con resistencia homogénea, heterogénea, pre-meticilina resistencia, resistencia tipo eagle, resistencia borderline (BORSA)1 Como es posible evidenciar, los datos referentes a MRSA en Bolivia, llaman la atención en gran manera, mostrando un aparente incremento del 3% al 38% en pocos años. Si esto es real, Staphylococcus spp. merece suma atención, primero, para verificar este incremento, y segundo, para establecer su comportamiento epidemiológico. Es así, que este trabajo pretende analizar si existe asociación entre genes implicados en la codificación de PBP2a con la expresión fenotípica de resistencia a meticilina en cepas de Staphylococcus spp. circulantes en nuestro medio, y así poder establecer la relación entre los diferentes métodos utilizados actualmente y su confiabilidad al momento de reportar los resultados.
MATERIALES Y MÉTODOS
Muestras Las muestras para este estudio fueron enviadas a partir del segundo semestre del año 2004, desde los Hospitales Obrero, Hospital de Clínicas, Hospital Copacabana y Hospital Arco Iris, de la ciudad de La Paz, así como del Hospital Holandés de la ciudad de El Alto. El procesamiento de las muestras se llevo a cabo en las unidades de Antimicrobianos y Genética Bacteriana del Laboratorio Nacional de Referencia en Bacteriología Clínica, del Instituto Nacional de Laboratorios en Salud (INLASA), en la ciudad de La Paz. Cepas bacterianas Se recepcionaron 70 aislamientos, de los cuales tres fueron descartados debido a contaminación, por tanto, ingresaron al estudio 67 aislamientos, de los cuales, de acuerdo a criterios estándares de laboratorio, 60 corresponden a S. aureus y 7 a S. coagulasa negativo.
Todas las pruebas fueron realizadas el mismo día, en paralelo, a partir de cultivos puros Como controles se utilizaron, 3 cepas de referencia:
S. aureus ATCC 43300, S. aureus ATCC N315 (premeticilina resistente) y S. aureus ATCC h4 (eagle type), todas mec A positivas, una cepa S.aureus sensible a meticilina (MSSA) mec A negativa ATCC 29213 y una cepa de S. coagulasa negativo ATCC 12228, las mismas que fueron utilizadas para estandarizar las condiciones tanto de PCR como de las otras pruebas
Procesamiento de las muestras
Pruebas de identificación de especie
Se utilizaron los métodos de catalasa y coagulasa libre en tubo
Pruebas fenotípicas de determinación de resistencia
- *Prueba de difusión en disco en agar (Bauer-Kirby).-Se utilizaron discos de 1 µg de meticilina (Difco Laboratories, Detroit, MT, USA) colocados en agar Muller Hinton (bioBRAS), con adición de 2% de NaCl.
- *Prueba de confirmación o test de screening .-Las cepas resistentes (y si hubieran dudosas), fueron inoculadas en placas de agar Muller Hinton, suplementadas con 4% de NaCl y 6µgde meticilina por ml
- *Prueba de aglutinación de PBP2a (Slidex MRSA Kit).- Esta prueba (bioMerieux Vitek, Hazelwood, Mo) es de aglutinación combinada, basada en componentes de látex y hemaglutinación, que detectan coagulasa unida, proteina A y antígenos específicos de pared celular de Staphylococcus.
- *Concentración inhibitoria mínima (CIM).- La CIM de la meticilina (Sigma, St Louis, MO, USA) fue determinada por el método de microdilución en caldo, con 2 % de NaCl, luego de 24 horas de incubación a 35 ºC, usando 105 UFC/ml. Todos los procedimientos de determinación de sensibilidad y resistencia, así como valores de referencia se basaron en parámetros establecidos por el National Committee for Clinical Laboratory Standards (NCCLS)5,6.
Preparación del ADN cromosómico
Se utilizáron dos métodos: extracción por ebullición y extracción con cloroformo
Condiciones de PCR
El ADN extraído fue utilizado para la amplificación de los segmentos de interés, por PCR, en un volumen final de 20 µl, consistente en buffer de PCR 1X (1,5mM de MgCl2,); 0,25mM de cada desoxinucleotido trifosfato, 0,8 µM de cada oligonucleotido (tabla 1, Figura 1), 1 UI de Taq DNA polimerasa (Promega corporation, Madison, WI, USA. La amplificacion fue realizada en un termociclador (Px2
Thermo electrocorporation), utilizando el siguiente programa: desnaturalización inicial a 94ºC 4 minutos, 30 ciclos de: desnaturalización a 95ºC por 1 minuto, hibridación a 58ºC para mecA, y 55ºC para los genes reguladores por 1 minuto, extensión a 72 ºC por 2 minutos y una extensión final a 72 ºC por 4 minutos. Una muestra de 20 µl de cada reacción fue analizada por electroforesis en gel de agarosa (SIGMA EC No. 232-731-8) al 1,5 % con bromuro de etidio, como marcador de peso molecular fue utilizado DNA Ladder 100pb (invitrogen) .

tabla 1.Oligonucleótidos para PCR utilizados para detectar los genes mecA, mecI y mecR1. PB: dominio de unión a la penicilina; MS: región transmembrana de mecR1
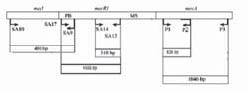
Figura 1. Representación esquemática de la organización genómica de la región mec. Las flechas indican la dirección de los oligonucleótidos usados. Los tamaños de los productos de PCR están incluidos. PB: dominio de unión a la penicilina; MS: región transmembrana de mecR1
RESULTADOS Las cepas recibidas por el INLASA, procedentes de los cinco centros de salud con el reporte diagnóstico de S. aureus y S. coagulasa negativos, fueron confirmadas utilizando los procedimientos estándares de detección de Staphylococcus. De 67 cepas estudiadas, 60 efectivamente, corresponden a S. Aureus y 7 corresponden a S. coagulasa negativos, resultando la concordancia del 90%.
Fenotipos de resistencia a meticilina
Aplicando el método de difusión en disco, en un total de 60 S.aureus se obtuvieron 9 cepas resistentes y las 7 cepas coagulasa negativas, fueron sensibles. Del total de cepas, por CIM, se encontraron 7 cepas S.aureus resistentes y las 7 S. coagulasa negativo fueron sensibles. En la figura 2, es posible apreciar los resultados tanto por difusión en disco confrontados con los de concentración inhibitoria mínima. De las 9 cepas S. aureus resistentes por difusión en disco detalladas anteriormente, 1 tiene un resultado discordante por CIM, es decir, fue sensible. Por otro lado las 7 cepas S. coagulasa negativo que fueron sensibles por difusión en disco dieron valores de resistencia por CIM.
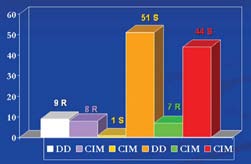
Figura 2. Comparación de resultados entre los métodos de difusión en disco y concentración inhibitoria mínima en el total de las cepas
Comparando un tercer método de determinación de sensibilidad y resistencia: el kit Slidex MRSA, basado en la detección de la proteína PBP2a por aglutinación. En el total de las cepas, observamos resultados discordantes con la prueba de difusión en disco en un 20% (14/67) y con la prueba CIM en un 34% (23/67) (fi gura 3).
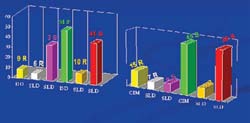
Determinación de los genes relacionados con resistencia a la meticilina De las 60 cepas de S. aureus, 10 (17%) fueron portadoras del gen mecA, detectados con al menos un par de oligonucleótidos, de los dos utilizados. De las 10 cepas mecA positivas, 3 (30%) no tuvieron alteraciones en su secuencia, puesto que la combinación p1-p2i dio un producto amplificado de 535 pares de bases (Figura 4), y con la combinación p1-p3 dio el producto de 1046pb (Figura 5).
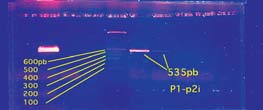
Figura 4. Amplifi cación de un segmento de mecA mediante el uso de par p1-p2i. Un marcador de Número de bases (Ladder 100bp) fue utilizado. Fuente: INLASA-LNRBC

Figura 5. Amplificación de un segmento de mecA, mediante el uso del par de oligonucleótidos p1-p3. También fue incluído un marcador de Número de pares de bases. Fuente: INLASA – LNRBC.
De las 10 cepas mecA positivas, 5 (50%) presentaron alteraciones en su secuencia al dar producto con los pares p1-p2i, pero no con el par p1-p3. Dos cepas (20%) presentaron alteración en su secuencia por ocurrir lo inverso (p1-p3 negativo).Así, en total,7 cepas (70%) son portadoras del gen mecA alterado en su secuencia. De 7 cepas de Staphylococcus coagulasa negativos, 4 (57%) tenían en su cromosoma el gen mecA. De estas,
sólo una (14%) portaba el gen intacto, mientras que tres (43%) presentaron alteraciones en su secuencia, en este caso no dieron producto de amplificación con el par p1-p3 . Para la detección de los genes reguladores mec1 y mecR1, fueron usados cinco oligonucleótidos, combinados en tres pares (Figura 1). La fracción que codifica la región Transmembrana (MS) de mecR1 fue detectada por el par SA14-SA13. La fracción de Unión a la Penicilina (PB), fue detectada por el par SA17-SA13 (Figura 6).

Figura 6. Productos de la amplificación de las dos regiones del gen mecR1: 310 pb para la región MS y 1593 pb para la región PB.
De las 10 cepas mecA positivas de S. aureus, 5 son portadoras del gen mecR1, de estas, 3 poseen el gen intacto y 2 tienen el gen alterado, ya que no dieron producto de amplificación sobre la región de unión a penicilina, pero sí sobre la región transmembrana . Realizando un análisis de concordancia entre los genes identificados, con cada uno de los métodos fenotípicos en ambas especies, obtuvimos los siguientes porcentajes: de 14 cepas mec A positivo, es decir que, serían resistentes basándonos en el genotipo, solo el 36 % fueron resistentes por difusión en disco y 64% fueron sensibles, 50% resistentes por CIM y 50% sensibles; finalmente un resultado similar al primero, encontramos por el kit slidex MRSA 36% fueron resistentes y 64% sensibles.
Por otro lado existe un porcentaje de cepas 43%, que siendo mecA positivo, fueron sensibles por los tres métodos fenotípicos.
DISCUSIONES
El principio de un buen resultado es una buena práctica. Así, no sólo es importante determinar la resistencia o sensibilidad de una cepa, en este caso, Staphylococcus, sino, previamente, haberla identificado correctamente. De ahí la necesidad de realizar la confirmación de los resultados obtenidos por los centros de salud participantes. Estas apreciaciones toman cuerpo, al observar los resultados en los cuales podemos verificar una concordancia sólo del 90 %, ya que de las 63 cepas reportadas como S. aureus, 5 corresponden a S.coagulasa negativo, y de las 4 reportadas como S.coagulasa positivo, en realidad sólo 2 lo son. Tomando en cuenta sólo los S.coagulasa positivo la discordancia es del 50% . Este tipo de errores afectaría dramáticamente en el reporte de sensibilidad y resistencia, ya que los puntos de corte, son diferentes para ambos grupos. Esto repercutiría epidemiológicamente, dando lugar a información errada. El efecto de este error sobre el paciente, también es relevante, porque el médico tomará una decisión acertada, por su criterio profesional, pero errada, por causa del reporte laboratorial. Fenotipos de resistencia a meticilina Aunque el método de difusión en disco es ampliamente utilizado en los laboratorios, para el género Staphylococcus, es el menos confiable para la determinación de resistencia a la meticilina1,7,8, ya que tiene baja capacidad de detección de cepas resistentes comparado con otros métodos, esto debido a las diferentes formas de expresión de resistencia de este género1 . Los esfuerzos para incrementar la sensibilidad de esta prueba con adición de NaCl al agar, o la incubación por 48 horas reduce la especificidad, particularmente para
S. Aureus, de todos modos, incubaciones más largas pueden mejorar la sensibilidad para la detección de cepas heterogéneas de S. coagulasa negativos, sin afectar apreciablemente la especificidad.1 Entonces, de acuerdo a las normas de la NCCLS 5,6, la lectura debe realizarse a las 48 horas, y esta podría ser la explicación del hallazgo de una cepa de S. aureus sensible por CIM entre las 9 resistentes por difusión en disco debido a la disminución de la sensibilidad. Pero algo más significativo todavía, es la detección de 7 cepas de S. coagulasa negativos resistentes por CIM, que fueron sensibles por difusión en disco, debido a la baja especificidad de esta última. Este hallazgo coincide con los resultados de otros estudios, en los cuales afi rman que los métodos convencionales a menudo tienen dificultades para detectar cepas resistentes a meticilina 1,7 El método del kit Slidex MRSA, aplicado para la detección de la proteína PBP2a no está validado por la NCCLS5,6. Sin embargo, existen reportes del uso del mismo, que muestran resultados óptimos8,9 . No obstante en nuestra práctica, los resultados de este, fueron los más discordantes entre los tres métodos.
El problema en este método radica en la característica de Staphylococcus de presentar cepas heterogéneas respecto a la resistencia a la meticilina1 . Algunas cepas meticilina resistentes, no expresarán la proteína PBP2a sin previa estimulación (cepas eagle type)10,11, y serán reportados como falsos negativos. Otras, que presentan resistencia a la meticilina por hiperproducción de β-lactamasas, no relacionadas con la producción de PBP2a, serán reportadas también como falsos negativos.1,2 La existencia de nueve casos resistentes por este kit, pero sensibles por difusión en disco y CIM, indicarían la presencia de la proteína PBP2a que no logra alcanzar una concentración suficiente para que pueda ser detectada por los otros dos métodos (reconocidos por la NCCLS). Esta apreciación está respaldada por investigaciones realizadas al respecto (1,2). Además, planteamos como hipótesis, la presencia de aglutinación por reacción cruzada con proteínas similares a PBP2a por lo menos a nivel de epítopes. Si esta hipótesis es válida, demostraría que el método Slidex MRSA no es confiable. Genes de resistencia a la meticilina De acuerdo a normas internacionales,5,6 la detección del gen mecA, al margen de cualquier resultado fenotípico con antimicrobianos, debe ser reportado como “meticilina resistente”. Entonces la expresión fenotípica, no es tan determinante como la genotípica, incluso, la detección de mecA, es considerada como la prueba “Gold Standard” para la resistencia a meticilina. Comparando con otros estudios7,12,13, la frecuencia de cepas portadoras del gen mecA, es baja (21%). Sin embargo algo que llama por demás la atención son los porcentajes tanto de concordancia como de discordancia que se expresan en los resultados, un buen porcentaje de cepas mecA positivo fueron negativas por difusión en disco, por CIM y por el kit slidex MRSA tanto en forma aislada como tomando en cuenta a los tres métodos; hecho que clínicamente se traduciría en una futura falla en el tratamiento. Estos resultados tampoco son reconfortantes, desde el punto de vista epidemiológico, puesto que los reportes sobre vigilancia epidemiológica en Bolivia3 por métodos fenotípicos, determinan un incremento de la resistencia entre los años 1999 y 2004 (de 3% a 38%). Con los hallazgos genéticos de este estudio, y puntualizando que la presencia del gen mecA está en directa relación con la resistencia a meticilina, podríamos inferir que estos porcentajes quizás son aún mayores, lo cual es bastante preocupante para los sistemas de salud de nuestra población Estudios realizados en otros países4, encuentran la secuencia del gen mecA altamente conservada, alcanzando valores de hasta 89% en S. aureus y 94.7% en S. coagulasa negativos. Sin embargo, este estudio, realizado sobre cepas bolivianas, halla una tasa baja de conservación de la secuencia del gen mecA 30% en S. aureus y 25% en S. coagulasa negativos. Esto probablemente se debe al tamaño de muestra insuficiente para determinar la confiabilidad del resultado. De todas maneras, el hallazgo de 14 cepas portadoras de mecA, de las cuales sólo 3 tienen el gen intacto es llamativo y sería un buen argumento para nuevos estudios. Si este resultado fuera significativo, indicaría que la secuencia no está lo suficientemente protegida de los diversos factores que llevan a la alteración de la secuencia. Además, la presencia de alteraciones no está dirigida a un solo punto, sino a dos (pudiera ser a mas lugares de la secuencia); ¿Qué tan beneficioso es para la clínica este hallazgo?. Respecto a la presencia del gen regulador positivo mecR1, y del gen regulador negativo mecI, en las cepas de S. aureus y S. coagulasa negativo mecA positivas, su importancia está enfocada a la asociación con el tipo de cassette cromosómico que podrían poseer, y por otra parte, a la asociación con el fenotipo de resistencia. Asociación del genotipo con el fenotipo de resistencia a meticilina Lo importante de realizar una asociación entre hallazgos genotipos y fenotipicos radica en la conclusión que podemos establecer en cuanto a qué tan confiables, sensibles y específicos son estos métodos, ya que como pudimos ver en los resultados, los métodos fenotípicos expresan variación aún entre ellos. Por otro lado el establecer la relación de ambos es bastante útil, ya que nos permitió, reconocer y detectar cepas que expresaron distintos tipos de resistencia, lo cual es prácticamente imposible de probar utilizando solo el fenotipo o el genotipo y cuya importancia radica en el efecto que estas causan en el tratamiento, así pudimos observar en S. aureus 5 premeticilinoresistentes, es decir, cepas fenotipicamente sensibles pero portadoras del gen mecA, su comportamiento se debe a una fuerte represión de la transcripción del gen mecA, ejercida por el gen mecI, que codifica la proteína represora MecI4,13. También se hallaron 4 cepas tipo eagle,10 es decir, presentan resistencia a altas concentraciones de meticilina 64-512 µg/ml, pero, sensibilidad a bajas concentraciones de meticilina 2-16 µg/ml. Son cepas heterogéneas, pero con tendencia a convertirse a cepas homoresistentes. Se obtuvo además 1 cepa tipo borderline (1) que es otro tipo de resistencia a la meticilina, exhibido por cepas resistentes que se caracterizan por presentar concentraciones inhibitorias mínimas a la meticilina, justo por encima del punto de susceptibilidad (4 a 8 µg/ml). Las cepas borderline que contienen mecA son cepas resistentes a la meticilina, extremadamente heterogéneas, que producen PBP2a1,14. Estas tienen una subpoblación de células resistentes, aunque muy pequeña que puede crecer a altas concentraciones de droga. Finalmente, luego del análisis de los resultados obtenidos, podemos concluir que no existe una asociación estrecha entre el fenotipo en cuanto a sensibilidad y resistencia, y la presencia de los genes implicados en la codificación de PBP2a. Sin embargo, como se pudo evidenciar, la resistencia a la meticilina obedece a m&uacu te;ltiples factores que los métodos fenotípicos clásicos no pueden englobar. La exploración genética de los Staphylococcus de mayor número de cepas, permitiría encontrar mayor diversidad a nivel de SCCmec, que aclararía, cómo, las distintas especies de Staphylococcus intercambian la información genética, relacionada con la multiresistencia a antibióticos, así como la presión selectiva del ambiente y su influencia fenotípica y genotípica.
AGRADECIMIENTOS
Al Dr. Rafael Sagárnaga Castaños, por su valioso aporte a este trabajo Al Dr.Giovanni García, por el gran aporte de conocimientos y sobre todo por su inigualable calidad humana y espiritual. Al Dr. Milton Lobo por su aporte y colaboración incondicional A los Drs. Keichi Hiramatsu y Teruyo Ito del departamento de Bacteriología de la universidad de Juntendo, Tokio-Japón, por su aporte con las cepas control y el apoyo logístico brindado incondicionalmente. A los responsables de los laboratorios de Bacteriología de los Hospitales: Arco Iris (Dr.Miltón Lobo), Obrero (Dr.Juan Callisaya), Hospital de Clínicas, Holandés (Dra.Claudia Portugal), Copacabana (Noemí Monzón), Luis Uría de la Oliva (Bladimir Feraudi); así como a los laboratorios MIC, La Paz y Bacter. Al personal del Laboratorio de Referencia Nacional en Bacteriología Clínica del I.N.L.A.S.A
REFERENCIAS
1. Chambers H.F. Methicillin resistance in Staphylococci: molecular and biochemical basis and clinical implications. Clin Microb Rev. 2001; 10: 781-91. [ Links ]
2. Tomasz, A., Drugeon, H., de Lancastre, D. New mechanism for methicillin resistance in Staphylococcus aureus: clinical isolates that lack the PBP2a gene and contain normal penicilin binding capacity. Antimicrob Agent Chemother. 1989; 33:1869-74.
3. Ministerio de Salud y Previsión Social, Instituto de Laboratorios en Salud. Laboratorio Nacional de Referencia Bacteriología Clínica. 2001. Vigilancia Epidemiológica de Resistencia a los Antimicrobianos (VERA) ,1999-2000. Boletín Informativo. [ Links ]
4. Kuroda, M.,Tohta,I. Uchiyama,T. Whole genoma sequencing of methicilin-resistant Staphylococcus aureus. Lancet.2001; 357:1225-40. [ Links ]
5. NCCLS. 2003. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically Approved Standard M7-A4. National Committee for Laboratory Standards.
6. NCCLS. 2003. Performance standards for disc antimicrobial susceptibility tests Approved Standard M2-A6. National Committee for Laboratory Standards.
7. Mehndirrata,P.L., S. Vidhani, and M.D. Mathur. A study on Staphylococcus aureus strains submitted to a reference laboratory. Indian J med. 2001; 114:90-4. [ Links ]
8. Smole Sandra. Sensitivity and Specifi city of an Improved Rapid Latex Agglutination Test for Identifi cation of Methicillin – Sensitive and Resistant Staphylococcus aureus Isolates. J. Clin. Microbiol.1998; 38:1109-1112.
9. Louie. L. Evaluation of Three Rapid Methods for Detection of Methicillin Resistance in Staphylococcus aureus. J. Clin. Microbiol 2000; 38:2170-2173. [ Links ]
10. Kondo, N., K. Kuwahara-Arai, H. Kuroda-Murakami, E. Tateda-Suzuki y K. Hiramatsu. Eagle-type methicillin resistance: new phenotype of high methicillin resistance under mec regulator gene control. Antimicrob. Agent Chemother 2001; 45:815-24. [ Links ]
11. Ito T., Katayama Y., Hiramatsu K. Cloning and nucleotide sequence determination of the entire mec DNA of pre-methicillinresistant Staphylococcus aureus N315. Antimicrob agent Chemother.1999;43(6): 1449-1458. [ Links ]
12. Katayama, Y., Ito, T., and Hiramatsu, K. Genetic Organization of Chromosome Region Surrounding mecA in Clinical Staphylococcal Strains: Role of IS431 – Mediated mecI Deletion in Expression of Resistance in mecA – Carrying Lowlevel Methicillin – Resistant Staphylococcus haemolyticus. Antimicrob.agents Chemother. 2001 Vol 45.7;1955-1963.
13. Franklin D. Lowy. Staphylococcus aureus infectious. New England Journal of medicine 2000; 339:520-32. [ Links ]
14. Berger-Bachi,B. Genetic basis of methicillin resistance in Staphylococcus aureus. Cell Mol. Life Sci 1999; 56:764-70. [ Links ]












 uBio
uBio 

