Introducción
La determinación de la estructura de edades y de los ritmos de crecimiento de los árboles es información básica para la gestión forestal sostenible de los bosques tropicales de América del Sur (Brienen & Zuidema 2007, Schöngart et al. 2007, López & Villalba 2016). Esta actividad requiere del fechado de maderas y de la evaluación fiable de los ritmos pasados y presentes del crecimiento de las diferentes especies (Villalba et al. 2006). Esta información no solo es válida para establecer las relaciones entre el crecimiento radial y el clima (Fritts 1976), sino también para determinar las tasas anules de crecimiento, los ciclos de rotación forestal y la edad que alcanzan los rodales en diferentes hábitats (Worbes & Junk 1999, Schöngart 2008, López et al. 2013). Asimismo, los cambios en el crecimiento permiten evaluar la respuesta del bosque a la intervención humana o simplemente a una determinada práctica silvicultural (Brienen & Zuidema 2005, Peña- Claros et al. 2008).
En comparación con otras técnicas de monitoreo del crecimiento que requieren años, incluso décadas para obtener resultados válidos, los anillos de crecimiento proveen información muy valiosa en forma práctica, económica y a corto plazo (Eckstein et al. 1981). Sin embargo, la aplicación de las técnicas dendrocronológicas en árboles tropicales todavía está limitada a pocas especies, mayormente a aquellas explotadas maderablemente con anillos de crecimiento visibles de carácter anual, de leño blando, y con relativamente buena uniformidad circular o bandas de crecimiento no muy irregulares (López & Villalba 2016). La aplicación de esta técnica dendrocronológica en biomas tropicales estuvo asociado principalmente a la incorporación de nuevas especies maderables al mercado (Brienen et al. 2020, López & Villalba 2016). En este sentido, la incorporación de la dendrocronología en los bosques tropicales es reciente y acompaño el uso de especies y sitios no anteriormente explotados (Brienen & Zuidema 2005, López & Villalba 2020, López et al. 2022).
Las condiciones climáticas en la provincia biogeográfica del Cerrado boliviano, con una estacionalidad marcada en las precipitaciones entre el periodo seco y el húmedo, brinda condiciones favorables para la formación de anillos de crecimiento (Worbes 1992). La mayoría de las especies arbóreas que crecen en esta región presentan bandas de crecimiento anuales bien diferenciadas (Brienen & Zuidema 2005, López & Villalba 2016).
En base a estos antecedentes, en esta contribución se examinan las secciones transversales de árboles previamente apeados con fines maderables, con el objetivo principal es, evaluar si las especies con diferentes densidades de madera, que crecen en diferentes condiciones ambientales, cumplen con el supuesto de crecimiento teórico (1 cm/año) adoptado en los planes de manejo de los bosques bolivianos. La dinámica del crecimiento entre especies y sitios proveerá una visión más realística del crecimiento y permitirán evaluar las incertidumbres asociadas a las pautas actuales con los que se manejan los bosques nativos tropicales. Esta nueva perspectiva permitiría garantizar la sostenibilidad a largo plazo de los bosques secos tropicales del Cerrado boliviano.
Areas de estudio
Los sitios de colección del material leñoso se encuentran en la región de la Chiquitania, porción del territorio también llamada provincia biogeográfica del Cerrado boliviano (Navarro & Maldonado 2004). Los sitios de muestreo están distribuidos de norte a sur, incluyendo desde los bosques húmedos tropicales, la transición semiárida, hasta alcanzar los bosques secos chiquitanos, muy próximos a los xéricos del Chaco. Los bosques chiquitanos comprenden extensas áreas de sabanas húmedas y bosques semideciduos distribuidos en pequeñas serranías, valles y llanuras (Navarro 2011). Estos bosques cubren una gran extensión territorial y cuentan con una alta biodiversidad, característica de ambientes tropicales estacionales. Los bosques se encuentran distribuidos en altitud que va desde los 200-600 m (Tabla 1). Particularmente, los bosques chiquitanos están dominados por especies leguminosas y alcanzan alturas del dosel superior entre 20-30 m (Killeen et al. 1993).
Tabla 1. Especie, nombre científico, local y coordenadas geográficas de los sitios de colección.
| Especies | Sitio (Código) | Altitud m | Coordenadas geográficas |
|---|---|---|---|
| Amburana cearensis (roble) | Bella Vista (BTA) | 290 | 15°40'38", 60°59'21" |
| Copaifera chodatiana (sirari) | Inpa (INP) | 503 | 16°21'28", 61°68'07" |
| Anadenanthera colubrina (curupaú) | Inpa (INP) | 503 | 16°21'28", 61°68'07" |
| Centrolobium microchaete (tarara amarilla) | Inpa (INP) | 503 | 16°21'28", 61°68'07" |
| Aspidosperma tomentosum (jichi) | San Julián (SAJ) | 249 | 16°51'48", 62°30'52" |
| Platimiscium ulei (tarara colorada) | Santa Anita (STA) | 430 | 16°32'12", 61°55'33" |
| Amburana cearensis (roble) | Santa Anita (STA) | 430 | 16°32'12", 61°55'33" |
| Cedrela fissilis (cedro) | Santa Anita (STA) | 430 | 16°32'12", 61°55'33" |
| Amburana cearensis (roble) | San Pablo del Sur (SPS) | 463 | 16°29'44", 61°26'06" |
| Schinopsis brasiliensis (soto) | S. M. de Velasco (SMV) | 480 | 16°34'56", 61°07'48" |
| Centrolobium microchaete (tarara amarilla) | Mercedes (MER) | 457 | 16°38'11", 62°04'03" |
| Machaerium acutifolium (tipa) | R. de la frontera (RDF) | 420 | 15°37'04", 61°39'12" |
| Centrolobium microchaete (tarara amarilla) | Bella Vista (BTA) | 290 | 15°40'38", 60°59'21" |
| Ficus boliviana (bibosi) | La Chonta (LCH) | 250 | 15°38'33", 62°46'51" |
| Hymenaea courbaril (paquió) | La Chonta (LCH) | 250 | 15°38'33", 62°46'51" |
| Centrolobium microchaete (tarara amarilla) | Palestina (PAL) | 296 | 15°38'20", 62°24'38" |
| Centrolobium microchaete (tarara amarilla) | Makanaté (MAK) | 246 | 15°29'13", 62°17'41" |
| Amburana cearensis (roble) | Bajo Paragua (BPA) | 247 | 14°31'55", 61°44'57" |
Todos los sitios estaban ubicados dentro de áreas destinadas al aprovechamiento forestal. En la mayoría de estos bosques nativos se extraen árboles maderables de 3 a 6 especies forestales. Los muestreos del material leñoso fueron realizados específicamente en áreas denominadas Concesiones Forestales, propiedades privadas y en Tierras Comunitarias de Origen (TCO). Los sitios BPA (Bajo Paragua), INP (Concepción) y LCH (La Chonta), son Concesiones Forestales. Por su parte, los sitios MAK (Makanaté), PAL, (Palestina), RDF (Rosario de la Frontera), STA (Santa Anita) y SPS (San Pablo del Sur), pertenecen al Manejo de bosques Intercomunales. Finalmente, los sitios de BTA (Bella Vista), MER (Mercedes), SAJ (San Julián) y SMV (San Miguel de Velasco) son propiedades privadas con áreas de bosques destinados al aprovechamiento maderable (Fig. 1).
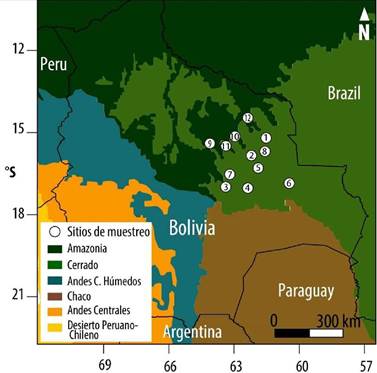
Figura 1. Ubicación geográfica de los sitios de colección del material leñoso, 1-BTA Bella Vista, 2-INP Inpa, 3-SAJ San Julián, 4-STA Santa Anita, 5-SPS San Pablo del Sur, 6-SMV San Miguel de Velasco, 7-MER Mercedes, 8-RDF Rosario de la Frontera, 9-LCH La Chonta, 10-MAK Makanaté, 11-PAL Palestina, 12-BPA Bajo Paragua.
En general, la mayoría de los sitios presentan suelos moderadamente profundos y con relieves rocosos dominados por serranías y mesetas (Navarro & Maldonado 2004). La temperatura media presenta una mínima variación entre los sitios cercanos a la Amazonia al norte y próximos al Chaco en el sur, variando de 25.6°C (1958-2019) en la estación meteorológica de Trinidad, a 24.3 °C (1979-2019) en San Miguel de Velasco, respectivamente. La precipitación total anual se caracteriza por una marcada estacionalidad, variando entre 1.682 mm en Trinidad (1959-2019) y 1.110 mm en San Miguel de Velasco (1950-2019). Las diferencias en la precipitación entre sectores determinan que en los sitios más húmedos el periodo seco sea más corto (mayo-septiembre) que, en los sitios más secos, donde se extiende en promedio a siete meses (abril- octubre).
Especies en estudio
Dentro de 12 áreas de aprovechamiento se colectaron 527 secciones transversales provenientes de 11 especies forestales del Cerrado boliviano y sus regiones boscosas vecinas (Tabla 1). Todos los árboles colectados formaban parte del dosel superior y tenían entre 40-50 cm de diámetro. En su mayoría provenían de aprovechamientos con Diámetros Mínimos de Corta (DMC) establecidos, en bosques con 25 años de Ciclos de Corte (CC) o rotación entre cosechas, siguiendo los lineamientos establecidos por la Ley Forestal de Bolivia (MDSMA 1997). Las 11 especies forestales fueron seleccionadas en base a la intensidad de aprovechamiento y la disponibilidad de más de 20 árboles de cada especie en cada sitio de muestreo. En las Fabaceae las especies Amburana cearenses, Platimiscium ulei y Centrolobium microchaete, Cedrela fissilis (Meliaceae) y Aspidosperma tomentosum (Apocynaceae) son consideradas maderas finas de fácil trabajabilidad (ITTO 2006). Por su parte las fabáceas Hymenaea courbaril, Anadenanthera colubrina, Copaifera chodatiana, Schinopsis brasiliensis y Machaerium acutifolium son especies de leño más denso (maderas duras), siendo sus principales usos la construcción y la fabricación de pisos. Finalmente, Ficus boliviana (Moraceae) es considerada una especie de madera muy liviana de baja densidad. Las 11 especies tiene anillos de crecimiento anual, 10 están delimitados por parénquima y solo F. boliviana por estrechamiento de fibras al final del periodo de crecimiento (Fig. 2). Las especies en estudio tienen una distribución exclusivamente tropical y subtropical en América del Sur (Killeen et al. 1993).
Colección y procesamiento de muestras
En sitios con aprovechamiento forestal, se colectaron secciones transversales del fuste de aquellos árboles que eran en su momento cortados para obtener maderas. En cada sitio se eligieron las especies de aquellos árboles intensamente aprovechados. Estudios preliminares en los bosques tropicales secos de América del Sur indican la dificultad de obtener muestras leñosas empleando métodos dendrocronológicos tradicionales (López 2011). Las dificultades de delimitar con precisión los anillos de crecimiento en estas especies, obliga a trabajar con secciones transversales del fuste de los árboles, en lugar de los tradicionales núcleos o tarugos de 5 mm de espesor. Las secciones transversales o radios permiten tener una mejor visión del plan leñoso y aumentar la precisión en la determinación y medición del espesor de los anillos de crecimiento.

Figura 2. Anillos de crecimiento en (a) Amburana cearensis, (b) Copaifera chodatiana, (c) Anadenanthera colubrina, (d) Centrolobium microchaete, (e) Aspidosperma tomentosum, (f) Platymiscium ulei, (g) Cedrela fissilis, (h) Schinopsis brasiliensis, (i) Machaerium acutifolium, (j) Hymenaea courbaril, (k) Ficus boliviana, y las flechas blancas indican los límites del crecimiento, escala (barras blancas) = 5 mm.
Las muestras fueron pulidas y posteriormente fechadas visualmente, siguiendo los criterios ya establecidos en dendrocronología (Stokes & Smiley 1968). En las muestras pulidas inicialmente se identificó el patrón anatómico característico de cada especie que ayuda y facilita la delimitación de los anillos de crecimiento (López 2011). Los anillos anuales fueron asignados al año en el cual comenzó la formación del leño siguiendo la convención para el Hemisferio Sur (Schulman 1956). En aquellas rodajas tomadas más próximas a la superficie del suelo notamos dificultad para datar, en este sentido se fecharon dos radios opuestos en una sección transversal. Si el número de anillos en un radio no coincidió con el número en el radio opuesto, los radios fueron reexaminados hasta lograr una coincidencia entre ambos. Posteriormente se procedió al fechado y medición del espesor de los anillos de crecimiento en una tableta Velmex UniSlide conectada a un contador digital Metronics Quick-Chek QC-10V con una precisión de 0.001 mm.
A partir de la medición del ancho de los anillos, se procedió a la construcción de las curvas de crecimiento anual acumulado empleando el programa AGE (crecimiento de los árboles por la edad). Este programa, que forma parte de la Librería de Programas para Dendrocronología (DPL, Holmes 1983), estima el incremento diamétrico corriente anual (ICA) y medio anual (IMA) para cada grupo de árboles y provee además un promedio para cada especie por sitio de colección (Holmes 1983). Los incrementos diamétricos corrientes y medios resultaron de promediar los incrementos correspondientes a dos radios (por lo general opuestos) dentro de una misma sección transversal. Para ello e independiente de la fecha calendario, se asignó al anillo central (en contacto con la médula) el año 1 (es decir, correspondiendo en cada sección transversal el año t = 1 al anillo más interno). Luego se compararon los incrementos anuales por especies con el supuesto de árboles con una tasa anual de 1 cm/año para todas las especies en todos los sitios estudiados (Fig. 3).
Por otro lado, se compararon los incrementos anuales por especies y por sitios, las diferencias en el crecimiento entre árboles se determinaron mediante una prueba estadística de Kruskal Wallis (Balzarini et al. 2008). Las diferencias estadísticamente significativas (P < 0.05) en el incremento diamétrico medio entre localidades y especies fueron evaluadas asumiendo que esta prueba no requiere distribución normal de las variables. Las diferencias de crecimiento fueron evaluadas durante periodos comunes entre sitios, tratando de incluir el número de individuos más elevado posible (≥ 10) con base en el número total de individuos colectados.
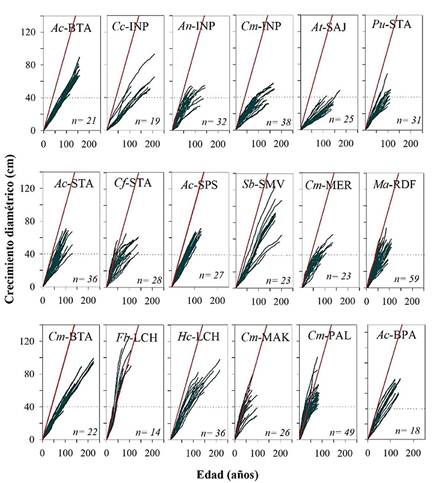
Figura 3. Las líneas verdes corresponden al crecimiento acumulado individual para cada especie en sitios específicos de crecimiento y la línea roja al ritmo supuesto de crecimiento de 1 cm/año. Ac-BTA Amburana cearensis, Cc-INP Copaifera chodatiana, An-INP 2 Anadenanthera colubrina, Cm-INP Centrolobium microchaete, At-SAJ Aspidosperma tomentosum, Pu-STA Platimiscium ulei, Ab-STA A. cearensis, Cf-STA Cedrela fissilis, Ac-SPS A. cearensis, Sb-SMV Schinopsis brasiliensis, Cm-MER C. microchaete, Ma-RDF Machaerium acutifolium, Cm-BTA C. microchaete, Fb-LCH Ficus boliviana, Hc-LCH Hymenaea courbaril, Cm-MAK C. microchaete, Cm-PAL C. microchaete, Ab-BPA Amburana cearensis. Las líneas en puntos indica cuando todos los árboles alcanzan 40 cm de crecimiento diamétrico.
Resultados
La determinación del anillo de crecimiento está marcada por el contraste entre los vasos con de mayor y menor diámetro en la madera temprana y la madera tardía, respectivamente. El cambio de tamaño en los vasos a lo largo del anillo anual fue acompañado por el aumento gradual de fibras, lo que da un color más oscuro a la madera tardía (Fig. 2). En la mayoría de las especies se observó una marcada variación en los crecimientos diamétricos. Esta variación en los ritmos de crecimiento entre árboles es comparativamente menor durante la etapa juvenil y a medida que los árboles alcanzan diámetros mayores edades el crecimiento es más variable y la diferencia entre árboles es mayor. Así, las diferentes especies estudiadas necesitan entre 38 y 150 años para alcanzar un diámetro medio de 40 cm. La especie que registró la menor variación entre los árboles de mayor y menor crecimiento para alcanzar un diámetro de 40 cm fue Amburana cearensis en el sitio Bella Vista (BTA). La especie con mayor variación en el crecimiento es Schinopsis brasiliensis en San Miguel de Velasco (SMV). Para alcanzar 40 cm de diámetro, los árboles requieren periodos entre 43 y 150 años (Fig. 3). Los árboles de Ficus boliviana tienen el mayor crecimiento anual dentro de los bosques secos tropicales, crece en promedio 1.18 cm/año, y requiere 38 años para alcanzar 40 cm de diámetro. En cambio, Aspidosperma tomentosum solo alcanza un crecimiento diamétrico medio de 0.27 cm/año (Tabla 2). Solo Ficus boliviana (LCH) y algunos individuos de C. microchaete en los sitios de Palestina (PAL) y Makanaté (MAK) alcanzan crecimientos diamétricos cercanos a 1 cm/año. Las otras especies en los diferentes sitios de muestreo, incluso aquellas consideradas de crecimiento rápido solo alcanzan 40 cm de diámetro en periodos menores a los 40 años (Fig. 3).
La comparación de los crecimientos medios anuales indica diferencias entre especies, y para una misma especio entre sitios. La prueba estadística de Kruskal Wallis muestra diferencias significativas en el crecimiento entre especies y entre especies creciendo en sitios diferentes. En base al estadístico de Kruskal Wallis, las especies del bosque chiquitano pueden agruparse en cinco categorías con diferencias significativas en el crecimiento. A. tomentosum, Copaifera chodatiana y C. microchaete en los ambientes secos de Concepción (INP) conforman el grupo de especies de menor crecimiento radial (Tabla 2) variando entre 0.27 y 0.36 mm/año. Un número importante de especie integra el segundo grupo con crecimientos medios en 100 años entre 0.45 y 0.57 mm/año. Este grupo está compuesto por Platimiscium ulei, Amburana cearensis en BTA, Centrolobium microchaete en BTA y MER, Anadenanthera colubrina en INP, Cedrela fissilis en STA y Schinopsis brasiliensis en SMV, sitios con condiciones de humedad intermedia. Hymenaea courbaril, Machaerium acutifolium y Amburana cearensis en tres localidades SPS, BPA y STA registran crecimientos medios entre 0.54 y 0.60 mm/año. Un cuarto grupo está conformado exclusivamente por C. microchaete en las localidades de MAK y PAL con crecimientos medios entre 0.69 y 0.71 mm/año, respectivamente. Finalmente, Ficus boliviana en LCH alcanza un ritmo de crecimiento cercano a 1.2 mm/año conformando un grupo independiente (Tabla 2). Existen especies que conforman más de un grupo, el caso de C. microchaete presente en los grupos de menor (a), menor a medio (b) y alto (d) crecimiento, indicando que el ritmo de crecimiento no solo depende de la especie, sino también de las condiciones del sitio de crecimiento (Tabla 2).
Tabla 2. Prueba de varianza de Kruskal Wallis para estimar diferencias, dentro de un periodo común de comparación de 100 años entre los incrementos medios anuales para las 11 especies forestales y 12 sitios de muestreo en bosques tropicales de Bolivia. Para el Incremento Medio Anual (IMA en cm), las diferentes letras indican diferencias estadísticamente significativas (p ≤ .05). SD = desviación estándar de la media.
| Especies (sitio) | Número de árboles | IMA (cm) / ± SD | IMA prom (cm) | IMA máx. (cm) | IMA mín. (cm) |
|---|---|---|---|---|---|
| Aspidosperma tomentosum (SAJ) | 25 | 0.27 ± 0.07 a | 0.27 | 0.43 | 0.19 |
| Copaifera chodatiana (INP) | 19 | 0.33 ± 0.09 a | 0.33 | 0.50 | 0.26 |
| Centrolobium microchaete (INP) | 39 | 0.36± 0.06 a | 0.36 | 0.47 | 0.22 |
| Platimiscium ulei (STA) | 31 | 0.45 ± 0.11 b | 0.45 | 0.70 | 0.29 |
| Centrolobium microchaete (BTA) | 22 | 0.46 ± 0.05 b | 0.46 | 0.56 | 0.36 |
| Amburana cearensis (BTA) | 22 | 0.47 ± 0.03 b | 0.46 | 0.53 | 0.41 |
| Centrolobium microchaete (MER) | 23 | 0.48 ± 0.08 b | 0.48 | 0.68 | 0.36 |
| Anadenanthera colubrina (INP) | 32 | 0.48 ± 0.12 b | 0.48 | 0.67 | 0.24 |
| Cedrela fissilis (STA) | 28 | 0.59 ± 0.24 b | 0.59 | 1.18 | 0.31 |
| Schinopsis brasiliensis (SMV) | 23 | 0.57 ± 0.25 b | 0.57 | 1.45 | 0.30 |
| Hymenaea courbaril (LCH) | 36 | 0.54 ± 0.11 c | 0.54 | 0.74 | 0.39 |
| Machaerium acutifolium (RDF) | 59 | 0.60 ± 0.17 c | 0.60 | 1.01 | 0.30 |
| Amburana cearensis (SPS) | 27 | 0.58 ± 0.06 c | 0.58 | 0.69 | 0.46 |
| Amburana cearensis (BPA) | 18 | 0.57 ± 0.08 c | 0.57 | 0.76 | 0.43 |
| Amburana cearensis (STA) | 36 | 0.57 ± 0.11 c | 0.57 | 0.78 | 0.31 |
| Centrolobium microchaete (PAL) | 26 | 0.71 ± 0.17 d | 0.71 | 1.27 | 0.30 |
| Centrolobium microchaete (MAK) | 49 | 0.69 ± 0.20 d | 0.69 | 1.02 | 0.30 |
| Ficus boliviana (LCH) | 14 | 1.18 ± 0.20 e | 1.18 | 1.60 | 0.84 |
Discusión
En la última década, la fragmentación y el acentuado cambio en el uso de miles de hectáreas de bosque se intensificó, con extensos incendios forestales que resultaron favorecidos por sequias prolongadas (Lean & Warrilw 1989). El presente estudio tiene por objetivo presentar la variación interanual en el crecimiento diamétrico de 11 especies forestales en 12 sitios a lo largo de los bosques tropicales chiquitanos (Fig. 1). Esta información fue obtenida a partir del fechado y medición del espesor de los anillos de crecimiento, técnica de fácil aplicación que provee datos precisos en el corto plazo para aplicaciones en temas ecológicos, forestales y climáticos, entre otros. Por muchos años la falta de información sobre tasas de crecimiento de los árboles ha sido un factor limitante para el establecimiento de pautas forestales validadas con datos específicos y bien replicados. El empleo de esta información obtenida para diferentes especies en sus hábitats de crecimiento, es fundamental ya que combina observaciones precisas y e largo plazo, muy difícil de lograr con otras técnicas de monitoreo del crecimiento (Schöngart 2008, López et al. 2013).
Los bosques chiquitanos son considerados los de mayor producción tanto de recursos maderables como no maderables de Bolivia. A su vez, estos bosques albergan la mayor biodiversidad de flora y fauna en Bolivia (Jardim et al. 2003, Vides-Almonacid et al. 2007). Su alta productividad ha convertido a la Chiquitania en una de las regiones más explotadas, y consecuentemente degradadas de los bosques nativos tropicales en América del Sur (Killeen et al. 2008). La presencia de especies maderables de alto valor comercial abrió el rápido acceso a la explotación selectiva y sin fiscalización de la madera, así como de otros productos del bosque chiquitano.
La estructura de edades del bosque chiquitano muestra una alta variación entre rodales y árboles de un mismo rodal reflejando diferentes historias de manejos y la ocurrencia de disturbios naturales o antrópicos, particularmente el fuego en los sectores más secos. La mayoría de los rodales visitados están compuestos por especies longevas que requieren de muchos años para alcanzar diámetros maderables y conformar masas boscosas maduras. Considerando los ritmos de crecimiento, los tiempos necesarios para lograr individuos adultos de gran porte, y las condiciones ambientales desfavorables asociadas al cambio climático, es poco probable que en el corto plazo se puedan recuperar las áreas boscosas degradadas. Aun considerando las tasas de rápido crecimiento como en Ficus boliviana que puede alcanzar 40 cm de diámetro en aproximadamente 40 años, la dinámica del bosque chiquitano en respuestas a los constantes disturbios antrópicos, hacen pensar que la recuperación forestal en el mediano plazo es poco probable. La situación es más crítica aun considerando que la mayoría de las especies forestales que crecen en estos bosques, requieren más de 50 años, a veces 150 años, para alcanzar un diámetro de 40 cm. Los escenarios de calentamiento regional, podrían a través de los incendios y sequías contribuir a la desaparición de los bosques chiquitanos (Urrutia & Vuille 2009). El aumento de las temperaturas incrementa las tasas de evapotranspiración, acelera la pérdida de agua en el suelo y reduce aún más la supervivencia y el desarrollo de los árboles en bosques secos tropicales (Lean & Warrilw 1989).
Mediante una comparación de los valores medios anuales del crecimiento entre árboles, se observó diferencias significativas entre especies y entre individuos de una misma especie creciendo en sitios diferentes (Tabla 2). Las tasas de crecimiento de las 11 especies estudiadas muestran la existencia de cinco grupos con similares ritmos de crecimiento, largamente asociados con las diferencias entre especies, pero también regulado por la calidad del sitio forestal donde crecen. Así, dependiendo de la calidad de sitio, una misma especie como C. microchaete puede formar parte de los grupos de menor (a), menor a medio (b) y alto (d) crecimiento (Tabla 2). Por ello, el ritmo de crecimiento no siempre depende de la especie, sino también de las condiciones del sitio de crecimiento, principalmente son favorecidos aquellos con mayor régimen de precipitaciones.
Estas observaciones indicarían que las pautas de manejo forestal basadas en diámetros mínimos de corta (DMC) de 40 cm y turnos de rotación (CC) de 25 años no se condicen con las tasas de crecimiento reportadas para la mayoría de las especies estudiadas (López et al. 2011). Las pautas de manejo necesitan ser revisadas en base a las tasas reales de crecimiento reportadas en este y otros trabajos, donde se ve que cada especie tiene diferentes ritmos de desarrollo, que a su vez varía en relación a la calidad forestal del sitio (Rozendaal & Zuidema 2011, Schöngart et al. 2017, López et al. 2019).
Conclusiones
Los anillos de crecimiento son una alternativa viable y exitosa para proveer edades y tasas de crecimiento de las especies forestales que son explotadas maderablemente. Esta técnica en comparación a otros métodos, permite observar la variación del crecimiento diamétrico durante toda la vida de un individuo. Por otro lado, existe una alta variabilidad con respeto al periodo necesario para alcanzar un diámetro de 40 cm, variando entre 38 y 150 años en la región chiquitana. En general, el crecimiento radial es substancialmente más bajo que el supuesto de 1 cm/año, ya que, si bien Ficus boliviana puede alcanzar crecimientos comparables, otras especies registran tasas mucho menores (0.27 cm/año, Tabla 2). Está marcada variabilidad del crecimiento entre especies y sitios sugiere que no se puede aplicar los mismos criterios de gestión para todas las especies y para una especie en diferentes sitios. Estos resultados enfatizan la necesidad de adecuar la gestión forestal a los crecimientos reales de las especies.
En este contexto, la gestión forestal sostenible y otras proyecciones de conservación de estos bosques requieren del conocimiento con precisión da la dinámica del crecimiento y los rendimientos futuros en base a los cambios ambientales.
La planificación sin considerar estos factores, en el mediano plazo los aprovechamientos forestales y el cambio de usos del bosque serían las principales actividades asociadas a la degradación los bosques chiquitanos.












 uBio
uBio 

