Ecología en Bolivia
versión impresa ISSN 1605-2528versión On-line ISSN 2075-5023
Ecología en Bolivia v.56 n.1 La Paz abr. 2021
Reseña
Roedores sigmodontinos de la Provincia de Misiones (Argentina): Síntesis de datos en una década de muestreos esporádicos
Sigmodontine rodents of the Province of Misiones (Argentina): data synthesis after a decade of sporadic samplings
Carlos A. Galliari1 & Ulyses F. J. Pardiñas 2*
1Centro de Estudios Parasitológicos y de Vectores, Consejo Nacional de Investigaciones Científicas y Técnicas, Universidad Nacional La Plata, Boulevard 120 s/n entre Av. 60 y calle 64, 1900 La Plata, Buenos Aires, Argentina
2Instituto de Diversidad y Evolución Austral, Consejo Nacional de Investigaciones Científicas y Técnicas, Boulevard Brown 2915, 9120 Puerto Madryn, Chubut, Argentina e Instituto Nacional de Biodiversidad, Calle Rumipamba 341 y Av. de Los Shyris, 17-07-8976 Quito, Ecuador
*Autor de correspondencia: ulyses@cenpat-conicet.gob.ar
Recibido: 23.10.20, Aceptado: 28.12.20.
Resumen
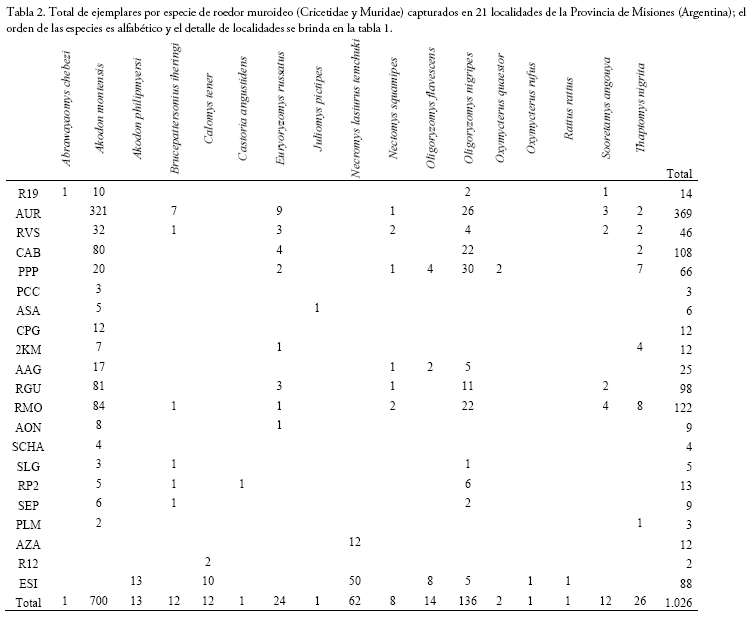
Son limitados los antecedentes sobre trampeos de micromamíferos en la Provincia de Misiones, Argentina, aspecto que se refleja no solo en un pobre conocimiento general de sus ensambles de roedores sigmodontinos, sino también en sus estatus de conservación (i.e., muchos caracterizados como datos deficientes). En esta contribución, que sigue parcialmente el estilo de un "data paper", se resumen los resultados obtenidos en algo más de una década, de muestreos, mayoritariamente ejecutados como apoyo a proyectos parasitológicos. Se llevaron a cabo trabajos de campo en 21 localidades que representan diversos ambientes del bosque Atlántico del Alto Paraná, bosque húmedo de Araucaria, campos y malezales. Se obtuvieron un total de 1.026 individuos correspondientes a 17 especies y 14 géneros de sigmodontinos y murinos, sobre un total acumulado de 12.662 trampas noche. Aquellos más abundantes fueron Akodon montensis (n = 700) y Oligoryzomys nigripes (n = 136), esto es, sigmodontinos resilientes al disturbio del hábitat. Las formas que se pueden considerar más estrictamente selváticas, como Abrawayaomys chebezi, Castoria angustidens o Juliomys pictipes, estuvieron virtualmente ausentes. Resulta imperativo extender los muestreos hacia los pocos sectores forestales aún conservados y, además, hacerlos más prolongados en el tiempo, como una estrategia para incrementar la acumulación de especies y detectar aquellas posiblemente raras. A la par, efectuar trampeos en el sotobosque y dosel arbóreo, a la fecha carentes de aproximaciones sistemáticas en Misiones.
Palabras clave : Akodon montensis, Bosque Atlántico del Alto Paraná, Bosque húmedo de Araucaria, Campos y malezales, Sigmodontinae.
Abstract
There have been only a very few collections of small mammals in the Misiones Province, Argentina, a fact that is reflected not only in a poor general knowledge of the sigmodontine rodent assemblages but also in their conservation status (i.e., many are characterized as data deficient). In this contribution, which partially follows the style of a "data paper," we summarize the results obtained through a little more than a decade of sampling, mostly undertaken in support of parasitological projects. We conducted field work in 21 localities representing several environments belonging to the Upper Paraná Atlantic forest, humid Araucaria forest, and fields and oldfields. A total of 1,026 individuals belonging to 17 species and 14 genera of sigmodontine and murine rodents were captured, after a cumulative effort of 12,662 trapping nights. Those species best represented were Akodon montensis (N = 700) and Oligoryzomys nigripes (n = 136), which typically inhabit disturbed environments. Those forms more strictly sylvan, such as Abrawayaomys chebezi, Castoria angustidens or Juliomys pictipes, were virtually absent. It is strongly recommended to expand surveys to the few better-preserved forest remnants and to have longer sampling periods as a strategy to increase species accumulation and detection of rare species. In addition, to increase trapping in the understory and canopy, which to date are lacking in systematic sampling in Misiones.
Keywords: Akodon montensis, Fields and oldfields, Humid Araucaria forest, Sigmodontinae, Upper Paraná Atlantic forest.
Introducción
El bosque Atlántico del Alto Paraná y el bosque húmedo de Araucana, dos de las 15 ecorregiones que se han identificado en el complejo Mata Atlántica, se extienden a lo largo de la región sudeste de Brasil, este de Paraguay y extremo nordeste de Argentina. También denominados Selva paranaense o misionera, en la Argentina se concentran en la Provincia de Misiones y poseen la mayor diversidad biológica del país (e.g., Galindo-Leal & Gusmão Cámara 2003, Fundación Vida Silvestre Argentina & WWF 2017). La situación ambiental de sus bosques con reducciones mayores al 90% de la superficie original del bioma y el fuerte impacto que en las últimas décadas han sufrido sus ecosistemas, han aumentado el interés de la comunidad científica por conocer el efecto de dicha presión sobre la biota.
En Argentina, sus mamíferos han sido objeto de numerosos estudios, desde aquellos pioneros del tipo inventario, en las décadas finales del siglo pasado (Massoia 1980, Crespo 1982, Massoia et al. 1987, Vaccaro & Massoia 1988, Massoia 1993, Barquez et al. 1999), hasta los contemporáneos, enfocados en la ecología de aquellas especies más sensibles a las actividades humanas (e.g., grandes depredadores, De Angelo et al. 2011, Paviolo et al. 2016, primates, Agostini et al. 2014, Oklander et al. 2020, por nombrar algunos). Por el contrario, los micromamíferos sólo son conocidos en aspectos taxonómicos básicos y, en menor grado, en su sistemática evolutiva y biogeografía, gracias al aporte de la biología molecular y a la comparación con otras taxocenosis en países vecinos. La mayoría de las especies carece de estudios sobre otros aspectos de su biología.
En la Provincia de Misiones, los roedores sigmodontinos (Cricetidae, Sigmodontinae), son uno de los grupos más diversos, con 17 géneros y 24 especies registradas (Massoia 1993, Massoia et al. 2006, Lanzone et al. 2018). Una síntesis sobre la diversidad y distribución de este grupo concluye en la necesidad de contar con datos de la biología de estas especies, toda vez que los escasos existentes poseen más de 40 años (Lanzone et al. 2018). La reciente categorización de los mamíferos de Argentina según su riesgo de extinción (SAyDS-SAREM 2019), resulta reflejo elocuente de esta pobreza de información. No solo considera a cinco de estas especies con "datos deficientes" para ser evaluadas, sino que para la mayoría de los taxones tratados se ha debido recurrir a datos biológicos obtenidos en países vecinos o en otras ecorregiones de su distribución.
Un aspecto crucial que hace a la comprensión de los ensambles de micromamíferos misioneros, es la virtual carencia de estudios basados en trampeos de mediana a larga duración en localidades específicas. Antes bien, buena parte de lo que se conoce, proviene de trabajos puntuales, asistemáticos, de mínima duración (< 5 noches de trampeo) y de análisis de egagrópilas (Massoia 1983, 1993, Pardiñas & Cirignoli 2002, Lanzone et al. 2018). Pardiñas & Cirignoli (2001), destacaban una de las consecuencias de estos sesgos, "Un somero análisis de la información conocida para Misiones sobre egagrópilas de lechuzas indica que la participación de taxones de ambientes selváticos versus aquellos que ocurren principalmente en capueras o campos es minoritaria.... Esto sugiere fuertemente que no estamos visualizando una parte importante de los potenciales taxones de hábitos selváticos... Quizás aquí radica nuestra falta de registro de «Thomasomys» pictipes, sin datos desde el año de su descripción original. Quizás aquí pueda explicarse la mínima o nula información existente sobre Blarinomys, Delomys, Oxymycterus misionalis y otros taxones de las selvas paranenses en su porción conservada más austral". Si bien, en las casi dos décadas desde que fueron escritas esas líneas, se ha efectuado algún aporte (por ejemplo, se ha redescubierto "T." pictipes; véase Pardiñas et al. 2008), poco es, en concreto, lo que se ha avanzado.
Suele indicarse a la contribución de Crespo (1982), la "ecología" de los mamíferos del Parque Nacional Iguazú, como pionera en el muestreo provincial de roedores mediante trampas. Sin embargo, como bien se aclara en dicho trabajo (Crespo 1982), las remociones de animales fueron limitadas por tratarse de impactos sobre un área protegida. Prueba de esto resulta el magro elenco de cricétidos registrado, limitado a seis especies (i.e., Akodon montensis, Nectomys squamipes, Oligoryzomys nigripes, Oxymycterus misionalis, Sooretamys angouya y Thaptomys nigrita). Aunque para las dos más abundantes, A. montensis y O. nigripes, se brindan algunos datos reproductivos que sugieren trampeo mensual (Crespo 1982), se desconoce el esfuerzo y otras características del mismo. Un muestreo intenso, aunque virtualmente omitido (e.g., Lanzone et al. 2018) fue el desarrollado a lo largo de tres campañas en diversos puntos de la cuenca del río Urugua-í (Massoia et al. 1987). Producto de estos trabajos de campo se registró un ensamble de 10 cricétidos, incluyendo el primer hallazgo para la mastofauna de Argentina de Akodon paranaensis (originalmente identificado como Akodon serrensis; véase Liascovich & Reig 1989, Pardiñas et al. 2003). El único estudio de largo aliento involucrando trampeo de micromamíferos, al menos con información publicada, corresponde al ejecutado en la Reserva Privada de Usos Múltiples Valle del Cuña Pirú. Sus resultados, basados en algo más de 5.000 noches-trampa, revelan un ensamble conformado por 11 especies, nuevamente con predominio de A. montensis y O. nigripes (Cirignoli et al. 2011). Otras aproximaciones realizadas en las últimas décadas, como los muestreos en inmediaciones del sector de Moconá (véase Mares & Braun 2000) o aquel en la Reserva de la Fundación Vida Silvestre Argentina en Urugua-í (Pereira et al. 2006), fueron abordajes puntuales espacial y temporalmente.
Durante algo más de una década hemos realizado prospecciones de roedores sigmodontinos en el territorio de la Provincia de Misiones. Estos trabajos fueron ejecutados, en su gran mayoría, en el contexto de proyectos de inventarios parasitológicos. Como resultado de los mismos, se han acumulado numerosos datos básicos. La pretensión única de esta contribución es ponerlos, mediante su publicación sintética, a disposición de potenciales interesados (otros mastozoólogos, pero también ecólogos, parasitólogos, virólogos, gestores de áreas protegidas, entre otros). En ese contexto, este trabajo se inserta, parcialmente, en la línea denominada "data paper", que busca "a scholarly journal publication whose primary purpose is to describe a dataset or a group of datasets, rather than to report a research investigation" (https://www.gbif.org/data-papers).
Métodos
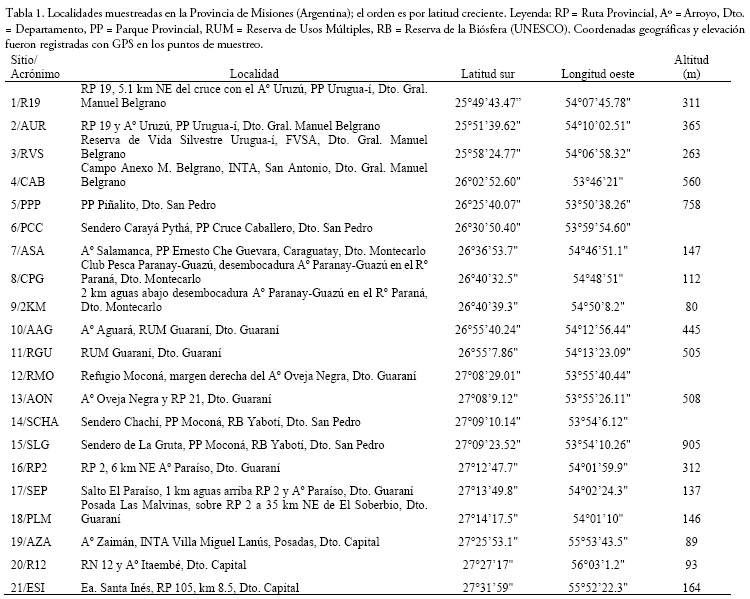
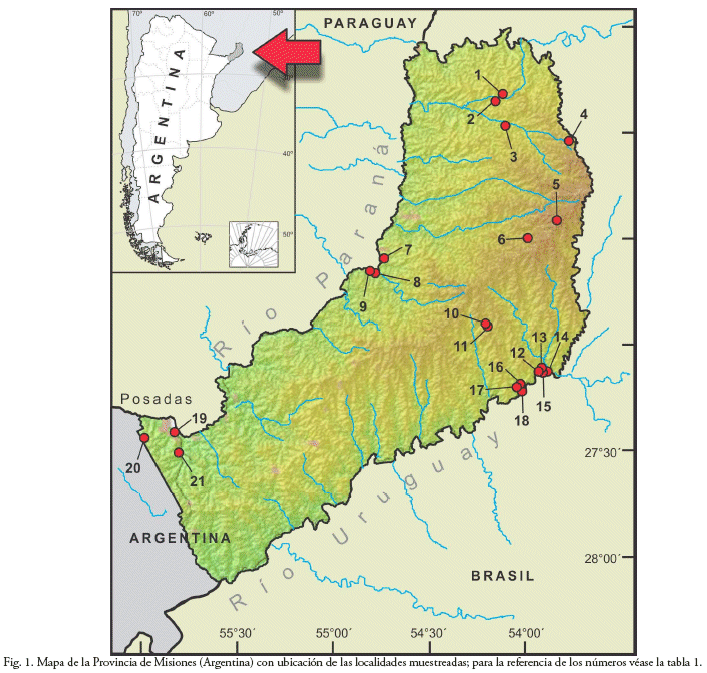
Entre abril de 2007 y mayo de 2018 llevamos a cabo muestreos esporádicos de micromamíferos en 21 sitios de la Provincia de Misiones (Tabla 1, Fig. 1). Si bien en la mayoría de los lugares se efectuaron muestreos únicos, en tres de estos fueron repetidos tres veces.
Se utilizaron trampas tipo Sherman (cajas de aluminio plegables) de dos tamaños (25 x 8 x 8 cm y 35 x 12 x 12 cm) y, subsidiariamente, 32 trampas jaula medianas (33 x 15 x 15 cm) y 20 trampas de golpe tipo Víctor (de tamaño grande). En cada localidad se establecieron estaciones de captura, con un número variable (usualmente 40) de trampas cada una, con separaciones de 8- 10 m entre cada trampa, siempre en función de las características ofrecidas por el terreno. Las trampas fueron cebadas con una mezcla de avena arrollada, esencia de vainilla y/o aceite de oliva y fueron revisadas durante las primeras horas de la mañana para recolectar los animales capturados y recebadas diariamente en horas de la tarde.
La mayoría de las trampas fue dispuesta directamente sobre el suelo, privilegiando situaciones que maximizaran una potencial captura (es decir, seleccionando micrositios por cobertura, presencia de objetos que pudieran oficiar de refugios). En algunas oportunidades, se colocaron trampas (atadas) en lianas colgantes gruesas, troncos o ramas, pero nunca por arriba de los 2 m de altura.
En líneas generales, la duración de los trampeos para cada sitio osciló entre 2-5 noches con una moda de tres. El esfuerzo de captura se determinó usando la unidad de trampas noche, definido como el número de trampas utilizadas por el tiempo de muestreo (Jones et al. 1996). El esfuerzo total realizado fue de 12.662 trampas/noche.
Se adoptó un sistema de muestreo estratificado por ambientes, en el cual cada estación de trampas fue colocada en un ámbito relativamente homogéneo previamente definido. Para delimitar estos ambientes se adoptaron los criterios sustentados por Srur et al. (2009) e Izquierdo & Srur (2009) - quienes asocian las comunidades vegetales a las características morfoestructurales y geomorfológicas del paisaje - y Frangi et al. (2005), sobre la sucesión ecológica de los bosques de Misiones sometidos a tala y quema.
Los ambientes muestreados por ecorregión estudiada fueron (Figs. 2-5):
A. Bosque Atlántico del Alto Paraná:
1. Bordes de caminos vehiculares (más de 3 m; Figs. 2a, b). Se trata de una vegetación de cicatrización, con gramíneas y arbustos heliófilos, que alcanzan alturas de más de 1 metro y con cobertura casi total del suelo. Casi todos presentan en sus bordes externos (respecto del camino), cobertura boscosa, sea de bosques empobrecidos o de bosques primarios. No se incluyen aquí senderos internos en la selva, en los que hay una continuidad del dosel arbóreo que oficia de techo del sendero.
2. Playones basálticos del lecho y bordes de arroyos (Fig. 2c). Casi todos los arroyos de la Selva paranense tienen cambios cíclicos en su caudal, que en época de estiaje deja expuesto el fondo rocoso, casi desnudo, conformado por bloques y planchas de meláfiros.
3. Selvas y sarandizales de bordes de arroyos (Figs. 2d, e). Desarrolladas a escasos metros del borde de los arroyos y ríos internos de Misiones. Son formaciones vegetales que se encuentran dentro del mismo cauce del arroyo o en el área afectada por las crecidas periódicas del mismo, generalmente provocadas por lluvias regionales. Las inundaciones tienen pocas horas de persistencia.
4. Bosques secundarios sucesionales o capueras (Fig. 2f). Áreas desmontadas cubiertas por vegetación pionera, arbustiva y arbolitos heliófilos (Solanum y Trema).
5. Selvas de terrazas (Figs. 3a, c). Estas selvas están asociadas a los bajos planos y bases de lomas que rodean a tacuarales cercanos a bordes de ríos, sobre pendientes nulas a muy leves de suelos pardos, nada o poco pedregosos y bien drenados superficialmente. Son selvas altas mixtas con dosel dominado por rabo itá, laurel negro y laurel amarillo.
El sotobosque es oscuro y abierto con abundancia de arbolitos, pastos y helechos. Pueden ser comunes las tacuaras de Chusquea, igual que los yatebozales de Guadua.
6. Selvas mixtas y abiertas de laureles de medias lomas (Fig. 3d). Selvas altas con dosel pluriestratificado, bastante abierto, con el sotobosque generalmente ocupado por el tacuarembó (Chusquea ramosissima). Existe cierta heterogeneidad espacial, de acuerdo a la densidad de los estratos superiores.
7. Bosques implantados (Fig. 3e). Formaciones arbóreas asociadas a emprendimientos comerciales o residenciales ("montes" de estancias). En algunos casos, merced a su progresivo abandono, pueden mostrar sotobosques densos.
8. Lagunas o bañados. Formados en depresiones cóncavas, con suelos grises, no pedregosos, saturados de agua. La periferie del cuerpo de agua está cubierta por un bosque bajo, de aspecto arbustivo. La vegetación de la laguna propiamente dicha presenta una fisonomía de pajonal muy denso, dominado por ciperáceas y poáceas, de más de 1 m de altura. En los períodos de estiaje, suele invadir la gramilla (Cynodon sp.) y conformar un pastizal bastante denso de hasta 0.5 m de altura.
B. Bosque húmedo de Araucaria:
9. Interior de bosque (Fig. 3b). Bosque mixto con Araucaria. Bosque alto de hasta 40 m de altura con predominancia de Araucaria angustifolia. Sotobosque con predominancia de helechos arborescentes.
10. Bosques implantados. Rodales de A. angustifolia de entre 40-60 años de antigüedad. Dosel arbóreo de 40 m, sotobosque con helechos arborescentes. Rodales de Eucalyptus de la misma antigüedad. Sotobosque escaso.
11. Bosque secundario en borde de arroyo. Lindante a los cuadros de bosques implantados. Abundantes helechos en sotobosque.
C. Campos y malezales
12. Yerbatal (Fig. 4b). Plantación de Ilex paraguariensis. Generalmente, son invadidos por malezas, las que son removidas cada año. Sin embargo, en ciertos lotes las malezas se hacen abundantes y llegan a cubrir el suelo hasta un 70-80%. Asimismo, los bordes de los lotes generalmente tienen una mayor cobertura de invasoras que el centro. En algunos lotes persisten las palmeras yatay-poni (Butia paraguayensis) que ofrecen refugio entre las hojas de su base.
13. Bosques implantados. Plantaciones arbóreas destinadas originalmente a la parquización de terrenos cercanos a cascos de estancia que, con el correr de los años, han sido invadidos por trepadoras, lianas, helechos, otorgándole el aspecto de un bosque alto, de 25-30 m de altura, con un denso sotobosque de renovales.
14. Sabana de Aristida iubata y palmeras (Fig. 4c). Sabana de pastizales en terrenos altos, con cobertura del suelo de más del 80% y de hasta un metro de altura, con sectores con paja colorada, y palmeras de coco (Acrocomia totai). Pastizales que, por la ausencia de fuego o por la carga ganadera, son poco a poco invadidos por una vegetación arbustiva, como talas (Celtís sp.) y otras especies leñosas.
15. Arbustal de Baccharis spp. La "chilca" (Baccharis spp.), invasora de terrenos degradados, se hace particularmente abundante en los bordes de caminos y cuadros de yerba mate.
16. Pastizales higrófilos Axonopus compresus (pasto iesuita) (Fig. 4a). En la planicie de inundación del arroyo Zaimán. Pastizal de unos 50 cm de altura cubriendo el 100% del suelo.
17. Bosque de ribera y pajonales. Bosque bajo en el delgado albardón del arroyo Itaembé, conformado por arbolitos de ingáes (Inga uruguensis), laureles (Ocotea sp. y Nectandra sp.) y timboes (Enterolobium contortisiliqum), interdigitado con pajonales de cortaderas y pastizales.
La mayoría de los ejemplares capturados fue sacrificada; solo unos pocos individuos juveniles fueron registrados y liberados in situ. Para el sacrificio, se empleó éter sulfúrico, que asegura una prospección parasitológica eficiente. Una vez muerto y revisado, cada animal fue etiquetado (con el empleo de diversos números de colector, según la campaña que se tratara), medido (medidas externas estándar: largo total, largo cola, largo pata con y sin uña, largo oreja, peso), sexado, registrado su estado reproductivo y preservado, ya fuere como piel rellena y esqueleto, ejemplar en fluido o alguna combinación de las varias existentes (Figs. 5-6). Todo el material obtenido fue depositado, o está en vías de serlo, en las colecciones de mamíferos del Centro Nacional Patagónico (CNP; Puerto Madryn, Chubut) o del Museo de La Plata (MLP; La Plata, Buenos Aires).
Resultados
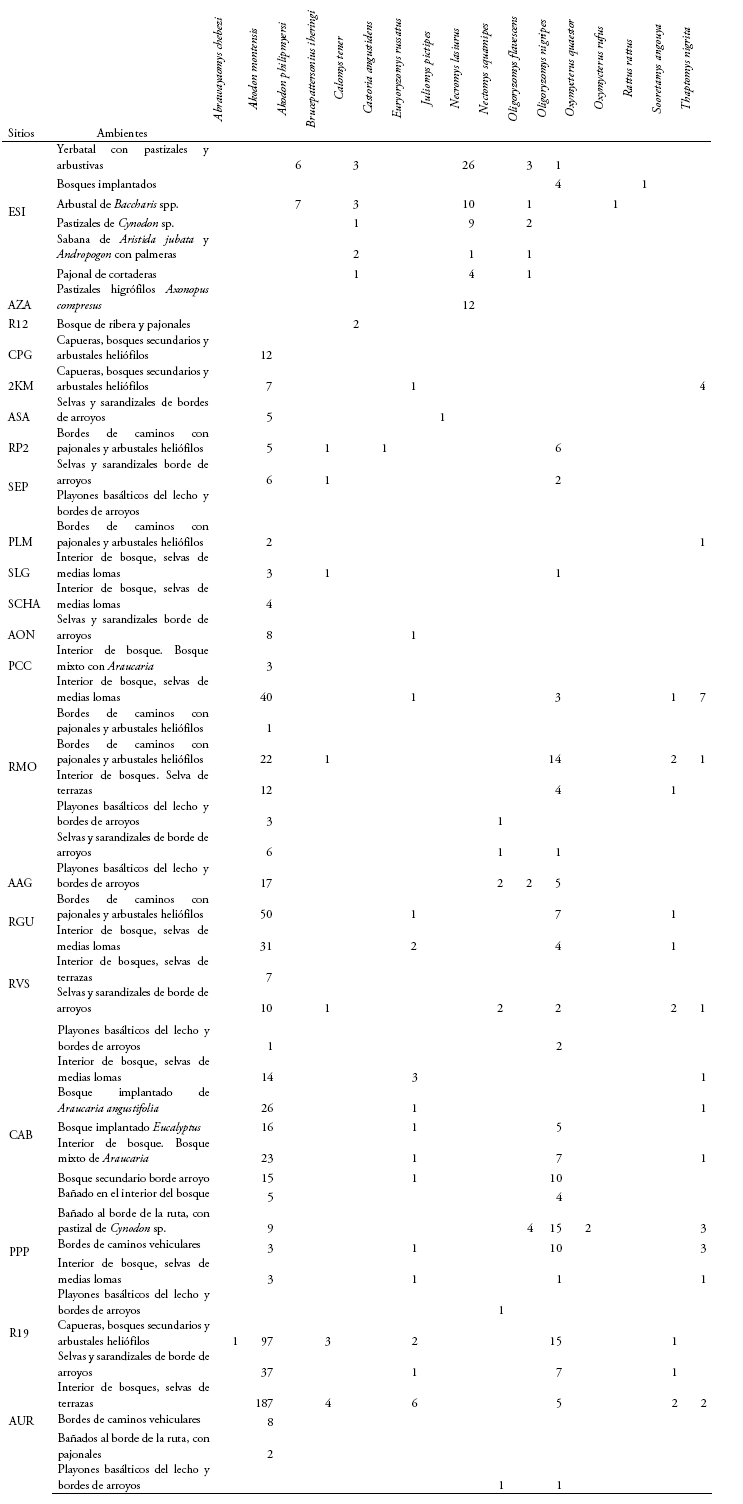
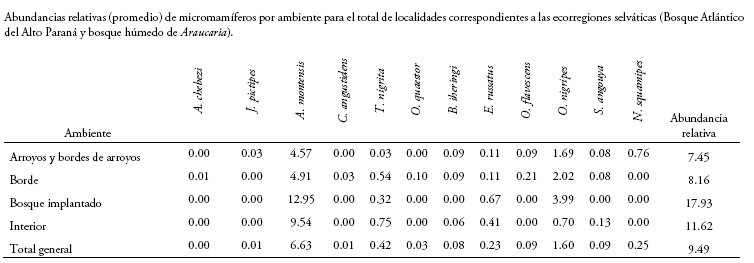
En las tablas 2-3 y Anexo 1 se brindan los datos obtenidos a partir de los muestreos efectuados. En las secciones siguientes, se ofrecen comentarios sintéticos sobre aspectos seleccionados de las especies registradas; el arreglo taxonómico general empleado es el de Pardiñas et al. (2017).
Especies capturadas: ambientes, abundancia general y datos reproductivos
Sigmodontinae, incertae sedis
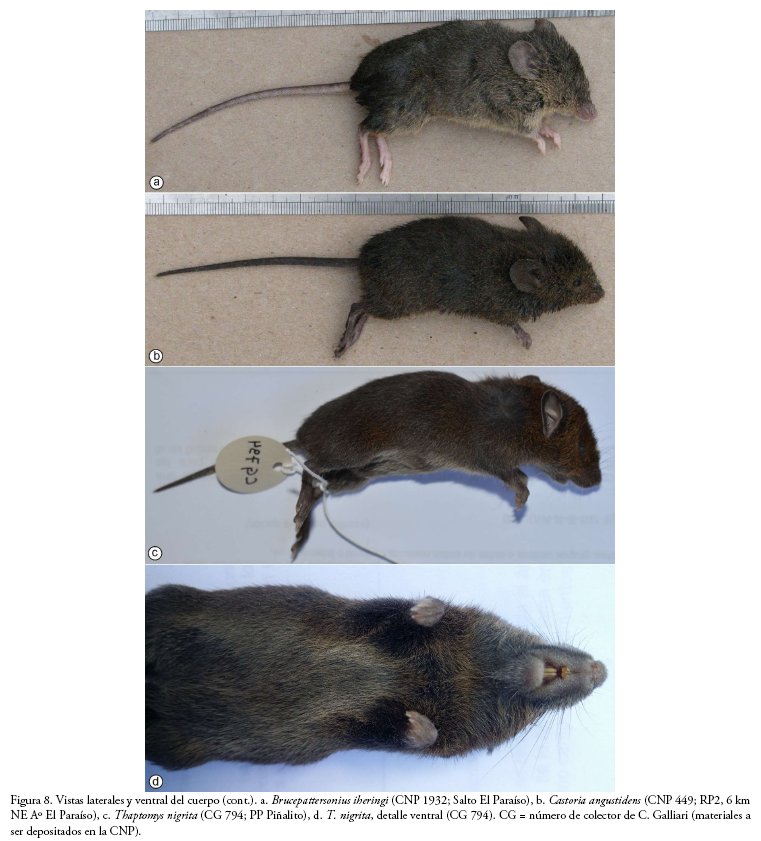
Abrawayaomys chebezi Pardiñas et al. 2009 (Fig. 7a): un único ejemplar fue capturado en un bosque sucesional de unos 20 años de antigüedad que ha colonizado un tramo del antiguo trazado de la Ruta Provincial 19, que fuera abandonado por la nueva traza de la pavimentación realizada entre 1994-2002 (Pardiñas et al. 2016b).
Akodontini
Akodon montensis Tilomas 1913 (Fig. 7f): es el roedor más abundante en la Selva Paranense, a juzgar por estos muestreos y datos previos (e.g., Crespo 1982, Massoia et al. 1987, Pereira et al. 2006, Cirignoli et al. 2011). Fue registrado en la mayoría de los ambientes: bosques sucesionales o capueras y bordes de caminos con pajonales y arbustales heliófilos, bosques secundarios, bosques implantados (ya fueran de Pinus sp., Araucaria angustifolia o Eucalyptus sp., especialmente en radales de cierta antigüedad), en playones basálticos del lecho y bordes de arroyos, en bañados del interior de la selva, en selvas y sarandizales de bordes de arroyos y en el interior de bosque, sea en selvas de terrazas, selvas de medias lomas y bosque mixto con Araucaria. Hembras preñadas, cuyo peso corporal medio fue 34.4 g (rango 25-46.5 g, n = 25), se registraron en abril, mayo, junio y septiembre, con la mayor frecuencia en este último mes. El número medio de fetos fue de 3.7 con una moda de 3 y un rango de 1 a 7 (n = 23). Las hembras de septiembre (primavera, media 4.1) presentaron mayor número de embriones (p= 0.008, test t varianza no igual) que las de abril, mayo y junio (otoño, media 2.8). Hembras con evidencias de lactación (pezones alargados, areolas desnudas a su alrededor y glándulas mamarias hipertrofiadas) se registraron en los meses de mayo, junio, agosto y septiembre. Si bien las abundancias relativas de sus poblaciones no presentan un patrón definido por ambientes, ya que resultan afectadas por la estacionalidad anual y los sitios de muestreo, las mayores fueron obtenidas en viejos bosques implantados de Araucaria y Eucalyptus y en bosques de terrazas y medias lomas. Algunos ejemplares muestreados en la localidad de PP Cruce Caballero fueron incluidos en el análisis filogeográfico de la especie por Valdéz & D'Elía (2013).
Akodon philipmyersi Pardiñas et al. 2005: registrado exclusivamente en los campos y malezales del sur de Misiones, en ambientes abiertos fuertemente impactados por el cultivo centenario de la yerba Ilex paraguariensis. Entre ellos, yerbatales invadidos por arbustos y pastizales, con cobertura total del suelo y arbustales densos de chilca (Baccharis spp.) en cuadros abandonados. No fue registrado en yerbatales recién desbrozados ni en sus bordes. No se detectaron hembras preñadas, pero si machos con testículos escrotales en mayo.
Brucepattersonius iheringi (Thomas 1896) (Figs. 7b, 8a): raro. Capturado en capueras, bosques secundarios y arbustales heliófilos en bordes de caminos rodeados de selva, selvas y sarandizales de borde de arroyos, interior de bosque, selvas de medias lomas y selvas de terraza. Registro de hembras preñadas en abril, mayo y septiembre, con un promedio de 2.2 fetos y moda 2 (n = 4). Pese a ser escasos los ejemplares obtenidos, la muestra incluye topotipos de las tres especies (B. guaraní, B. misionensis y B. paradisus) descriptas por Mares & Braun (2000) con localidades típicas en Misiones.
Castoria angustidens (Winge 1887) (Fig. 8b): un único ejemplar fue obtenido en el borde de un camino abandonado, en una comunidad de arbustos y pajonales ubicado entre el camino y un bosque secundario (Pardiñas et al. 2016a).
Necromys lasiurus temchuki (Massoia 1982) (Fig. 7d): es una de las especies predominantes en los campos y malezales del sur de la provincia. Registrado en varios ambientes abiertos, casi todos transformados o con fuerte presión agrícola y ganadera: yerbatales con cierto tipo de cobertura graminosa y arbustiva, pastizales higrófilos de Axonopus y Cynodon, arbustales de Baccharis, pajonales de cortaderas y sabanas de Aristida jubata y Andropogon con palmeras, como el coco (Acrocomia totaí) y el yatai poni (Butia paraguayensis). Hembras preñadas y amamantando fueron encontradas en mayo. Las mayores abundancias relativas de esta especie fueron obtenidas en yerbatales invadidos por gramíneas y arbustos.
Oxymycterus quaestor Tilomas 1903 (Fig. 7c): raro. Registrado en ambientes abiertos, modificados. En pastizal con cobertura total del suelo de Cynodon, en bordes de bañados en los préstamos de rutas vehiculares.
Oxymycterus rufus (G. Fischer 1814): raro. Restringido a pastizales con arbustos de Baccharis spp. en campos y malezales.
Thaptomys nigrita (Lichtenstein 1829) (Fig. 8c): registrada en el interior de bosques, especialmente en los bosques de medias lomas, aunque también en los de terrazas cercanas a cuerpos de agua. También en capueras, bosques secundarios y arbustales heliófilos en bordes de caminos, en bordes de bañados con abundante Cynodon sp. de hasta 50 cm de altura, e incluso, aunque más raramente, en bosques implantados de Araucaria angustifolia. Hembras preñadas y amamantando en septiembre y abril. Las mayores abundancias relativas se obtuvieron en el interior de bosques abiertos de medias lomas.
Oryzomyini
Euryoryzomys russatus (Wagner 1848) (Fig. 7e): Capturado en diferentes ambientes, incluyendo capueras, bosques secundarios y arbustales heliófilos en bordes de caminos rodeados de selva, selvas y sarandizales de borde de arroyos, interior de bosque, selvas de medias lomas y selvas de terraza, bosques mixtos con Araucaria y bosques implantados de Araucaria y Eucalyptus. Hembras preñadas fueron registradas en mayo y septiembre, machos con testículos escrotales en agosto.
Nectomys squamipes Brants 1827: Siempre los ejemplares fueron obtenidos en los playones basálticos de los lechos y en las selvas y sarandisales de los bordes de arroyos, nunca a mayor distancia de 10 metros del cuerpo de agua. Se registró una hembra preñada en septiembre con tres fetos de 15 mm.
Oligoryzomys flavescens (Waterhouse 1837): Se han capturado ejemplares de esta especie en ambientes abiertos de los Campos y Malezales del sur de Misiones, en arbustales de Baccharis spp., en yerbatales con vegetación espontanea arbustiva, en pastizales y pajonales. Además, se registraron ejemplares de esta especie en ambientes abiertos y modificados de la selva paranaense, como en bordes de bañados con gramillares y en bordes de arroyos y su intersección con caminos vehiculares. No se registraron hembras preñadas, pero si una amamantando en mayo.
Oligoryzomys nigripes (Olfers 1818): Capturado en una gran variedad de ambientes, en el interior de bosques de medias lomas, selvas de terraza, sarandisales y playones basálticos de arroyos, bosques mixtos con Araucana y bosques implantados, aunque particularmente abundante en ambientes de bordes, por ejemplo, en banquinas de caminos, en capueras y bosques secundarios con pajonales y arbustales heliófilos. Se encontraron hembras preñadas en junio, agosto y septiembre, amamantando en mayo y junio.
Sooretamys angouya (G. Fischer 1814): Se capturaron ejemplares en bosques de medias lomas y de terrazas, en sarandisales de bordes de arroyos, en capueras, bosques secundarios y banquinas de caminos vehiculares con buena cobertura arbustiva y poco tránsito. Hembras preñadas en mayo y agosto, con 6, 3 y 2 fetos de 30, 2 y 13 mm de longitud cabeza-cuerpo, respectivamente. Dos ejemplares de Refugio Moconá fueron analizados genéticamente en Chiquito et al. (2014).
Phyllotini
Calomys tener (Winge 1887): Se han obtenido ejemplares en ambientes abiertos de los campos y malezales del sur de Misiones, como sabanas de Aristida jubata y Andropogon con palmeras del género Butia y Acrocomia, yerbatales invadidos por arbustales y pajonales, pastizales y pajonales de cortaderas y en pajonales lindantes con bosques de ribera. No se registraron hembras preñadas. Sobre la asignación específica, parte de los ejemplares muestreados han sido confirmados mediante marcadores moleculares (González-Ittig et al. 2019).
Wiedomyini?
Juliomys pictipes (Osgood 1933): un único ejemplar obtenido en el borde de un arroyo, con sarandisales y sotobosque denso de bambúes (Chusquea reamossissima; Pardiñas et al. 2008).
1. Especies capturadas: observaciones sobre modos de vida y dieta
Nectomys squamipes: siempre capturado en sectores con exposiciones rocosas desnudas directamente inmediatos a cursos de agua de diverso caudal.
Oligoryzomys nigripes: algunos ejemplares fueron obtenidos en trampas colocadas sobre ramas de árboles o lianas (hasta aproximadamente 2 m de altura), aspecto que señala la capacidad trepadora de este colilargo.
Oxymycterus quaestor: los pocos ejemplares obtenidos fueron capturados en sectores con coberturas herbáceas densas. Contra lo que se esgrime sobre la potencial condición semi-fosorial de las especies del género, nada lo indica a partir de datos de captura, antes bien, su tratamiento como un cursorial típico. Por su tamaño corporal (> 100 g en adultos) y contenido estomacal, podría constituir algo así como el "depredador tope" en la comunidad de cricétidos misioneros.
Sooretamys angouya: aplica lo indicado previamente para O. nigripes.
Thaptomys nigrita: si bien no se ha realizado un muestreo "ad-hoc" para comprobarlo, las capturas de esta especie se efectúan en trampas contiguas o en las mismas trampas durante días sucesivos. Esto sugiere que podrían tener una disposición agregada o contagiosa y, quizás, cierto tipo de socialidad, presumiblemente relacionada al uso compartido de refugios o cuevas. Respecto de esto último, no hay certeza sobre si T. nigrita excava cuevas, pero nuestras observaciones indican que las hay unos orificios pequeños de boca circular abierta en la tierra roja en los lugares donde los hemos capturado. Todo esto se potencia con ciertos rasgos morfológicos de la especie que se atribuyen a semi-fosorialidad.
2. Especies capturadas: variación entre muestreos y conservación
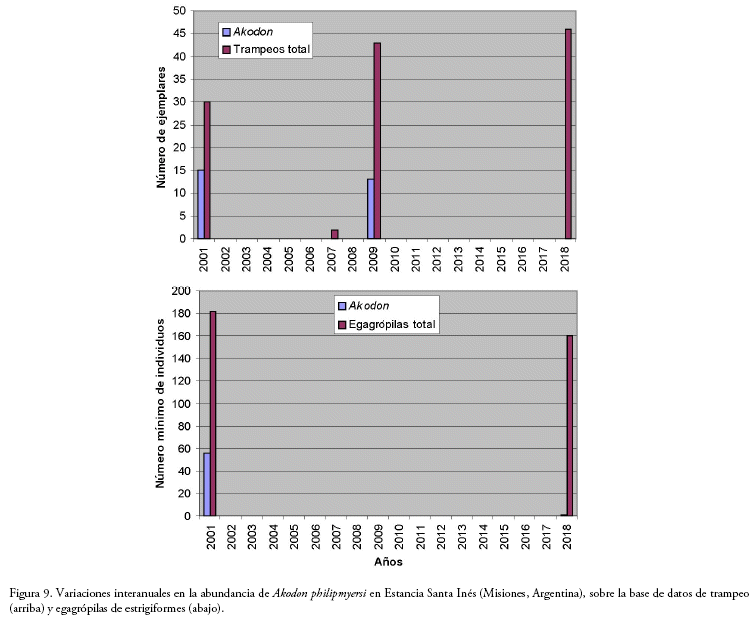
Akodon philipmyersi: para esta especie contamos con datos adicionales (muestreos efectuados en 2001 y análisis de egagrópilas) que permiten entrever cierta dinámica de su abundancia. Ya que ha sido considerada como "en peligro" en su reciente categorización (Teta et al. 2019), proporcionar esta información puede ser útil para analizar su caso desde una perspectiva sustentada en datos concretos de campo. La especie fue detectada, por primera vez, en una muestra de egagrópilas coleccionadas en la localidad tipo (Ea. Santa Inés) en el año 1999. Con la finalidad de obtener ejemplares completos para su descripción formal, se efectuó un primer trampeo en marzo 2001 que arrojó 15 individuos de A. philipmyersi sobre un total de 30 roedores capturados. Un nuevo muestreo en la localidad tipo, en abril de 2007, fue negativo en capturas. Sin embargo, una campaña en mayo de 2009 proporcionó 13 ejemplares (sobre un total de 43 roedores). Finalmente, en mayo de 2018, el resultado volvió a ser negativo para A. philipmyersi. A la par, una muestra de egagrópilas frescas (i.e., de 2018) reveló solo un ejemplar sobre 160 micromamíferos, pero la muestra original de 1999 contenía 56 individuos sobre 182 micromamíferos. Todo sugiere que en la última década la abundancia de este akodontino, al menos en su localidad tipo, ha experimentado fluctuaciones importantes (Fig. 9).
La merma, igualmente verificada (a través de los análisis de egagrópilas), de otras especies propias de ambientes de pastizal (como el cricétido Bibimys chacoensis o el marsupial Monodelphis dimidiata), sugiere un cambio importante en la estructura del paisaje, al menos durante la última década. Esto también se ve reflejado en las abundancias de un cricétido típico en arbustales ("chilcales"), como es Necromys lasiurus temchuki. En el trampeo de 2001, se registraron dos ejemplares; 30 animales en el trampeo de 2018. Sin embargo, se ignora si este tipo de variaciones de abundancia, esta marcha "especular" entre A. philipmyersi y N. l. temchuki, no constituye algún tipo de "ciclo" natural establecido en el paisaje ya profundamente antropizado del sur misionero (cabe recordar que el ámbito de Santa Inés fue pionero en la aclimatación yerbatera hacia comienzos del siglo XX y que llegaron a trabajar, en el acmé, hasta 1700 personas; Núñez 1997). En concreto, para A. philipmyersi, apenas se cuenta con información básica mínima. A tal punto, su registro fehaciente se restringe a dos localidades en Misiones, Estancia Santa Inés (localidad tipo) y Parada Leis (Pardiñas et al. 2005). El mapa de su rango geográfico en Teta et al. (2019), que indica poblaciones desde el río Paraná en Candelaria hasta cercanías de Apóstoles, carece de sustento fáctico. Antes bien, está negativamente contrastado por la evidencia disponible: una importante muestra de egagrópilas de Candelaria, con cientos de micromamíferos, carece de A. philipmyersi.
Discusión
El coleccionar especímenes, bajo parámetros razonables y éticos, sigue siendo algo clave en los estudios biológicos contemporáneos (e.g., Rocha et al. 2014, Krell & Wheeler 2014, de la Sancha et al. 2017). En Argentina, a diferencia de otros países de la región (véase más abajo), resulta perceptible un creciente desinterés por los trampeos de micromamíferos con remoción y preservación de ejemplares. Los pocos museos y centros de investigación que mantienen colecciones reflejan, excepto contadas excepciones, esta realidad. Hacia la segunda mitad del siglo pasado se efectuó un trasvasamiento de responsabilidad en las políticas de colección. Los planes de incremento en el número de especímenes biológicos ingresados dejaron de ser una prioridad global de las instituciones, para quedar regidos bajo la exclusiva responsabilidad y acción del curador de turno. A la par, el papel de "encargado de colección" fue perdiendo prestigio y se convirtió en una actividad puramente "técnica" y, en muchos casos, degradada intrínseca y extrínsecamente. Ejemplo señero, la colección de mamíferos del tradicional Museo Argentino de Ciencias Naturales "Bernardino Rivadavia", hoy día Colección Nacional de Mastozoología, alberga menos de 25.000 ejemplares y es, con mucho, la mayor del país (Barquez & Díaz 2014). Sin entrar en detalle sobre la calidad, representatividad y otros de dicho acervo, su comparación con la colección de mamíferos del Museu Nacional de Rio de Janeiro (Brasil), que alberga más de 100.000 ejemplares (Ávila-Pires & Oliveira 2014), resulta casi ociosa. Clásicamente a contrapelo, mientras en Argentina la inacción en colecciones mastozoológicas se mantiene incólume, la tendencia del Hemisferio Norte indica, aunque no en forma unánime, que cada vez son más valoradas y acrecentadas (e.g., Cook & Light 2019).
Misiones no ha sido la excepción a este proceso pauperizante y resulta palpable la casi virtual inexistencia de trabajos sistemáticos de muestreo de micromamíferos en su territorio. En el reciente y más comprensivo estudio a la fecha que explora los patrones de diversidad en el Bosque Atlántico (de la Sancha et al. 2020b), de los 340 trampeos incluidos en la base de análisis, ninguno corresponde a Misiones. La razón es sencilla: virtualmente no existen. Contra esto, Brasil y Paraguay han desarrollado planes extensivos que abarcan el relevamiento mediante trampeo de los micromamíferos de sus selvas. Podría argumentarse, aunque falazmente, que Brasil, en su porción sur y sudeste, es "mayormente selva" y que esa es la razón del número de muestreos (Graipel et al. 2017). Con un criterio similar, el peso de los 700.000 km2 de Patagonia en Argentina, debería inclinar la balanza de sus colecciones, pero la realidad es muy diferente.
Resulta instructivo analizar con algún mayor detalle el caso de Paraguay en las últimas décadas. Dos importantes programas de muestreo, involucrando estudios parasitológicos y virológicos, han dado lugar a una profusa producción bibliográfica que abarca desde aspectos puntuales a nivel taxonómico y distribucional (e.g., D'Elía et al. 2008, Owen et al. 2018, de la Sancha et al. 2020a), pasando por aproximaciones ecológicas diversas (e.g., Owen 2013, de la Sancha 2014), hasta exploraciones biogeográficas y evolutivas (e.g., de la Sancha et al. 2014, 2020b, Eastwood et al. 2018). Sin dudas, el despliegue analítico de algunos de los trabajos mencionados es encomiable, pero una de las claves del desarrollo ha sido un intenso muestreo a nivel local y regional. Por ejemplo, en la Reserva Natural del Bosque Mbaracayú, uno de los más grandes fragmentos de bosques que se encuentran protegidos en Paraguay, una transecta de aproximadamente 25 km de largo con 22 estaciones de trampeo involucró unas 8.600 noches trampa y la captura de 11 especies de cricétidos sobre 415 animales (Eastwood et al. 2018). Este muestreo, más otros complementarios en la misma reserva, han posibilitado diversos análisis (e.g., Barreto Cáceres & Owen 2019).
En palmario contraste con la situación reseñada para la Reserva Natural del Bosque Mbaracayú, el Parque Nacional Iguazú, por mencionar la unidad protegida más importante del territorio misionero (emblemática, además, a nivel nacional), solo cuenta con el antecedente édito del estudio de Crespo (1982). Cabría preguntarse si no se han efectuado nuevos muestreos desde entonces. La respuesta es que si se hicieron (e.g., Marconi 1988), pero poco se ha publicado, según nuestro mejor conocimiento. Y esto roza una característica recurrente adicional que atañe a parte del trabajo ejecutado con pequeños mamíferos en Misiones: falta de aplicación de pautas básicas de colección y escasa o nula publicación de resultados. La provincia aún carece de una colección de mamíferos y, de los numerosos cricétidos removidos, poco se ha preservado y menos estudiado (e.g., Pardiñas et al. 2008).
Los bosques y ambientes asociados de Misiones avanzan, en forma vertiginosa e incontrolada, hacia una degradación inexorable. Si no se promueve un cambio sustantivo en las políticas de colección, se perderá la oportunidad de conservar (al menos en los museos), una muestra de esta magnífica biodiversidad para estudios contemporáneos y futuros. Las condiciones básicas para el desarrollo de muestreos rigurosos y representativos existen, no solo en unidades protegidas y logística, sino también en toda una cadena de recursos humanos (desde guardaparques hasta científicos). Quizás, el único impedimento mayúsculo, es de tipo idiosincrásico. El presente trabajo se inscribe como un intento de resignificar lo que constituye el esfuerzo silente de la acción de colecta y la disponibilidad universal de esos datos.
Agradecimientos
Casi una década de trabajos de campo implicó el esfuerzo de numerosas personas, cuya asistencia fue crucial. Queremos reconocer aquí a nuestros compañeros de tantas campañas, las parasitólogas Marcela Lareschi, Rosario Robles y Juliana Notarnicola. Soportaron con singular estoicismo no solo los largos viajes, sino también lluvias torrenciales, encajadas de vehículos, picaduras de todo tipo de insectos, tórridas sesiones de trampeo y hasta los avatares de un tornado en inmediaciones de San Pedro. En forma saltuaria, pero igualmente valiosa, también participaron Cecilia Ezquiaga, Ekaterina Savchenko, Erika Cuéllar, Gabriela V. García, Guillermo Panisse, Jorge Barneche, Juliana Sánchez, Julio Torres, Natalia G. Martins y Mará Urdampilleta. Todos los trabajos de campo se efectuaron previa autorización del Ministerio de Ecología y Recursos Naturales de la Provincia de Misiones, quienes además extendieron las pertinentes guías de tránsito para el traslado del material coleccionado. En especial queremos agradecer a Ernesto Krauczuk, quien durante su período como funcionario atendió y entendió nuestras solicitudes, incluso los días feriados. Siempre, además, contamos con la colaboración de guardaparques, entre los que nos place recordar a Mariano Chudy y Víctor Matuchaka. La cordialidad y hospitalidad de numerosos pobladores, entre los cuales destacamos a la familia Nuñez (dueños de la Ea. Santa Inés), especialmente a Nanny Nuñez (que nos gratificó con la maravillosa experiencia de hospedarnos en el casco de su señorial estancia), fue una constante. Estos trabajos fueron posibles gracias al apoyo económico sostenido de la Agencia para la Promoción Científica y Tecnológica (PICTs 2010-0924 [a G. Navone], 2014-1039 [a UFJP], 2015-1348 [a G. Navone], 2015-1564 [a M. Lareschi]), el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET PIPs 6179 [a UFJP]) y subsidios automáticos de la Universidad Nacional de La Plata, como así también al apoyo logístico del Centro de Estudio de Parásitos y Vectores (CEPAVE-CONICET). En particular, la actual directora de esta última institución, Graciela T. Navone, fue una de las principales entusiastas de las tareas desarrolladas. Damián Voglino fue artífice del mapa de la figura 1. Finalmente, Robert Owen y Noé de la Sancha proveyeron valiosa bibliografía para explorar los muestreos de las últimas décadas en Paraguay; a la par, ambos actuaron como revisores de este manuscrito. A todas las personas e instituciones mencionadas, nuestro profundo reconocimiento.
Referencias
Agostini, I.I., I. Holzmann, M.S. Di Bitetti, L.I. Oklander, M.M. Kowalewski, P.M. Beldomnico, S. Goenaga, M. Martínez, E. S. Moreno, E. Lestani et al. 2014. Building a species conservation strategy for the Brown Howler Monkey (Alouatta guariba clamitans) in Argentina in the context of yellow fever outbreaks. Tropical Conservation Science 7: 25–34.
Ávila-Pires, F.D. & J.A. de Oliveira. 2014. A summarized history of Brazilian mammalogy – Una historia resumida de la mastozoología brasileña. Pp. 107–128. En: Ortega, J., J. L. Martínez & D. Tirira (eds). Historia de la mastozoología en Latinoamérica, las Guayanas y el Caribe. Editorial Murciélago Blanco y Asociación Ecuatoriana de Mastozoología, Quito.
Barquez, R.M. & M.M. Díaz. 2014. Historia de la mastozoología argentina – History of mammalogy in Argentina. Pp. 15–50. En: Ortega, J., J. L. Martínez & D. Tirira (eds). Historia de la mastozoología en Latinoamérica, las Guayanas y el Caribe. Editorial Murciélago Blanco y Asociación Ecuatoriana de Mastozoología, Quito.
Barquez, R.M., M.A. Mares & J.K. Braun. 1999. The bats of Argentina. Special Publications, Museum Texas Tech University 42: 1–275.
Barreto Cáceres, M.B. & R.D. Owen. 2019. Relación de los pequeños mamíferos terrestres (Rodentia y Didelphimorphia) con la estructura de la vegetación en el Bosque Atlántico Interior - un análisis multivariado. Therya 10: 359–369.
Chiquito, E.A., G. D’Elía & A.R. Percequillo. 2014. Taxonomic review of genus Sooretamys Weksler, Percequillo & Voss (Rodentia: Cricetidae: Sigmodontinae): an integrative approach. Zoological Journal of the Linnean Society 171: 842–877.
Cirignoli, S., C.A. Galliari, U.F.J. Pardiñas, D. Podestá & R. Abramson. 2011. Mamíferos de la Reserva Valle del Cuña Pirú, Misiones, Argentina. Mastozoologia Neotropical 18: 25–43.
Cook, J.A. & J.E Light. 2019. The emerging role of mammal collections in 21st century mammalogy. Journal of Mammalogy 100: 733–750.
Crespo, J.A. 1982. Ecología de la comunidad de mamíferos del parque Nacional de Iguazú, Misiones. Revista del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia”, Ecología 3: 45–162.
De Angelo, C., A. Paviolo & M. Di Bitetti. 2011. Differential impact of landscape transformation on pumas (Puma concolor) and jaguars (Panthera onca) in the Upper Paraná Atlantic Forest. Diversity and Distributions 17: 422–436.
de la Sancha, N.U. 2014. Patterns of small mammal diversity in fragments of subtropical Interior Atlantic Forest in eastern Paraguay. Mammalia 78: 437–449.
de la Sancha, N.U., S.A. Boyle & B. Patterson. 2017. Getting back to the basics: museum collections and satellite imagery are critical to analyzing species diversity. BioScience 67: 405–406.
de la Sancha, N.U., C.L. Higgins, S.J. Presley & R.E. Strauss. 2014. Metacommunity structure in a highly fragmented forest: Has deforestation in the Atlantic Forest altered historic biogeographic patterns? Diversity and Distribution 20: 1058–1070.
de la Sancha, N.U., G.S. Libardi & U.F.J. Pardiñas. 2020a. Discovery of a new genus record for Paraguay, the Atlantic Forest endemic rodent, Abrawayaomys (Cricetidae, Sigmodontinae). Mammalia 84: 366–371.
de la Sancha, N.U., R. Maestri, R.S. Bovendorp & C.L. Higgins. 2020b. Disentangling drivers of small mammal diversity in a highly fragmented forest system. Biotropica 52: 182–195.
D’Elía, G., I. Mora, P. Myers & R.D. Owen. 2008. New and noteworthy records of Rodentia (Erethizontidae, Sciuridae, and Cricetidae) from Paraguay. Zootaxa 1784: 39–57.
Eastwood, G., J.V. Camp, Y.K. Chu, A.M. Sawyer, R.D. Owen, X. Cao, M.K. Taylor, L. Valdivieso-Torres, R.D. Sage, A. Yu et al. 2018. Habitat, species richness and hantaviruses of sigmodontine rodents within the Interior Atlantic Forest, Paraguay. PloS ONE 13: e0201307.
Frangi, J., M.F. Arturi, J.F. Goya, S. Vaccaro & G. Píccolo. 2005. La sucesión secundaria del bosque subtropical y su importancia ecológica y agrícola en el centro y sur de Misiones. Pp. 1–11. En: Goya, J. F., J. L. Frangi & M. F. Arturi (comp). Ecología y manejo de los bosques de Argentina. Editorial de la Universidad Nacional de La Plata, Buenos Aires.
Fundación Vida Silvestre Argentina & WWF. 2017. El Estado del Bosque Atlántico: tres países, 148 millones de personas, uno de los bosques más ricos del Planeta. Puerto Iguazú. [ Links ]
Galindo-Leal, C. & I. Gusmão Câmara (eds). 2003. The Atlantic Forest of South America: biodiversity status, threats and outlook. Island Press, Washington.
González-Ittig, R., N.P. Kandel, C.R. Bonvicino & J. Salazar-Bravo. 2019. Does the widely distributed rodent Calomys tener (Cricetidae: Sigmodontinae) constitute a single evolutionary unit? Zoologia 36:e30354.
Graipel, M.E, J.J. Cherem, E.L. Monteiro-Filho & A.P. Carmignotto. 2017. Mamíferos da Mata Atlântica. Pp. 391–482. En: Monteiro-Filho E. L. & C. E. Conte (org). Revisões em Zoologia: Mata Atlântica. Editorial UFPR, Curitiba.
Izquierdo, A.E. & M. Srur. 2009. Diversidad de tipos de vegetación y ambientes en la Reserva de Vida Silvestre Urugua-í. Informe Técnico, Fundación Vida Silvestre, Buenos Aires.
Jones, C., W. McShea, M. Conroy & T. Kunz. 1996. Capturing mammals. Pp. 115–155. En: Wilson, D. E., F. R. Cole, J. D. Nichols, R. Rudran & M. S. Foster (eds) Measuring and Monitoring Biological Diversity - Standard Methods for Mammals. Smithsonian Institution Press, Washington DC.
Krell, F.-T. & Q.D. Wheeler. 2014. Specimen collection: Plan for the future. Science 344: 815–816.
Lanzone, C., C.A. Labaroni, A. Formoso, L.M. Buschiazzo, F. Da Rosa & P. Teta. 2018. Diversidad, sistemática y conservación de roedores en el extremo sudoccidental del Bosque Atlántico Interior. Revista del Museo Argentino de Ciencias Naturales 20: 151–164.
Liascovich, R.C. & O.A. Reig. 1989. Low chromosomal number in Akodon cursor montensis Thomas and karyologic confirmation of A. serrensis. Journal of Mammalogy 70: 391–396.
Mares, M.A. & J.K. Braun. 2000. Three new species of Brucepattersonius (Rodentia: Sigmodontinae) from Misiones Province, Argentina. Occasional Papers, Oklahoma Museum of Natural History 9: 1–13.
Marconi, P.N. 1988. Efecto de las perturbaciones intensas sobre la estructura de las comunidades de roedores. Tesis de Doctorado. Universidad Nacional de Buenos Aires, Buenos Aires. [ Links ]
Massoia, E. 1980. Mammalia de Argentina - I - Los mamíferos silvestres de la provincia de Misiones. ACNA (Iguazú) 1: 15–43.
Massoia, E. 1983. La alimentación de algunas aves del orden Strigiformes en la Argentina. El Hornero, Número Extraordinario 125–148.
Massoia, E. 1993. Los roedores misioneros -1- Lista sistemática comentada y geonemia provincial conocida. APRONA (Asociación para la Protección y Conservación de la Naturaleza), Boletín Científico 25: 40–51.
Massoia, E., J.C. Chebez & A. Bosso. 2006. Los mamíferos silvestres de la provincia de Misiones Argentina. Edición de los autores, Buenos Aires.
Massoia, E., O.B. Vaccaro, C.A. Galliari & S. Ambrosini. 1987. Las mastofauna del río Urugua-í, provincia de Misiones. Revista del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” e Instituto Nacional de Investigación de las Ciencias Naturales, Zoología 14: 111–124.
Núñez, J. 1997. Ivirareta – País de árboles. 3ra. Edición, Editorial Montoya, Posadas.
Owen, R.D. 2013. Ecology of small terrestrial mammals in an isolated Cerrado patch, eastern Paraguay: communities, species, and effects of ENSO, precipitation, and fire. Mastozoología Neotropical 20: 97–112.
Owen, R.D., H. Sánchez, K. Atkinson, L. McMahon & C.B. Jonsson. 2018. New and noteworthy records of rodents (Mammalia, Rodentia, Cricetidae and Echimyidae) from Paraguay. Check List 14: 721–730.
Oklander, L.I., M. Caputo, A. Solari & D. Corach. 2020. Genetic assignment of illegally trafficked neotropical primates and implications for reintroduction programs. Scientific Reports 10: e3676.
Pardiñas, U.F.J. & S. Cirignoli. 2001. ¿Cuán bien conocemos los pequeños roedores misioneros? Mastozoología Neotropical 8: 165–166.
Pardiñas, U.F.J. & S. Cirignoli. 2002. Bibliografía comentada sobre los análisis de egagrópilas de aves rapaces en Argentina. Ornitología Neotropical 13:31–59.
Pardiñas, U.F.J., G. D’Elía & S. Cirignoli. 2003. The genus Akodon (Muroidea: Sigmodontinae) in Misiones, Argentina. Mammalian Biology 68: 129–143.
Pardiñas, U.F.J., G. D’Elía, S. Cirignoli & P. Suárez. 2005. A new species of Akodon (Rodentia, Cricetidae) from the Northern Campos grasslands of Argentina. Journal of Mammalogy 86: 462–474.
Pardiñas, U.F.J., Geise, L., Ventura, K. & Lessa, G. 2016a. A new genus for Habrothrix angustidens Winge, 1887, and Akodon serrensis Thomas, 1902 (Cricetidae: Sigmodontinae): again paleontology meets neontology in the legacy of Lund. Mastozoología Neotropical 23: 93–115.
Pardiñas, U.F.J., P. Myers, L. León-Paniagua, N. Ordóñez Garza, J.A. Cook, B. Kryštufek, R. Haslauer, R.D. Bradley, G.I. Shenbrot & J.L. Patton. 2017. Family Cricetidae (True Hamsters, Voles, Lemmings and New World Rats and Mice). Pp. 204–279. En: Wilson, D. E., T. E. Lacher & R. A. Mittermeier (eds). Handbook of the Mammals of the World. Volume 7. Rodents II. Lynx Edicions, Barcelona.
Pardiñas, U.F.J., P. Teta & G. D’Elía. 2009. Taxonomy and distribution of Abrawayaomys (Rodentia: Cricetidae), an Atlantic Forest endemic with the description of a new species. Zootaxa 2128: 39–60.
Pardiñas, U.F.J., P. Teta, G. D’Elía & C.A. Galliari. 2008. Rediscovery of Juliomys pictipes (Rodentia: Cricetidae) in Argentina: emended diagnosis, geographic distribution, and insights on genetic structure. Zootaxa 1758: 29–44.
Pardiñas, U.F.J., P. Teta, M. Lareschi & C.A. Galliari. 2016b. New data on Abrawayaomys chebezi (Rodentia, Cricetidae), a poorly known South American sylvan rodent. Mammalia 80: 341–348.
Paviolo, A., C. De Angelo, K.M. Ferraz, R.G. Morato, J. Martinez Pardo, A.C. Srbek-Araujo, B.M. Beisiegel, F. Lima, D. Sana, M. Xavier da Silva, et al. 2016. A biodiversity hotspot losing its top predator: The challenge of jaguar conservation in the Atlantic Forest of South America. Scientific Reports 6:e37147.
Pereira, J., P. Teta, N. Fracassi, A. Johnson & P. Moreyra. 2006. Sigmodontinos (Rodentia, Cricetidae) de la Reserva de Vida Silvestre Urugua-í (provincia de Misiones, Argentina), con la confirmación de la presencia de “Akodon” serrensis en la Argentina. Mastozoología Neotropical 12: 83–89.
Rocha, L.A., A. Aleixo, G. Allen, F. Almeda, C.C. Baldwin, M.V.L. Barclay, J.M. Bates, A.M. Bauer, F. Benzoni, C.M. Berns, et al. 2014. Specimen collection: An essential tool. Science 344: 814–815.
SAyDS–SAREM (Secretaría de Ambiente y Desarrollo Sustentable de la Nación y Sociedad Argentina para el Estudio de los Mamíferos, eds.). 2019. Categorización 2019 de los mamíferos de Argentina según su riesgo de extinción. Lista Roja de los mamíferos de Argentina. <http://cma.sarem.org.ar>.
Srur, M., J. Herrera & A. Izquierdo. 2009. Planificación de las Áreas Protegidas del núcleo norte de la Provincia de Misiones. Directrices Generales de manejo. Anexo II. Identificación de Ambientes. Proyecto Araucaria XXI. Administración de Parques Nacionales, 61 pp.
Teta, P., E. Burgos & I. Gómez Villafañe. 2019. Akodon philipmyersi. Categorización 2019 de los mamíferos de Argentina según su riesgo de extinción. Lista Roja de los mamíferos de Argentina. Disponible en: http://cma.sarem.org.ar
Vaccaro, O. B. & E. Massoia. 1988. La presencia de Glossophaga soricina soricina (Pallas, 1766) en la provincia de Misiones, Argentina. (Chiroptera, Phyllostomidae). Revista del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” e Instituto Nacional de Investigación de las Ciencias Naturales, Zoología 15: 49–53.
Valdéz, L. & G. D’Elía. 2013. Differentiation in the Atlantic Forest: phylogeography of Akodon montensis (Rodentia, Sigmodontinae) and the Carnaval–Moritz model of Pleistocene refugia. Journal of Mammalogy 94: 911–922.













 uBio
uBio