Ecología en Bolivia
versión impresa ISSN 1605-2528versión On-line ISSN 2075-5023
Ecología en Bolivia vol.54 no.1 La Paz abr. 2019
Artículo
Diversidad arbórea del bosque tucumano-boliviano en la alta cuenca del río Bermejo (Tarija, Bolivia)
Tree diversity of the Tucuman -Bolivian forest in the upper river basin of Bermejo (Tarija, Bolivia)
Silvia C. Gallegos*, Freddy S. Zenteno-Ruiz, Stephan G. Beck & Ramiro P. López
Herbario Nacional de Bolivia (LPB), Instituto de Ecología, Museo Nacional de Historia Natural, Universidad Mayor de San Andrés, Campus Universitario Cota-Cota, calle 27, La Paz, Bolivia *Autora de correspondencia: silvia.gallegos.a@gmail.com
Recibido: 07.07.18, Aceptado: 13.11.18.
Resumen
Pocos estudios han documentado la diversidad del bosque tucumano-boliviano en Bolivia, especialmente en Tarija, donde muchos de los trabajos consisten en informes inéditos. Pese a dichos vacíos de información, se sabe que la diversidad de especies arbóreas en estos bosques disminuye con la latitud, destacando la importancia del estudio de los mismos en el sector boliviano. Por otro lado, todavía no se conoce cómo cambia la diversidad de estos bosques con relación a la altitud. El presente trabajo analizó la variación en la diversidad α y β, además de su contribución relativa a la diversidad y, en un gradiente altitudinal de 2.000 m en la alta cuenca del río Bermejo en el sector boliviano. En 2006 se establecieron 13 parcelas temporales de muestreo de 0.1 ha entre 650-2.600 m de altitud, en lugares representativos de la vegetación, donde se midieron todas las plantas leñosas con un dap ≥2.5 cm. En total registramos 2.758 individuos pertenecientes a 143 especies, 84 en las formaciones submontana y montana y 26 en la altimontana. Encontramos un pico de riqueza de especies a elevaciones medias entre 900 y 1.200 m con una disminución marcada entre 1.700 y 2.000 m. La diversidad β fue elevada dentro y entre las formaciones vegetales, destacando el alto recambio de especies en áreas reducidas y la necesidad de tener más estudios en esta ecorregión. La distribución de las especies estuvo determinada por la altitud y la pendiente. Además de contribuir con el análisis de la diversidad α y β, con esta publicación se pretende llamar la atención sobre la ejecución de nuevas investigaciones en la zona para documentar el cambio en la diversidad tras diversas presiones a la biodiversidad que se han estado registrando en los últimos años.
Palabras clave: Altitud, las Yungas, partición aditiva de la riqueza de especies, similitud, subtropical.
Abstract
Few studies documented the diversity at Tucuman-Bolivian forest in Bolivia, especially in Tarija, where most studies are inedited reports. In spite of the knowledge gaps, it is known that tree species diversity within these forests reduces with latitude, highlighting the importance of studying them in Bolivia. Furthermore, studies about the altitudinal variation of diversity within these forests are still scarce. This study analyzed the variation in alpha and β diversity, besides their relative contribution to y diversity, in an elevational gradient of 2000 m in the upper river basin of Bermejo in Bolivia. In 2006, we established 13 temporary sampling plots of 0.1 ha, between 650 and 2600 m above sea level, located in representative vegetation stands, where we measured all woody plants with diameter at breast high (dbh) higher than 2.5 cm. We registered 2,758 individuals from 143 species, 84 in both lower montane and montane forest and 26 in the upper montane forest. We found a mid-elevation species richness peak between 900 and 1,200 m, with a steep decrease between 1,700-2,000 m. β diversity was high within and between forest types, standing out the high species turnover in reduced areas and the need of more studies in this eco-region. Species distribution was determined by elevation and slope. Besides documenting alpha and β diversity, this publication aims to calli for new research in the study area to assess the changes in diversity after different pressures that have been registered within last years.
Keywords: additive partitioning of species diversity, elevation, Yungas, similarity, subtropical.
Introducción
El bosque tucumano-boliviano, también conocido como las Yungas subtropicales, es una de las ecorregiones con mayores vacíos de información sobre biodiversidad (Malizia et al. 2006, Carretero et al. 2011, Villegas & Mostacedo 2011). La mayor parte de los estudios sobre biodiversidad de esta ecorregión se llevó a cabo en el noroeste de Argentina (p.e., Brown et al. 1985; Grau & Brown 1995; Malizia et al. 2006). De las publicaciones existentes en Bolivia (Ayarde et al. 1999, Moraes & Sarmiento 1999, Meneses & Chávez 2001, ZONISIG 2001, PEA-Bermejo 2003, Serrano 2003, Caballero & Jørgensen 2005, Malizia et al. 2006, Beck et al. 2007, Villarroel & Ruiz 2009, Zenteno-Ruiz & López 2010, Zenteno-Ruiz et al. 2010), la mayor parte describe la vegetación de la zona y muy pocas analizan la variación de la diversidad de especies.
El estudio de la diversidad de especies es muy importante para entender qué procesos naturales pueden estar actuando sobre la biota de una región y para promover estrategias de conservación a escalas adecuadas. La diversidad se puede medir a diferentes escalas espaciales. La diversidad γ (gamma) corresponde a la diversidad total de especies de un paisaje o región. Está determinada por la diversidad α (alfa), que representa la diversidad dentro de una comunidad (a escala local) y la diversidad β (beta), que representa la diversidad entre comunidades (Veech et al. 2002). Al mismo tiempo, la diversidad β mide el cambio en la composición y abundancia de las especies a lo largo de gradientes ambientales (Whittaker 1956). La diversidad β, a su vez, presenta dos componentes: la disimilitud correspondiente al recambio de especies (i.e., reemplazo de algunas especies por otras de un sitio al otro) y la disimilitud correspondiente al anidamiento (i.e. el sitio más pobre es un "subset" del sitio más rico en especies, Baselga 2012). La diversidad total en una región (γ) es igual a la suma de la diversidad dentro de las comunidades (α) y entre las comunidades (β); esta relación es conocida como la partición aditiva de la diversidad (Veech et al. 2002). Dicha suma facilita la comparación de los valores de diversidad a diferentes escalas espaciales y temporales y permite comparar valores observados con valores esperados al azar (Veech et al. 2002). Además, la partición aditiva permite identificar la fuente primaria de la diversidad total de una región. Finalmente, los resultados a partir de estos cálculos pueden permitir recomendar el nivel al que las estrategias de conservación serían más efectivas para mantener la diversidad regional (Gering et al. 2003).
En el bosque tucumano-boliviano se pueden distinguir tres fajas o pisos altitudinales (distritos, sensu Cabrera 1976) que responden a las diferencias climáticas, especialmente de humedad y temperatura, con cierta continuidad a lo largo de toda su extensión (Ayarde et al. 1999). Los tres pisos altitudinales, de aquí en adelante denominados formaciones vegetales a partir de Zenteno-Ruiz et al. (2010) son el bosque submontano (o selva submontana sensu Brown et al. 2002) entre 400 y 700-900 m de altitud, el bosque montano (o selva montana sensu Brown et al. 2002) entre 600-700 m y 1.500-1.800 m y el bosque altimontano (o bosque montano sensu Brown et al. 2002) entre 1.500-1.800 m y 2.500-3.000 m (Cabrera 1976, Brown 1995, Ayarde et al. 1999, Brown et al. 2002, Zenteno-Ruiz et al. 2010). Según algunos estudios, la riqueza de especies del bosque tucumano-boliviano disminuye conforme aumenta la latitud, por lo que se esperaría que los bosques bolivianos sean más diversos que los argentinos (Ayarde 1995, Morales et al. 1995, Brown et al. 2002).
Por otro lado, la diversidad varía también en función de la altitud. Para los bosques montanos tropicales, se alcanzan picos de diversidad a 1000-1500 m (Gentry 1988, Lieberman et al. 1996, Vázquez & Givnish 1998, Antezana 2007, López & Duque 2010), en parte debido a que a estas altitudes se da una combinación de temperatura (no hace frío) y humedad (máximos picos de precipitación) más favorable para muchas plantas. Sin embargo, más al sur en el subtrópico (sur de 20° de latitud), ya existe estacionalidad térmica, con temperaturas mucho más frías en invierno (Brown et al. 2001). No está del todo claro cómo el efecto de esta mayor estacionalidad afecta a los patrones de diversidad conforme cambia la altitud, y este es uno de los temas que merecen más investigación por su interés teórico y aplicado. Nuestro estudio dará algunos indicios para el estudio de estos patrones a mayor profundidad.
Aunque hasta 2010 este bosque era una de las ecorregiones con menores tasas de deforestación en Bolivia (Müller et al. 2014), actualmente está siendo amenazado por el ingreso de proyectos hidroeléctricos e hidrocarburíferos en la Reserva Nacional de Flora y Fauna Tariquía, además de la ganadería, el avance de la frontera agrícola, las quemas descontroladas, la explotación forestal selectiva y sin planificación. Por esta razón, es importante promover las investigaciones en la zona para dar a conocer los patrones de biodiversidad de estos bosques, lo cual es esencial para promover adecuadas políticas de conservación basadas en conocimiento científico.
El presente estudio forma parte del proyecto "Estado actual de conservación de la biodiversidad en la cuenca del río Bermejo - PEA" y tiene como objetivo analizar la diversidad α, β y γ e investigar la relación entre la riqueza y la altitud en la alta cuenca del río Bermejo en el sector boliviano hasta 2006.
Área de estudio
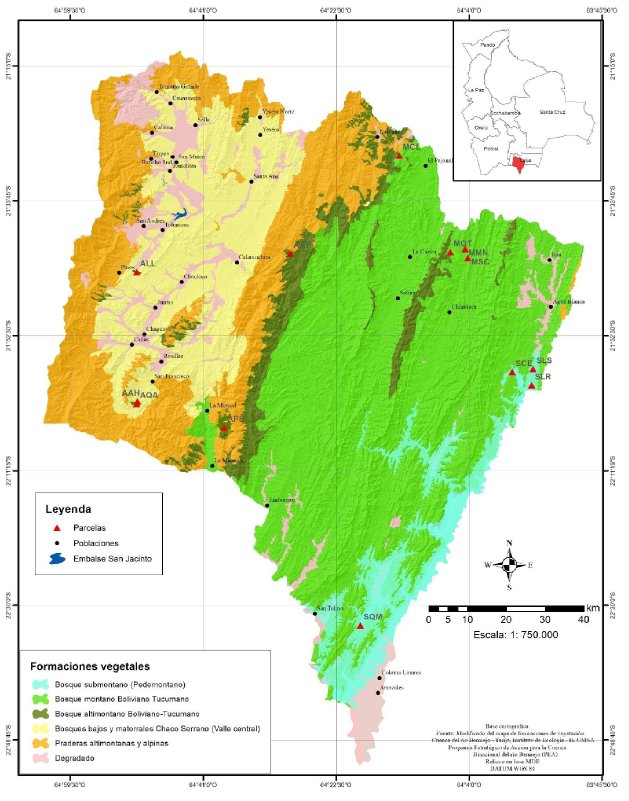
La alta cuenca del río Bermejo (ACRB) se extiende desde los 21-25° de latitud sur, desde el sur de Bolivia hasta el noroeste de Argentina, sobre la margen oriental de la cordillera de los Andes. En Bolivia se encuentra íntegramente en el departamento de Tarija, donde ocupa un área de 11.896 km2 (Anexo 1); limita al norte y oeste con la cuenca del río Pilcomayo, al este con la cuenca del río Caraparí y al sur con la Argentina (PEA-Bermejo 2003). En la ACRB se distinguen dos provincias fisiográficas: la cordillera Oriental de los Andes y las serranías del subandino (ZONISIG 2001, PEA-Bermejo 2003). Las serranías del subandino están formadas por el bosque tucumano-boliviano que presenta tres formaciones vegetales cuyas características se describen a continuación:
La formación submontana (Zenteno-Ruiz et al. 2010), también denominada bosque pedemontano subandino (Prado & Gibbs 1993, Prado 2000), selva pedemontana (Brown 1995, Brown et al. 2001, 2002) y vegetación subandina pluviestacional boliviano-tucumana (Navarro 2002), se extiende al pie y en las lomas bajas de las primeras elevaciones montanas entre 400 y 700-900 m de altitud (Ayarde et al. 1999). El clima es cálido subhúmedo, con temperaturas medias anuales de entre 22 y 24°C y precipitación anual de 1.000-1.300 mm (PEA-Bermejo 2003). Se caracteriza por presentar bosques mayormente caducifolios de 20-25 m de altura, con emergentes que alcanzan los 30 m (Moraes & Sarmiento 1999). Es una unidad claramente distinguible del bosque montano y altimontano, tanto fisonómica como florísticamente, motivo por el cual su ubicación en la provincia de las Yungas (sensu Cabrera 1976) o en la provincia Boliviano-Tucumana (sensu Navarro 2002) es muy dudosa. Por su composición de especies es considerada como un relicto de bosque del Arco Pleistocénico (Prado & Gibbs 1993). Además, constituye una de las áreas boscosas con mayor grado de transformación y degradación por el hombre y uno de los ambientes con mayor prioridad de conservación por la presencia de especies ecológica y económicamente valiosas (Vides-Almonacid et al. 1998, Brown 2009).
La formación montana (Zenteno-Ruiz et al. 2010), también llamada selva montana (Cabrera 1976, Brown 1995, Brown et al 2002) o bosque montano boliviano-tucumano (Navarro 2002), se extiende desde 600-700 y 1.500-1.800 m de altitud (Brown 1995, Ayarde et al. 1999, Brown et al. 2002) por las laderas de las montañas, constituyendo una densa masa de vegetación que se caracteriza por la alta diversidad arbórea, la gran cantidad de epífitas, lianas y enredaderas. El clima varía entre cálido húmedo y muy húmedo, con temperaturas medias anuales de entre 20 y 22°C y precipitación anual de 1.200 a 2.200 mm (PEA-Bermejo 2003). El bosque es mayormente siempreverde, y el dosel alcanza los 20 m de altura con emergentes que pueden sobrepasar los 25 m (Moraes & Sarmiento 1999).
La formación altimontana (Zenteno-Ruiz et al. 2010), también denominada bosque montano (Cabrera 1976, Brown 1995, Morales et al. 1995, Brown et al 2002), bosque del piso montano superior (Hueck 1978) y bosque altimontano subhúmedo boliviano-tucumano (Navarro 2002), se extiende entre 1.500-1.800 y 2.500-3.000 m de altitud (Cabrera 1976, Brown 1995, Ayarde et al. 1999), coincidiendo con el límite altitudinal de los bosques, que depende de la altura de las montañas y de la actividad humana (deforestación e incendios para el rebrote de pasturas; Brown 1995). El clima es templado subhúmedo, con temperaturas medias anuales de entre 16 y 18°C y precipitación anual de 1.000 a 1.200 mm (PEA-Bermejo 2003). El bosque es mayormente caducifolio, con un dosel de 10 m de altura (Moraes & Sarmiento 1999).
Métodos
Se instalaron 13 parcelas temporales de muestreo de 0.1 ha, o parcelas Gentry (Gentry 1982, Phillips & Miller 2002) modificadas a 50 x 20 m ó 100 x 10 m (Duque et al. 2001, Cuello 2002, Araujo-Murakami et al 2005), divididas en 10 subparcelas de 10 x 10 m. Cuatro parcelas fueron instaladas en el bosque submontano, cuatro en el bosque montano y cinco en el bosque altimontano. Las parcelas fueron nombradas por siglas, cuya letra inicial corresponde a la formación vegetal a la que pertenecen: S = submontana, M = montana, A = altimontana (ver detalles de las parcelas en el Anexo 2). En cada parcela se consideraron todos los individuos leñosos (i.e. árboles, arbustos y lianas) con diámetro a la altura del pecho (dap) ≥ 2.5 cm. Se registró la especie, diámetro, altura total y estado fenológico. Todos los individuos que no pudieron ser identificados a nivel de especie en el campo fueron recolectados para su posterior identificación por especialistas y almacenamiento de vouchers en el Herbario Nacional de Bolivia (LPB, con el acrónimo SGA = Silvia Gallegos Ayala). En cada parcela se tomaron datos de altitud, pendiente, exposición de la ladera y coordenadas geográficas.
Análisis de datos
Para el análisis de la diversidad α se calcularon la riqueza de especies (número de especies), índice de diversidad de Shannon-Wiener (H'), índice de dominancia de Simpson (D) (Magurran 2004) y estimador de diversidad Chao 1 (Chao et al. 2009). Las diferencias entre los valores promediados de las parcelas para cada formación fueron comparadas mediante análisis de varianza. Además se realizaron rarefacciones (Gotelli & Colwell 2001) para cada parcela y por formación vegetal. Para analizar la relación entre la riqueza y la altitud se ejecutaron regresiones lineales, de segundo y tercer orden, considerando la distribución de errores normal y Poisson para la riqueza de especies, mediante modelos lineales generalizados, incluyendo a la riqueza como variable dependiente y a la altitud, su función cuadrática y cúbica, como variables independientes. Posteriormente, se compararon los valores AICc (Criterio de Información de Akaike con corrección para pequeños tamaños de muestra; Burnham & Anderson 2002) de los diferentes modelos, y se seleccionó el modelo con menor AICc como el que mejor describía la relación entre la riqueza y la altitud.
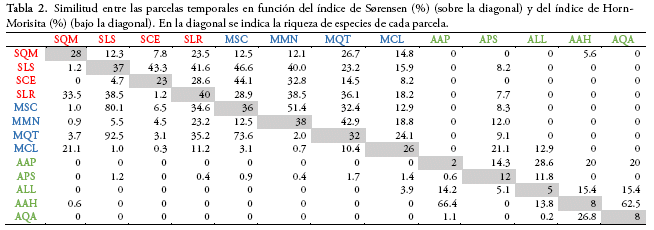
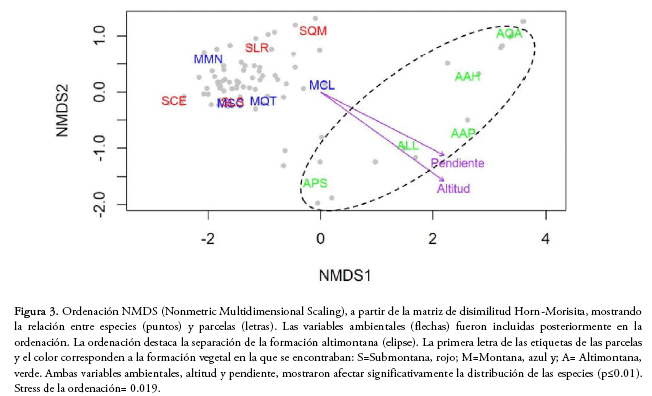
Para el análisis de la diversidad β, que considera el recambio en la composición de especies entre hábitats, se evaluó la similitud en la composición de especies entre las diferentes parcelas y formaciones vegetales calculando los índices de similitud de Sørensen (presencia/ausencia) y Horn-Morisita (cuantitativo) (Magurran 2004). Para ver si las diferentes formaciones vegetales se distinguen de acuerdo con la composición de especies y visualizar el efecto de la altitud, la pendiente y la exposición de la ladera en la distribución de las especies se realizó una ordenación NMDS (Nonmetric Multidimensional Scaling). Para este análisis se usaron dos tablas, una con el número de individuos de las 143 especies en las 13 parcelas, previamente transformados a la raíz cuadrada, y otra tabla con las variables de altitud, pendiente y exposición por parcela. Este análisis se hizo en base a una matriz de disimilitud Horn-Morisita (Oksanen et al. 2018).
Para analizar la partición aditiva de la diversidad consideramos y = ![]() + β, donde: γ = riqueza total de especies en un conjunto de muestras, a cualquier escala;
+ β, donde: γ = riqueza total de especies en un conjunto de muestras, a cualquier escala; ![]() = promedio del número de especies dentro de una muestra; y β= promedio del número de especies no observadas en una muestra (Veech et al. 2002, Crist et al. 2003). Para obtener estos valores se calcularon las diversidades locales a nivel de parcelas (
= promedio del número de especies dentro de una muestra; y β= promedio del número de especies no observadas en una muestra (Veech et al. 2002, Crist et al. 2003). Para obtener estos valores se calcularon las diversidades locales a nivel de parcelas (![]() parcelas= promedio de la riqueza de todas las parcelas) y formaciones (
parcelas= promedio de la riqueza de todas las parcelas) y formaciones (![]() formaciones= promedio de la riqueza en cada formación), la diversidad β entre parcelas dentro de cada formación (βparcelas=
formaciones= promedio de la riqueza en cada formación), la diversidad β entre parcelas dentro de cada formación (βparcelas= ![]() formaciones-
formaciones-![]() parcelas) y la diversidad β entre las formaciones (βformaciones= γ -
parcelas) y la diversidad β entre las formaciones (βformaciones= γ - ![]() formaciones), obteniendo finalmente la ecuación: γ =
formaciones), obteniendo finalmente la ecuación: γ = ![]() parcelas + βparcelas + βformaciones (Veech et al. 2002, Crist et al 2003). Estos valores fueron posteriormente comparados con valores obtenidos al azar, tras 1000 permutaciones Monte Cario (Crist et al. 2003). Se realizó el mismo procedimiento considerando el índice de Shannon-Wiener, para incluir los efectos combinados de la riqueza y abundancia de las especies (Gering et al. 2003).
parcelas + βparcelas + βformaciones (Veech et al. 2002, Crist et al 2003). Estos valores fueron posteriormente comparados con valores obtenidos al azar, tras 1000 permutaciones Monte Cario (Crist et al. 2003). Se realizó el mismo procedimiento considerando el índice de Shannon-Wiener, para incluir los efectos combinados de la riqueza y abundancia de las especies (Gering et al. 2003).
Finalmente, analizamos la diversidad β, considerando la variación en la composición de especies entre sitios, a partir de la contribución de sus componentes: el recambio de especies y las especies que se pierden entre un sitio y otro (anidamiento). La diversidad β se midió a partir del índice de disimilitud de Sørensen (βsor), la disimilitud basada en el recambio de especies se midió a partir del índice de disimilitud de Simpson (βsim) y la disimilitud basada en el anidamiento consideró el componente de anidamiento del índice de Sørensen (βsne), considerando a como el número de especies compartidas entre dos sitios, b el número de especies únicas en el sitio con menor número de especies, y c el número de especies únicas en el sitio con mayor número de especies (Baselga & Orme 2012), incluidos en la siguiente ecuación:
![]()
Todos los análisis se realizaron en el programa R (R Core Team 2018, versión 3.5.0) usando los paquetes vegan (Oksanen et al. 2018), lme4 (Bates et al. 2015) y betapart (Baselga et al. 2018).
Resultados
Diversidad α
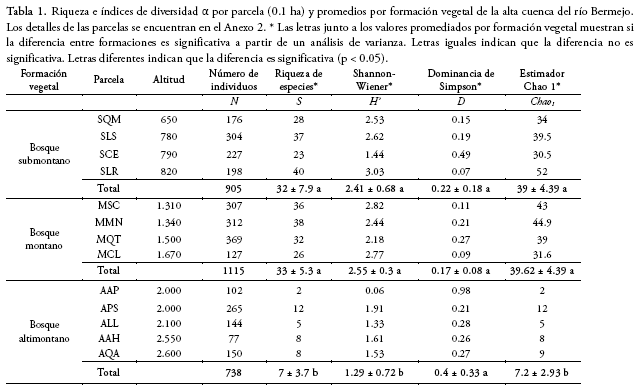
En las 13 parcelas temporales de 0.1 ha se registraron 2.758 individuos (2.397 árboles/arbustos y 361 lianas) con dap ≥ 2.5 cm pertenecientes a 143 especies, 111 géneros y 51 familias (ver la lista de especies en el Anexo 3). En cada una de las formaciones submontana y montana encontramos 84 especies y en la altimontana, 26. La riqueza de especies y la diversidad, analizadas mediante el índice de Shannon-Wiener, fueron
significativamente mayores en las parcelas del bosque submontano y montano que en el altimontano (Tabla 1). La parcela con mayor riqueza de especies, mayor índice de Shannon-Wiener y menor dominancia fue SLR, en la formación submontana, mientras que la parcela con menor riqueza, menor índice de Shannon-Wiener y mayor dominancia fue AAP, en la formación altimontana (Anexo 1). Todas las parcelas mostraron una dominancia variable, excepto la parcela AAP en la formación altimontana, con una dominancia muy elevada (D=0.98). Al analizar los índices por formación vegetal, las formaciones montana y submontana mostraron tener significativamente mayor riqueza de especies y diversidad según el índice de Shannon-Wiener que la formación altimontana (Tabla 1). Los valores de dominancia de Simpson no fueron significativamente diferentes.
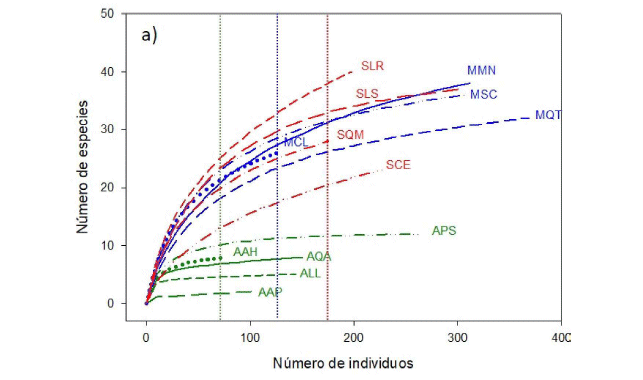
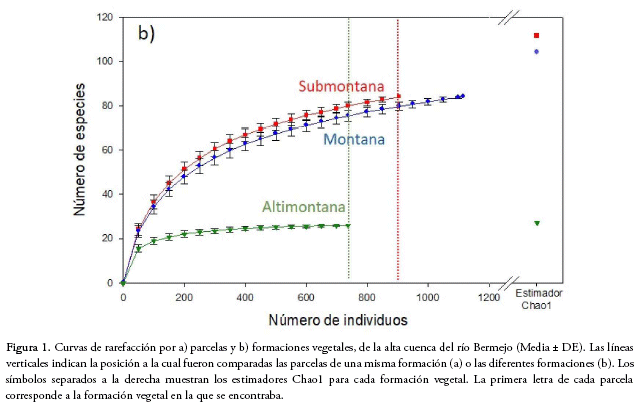
Las curvas de rarefacción por parcela revelaron cuan variable puede ser la riqueza de especies en las formaciones submontana y montana, mostrando en todos los casos mayores valores que las parcelas de la formación altimontana (Fig. 1a). Tanto la rarefacción como el estimador Chao 1 mostraron a la formación submontana como la más diversa, seguida de la montana con valores muy cercanos y muy por debajo la altimontana (Fig. 1b, Tabla 1). La forma de las curvas de rarefacción, al acercarse a valores asintóticos en el caso de la formación altimontana, muestra que el esfuerzo de muestreo fue suficiente para dicha formación, pero no fue suficiente para las formaciones submontana y montana (Fig. 1a, b).
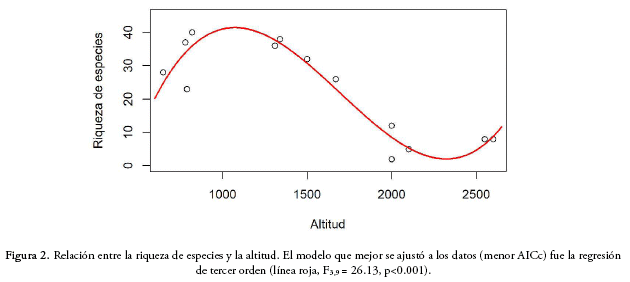
Para establecer la relación entre la riqueza de especies y la altitud, comparamos modelos lineares, de segundo y tercer orden y encontramos que el modelo que se ajusta mejor a los datos es la regresión polinomial de tercer orden (cúbica), lo que indica que la riqueza de especies presenta un pico a elevaciones medias, entre los 900 y 1.200 m de altitud, y una drástica disminución en zonas altas entre 1.700 y 2.000 m (F3,9 = 26.13; p<0.01, R2 = 0.86; AICc= 93.36; Fig. 2).
Diversidad β
Tras calcular los índices de similitud de Sørensen y Horn-Morisita, encontramos que la similitud en la composición de especies entre parcelas es en general muy baja. Menos del 5% de los índices mostraron una similitud mayor al 50%. Los valores más bajos se observaron entre parcelas de la formación altimontana y las otras formaciones (Tabla 2). Los valores de similitud más altos (≥ 50%) se obtuvieron entre las parcelas AQA - AAH y MMN - MSC con el índice de Sørensen, que sólo considera presencia/ausencia de las especies y entre las parcelas MQT - SLS, MSC - SLS, MQT - MSC y AAH -AAP con el índice Horn-Morisita, que considera la abundancia de las especies (ver el significado de las siglas en el Anexo 2). La similitud entre formaciones vegetales fue mayor entre la formación submontana y montana (Sørensen = 50%, Horn-Morisita = 60%, con 42 especies compartidas), seguida por la montana y altimontana (Sørensen = 14.5%, Horn-Morisita = 1.1%, con 8 especies compartidas) y finalmente la submontana y altimontana (Sørensen = 7.3%, Horn-Morisita = 0.4%, con 4 especies compartidas).
Al analizar la similitud en la composición de especies mediante la ordenación NMDS, sólo se pudo separar la formación altimontana, mientras que las formaciones submontana y montana mostraron tener una composición de especies similar (Fig. 3). Al mismo tiempo, pudimos detectar que la distribución de las especies está determinada por la altitud y la pendiente, las cuales se ajustaron significativamente al NMDS (p ≤ 0.01, Fig. 3), mientras que la exposición no tuvo un efecto significativo (p = 0.17). La representación de la ordenación NMDS en dos ejes mostró ser elevada, lo que se refleja en el bajo stress (0.019).
Partición aditiva de la diversidad
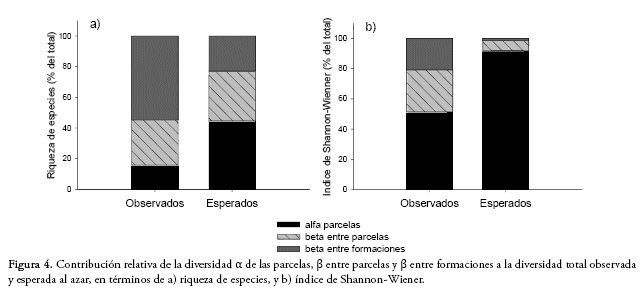
Al analizar la diversidad total a partir de la suma de sus componentes (γ = ![]() + β) en términos de la riqueza de especies, encontramos que el 55% de la riqueza de especies observada correspondió a la diversidad β entre formaciones, 29% a la diversidad β entre parcelas y sólo un 16% de la diversidad total estuvo representada por la diversidad α de las parcelas (Fig. 4). Los valores observados de diversidad α y β entre parcelas fueron significativamente menores a los valores esperados, mientras que la diversidad β entre formaciones vegetales observada fue significativamente mayor a la esperada (Fig. 4). Los valores encontrados con el índice de Shannon-Wiener, que considera la abundancia de las especies, mostraron una contribución de la diversidad α menor a la esperada, mientras que las diversidades β entre parcelas y formaciones observadas fueron mayores a las esperadas.
+ β) en términos de la riqueza de especies, encontramos que el 55% de la riqueza de especies observada correspondió a la diversidad β entre formaciones, 29% a la diversidad β entre parcelas y sólo un 16% de la diversidad total estuvo representada por la diversidad α de las parcelas (Fig. 4). Los valores observados de diversidad α y β entre parcelas fueron significativamente menores a los valores esperados, mientras que la diversidad β entre formaciones vegetales observada fue significativamente mayor a la esperada (Fig. 4). Los valores encontrados con el índice de Shannon-Wiener, que considera la abundancia de las especies, mostraron una contribución de la diversidad α menor a la esperada, mientras que las diversidades β entre parcelas y formaciones observadas fueron mayores a las esperadas.
Al analizar la importancia relativa de la disimilitud correspondiente al recambio de especies y la correspondiente a la anidación en la diversidad β, medida a partir de la disimilitud total, 93.5% de la disimilitud total explicada por los datos se debió al recambio de especies y sólo el 6.5% a la anidación. La importancia relativa mostró valores similares para cada formación.
Discusión
Diversidad α
Encontramos mayor riqueza y diversidad de especies en las parcelas de las formaciones submontana y montana, con valores significativamente menores para la formación altimontana. Este patrón se observó tanto en los índices de diversidad como en la rarefacción, mostrando que entre los 1.700 y 2.000 m de altitud existe una marcada reducción de la riqueza y diversidad de especies. Al analizar la relación entre la riqueza de especies de las diferentes parcelas y la altitud, encontramos que la disminución no es lineal, si no que se observa un pico de riqueza a elevaciones medias. Este patrón fue evidenciado con la regresión cúbica como el mejor modelo para explicar nuestros datos. El encontrar mayor riqueza de especies a elevaciones medias podría deberse a las condiciones favorables de humedad y temperatura en esta franja y a una mayor variabilidad de los ambientes que podrían beneficiar el establecimiento de un número mayor de especies, provenientes de mayores y menores altitudes. El pico de riqueza a elevaciones medias fue documentado por Rahbek (1995) tras analizar esta relación para diferentes datos de plantas y animales de diferentes regiones del planeta, y fue respaldado por varios estudios posteriores (p.e., Herzog et al. 2005, Longino & Branstetter 2018). Este mismo patrón fue reportado en otros estudios sobre bosques tucumano-bolivianos (Holst et al. 1997, Serrano 2003, Malizia et al 2006, 2012, Villarroel & Ruiz 2009) y en bosques tropicales (Gentry 1988, Lieberman et al 1996, Vazquez & Givnish 1998, López & Duque 2010). Sin embargo, en otros estudios se observó un patrón de disminución monotónica de la riqueza de especies con la altitud, tanto para bosques neotropicales (Gentry 2001) como tucumano-bolivianos de Argentina (Grau & Brown 1995, Brown et al. 2001, Phillips & Miller 2002, Cuyckens et al. 2015). Aunque los datos del presente estudio sugieren un pico de riqueza de especies a elevaciones medias (cerca a los 1.000 m), por la gran variabilidad de estos bosques y el número reducido de parcelas, nuestros datos son todavía insuficientes para poder confirmar uno de estos patrones. Por lo tanto, un muestreo con mayor número de parcelas a lo largo de un mismo sistema de montaña podría permitir confirmar la relación entre la riqueza de especies y la altitud en los bosques tucumano-bolivianos. Además, el pico podría ser más evidente si se muestrearan comunidades en tierras más bajas y secas, donde se esperaría una menor diversidad, como la reportada por Malizia et al. (2012) entre 300 y 500 m.
Los valores de diversidad de especies del presente estudio, calculados a partir del índice de Shannon-Wiener, fueron en general mayores a los reportados en Argentina (Ayarde 1995, Roldan 1995, Cuyckens et al. 2015), pero menores a los reportados en Santa Cruz (Villarroel & Ruiz 2009) y Chuquisaca (Serrano 2003), al norte de los sitios analizados. Los valores de dominancia de las formaciones vegetales de este estudio fueron mayores a los reportados a menor latitud, en Santa Cruz (Villarroel & Ruiz 2009). Esta tendencia a la disminución de la riqueza y diversidad de especies con la latitud en el bosque tucumano-boliviano fue propuesta por Sarmiento (1972), Hueck (1978), Ayarde (1995) y Morales et al. (1995). Dichos autores atribuyen esta disminución a las discontinuidades físicas (aislamiento geográfico y temporal, sobre todo en el sector argentino) y a las menores temperaturas en invierno a medida que aumenta la latitud, destacando la mayor diversidad de estos bosques en el sector boliviano. Es importante subrayar que nuestro estudio se basó en la riqueza de especies leñosas ≥ 2.5 cm de diámetro, por lo cual no consideramos hierbas y arbustos más pequeños entre los que se esperaría encontrar una mayor riqueza de especies, pero todavía no se conoce mucho acerca de estas plantas en el sector boliviano.
Diversidad β
La mayoría de los valores de similitud entre las parcelas de una misma formación fue muy baja (con un promedio de 13 a 17% de especies compartidas con el índice Horn-Morisita), destacando la gran diferencia en la composición de especies. Estos resultados podrían indicar, por un lado, la elevada diversidad β de estos bosques y, por otro, la baja representatividad de estas parcelas por su pequeño tamaño. La similitud entre parcelas de diferentes formaciones fue aún menor, principalmente entre las parcelas del bosque altimontano y las otras formaciones vegetales (con un promedio de 0.1% y 0.4% de especies compartidas con el submontano y montano, respectivamente). La diversidad β entre formaciones vegetales también fue elevada, especialmente entre la formación altimontana y las otras formaciones, principalmente cuando se consideró la abundancia de las especies (con el índice de Horn-Morisita). La baja similitud encontrada entre el bosque altimontano y los otros bosques podría responder al contraste altitudinal, de temperatura y humedad, y a una gran distancia geográfica. La distancia geográfica es la principal determinante de la similitud de especies a escala regional en bosques submontanos de Argentina, ocasionando un gran recambio de especies posiblemente ligado a la limitación en la dispersión de semillas (Blundo et al. 2016). En Argentina también se observó una menor similitud en la composición de especies entre el bosque altimontano y las otras formaciones (Malizia et al. 2012). La gran diversidad β también podría responder a las diferentes afinidades florísticas de las formaciones vegetales, como el predominio de especies de origen holártico y gondwánico en la formación altimontana (Malizia et al. 2012), la mayor influencia tropical en la formación montana (Brown et al. 2001) y la mayor afinidad con los bosques secos del Arco Pleistocénico de la formación submontana (Prado & Gibbs 1993).
El alto recambio de especies de los bosques tucumano-bolivianos con relación a la altitud también se reflejó en un gradiente marcado de fenología y síndromes de dispersión en un estudio en Argentina (Malizia et al. 2012). En dicho estudio observaron diferentes fisiologías de las especies arbóreas que responden al marcado gradiente ambiental, mostrando más especies caducifolias en el bosque submontano y altimontano y más especies siempreverdes a elevaciones intermedias. Dichos autores sugieren que los cambios fenológicos responden a la mayor precipitación y humedad por neblina a elevaciones medias, bajas temperaturas invernales y sequía encima los 1.600 m y un ambiente más seco y caliente en el bosque submontano (Blundo et al. 2012), reflejando su diferente fisiología (Borchert et al. 2002). De la misma forma, observaron más especies con síndrome de dispersión por viento en el bosque submontano, mientras que la mayoría de las especies del bosque montano y altimontano tenían adaptaciones para ser dispersadas por animales. Las diferencias en fenología y síndromes de dispersión en estos tipos de bosques destacan la forma en la que los gradientes ambientales condicionan la fisiología de las especies, lo cual limita la capacidad de las mismas a distribuirse a lo largo de todo el gradiente, determinando el recambio de las especies.
Por el método de ordenación sólo logramos diferenciar a las parcelas de la formación altimontana de las parcelas de las otras formaciones. Las parcelas de las formaciones submontana y montana no pudieron ser separadas por este método, mostrando valores muy cercanos en ambos ejes de la ordenación, posiblemente por los mayores valores de similitud en la composición de especies. El mismo patrón fue observado por Morales et al. (1995), quienes encontraron mayor similitud en la composición del bosque montano y submontano, tanto a nivel de familias como de especies, en un análisis sobre el cambio en la riqueza y composición de especies en el gradiente altitudinal y latitudinal del bosque tucumano-boliviano en Argentina. La similitud en la composición de estos bosques podría responder al elevado número de especies de afinidad tropical en ambas formaciones y al ambiente más favorable en invierno, lo que hace que estas especies tropicales, termófilas, vivan relativamente bien en cualquiera de ellos. Al mismo tiempo, encontramos tres especies comunes en algunas parcelas de las formaciones montana y submontana, incrementando su similitud. Por otro lado, la similitud entre estas formaciones podría responder a que el bosque submontano del presente estudio correspondería mejor con un bosque de transición entre el montano y submontano. Los bosques submontanos propiamente dichos podrían estar presentes más cerca del Chaco (p.e., en las cercanías de Yacuiba), donde las condiciones climáticas, con períodos más largos de sequía y mayores temperaturas diurnas, serían más favorables para la dominancia de las especies características del Arco Pleistocénico (Prado 2000). La aparición disyunta de dichas especies en Sudamérica impulsó a Prado (2000) a ubicar estos bosques en la Provincia Fitogeográfica de los Bosques del Piedemonte Subandino dentro del Dominio de los Bosques Tropicales Estacionales. Aunque muchas de estas especies están presentes en la formación submontana de este estudio, no necesariamente son las especies dominantes.
La ordenación también mostró que la altitud y la pendiente fueron los factores determinantes en la distribución de las especies. La influencia de la altitud en la distribución de especies también se observó en bosques tucumano-bolivianos de Santa Cruz y Argentina (Villarroel & Ruiz 2009, Blundo et al. 2012, Cuyckens et al. 2015). Brown et al. (2001) sugieren que las variables ambientales tienen un importante rol en determinar la distribución de especies en bosques andinos. La altitud está inversamente correlacionada con la temperatura, la presión atmosférica y el área en los cinturones bioclimáticos, y directamente correlacionada con la radiación (Korner 2007). Dichas variables determinan un gradiente altitudinal en la distribución de las especies. La pendiente también fue determinante en la distribución de especies, concordando con lo encontrado por Blundo et al. (2016). La topografía pudo haber tenido ese efecto, pues influye en la deposición de nutrientes y en la variación en las características y drenaje de los suelos (John et al. 2007). Es importante considerar que además de la marcada influencia de la altitud, mediante los factores ambientales correlacionados, y la pendiente, también son importantes otras variables como la precipitación, la característica de los suelos y las perturbaciones relacionadas con la extracción de madera, ganado de transhumancia, incendios, etc. Dichas variables pueden tener un efecto en la diversidad y distribución de las especies a diferentes escalas (Blundo et al. 2012), pero no fueron consideradas en este estudio.
Partición aditiva de la diversidad
Los resultados de la partición aditiva de la diversidad destacan la baja contribución de la diversidad α y la gran influencia de la diversidad β (tanto entre parcelas como formaciones vegetales) en la diversidad total (γ). Este patrón se reflejó al fraccionar la diversidad en sus componentes α y β (Fig. 4) y en la elevada disimilitud de las parcelas, tanto dentro de las formaciones como entre formaciones (Tabla 2). La elevada diversidad β encontrada podría responder a la gran variación en las condiciones ambientales que existe a lo largo de este amplio gradiente altitudinal (Blundo et al. 2012), produciendo un elevado recambio en la composición de especies tanto entre parcelas como
formaciones. El recambio de especies también mostró ser muy importante (93%) al fraccionar la diversidad β en sus componentes (Le., disimilitud contribuida por el recambio de especies y el anidamiento). Otro estudio en el bosque tucumano-boliviano en Argentina también reportó altas tasas de recambio de especies a lo largo del gradiente altitudinal (Blundo et al. 2012). La combinación de factores bióticos y abióticos, que varían a lo largo del gradiente altitudinal, podrían determinar el alto recambio de especies (Báez et al. 2015). Este elevado recambio puede responder a la distancia geográfica entre las parcelas, a la gran variabilidad topográfica y climática a escala regional, a grandes variaciones edáficas a escala local y a la heterogeneidad ambiental de estos bosques a lo largo del gradiente altitudinal (Blundo et al. 2016).
El hecho de que la diversidad β aporte más a la diversidad regional destaca la importancia de conservar espacios grandes y promover el establecimiento de amplios corredores para impulsar la conservación de la mayor parte de las especies del bosque tucumano-boliviano. El bosque tucumano-boliviano está subrepresentado en el sistema nacional y subnacional de áreas protegidas de Bolivia (Larrea-Alcázar et al. 2016). La alta cuenca del río Bermejo es una de las áreas prioritarias de conservación de este bosque por su elevada biodiversidad, endemismo, diversidad de ecosistemas amenazados y potencial estabilidad a largo plazo (Brown et al. 2002). Lamentablemente, además de la ganadería, el avance de la frontera agrícola, las quemas descontroladas y la explotación forestal amenazan la diversidad de la zona desde hace varias décadas (Ayala 2004). Estas amenazas ponen en riesgo la permanencia del servicio ecosistémico de captación de humedad a partir de la neblina y el control de la erosión por parte de los bosques (Brown 1995). Asimismo, en los últimos años, se está promoviendo la entrada de varios proyectos hidroeléctricos (Ministerio de Energías, www.evh.bo) e hidrocarburíferos (Ministerio de Hidrocarburos, www3.hidrocarburos.com.bo), dentro y fuera de la Reserva Nacional de Flora y Fauna Tariquía, amenazando la diversidad de grandes extensiones del bosque tucumano-boliviano. La formación submontana es una de las regiones más amenazadas por la deforestación y el cambio de uso del suelo tanto en el sector boliviano (Vides-Almonacid et al. 1998, Zenteno-Ruiz et al. 2010), como en el argentino (Brown 2009, Malizia et al. 2012). Dada su reducida extensión, es importante generar estrategias de conservación a nivel binacional para este ecosistema. La elevada riqueza y abundancia de recursos forestales maderables que existe en la formación submontana destaca el potencial de esta formación para un aprovechamiento forestal sostenible que evite la conversión de estos bosques en tierras de cultivo (Malizia et al. 2009).
Conclusiones
La diversidad del bosque tucumano-boliviano en la alta cuenca del río Bermejo en Bolivia mostró un pico de riqueza de especies a elevaciones medias, revelando una marcada disminución a mayor altitud. La diversidad β fue muy elevada, tanto entre parcelas de una misma formación como entre parcelas de diferentes formaciones vegetales. Nuestro estudio sólo permitió diferenciar a la formación altimontana de las otras formaciones de acuerdo con su composición de especies. La distribución de las especies estuvo determinada por la altitud y la pendiente del terreno. Nuestros resultados destacan el gran recambio de especies que existe entre localidades dentro de un mismo ambiente, por lo cual sugerimos se promueva la conservación de áreas grandes, a lo largo del gradiente altitudinal, para asegurar la permanencia de estas especies. Finalmente, debido a las grandes amenazas que actualmente están afectando la diversidad de la alta cuenca del río Bermejo, proponemos que se realice una evaluación sobre el estado actual de la diversidad de la zona, para lo cual motivamos a la publicación de los estudios realizados (p.e., Beck et al. 2007), para promover el uso de este y otros trabajos como una línea base.
Agradecimientos
El presente estudio fue realizado en el marco del proyecto "Estado actual de conservación de la biodiversidad en la cuenca del río Bermejo" a cargo del Instituto de Ecología, financiado por el Programa Estratégico de Acción (PEA) para la Cuenca Binacional del río Bermejo y las becas del Instituto de Ecología. Agradecemos a Kazuya Naoki por su apoyo en el análisis de datos, a Abraham Poma y Ever Cuevas por su invaluable ayuda en el trabajo de campo, al SERNAP-Tarija y a los guías de campo de las comunidades locales.
Referencias
Antezana, A. 2007. Composición florística y estructura del bosque subandino pluvial de Yungas en dos rangos altitudinales en el Área Natural de Manejo Integrado Apolobamba, Bolivia. Tesis de Licenciatura en Biología. Universidad Mayor de San Andrés, La Paz. 120 p.
Araujo-Murakami, A., F. Bascopé, V. Cardona - Peña, D. De la Quintana, A. Fuentes, P.M. Jørgensen, C. Maldonado, T. Miranda, N. Paniagua-Zambrana & R. Seidel. 2005. Composición florística y estructura del bosque amazónico preandino en el sector del Arroyo Negro, Parque Nacional Madidi, Bolivia. Ecología en Bolivia 40(3): 281-303.
Ayala, R. (ed.). 2004. Áreas protegidas del departamento de Tarija. 2da. Edic. Protección del Medio Ambiente (PROMETA) Tarija. 204 p.
Ayarde, H.R. 1995. Estructura de un sector de selva pedemontana, Reserva Fiscal Parque la Florida, Tucumán (Argentina). Pp. 69 -78. En: Brown, A.D. & H.R. Grau (eds.) Investigación, Conservación y Desarrollo en Selvas Subtropicales de Montaña. Proyecto de Desarrollo Agroforestal / Laboratorio de Investigaciones Ecológicas de las Yungas, Tucumán.
Ayarde, H.R., C. Boero, M. Moris, A. Slanis & J.A. Gonzáles. 1999. Flora y vegetación de Tariquía. Pp. 29 -62. En: Gonzáles, J.A. G.J. Scrocchi & E.O. Lavilla (eds.) Relevamiento de la Biodiversidad de la Reserva Nacional de Flora y Fauna Tariquía (Tarija, Bolivia). Serie Conservación de la Naturaleza N° 14. Fundación Miguel Lillo, Tucumán.
Báez, S., A. Malizia, J. Carilla, C. Blundo, M. Aguilar, N. Aguirre, Z. Aquirre, E. Álvarez, F. Cuesta, Á. Duque, W. Farfán -Ríos, K. García-Cabrera, R. Grau, J. Homeier, R. Linares - Palomino, L.R. Malizia, O.M. Cruz, O. Osinaga, O.L. Phillips, C. Reynel, M.R. Silman, and K.J. Feeley. 2015. Large-scale patterns of turnover and basal area change in Andean forests. PLoS ONE 10(5): e0126594.
Baselga, A. 2012. The relationship between species replacement, dissimilarity derived from nestedness, and nestedness. Global Ecology and Biogeography 21(12): 1223-1232. [ Links ]
Baselga, A. & C.D.L. Orme. 2012. Betapart: an R package for the study of beta diversity. Methods in Ecology and Evolution 3(5): 808–812.
Baselga, A., D. Orme, S. Villeger, J. De Bortoli & F. Leprieur. 2018. betapart: Partitioning beta diversity into turnover and nestedness components. R package version 1.5.0. https://CRAN.Rproject.org/package=betapart
Bates, D., M. Maechler, B. Bolker, S. Walker. 2015. Fitting linear mixed-effects models using lme4. Journal of Statistical Software, 67(1): 1-48.
Beck, S.G., F. Zenteno -Ruiz, S.C. Gallegos & R.P. López. 2007. Vegetación y diversidad florística. pp. 30-180. En: M. Marconi (ed.) Biodiversidad en la alta cuenca del río Bermejo. PEA-Bermejo, informe no publicado.
Blundo, C., L.R. Malizia, J.G. Blake & A.D. Brown. 2012. Tree species distribution in Andean forests: Influence of regional and local factors. Journal of Tropical Ecology 28(1): 83–95.
Blundo, C., M. González-Espinosa, and L. R. Malizia. 2016. Relative contribution of niche and neutral processes on tree species turnover across scales in seasonal forests of NW Argentina. Plant Ecology 217(4): 359–368.
Borchert, R., G. Rivera & W. Hagnauer. 2002. Modification of vegetative phenology in a tropical semideciduous forest byvabnormal drought and rain. Biotropica 34(1): 27-39.
Brown, A.D. 1995. Fitogeografía y conservación de las selvas de montaña del noroeste de Argentina. Pp. 663-672. En: Churchill, S.P., H. Balslev, E. Forero & J.L. Luteyn (eds.) Biodiversity and Conservation of Neotropical Montane Forests. The New York Botanical Garden, Nueva York.
Brown, A.D. 2009. Las selvas pedemontanas de las Yungas: Manejo sustentable y conservación de la biodiversidad de un ecosistema prioritario del noroeste argentino. Pp. 13-37. En: Brown, A.D., P.G. Blendinger, T. Lomáscolo & P. García-Bes (eds.) Selva Pedemontana de las Yungas: Historia Natural, Ecología y Manejo de un Ecosistema en Peligro. Fundación ProYungas. Ediciones del Subtrópico, Tucumán.
Brown, A.D., S.C. Chalukian & L.M. Malmierca. 1985. Estudio florístico-estructural de un sector de selva semidecidua del noroeste argentino. I. Composición florística, densidad y diversidad. Darwiniana 26: 27-41.
Brown, A.D., H.R. Grau, L.R. Malizia & A. Grau. 2001. Argentina. Pp. 623-659. En: Kapelle, M. & A.D. Brown (eds.) Bosques Nublados del Neotrópico. Instituto Nacional de Biodiversidad, Santo Domingo de Heredia.
Brown, A.D., A. Grau, T. Lomáscolo & N.I. Gasparri. 2002. Una estrategia de conservación para las selvas subtropicales de montaña (Yungas) de Argentina. Ecotropicos 15(2):147-159.
Burnham, K.P. & D.R. Anderson. 2002. Model Selection and Multimodel Inference: A Practical Information-Theoretic Approach. Springer, Nueva York. 488 p.
Caballero, J. & P.M. Jørgensen. 2005. Composición, estructura y riqueza florística de dos sitios en el bosque boliviano-tucumano, Chuquisaca, Bolivia. Revista Ciencia y Desarrollo 3:16-27.
Cabrera, A.L. 1976. Regiones fitogeográficas argentinas. pp. 1-85. En: Kugler, W. F. (ed.) Enciclopedia Argentina de Agricultura y Jardinería. 2º ed., Edit. Acme, Buenos Aires.
Carretero, M.A., M. Serrano, F. Borchsenius & H. Balslev (eds.). 2011. Pueblos y plantas de Chuquisaca. Estado del conocimiento de los pueblos, la flora, uso y conservación. BEISA2, Herbario del Sur de Bolivia, Universidad Mayor Real y Pontificia de San Francisco Xavier de Chuquisaca, Sucre. 351 p.
Chao, A., R.K. Colwell, C.W. Lin & N.J. Gotelli. 2009. Sufficient sampling for asymptotic mínimum species richness estimators. Ecology 90(4): 1125-1133.
Crist, T.O., J.A. Veech, J.C. Gering & K.S. Summerville. 2003. Partitioning species diversity across landscapes and regions: a hierarchical analysis of α, β, and γ diversity. The American Naturalist 162(6): 734–743.
Cuello, N.L. 2002. Altitudinal changes of forest diversity and composition in the Ramal de Guaramacal in the Venezuelan Andes. Ecotropicos 15(2): 160-176. [ Links ]
Cuyckens, G.A.E., L.R. Malizia & C. Blundo. 2015. Composición, diversidad y estructura de comunidades de árboles en un gradiente altitudinal de selvas subtropicales de montaña (Serranías de Zapla, Jujuy, Argentina). Madera y Bosques 21(3):137-148.
Duque, A., M. Sánchez, J. Cavelier, J.F. Duivenvoorden, P. Miraña, J. Miraña & A. Matapí. 2001. Relación bosque-ambiente en el Medio Caquetá, Amazonía colombiana. Pp. 99-129. En: Duivenvoorden, J.F., H. Balslev, J. Cavelier, C. Grandez, H. Tuomisto & R. Valencia (eds.) Evaluación de Recursos Vegetales no Maderables en la Amazonía noroccidental. IBED. Universiteit van Amsterdam, Amsterdam.
Gentry, A.H. 1982. Neotropical floristic diversity: Phytogeographical connections between Central and South America, Pleistocene climatic fluctuations, or an accident of the Andean orogeny? Annals of the Missouri Botanical Garden 69(3): 557-593. [ Links ]
Gentry, A.H. 1988. Changes in plant community diversity and floristic composition on environmental and geographic gradients. Annals of the Missouri Botanical Garden 75(1):1-34. [ Links ]
Gentry, A.H. 2001. Patrones de diversidad y composición florística en los bosques de las montañas neotropicales. pp. 85-123. En: Kapelle, M. & A.D. Brown (eds.) Bosques Nublados del Neotrópico. Instituto de Biotecnología Agrícola, San José.
Gering, J.C., T.O. Crist & J.A. Veech. 2003. Additive partitioning of species diversity across multiple spatial scales: implications for regional conservation of biodiversity. Conservation Biology 17(2): 488-499.
Gotelli, N.J. & R.K. Colwell. 2001. Quantifying biodiversity: procedures and pitfalls in the measurement and comparison of species richness. Ecology Letters 4: 379-391.
Grau, H.R. & A.D. Brown. 1995. Patterns of tree species diversity along latitudinal and altitudinal gradients in the Argentinean subtropical montane forests. Pp. 295-300. En: Churchill, S.P., H. Balslev, E. Forero & J.L. Luteyn (eds.) Biodiversity and Conservation of Neotropical Montane Forests. The New York Botanical Garden, Nueva York.
Herzog, S.K., M. Kessler & K. Bach. 2005. The elevational gradient in Andean bird species richness at the local scale: a foothill peak and a high-elevation plateau. Ecography 28(2): 209–222.
Holst, B.K., M. Serrano & L. Arroyo. 1997. Vegetation of tucumano-boliviano forests in Chuquisaca, Bolivia. Pp. 21-71. En: Schulenberg, T.S. & K. Awbrey (eds.) A Rapid Assessment of the Humid Forests of South Central Chuquisaca, Bolivia. RAP Working papers 8. Conservation International, Washington D.C.
Hueck, K. 1978. Los bosques de Sudamérica: Ecología, composición e importancia económica. Sociedad Alemana de Cooperación Técnica, Eschborn. 476 p. [ Links ]
John, R., J.W. Dalling, K.E. Harms, J.B. Yavitt, R. Stallard, M. Mirabello, S.P. Hubbell, R. Valencia, H. Navarrete, M. Vallejo & R.B. Foster. 2007. Soil nutrients influence spatial distributions of tropical tree species. Proceedings of the National Academy of Sciences 104(3): 864–869.
Körner, C. 2007. The use of “altitude” in ecological research. Trends in Ecology and Evolution 22(11): 569-574.
Larrea-Alcázar, D. M., R.P. López, F.S. Zenteno - Ruíz, I. Lafuente & Y. Fernández. 2016. Uneven representation of biogeographical regions in Bolivia’s protected areas and indigenous territories. Ecología en Bolivia 51(2): 141–156.
Lieberman, D., M. Lieberman, R. Peralta & G.S. Hartshorn. 1996. Tropical forest structure and composition on a large-scale altitudinal gradient in Costa Rica. Journal of Ecology 84(2): 137-152.
Longino, J.T. & M.G. Branstetter. 2018. The truncated bell: an enigmatic but pervasive elevational diversity pattern in middle American ants. Ecography 41: 1-12.
López, W. & A. Duque. 2010. Patrones de diversidad alfa en tres fragmentos de bosques montanos en la región norte de los Andes, Colombia. Revista de Biología Tropical 58(1): 483-498.
Magurran, A.E. 2004. Measuring biological diversity. Blackwell Science, Oxford. 256 p. [ Links ]
Malizia, L.R., C. Blundo & S. Pacheco. 2006. Diversidad, estructura y distribución de bosques con cedro en el noroeste de Argentina y sur de Bolivia. pp. 83-104. En: Pacheco, S. & A. Brown (eds.) Ecología y Producción de Cedro (género Cedrela) en las Yungas Australes. Laboratorio de Investigaciones Ecológicas de las Yungas-ProYungas, Tucumán.
Malizia, L.R., S. Pacheco & B.A. Loiselle. 2009. Árboles de valor forestal en las Yungas de la Alta Cuenca del Río Bermejo. pp. 105-120. En: Brown, A.D., P. Blendinger, T. Lomáscolo & P. García (eds.) Ecología, Historia Natural y Conservación de La Selva Pedemontana de Las Yungas Australes. Ediciones del Subtrópico, Jujuy
Malizia, L., S. Pacheco, C. Blundo & A.D. Brown. 2012. Caracterización altitudinal, uso y conservación de las Yungas subtropicales de Argentina. Ecosistemas 21(1-2): 53-73.
Meneses, R.I. & L.R. Chávez. 2001. Estudio de la vegetación arbórea y arbustiva de las áreas aledañas al derecho de vía del gasoducto en el bloque San Alberto, provincia Gran Chaco, Departamento de Tarija. Consultora Multiservicios Paraba Azul. Informe no publicado, La Paz. 46 p.
Moraes R., M. & J. Sarmiento (eds.). 1999. Estudio de biodiversidad en la Reserva Nacional de Flora y Fauna Tariquía (Tarija). Instituto de Ecología – FUNDECO. Informe final no publicado, La Paz. 135 p.
Morales, J.M., M. Sirombra & A.D. Brown. 1995. Riqueza de árboles en las Yungas argentinas. Pp. 163-174. En: Brown, A.D. & H.R. Grau (eds.) Investigación, conservación y Desarrollo en las Selvas Subtropicales de Montaña. Proyecto de Desarrollo Agroforestal/Laboratorio de Investigaciones Ecológicas de las Yungas, Tucumán.
Müller, R., P. Pacheco & J.C. Montero. 2014. El contexto de la deforestación y degradación de los bosques en Bolivia: Causas, actores e instituciones. CIFOR, Bogor. 90 p.
Navarro, G. 2002. Vegetación y unidades biogeográficas de Bolivia. Pp. 1-500. En: Navarro, G. & M. Maldonado (eds.) Geografía Ecológica de Bolivia: Vegetación y Ambientes Acuáticos. Centro de Ecología Simón I. Patiño, Cochabamba.
Oksanen, J., F.G. Blanchet, M. Friendly, R. Kindt, P. Legendre, D. McGli nn, P.R. Minchin, R.B. O'Hara, G.L. Simpson, P. Solymos, M.H.H. Stevens, E. Szoecs & H. Wagner. 2018. vegan: Community Ecology Package. R package version 2.5-2. https://CRAN.Rproject.org/package=vegan.
PEA-Bermejo. 2003. Diagnóstico ambiental de la alta cuenca del río Bermejo – territorio boliviano. Programa estratégico de acción de la cuenca binacional del río Bermejo. Editorial Luis de Fuentes, Tarija. 228 p.
Phillips, O. & J.S. Miller. 2002. Global Patterns of Plant Diversity: Alwin H. Gentry’s forest transects data set. Missouri Botanical Garden Press. St. Louis. 319 p.
Prado, D.E. 2000. Seasonally dry forests of tropical South America: from forgotten ecosystems to a new phytogeographic unit. Edinburgh Journal of Botany 57(3): 437-461. [ Links ]
Prado, D.E. & P.E. Gibbs. 1993. Patterns of species distributions in the dry seasonal forests of South America. Annals of Missouri Botanical Garden 80(4): 902-927.
R Core Team. 2018. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Viena. URL https://www.R-project.org/. [ Links ]
Rahbek, C. 1995. The elevational gradient of species richness: a uniform pattern? Ecography 18(2): 200–205.
Roldan, A.I. 1995. Estructura de sitios disturbados y no disturbados de las selvas montanas de la sierra de San Javier (Tucumán -Argentina). Lilloa 38(2): 133-156. [ Links ]
Sarmiento, G. 1972. Ecological and floristic convergences between seasonal plant formations of tropical and subtropical South America. Journal of Ecology 60(2): 367-410. [ Links ]
Serrano, M. 2003. Estructura y composición de bosques montanos subtropicales y sus implicaciones para la conservación y el manejo de los recursos forestales en la serranía del Iñao, Bolivia. Tesis de maestría. Universidad Nacional de Costa Rica, Turrialba. 142 p.
Vazquez, J.A. & T.J. Givnish. 1998. Altitudinal gradients in tropical forest composition, structure, and diversity in the Sierra de Manantlan. Journal of Ecology 86(6): 999-1020.
Veech, J.A., K.S. Summerville, T.O. Crist, & J.C. Gering. 2002. The additive partitioning of diversity: recent revival of an old idea. Oikos 99(1): 3–9.
Vides-Almonacid, R.H., H.R. Ayarde, G. Scrocchi, F. Romero, C. Boero & J.M. Chani. 1998. Biodiversidad de Tucumán y el noroeste argentino. Aportes de la Fundación Miguel Lillo a su conocimiento, manejo y conservación. Opera Lilloana 43: 1-89.
Villarroel, D. & T. Ruiz. 2009. Estructura y diversidad arbórea de los bosques tucumanobolivianos. pp. 27-48. En: Arroyo, L. & S. P. Churchill (eds.) Inventarios Botánicos del Área de Bella Vista, Departamento de Santa Cruz, Bolivia: Una base para la conservación. Museo de Historia Natural Noel Kempff Mercado y Missouri Botanical Garden, Santa Cruz.
Villegas, Z. & B. Mostacedo. 2011. Diagnóstico de la situación actual sobre políticas, información, avances y necesidades futuras sobre MRV en Bolivia. CIFOR, Bogor. 51 p.
Whittaker, R.H. 1956. Vegetation of the Great Smoky Mountains. Ecological Monographs 26(1): 1–80.
Zenteno-Ruiz, F.S & R.P. López. 2010. Composición, estructura y patrón espacial de un bosque tucumano boliviano en el departamento de Tarija (Bolivia). Darwiniana 48(1): 32-44.
Zenteno-Ruiz, F.S., S. Beck, R.P. López & S.C. Gallegos. 2010. Caracterización de la vegetación y de la diversidad florística de la cuenca alta del río Bermejo, Tarija: implicaciones para su conservación. pp. 162–173. En: Beck, S., N. Paniagua-Zambrana, R.P. López & N. Nagashiro (eds.) Biodiversidad y Ecología en Bolivia – Simposio de los 30 años del Instituto de Ecología. Instituto de Ecología, Universidad Mayor de San Andrés, La Paz.
ZONISIG (Zonificación Agroecológica y Establecimiento de una Base de Datos y Red de Sistema de Información Geográfica en Bolivia). 2001. Zonificación agroecológica y socioeconómica, departamento de Tarija. Sierpe publicaciones, La Paz. 249 p. [ Links ]
Anexo 1. Mapa de formaciones vegetales de la Alta Cuenca del rio Bermejo (Tarija, Bolivia) con la posición de las parcelas temporales de muestreo. La primera letra de las etiquetas de las parcelas corresponde a la formación vegetal en la que se encontraban: S=Submontana, M=Montana y A= Altimontana. Ver más detalles sobre las parcelas en el Anexo 2.
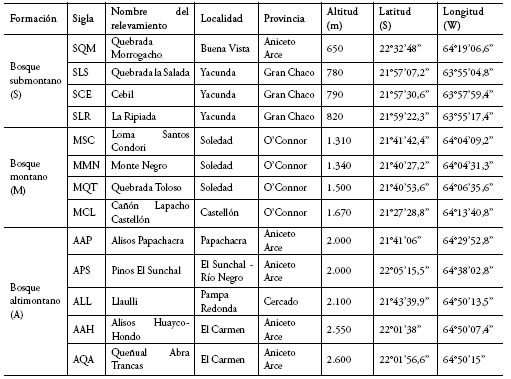
Anexo 2. Detalle de las parcelas temporales de muestreo.
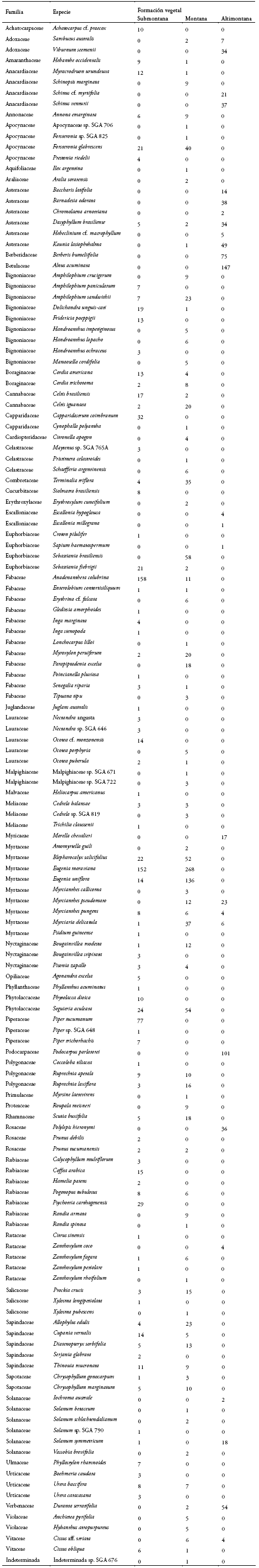
Anexo 3. Lista de especies indicando el número de individuos encontrados por formación vegetal en la Alta Cuenca del rio Bermejo (Tarija, Bolivia). Sistema de clasificación APG III.












 uBio
uBio