Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Ecología en Bolivia
versión impresa ISSN 1605-2528versión On-line ISSN 2075-5023
Ecología en Bolivia v.52 n.1 La Paz mayo 2017
Reseña
El guanaco (Lama guanicoe Müller 1776) en el Gran Chaco boliviano: Una revisión
The guanaco in the Bolivian Gran Chaco: a review
Erika Cuéllar Soto*1, Jorge Segundo2, Jorge Banegas3
1 University of Oxford, Dept Zoology, Wildlife Conservation Research Unit, Recanati Kaplan Centre, Tubney OX13 5QL, Oxon, Inglaterra.
*Autor de correspondencia: erika.cuellar71@gmail.com
2 Capitanía del Alto y Bajo Izozog (CABI), Santa Cruz, Bolivia.
3 Parque Nacional y Area de Manejo Integrado KAA-IYA del Gran Chaco. Barrio La Morita, Calle Gabriel José Mareno N- 42, Santa Cruz, Bolivia.
Resumen
La pérdida de hábitat por la transformación de ecosistemas abiertos (sabanas, pastizales) hacia ecosistemas impenetrables por la cobertura de especies leñosas puede estar teniendo un rol importante en las retracciones y extinciones de especies. El aumento sustancial de la densidad de especies leñosas está cambiando la fisonomía de las pampas chaqueñas y esto resulta efectivamente en la pérdida o degradación del hábitat para el guanaco. El guanaco es una especie que necesita acciones urgentes de cara a la pérdida del hábitat y estudios específicos sobre los patrones espaciales de transformación de estos ambientes, dado que su dieta, sus áreas de movimiento, sus áreas de reproducción, y su comportamiento social están ligados a estos ecosistemas. En este trabajo resumimos la información que se tiene sobre la situación del guanaco en el Gran Chaco y esperamos sea la base para desarrollar acciones de prioridad a nivel nacional.
Palabras clave: Arborización, Camélidos, Conservación, Herbívoro, Sabanas.
Abstract
Habitat loss through the transformation of open ecosystems (savannahs, grasslands) into scrubby habitats dominated by woody species may be playing an important role in the decline and extinction of species. The increase in the density of woody species is changing the physiognomy of the Chacoan pampas system and this effectively results in the loss or degradation of the habitat for the guanaco. The guanaco is an example of a species requiring urgent actions to stop habitat loss, as well as specific studies on the spatial transformation patterns of these environments, since its diet, feeding areas, reproduction areas, and social behavior are linked to these ecosystems. In this paper we summarize the information about the situation of guanaco in the Gran Chaco and we hope that this will be the basis for developing priority actions at the national level.
Key words: Camelidae, Conservation, Grasslands, Herbivore, Woody encroachment.
Introducción
En Sudamérica el mayor herbívoro silvestre actual es el guanaco (Lama guanicoe). La distribución de esta especie se ha reducido dramáticamente en épocas históricas: en Argentina, las poblaciones de guanacos oscilaban entre 30 y 50 millones de individuos antes de la conquista europea (Raedeke 1979). Probablemente hubieron presiones que afectaron la dispersión del guanaco, con períodos alternados de expansión y colonización, y con la contracción y extinción de las poblaciones locales (Miotti & Salemme 1999, Lepetz et al. 2003, Barrientos & Pérez 2005, Gonzáles et al. 2006). Sin embargo, la evidencia arqueológica indica que las poblaciones de esta especie ya estaban en declive considerable en muchas áreas antes de la llegada de los españoles (Tonni & Politis 1980). Esta declinación previa al periodo precolombino fue probablemente debida a factores complementarios y quizás menos evidentes que los normalmente mencionados como enfermedad o la presión de la caza. De hecho, estudios recientes sobre la distribución geográfica pasada de guanacos, utilizando isótopos estables en muestras arqueológicas del Holoceno tardío demuestran que la dieta base del guanaco estaba compuesta por gramineas en lugares donde esta comunidad vegetal ya no es dominante o no existe (Barberena et al. 2009). Además, las condiciones ambientales eran más áridas de lo que son hoy en día (Tonni & Politis 1980) y esto podría haber contribuido a disparar los cambios en la estructura y composición de la vegetación como consecuencia de causas ecológicas relacionadas con el cambio climático y por lo tanto con la distribución y abundancia actuales de los guanacos. El cambio en la fisionomía de las comunidades vegetales (en este caso el cambio de las proporciones de gramineas y leñosas) se traduce efectivamente en un cambio en el hábitat para herbívoros grandes dependientes de zonas abiertas. Sin embargo, la dinámica sucesional de la vegetación y el equilibrio entre diferentes comunidades, como los mosaicos de pastizales/leñosas, no siempre pueden ser bien definidos (Behling et al. 2007). Adicionalmente, son escasos los estudios que investigan los umbrales de tolerancia de herbívoros grandes con relación a los cambios en la estructura y composición de la vegetación. Por ejemplo, no se conoce los efectos que pueden tener los cambios que provoca las etapas sucesionales en la estructura y composición de la vegetación sobre el comportamiento adaptativo, la fisiología y/o la dinámica poblacional de un herbívoro dependiente de zonas de pastizales (Hofmann 1989). Además, las adaptaciones eco-fisiológicas al ambiente también pueden ser evolutivas (Cloudsley-Thompson 1991).
A pesar de la amplia distribución de esta especie desde Perú hacia el sur hasta las laderas central, oriental y occidental de los Andes, a través de la parte norte del Gran Chaco (Villalba 1992, Emmons 1993, Cuéllar & Fuentes 2000) y a través de la estepa patagónica hasta Tierra del Fuego e Isla Navarino (Franklin 1982).
La especie está catalogada como preocupación menor por la UICN (Baldi et al. 2016). Sin embargo, su estado de conservación depende en cada pais del tamaño de sus poblaciones y el nivel de amenazas. En Bolivia y Paraguay se encuentran las poblaciones que representan la distribución más oriental de la especie y estas fueron categorizadas como en peligro en las listas rojas de ambos países (Gonzalez et al. 2006). El guanaco está protegido en Bolivia por el decreto supremo 11238 de 1973, el cuál prohibe la caza y captura de esta especie (Villalba 1992). El primer libro Rojo de los Vertebrados de Bolivia categorizó al guanaco "en Peligro", debido a la reducción de sus poblaciones y su área de distribución. Luego fué recategorizado a «Extinto» refiriéndose a las poblaciones de las tierras altas de Bolivia. Actualmente se encuentra categorizada como «En peligro crítico» debido a que las poblaciones presentes son relictuales y aisladas, además de estar amenazadas por la cacería y pérdida del hábitat (Cuéllar & Núñez 2009).
En la actualidad, los guanacos en Bolivia están restringidos a parches de sabanas chaqueñas (Villalba et al. 2010). Estas sabanas o localmente llamadas pampas están desapareciendo debido al fenómeno de arborización de las áreas abiertas previamente dominadas por gramíneas (Pinto 2005, Cuéllar 2011). A pesar de su aparente capacidad de adaptación por ocupar una variedad de hábitats, que incluyen desiertos, pastizales, matorrales, sabanas y bosques (Miller et al. 1973, Franklin 1982), el guanaco muestra un comportamiento preferencial por los ambientes relativamente más abiertos, donde generalmente los pastizales son la cobertura dominante (Travaini et al. 2007).
La situación del guanaco en el Chaco boliviano ha sido objeto de varias investigaciones, así como de acciones para su conservación que describiremos más adelante en este trabajo. Estos estudios fueron realizados dentro del marco institucional formado por la Sociedad para la Conservación de la Fauna Silvestre (Wildlife Conservation Society, WCS) y la organización indígena Isoseño-Guaraní Capitania del Alto y Bajo Isoso (CABI) entre 2000 y 2009 a través de un programa específico para esta especie. Luego y hasta la fecha, la dirección del Parque Nacional y Area Natural de Manejo Kaa-Iya del Gran Chaco (PNKI) continúa con el programa de monitoreo y protección de la especie. Paralelamente, se han creado fuertes alianzas con actores locales que actualmente promueven la conservación del guanaco y el manejo de su hábitat a través de la creación de reservas. Los logros en cuanto conocimiento sobre la especie y la conservación de la misma han sido fuertemente facilitados por la participación de parabiólogos y guardaparques oriundos del Gran Chaco que han constituido los diversos equipos de estudio sobre esta especie.
En este trabajo presentamos por un lado una breve revisión bibliográfica específica sobre el guanaco chaqueño y por otro lado algunos datos inéditos o datos que son parte de trabajos ya publicados o en proceso de publicación. En general los principales temas de investigación estuvieron enfocados en la transformación estructural del hábitat y cómo estos cambios han influenciado en los patrones de dispersión, selección de hábitat por alimento y refugio, y estructura demográfica de la población de guanacos estudiada.
Nuestra expectativa es que los resultados presentados en este trabajo sirvan de base para la formulación de recomendaciones efectivas en implementación del ordenamiento territorial, implementando prácticas adecuadas de manejo (ganadería, fuego, entre otras) favoreciendo la restauración de sabanas nativas y la supervivencia de la población de guanacos chaqueños, así como del ensamblaje de otras especies dependientes de estos ambientes abiertos.
Área de estudio
El Gran Chaco Americano
El bioma del Gran Chaco contiene las mayores extensiones de bosque seco tropical en América del Sur (Hannah et al. 1994) e incluye un mosaico de pastizales, sabanas, bosques abiertos y bosque de espinosos xéricos (Short 1975, Navarro & Fuentes 1999). El Gran Chaco es una de las provincias biogeográficas más extensas de Sudamérica (Taber et al. 1997), que abarca aproximadamente un millón de km2, incluyendo partes de Paraguay, Argentina, Brasil y Bolivia. El Gran Chaco suele dividirse en cuatro subregiones: el Chaco oriental, el Chaco central, el Chaco occidental y el montañoso Chaco serrano (Abril & Bucher 2001). El Chaco occidental se caracteriza por una precipitación anual de 750 mm en las zonas más húmedas (Bucher 1982) y 200 mm en el oeste más árido (Taber et al. 1997). Las prácticas humanas de uso del suelo han sido durante mucho tiempo críticas para definir la forma del paisaje en ésta región (Zak et al. 2004). A pesar de la evidencia del aumento de las perturbaciones, en las sabanas áridas y semiáridas (Archer et al. 1995) hay notablemente poca información sobre los cambios resultantes y prácticas asociadas al uso de la tierra en biomas subtropicales, especialmente en bosques secos estacionales como el Gran Chaco (Janzen 1988, Redford et al. 1990, Pennington et al. 2000).
El fenómeno de la arborización de las sabanas
En contraste con varios estudios que documentan la pérdida de bosques en el Chaco (Bucher 1982, Lewis et al. 1990, Zak & Cabido 2002, Zak et al. 2004), ha habido comparativamente reducida investigación sobre la transformación de las sabanas chaqueñas debido a la invasión de plantas leñosas (Cabral et al. 2003). La información disponible proviene del Chaco argentino húmedo donde la invasión leñosa ha sido intensa en algunas partes, provocando un cambio en la fisonomía del paisaje (Cabral et al. 2003). Según Adamoli et al. (1990), el principal factor responsable de la invasión leñosa en las sabanas del Chaco ha sido la introducción de un gran número de ganado bovino. El cambio relativamente reciente (en los últimos 70-80 años) en el énfasis de la gestión desde la quema hasta el pastoreo del ganado ha causado que la vegetación cambie de comunidades inflamables (pastizales y matorrales) a matorrales (Adamoli et al. 1990). En relación con esto último, el sobrepastoreo elimina la biomasa herbácea y, por lo tanto, desaparece el combustible potencial necesario para completar el ciclo natural de mantenimiento del pastizal por el fuego (Cabral et al. 2003). La vegetación herbácea puede que no obtenga una ventaja sobre los arbustos en áreas con alta intensidad de pastoreo, de ahí que un ambiente dominado por arbustos tiene pocas posibilidades de regresar a su composición herbácea original (Christensen et al. 2003). Es decir que esto último culminaría en una comunidad climática final modificada dominada por vegetación leñosa. La invasión de una o más especies leñosas normalmente produce el cierre del dosel en un período relativamente corto de tiempo, alrededor de 40 años (Van Auken 2009) y por lo tanto, la fisonomía de la sabana cambia completamente. En otros casos, sin embargo, una comunidad vegetal en particular puede no alcanzar un punto culminante o un punto final estable de sucesión en un período de tiempo tan corto (es decir décadas) y puede permanecer mucho más tiempo en una etapa transitoria de vegetación leñosa espesa e impenetrable.
Aparentemente, los fuegos provocados por los nativos del Gran Chaco promovían el equilibrio entre las comunidades de bosque y sabanas con pastizal, pero estas prácticas fueron interrumpidas por la intervención de los europeos hace más de 400 años (Morello & Saravia-Toledo 1959, Schofield & Bucher 1986). Desde entonces el manejo tradicional de la tierra ha sido reemplazado por la ganadería extensiva. El resultado de las investigaciones sobre la pérdida de sabana constituye la línea de base para las etapas de investigación complementarias y permite una comprensión más profunda de la selección del hábitat por el guanaco.
Según Navarro (2002) la vegetación original de la zona era el bosque chaqueño de arenales (serie de Acacia emilioana y Schinopsis cornuta) en las crestas y laderas de las dunas, cambiando en las depresiones interdunares de sustratos arcillosos mal drenados, a bosque chaqueño de mampuesto mal drenado (serie de Cordia bordasii y Tabebuia nodosa).
Actualmente, el paisaje aparece conformado como un mosaico sucesional de etapas seriales (descritas más adelante) en diversos grados de madurez y con diferentes estructuras como respuesta principalmente al comportamiento diferencial del fuego según los tipos de vegetación potencial y las diferencias locales de relieve y uso de la tierra (Navarro 2002).
El Parque Nacional y Área Natural de Manejo Kaa-Iya del Gran Chaco (PNKI)
Como una respuesta a la expansión agrícola-ganadera, el gobierno boliviano dió curso a la creación de una de las áreas protegidas más grandes de Sudamérica. Con 3.440 km2 el PNKI abarca la mayor extensión de bosque tropical seco protegido (Taber et al. 1997). Durante más de una década, el PNKI estuvo bajo la administración de la organización indígena Isoseño-Guaraní, la Capitanía del Alto y Bajo Isoso. Este modelo de gobernanza puso en práctica la conservación basada en la comunidad, especialmente a través de la participación de cazadores indígenas (Noss et al. 2003) y otros miembros de la comunidad entrenados como parabiólogos (Cuéllar & Noss 2014).
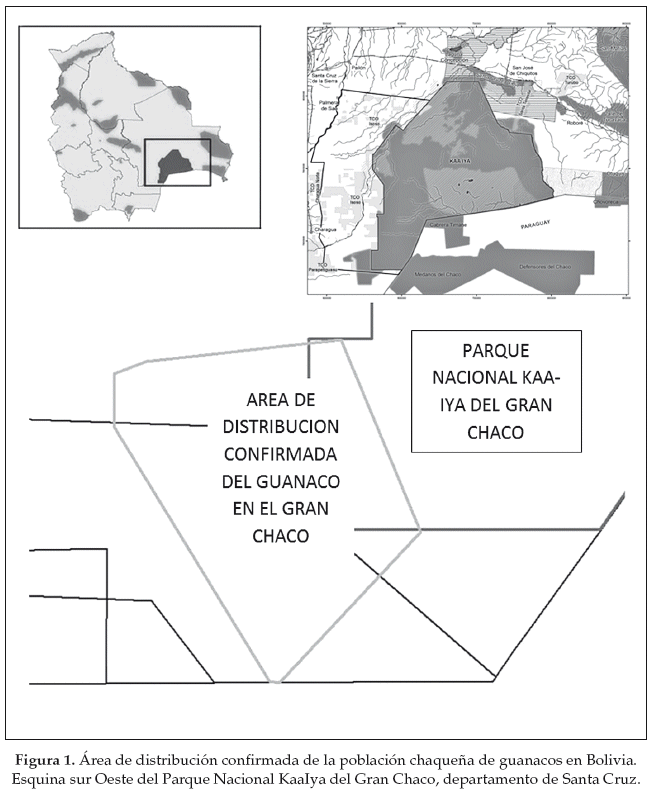
En 2002, WCS estableció un campamento (19°45'S, 62°00'W-20°30'S, 63°00'W) de investigación (actualmente pertenece al PNKI) como base permanente y estratégica para el estudio y la protección de la población de guanacos. El área de estudio incluyó el extremo sur del departamento de Santa Cruz hasta la frontera con Paraguay, además parte de la Tierra Comunitaria de Origen Isoseño-Guaraní y la esquina suroeste del PNKI (Figura 1).
El guanaco
Filogenia, taxonomía, y descripción
En cuanto a los aspectos filogenéticos y taxonómicos de la especie, en el capítulo dedicado a los camélidos del país Villalba et al. (2010) compilan información detallada sobre el origen y la diversificación de los mismos a través del tiempo pero exhibiendo similitudes en su morfología (McKenna 1966). Mencionan al género Lama (tribu Lamini) como único sobreviviente al inicio del Holoceno (Cardozo 1975, Hofmann et al. 1983) que dio el origen de los camélidos sudamericanos actuales. Estudios moleculares basados en la secuencia del citocromo b del ADN mitocondrial reconoce solamente dos subespecies: Lama guanicoe cacsilensis (poblaciones peruanas) y L. g. guanicoe (el resto de las poblaciones) (Marin et al. 2008). Esta última incluye a las poblaciones chaqueñas que se reconocian previamente como L. guanicoe voglii (Krumbiegel 1944), según la clasificación de Wheeler (1995).
El guanaco es el más grande entre los dos camélidos sudamericanos silvestres con una variación en peso corporal que va desde los 48 a 140 kg (Miller et al. 1973, Kostritsky & Vilchez 1974, Raedeke 1979, Torres 1992). Es un animal de pelo relativamente corto y de color uniforme entre individuos. La parte superior del cuerpo está cubierta con pelo de color marrón y la región interior del cuerpo, desde el cuello, con pelo de color blanco. La cabeza es fina con orejas largas y terminadas en punta. El labio presenta una hendidura central y es muy móvil (Cardozo 1975). No existe diferencia morfométrica obvia desde la distancia entre hembras y machos.
Distribución
La distribución histórica reciente del guanaco fue mucho más amplia y continua que la actual desde el norte de Perú (8°30'S) a la Isla Navarino (55°S) en el sur de Chile, desde el Océano Pacífico en el noroeste hasta el Océano Atlántico en el Sureste y desde el nivel del mar hasta los 5.000 metros de altitud en las montañas andinas (Franklin 1982, González et al. 2006). Sin embargo, las poblaciones han sufrido una fuerte presión de cacería por el comercio de su piel y la persecución por los terratenientes ganaderos (Franklin 1982) y algunas poblaciones locales han desaparecido, principalmente en Perú; en Chile el número de guanacos ha declinado rápidamente; y las poblaciones en el norte de Paraguay, sur de Bolivia y norte de Argentina persisten como poblaciones relictuales. Solo sigue siendo una especie común en la región sur del continente (Franklin 1982, Baldi et al. 2016).
Las primeras menciones de la presencia del guanaco en Bolivia están publicadas por Torres (1985). Luego Villalba (1992) se refiere a una población de guanacos en el país (sin referencia geográfica específica). Parker et al. (1993) afirman que los últimos registros confirmados apuntan a que su distribución está restringida a la zona chaqueña de Santa Cruz. Emmons (1993) reporta la presencia de una población relictual de guanacos cerca de la estancia Perforación que es aprovechada por los cazadores de las estancias. Cabot et al (1994) mencionaron al guanaco para las colecciones que se realizaron en Bolivia por la Estación Biológica de Doñana de España, puntualmente reporta que en 1986 se encontraron restos de guanacos cazados al sur de Santa Cruz, cerca de Rancho Chico y 40 km al sur de la estancia Perforación. Según Anderson (1997), se tienen registros de guanacos en los departamentos de Santa Cruz, Cochabamba, Chuquisaca, Tarija, La Paz, Oruro y Potosí entre 373 y 4.895 m. Los únicos registros actuales confirmados fuera del Gran Chaco son las observaciones de algunos individuos en la Cordillera de Mochara y confirmadas por entrevistas a la gente local (Nuñez 2008) y otras observaciones realizadas durante un relevamiento solicitado por la fundación PROMETA en el marco de sus investigaciones con camélidos en el Altiplano sur de Bolivia. En este relevamiento se observó un grupo de guanacos en las coordenadas (20º11'0.08''S, 66°11'45.51''W). El grupo de guanacos se encontraba entre un grupo de llamas y por las marcas que llevaban en las orejas los guanacos estaban aparentemente domesticados sin descartar que hubiesen sido traídos de otro lugar (Cuéllar et al. 2011). Anderson (1997) hace referencia a que la subespecie que se encuentra en Bolivia podría ser la misma que se encuentra en la región chaqueña de Argentina y Paraguay. Esto último hace suponer que se refiere a los registros en el departamento de Santa Cruz.
Los primeros estudios dedicados al guanaco en el Gran Chaco se realizaron en el contexto del Proyecto Kaa-Iya que financió una tesis de licenciatura sobre el uso de hábitat y densidad poblacional de la especie en la zona de Rancho Chico, en un área de 12.000 ha (Weber 2000). Esta tesis fue la base para posteriores estudios en la zona. En ese mismo año se realizó un censo aéreo cubriendo un área de 103.707 ha con el objetivo de delimitar la distribución del hábitat potencial para la especie y realizar una estimación de abundancia basada en las observaciones directas durante los sobrevuelos (Cuéllar & Fuentes 2000). Con este ultimo trabajo y cuatro censos aéreos adicionales hasta el 2011 y las 484 observaciones directas en el área de estudio, Cuéllar (2011) estableció el rango de distribución de especies en la región del Chaco a 791 km2, con una área de ocupación de ca. 200 km2 (Fig. 1). Además de las observaciones directas se obtuvieron indicios de presencia de la especie mediante el monitoreo sistemático de revolcaderos, letrinas y huellas. Adicionalmente, se tuvieron registros fotográficos mediante trampas cámara utilizadas para el monitoreo de jaguares (Cuéllar 2011). El primer muestreo sistemático con trampas cámara confirmó la presencia de guanacos dentro del Parque Nacional Kaa-Iya, registrando dos individuos nuevos que las observaciones directas en el campo no habían identificado previamente (Cuéllar et al. 2004). En 2004 se redescubre la especie en Paraguay durante un sobrevuelo en la zona noroeste del Chaco paraguayo, muy cerca de la frontera con Bolivia (Villalba 2004).
Historia natural (hábitat, hábitos, reproducción, organización social)
Relación con el hábitat
El guanaco es considerado como un camélido muy adaptable a una variedad de ambientes, por su amplia distribución en el continente (Franklin & Fritz 1991, Wheeler 1991). Sin embargo, a una escala más local, el guanaco prefiere hábitats con baja cobertura vegetal, especialmente en la época reproductiva, cuando los animales están más vulnerables al ataque de los depredadores (Bank et al. 2003). Por otro lado, el guanaco como otros ungulados selecciona hábitats de mejor calidad de forraje (Raedeke & Simonetti 1988, Fraser 1998, Puig et al. 2001).
Los guanacos chaqueños viven en un mosaico de vegetación densa con un alto porcentaje de cobertura como consecuencia de la invasión leñosa en las últimas décadas: una expansión de 2174 ha/año entre 1984 y 1999 a 10.808 ha/año entre 1999 y 2007 (Cuéllar 2011). Navarro (2002) examinó la estructura, composición, diversidad y riqueza de especies de la vegetación en el Chaco boliviano, comparando las diferentes etapas seriales de un proceso sucesional basado en la edad, la frecuencia del fuego y la presión de pastoreo del ganado. Específicamente, se atribuyó la eliminación de los pastizales y la consecuente invasión leñosa al sobrepastoreo prematuro después del incendio, así como al papel del ganado como dispersores de ciertas especies leñosas. Gráficamente se muestran las diferencias en la estructura y composición de las especies de las etapas sucesionales y lo relevante y puntual de cara al hábitat del guanaco es la densidad de los arbustos y por lo tanto lo impenetrable que pueden resultar para el guanaco. La clasificación de Navarro (2002) está basada en inventarios fito-sociológicos florísticos siguiendo a Braun-Blanquet (1979): a) pastizales dominados asociaciones de Gaya tarijensis-Richardia scabra y Rhyncchosia burkartii-Aristida mendocina, con dos estratos de 40-120 cm, respectivamente, b) matorrales dominados una asociacion de Lantana fiebrigii-Lippia matogrossensis, con plantas de aproximadamente 140 cm, c) arbustedas dominadas por Pithecellobium chacoense, Castela coccinea, Mimozyganthus carinatus y Senna cloroclada, con plantas de hasta 4 m, d) bosque chaqueño de arenales caracterizados principalmente por la presencia y abundancia del urundei o sotillo (Schinopsis cornuta) en el nivel de emergentes y Acacia emilioana, Chloroleucon chacoense y Senna chloroclada en el dosel y sotobosque arbustivo, y e) bosque chaqueño medianamente drenado: son bosques espinosos bajos, densos, con emergentes dispersos.
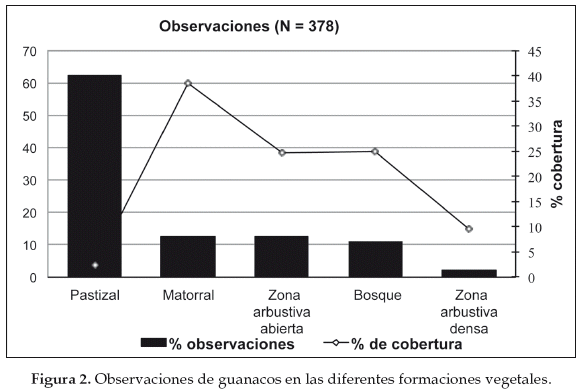
Considerando estas cinco categorías, Cuéllar (2011) comparó el hábitat «utilizado» con el «disponible» durante los sobrevuelos y encontró que los pastizales abiertos fueron los más utilizados en relación con su disponibilidad. Este mismo patrón se encontró en una comparación realizada en las áreas de utilización de algunos grupos monitoreados, los cuales utilizaron el espacio de forma no aleatoria (Λ = 0.0859, x2 = 14.7250, P <0.05), siendo el pastizal el hábitat más utilizado seguido por el matorral. En su trabajo de tesis, Weber (2000) describe el uso de hábitat en la zona de Rancho Chico y mencionó que el hábitat más utilizado en términos de letrinas fue el de pastizales relativamente más abiertos. Adicionalmente, desde el estudio realizado por Weber (2000) se ha observado una retracción en la distribución del guanaco debido probablemente a la pérdida de zonas abiertas dominadas principalmente por la gramínea A. mendocina (Pinto 2005). Finalmente, Cuéllar (2011) demostró con base a 378 observaciones de guanacos durante los censos por tierra que el pastizal fue utilizado desproporcionadamente en relación con su disponibilidad (62% de las observaciones) de los remanentes de pastizales que cubren aproximadamente el 2% del área de distribución del guanaco en la región (Fig. 2). Adicionalmente, registró que a una escala más fina de las áreas utilizadas por el guanaco la principal variabilidad estructural entre las comunidades vegetales presentes en el mosaico de vegetación fueron dadas por algunas especies: Aristida mendocina para áreas abiertas, Lippia sp. junto con Pappophorum krapovickassii para áreas relativamente abiertas y P. chacoense para arbustedas.
Habiendo identificado a P. chacoense como la especie principal de la formación de agregaciones de arbustos invadiendo las zonas abiertas y preferidas como hábitat por el guanaco, Cuéllar (2011) realizó un estudio aplicando quemas experimentales y demostró que el fuego no inhibía la regeneración y el crecimiento de P. chacoense, dada su tasa de supervivencia del 94%, incluso después de que la parte aérea de las plantas se había quemado completamente. Es decir que P. chacoense parece tolerar el fuego y asegura el buen reclutamiento después de la quema. Este hallazgo podría ser relevante para el manejo de la zona, dado que el uso del fuego es polémico en Bolivia y no existen estudios puntuales que apoyen su aplicación a la gestión del paisaje en el entorno del Chaco. La respuesta de los ecosistemas a la perturbación y cómo esto desencadena la sucesión vegetal, es compleja y depende de un conjunto de variables que deben ser estudiadas específicamente (Fernández-Giménez & Allen-Díaz 1999). Esto último es relevante para el Gran Chaco, dada su historia de uso del suelo incorporando ganadería extensiva, tala y quema de bosque.
Dieta
Como base de información previa al estudio de la dieta del guanaco, Becerra (2002) elaboró una guía microfotografiada de los cortes histológicos de plantas, frutos y flores de 70 especies que consideramos eran potenciales en la dieta del guanaco. Esta guía luego fue la base utilizada como control en la comparación con las estructuras encontradas en 29 muestras fecales (Williams 1962) de guanacos preparadas siguiendo el protocolo de identificación microhistológica de Baumgartner & Martin (1939). Este trabajo se realizó en los laboratorios de la Carrera de Biología de la Universidad Autónoma Gabriel René Moreno en Santa Cruz con la participación de dos auxiliares (Paula Urquidi y Elena Morón). Se confirmaron 53 especies de plantas consumidas por el guanaco, aunque solo algunas con mayor frecuencia (Cuéllar 2011): Urvillea chacoensis (trepadora; 100%), Ximenia americana (arbórea; 86%) y Celtis chichape (arbórea), Angelphyton pseudosilphioides (herbácea) y Aristida mendocina (gramínea; 83%). Finalmente, encontramos que P. chacoense, la especie dominante entre los arbustos que arborizan las pampas y por lo tanto reduciendo las áreas de pastizales, estuvo ausente en las muestras de guanacos.
Estructura social y reproducción
En general el guanaco presenta una estructura social característica con agrupamientos familiares, grupos de machos y machos solitarios (Koford 1957, Franklin 1974, 1982, Raedeke 1979, Cajal 1989). En cuanto a la estructura de la población residente en el Gran Chaco, Cuéllar (2011) identificó tres formas de organización social: Solo adultos, grupos familiares (con crías), e individuos solitarios (tanto hembras como machos). El tamaño de grupo promedio fue de 2.8 individuos. Adicionalmente, los registros de guanacos solitarios (siendo estos adultos o juveniles, así como hembras o machos) fueron observados con mayor frecuencia que los grupos con dos o más individuos. Dado que este patrón de composición de grupos se mantuvo a lo largo de nuestro estudio, es probable que estos individuos solitarios no lograran conformar parejas o acoplarse a algún grupo familiar por su comportamiento poligínico y de fidelidad al territorio, como se ha reportado en algunos casos en la Patagonia chilena (Young & Franklin 2004). Además, es difícil que los machos solitarios aseguren la copulación con hembras que aparentemente sólo entran en periodo receptivo con machos que tienen su territorio o machos con un grupo familiar (Franklin 1982, 1983). Sin embargo, también se ha reportado observaciones de hembras que comparten el territorio de machos solitarios después de que el periodo de copulación hubiese terminado (Jurgensen 1985). Nosotros observamos cuatro casos de individuos solitarios (dos machos y una hembra sub adultos y una hembra adulta) que permanecieron con el ganado por algunos meses.
Los grupos familiares monitoreados en el Gran Chaco permanecen juntos durante todo el año sin mostrar ninguna agregación estacional o un cambio en su estructura social (Cuéllar 2011), contrariamente a otros sitios donde se observan las mayores agregaciones en el verano y más pequeñas durante el invierno, debido a que las hembras se unen o dejan al grupo de manera más libre (Franklin, 1982). En nuestra área de estudio, las hembras generalmente mantienen una fidelidad al territorio del macho dominante, quizá por una estrategia reproductiva en un ambiente con hábitat óptimo reducido (Cuéllar 2011). Además, no se observó ningún cambio estacional en la localización de sus territorios, en contraste con los patrones reportados en otros ambientes (Franklin 1983, Jurgensen 1985, Ortega & Franklin 1995, Young & Franklin 2004, Sarno et al. 2006). Esto sugiere que la población de guanaco en el Chaco es sedentaria (Franklin 1982, Marino & Baldi 2008), probablemente en respuesta a la disponibilidad limitada de recursos alimenticios y la falta de hábitat adecuado disponible para la dispersión y formación de nuevos grupos.
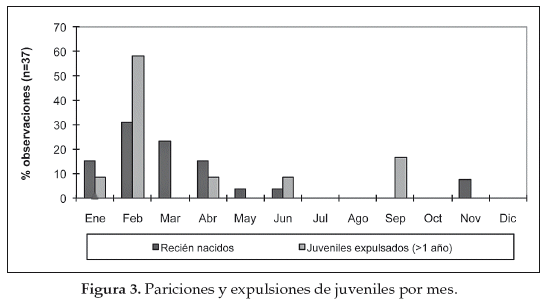
Las hembras presentan ovulación inducida y tienen un periodo de gestación de aproximadamente 11 meses (Franklin 1982, 1983). Se vuelven receptivas reproductivamente aproximadamente dos semanas después del parto (Bank et al. 2003). Las pariciones y la expulsión de juveniles de los grupos familiares fueron concentradas en la época lluviosa, enero a abril (Fig. 3) (Cuéllar 2011). Los guanacos juveniles son expulsados de su grupo familiar, probablemente para evitar la consanguinidad y la competencia por los recursos con los adultos y especialmente evitar la competencia con el macho dominante de la tropa (Sarno et al. 2003).
Algunos temas prioritarios que aportarían al conocimiento de la dinámica poblacional de los guanacos en el Gran Chaco serían: confirmar los rangos de éxito en las copulaciones, las tasas de pariciones, la mortalidad en los juveniles y las tasas de migración (si las hubiera) o áreas de dispersión de juveniles luego de ser expulsados de sus grupos familiares.
Patrones de actividad
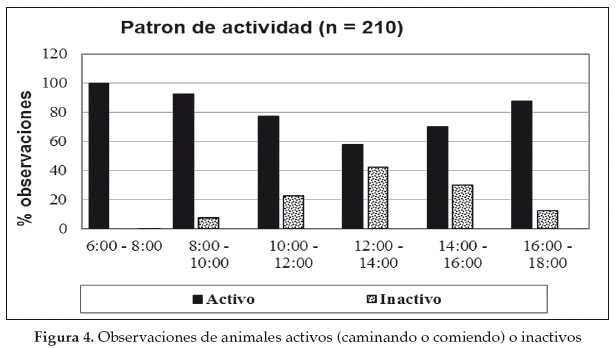
El guanaco es diurno y pasa la mayor parte del día ramoneando (Franklin 1982). Las actividades principales (comer, caminar) de los grupos monitoreados en el Gran Chaco se desarrollan en las primeras horas del día (6:00 y 10:00) y están relacionadas en forma inversa con la temperatura (más activos en las horas menos cálidas del día) (Cuéllar 2011). La actividad de forrajeo declina alrededor de 50% entre las 12:00 y 14:00 hrs, periodo en que muchas veces fueron observados descansando bajo la sombra de un árbol o una isla de bosque (Fig. 4). Aparentemente el guanaco se refugia durante las horas más calientes (con temperaturas que sobrepasan los 40°C) del día para complementar su estrategia de regulación de la temperatura del cuerpo (De Lamo et al. 2001). Aunque se han realizado muy pocas observaciones durante horas de la noche, éstas sugieren que los guanacos duermen en lugares abiertos (Cuéllar 2011). Es probable que por variaciones de temperaturas, los patrones de actividad de los guanacos andinos en Bolivia difieran significativamente de los guanacos en el Gran Chaco.
Areas de acción
Mediante el desarrollo de un método no invasivo de reconocimiento por marcas y características externas de los animales de cada grupo, los parabiólogos lograron monitorear sistemáticamente seis grupos entre 2008 y 2009. La estimación del área promedio de acción de estos grupos monitoreados (entre 2 y 6 individuos) fue de 24 km2 (± 14 SD) con un rango de entre 13-51 km2(Cuéllar 2011).
Uso del guanaco
En general, en la época previa a la llegada de los españoles al continente americano, el guanaco fue la principal fuente de proteína para muchos pueblos (Franklin 1975, Politis et al. 2009). Actualmente, es utilizado como animal de carne para la subsistencia y de vellón para la fabricación de tejidos. Algunas partes también son utilizadas como medicina tradicional, por ejemplo el pelo es utilizado contra el dolor de oído por los Isoseño-guaraníes (Cuéllar & Noss 2003).
Situación local
A pesar del importante incremento en el área de protección de los ecosistemas chaqueños con la creación del Parque Nacional y Area de Manejo Integrado Kaa-Iya del Gran Chaco en 1995, la zona con el rango de mayor distribución de guanacos quedó al borde de esta área protegida (Taber et al 1997). Sin embargo, gracias al desarrollo del proyecto "Guanaco" en el contexto del proyecto Kaa-Iya coordinado y ejecutado por WCS/CABI, y luego con las acciones concretas y contínuas del Parque Kaa-Iya es que esta especie sigue siendo monitoreada y protegida. El proyecto Guanaco ha recolectado años de datos continuos sobre poblaciones entre otras especies silvestres dependientes de pastizales en el área de estudio y ha creado fuertes alianzas con actores locales. Estos logros se deben en gran medida al papel de los parabiólogos indígenas que mantuvieron una presencia permanente en el campo y tuvieron contacto frecuente con las comunidades indígenas locales, los terratenientes privados y las autoridades del municipio de Charagua. Concretamente, la cacería furtiva fue eliminada desde 2001 con la participación de los dueños y encargados de estancias. Sin embargo, quedó sin efecto la propuesta de asegurar que los alambrados no aislaran a los grupos entre sí o que no impidieran los desplazamientos estacionales o dispersión de juveniles, manteniendo corredores viables. El mantenimiento de alambrados es vital para contener al ganado en potreros y evitar que el ganado utilice zonas dentro del Parque. El plan de manejo del AP Kaa Iya del Gran Chaco actualizado el 2012 (Plan de Manejo 20012) ha identificado 14 puestos ganaderos en la zona (con extensiones de entre 2.500 y 10.000 hectáreas y con hatos desde 250 a 1.300 cabezas) que practican ganadería extensiva de cría para carne con bovinos de raza criolla y algunos también con ganado Nelore. Este plan de manejo propuso impulsar un mejor manejo de la ganadería a través del mejoramiento de la infraestructura ganadera con divisiones internas para el diferimiento del pastoreo que permita la alternancia, a fin de recuperar y mantener el valor forrajero de pasturas con la rotación del ganado. Además de ampliar el abastecimiento de agua con pozos, atajados y redes de distribución en bebederos, la construcción de reservorios artificiales de agua favorecerá también a la fauna chaqueña.
Mientras se concretan las recomendaciones sobre este tema, la participación de los terratenientes equivale efectivamente a una ganancia territorial de unos 2.000 km2 a favor de la conservación del guanaco. Finalmente, el fortalecimiento en la cooperación y la comunicación entre los diferentes actores logrado desde el inicio del proyecto Guanaco ha servido para consolidar las propuestas posteriores para la creación de una reserva municipal con el fin de garantizar los espacios de dispersión de esta especie. En este contexto se han realizado dos propuestas concretas: 1) la creación de una zona de amortiguación y conectividad del AP Kaa Iya del Gran Chaco y 2) una propuesta reciente liderada por la Fundación Natura Bolivia y el Municipio de Charagua.
La primera propuesta forma parte de la actualización del plan de manejo del AP Kaa Iya del Gran Chaco y plantea que la estrategia de amortiguación se enmarque en el agenda estratégica del SNAP (Sistema Nacional de Áreas Protegidas), identificando los corredores biológicos a nivel local, regional y fronterizos. En el plan de manejo actualizado se ha identificado la zona específica de distribución del guanaco en forma de un polígono como zona de amortiguamiento externo, con el principal objetivo de mantener la conectividad de los bosques y pampas de arenales de Guanacos y Yanaigua hasta la frontera con Paraguay.
Acuerdo binacional
El esfuerzo invertido en la conservación del guanaco en el Chaco boliviano desde 2001 ha logrado resultados clave en cuanto a mantener una población sin presión de cacería, difundir sobre la importancia de la especie para la zona y ha complementado el conocimiento de la distribución y el uso de espacio por la especie. Sin embargo, cualquier esfuerzo independiente sería incompleto sin la coordinación de un programa binacional de conservación para el guanaco chaqueño. La población de guanacos en Bolivia se encuentra vinculada con la recientemente confirmada población de guanacos en Paraguay a solo 37 km de la población boliviana (Villalba 2004). Ambas poblaciones son pequeñas y fragmentadas, y por lo tanto altamente vulnerables. Un paso concreto en este sentido se dio durante la Evaluación Ecorregional del Chaco en 2005, consolidando un acuerdo de trabajo conjunto entre Paraguay y Bolivia para la protección de la especie. Entre los resultados logrados de este proyecto estuvieron: La confirmación de la presencia, distribución y situación del guanaco en Paraguay; la identificación de acciones prioritarias para garantizar la conservación del guanaco chaqueño; el establecimiento de un monitoreo adecuado, de acuerdo a las necesidades de la zona y según los requerimientos prioritarios de la especie; y el establecimiento de un programa coordinado y seguido por autoridades locales, investigadores especialistas, militares de frontera y parques nacionales de ambos países.
Un importante avance en el trabajo internacional ha sido la oportunidad de desarrollar un curso de capacitación con la participación de parabiólogos bolivianos y paraguayos. Estos cursos (2008, 2012-2013) han sido posible gracias al generoso apoyo de The Shared Earth Foundation, Whitley Fund for Nature y el premio Rolex Award for Enterprise que nos permitió formalizar y extender el «concepto de parabiólogo» utilizando como base fisica el Campamento Guanaco y como aprendizaje los desafíos que implica encarar la conservación de una especie en peligro.
Comentarios finales
El fenómeno de arborización de las pampas chaqueñas
Aunque la degradación de las sabanas es un proceso muy complejo, consideramos que el fenómeno de arborización de las zonas abiertas, particularmente pronunciado en los ecosistemas tropicales semiáridos, está causando la pérdida de hábitat y potencialmente retracciones y extinciones de especies afectando a la biodiversidad en el Gran Chaco boliviano. Este proceso de arborización ha aumentado de 2174.07 ha/ año (entre 1984 y 1999) a 10808.66 ha/año (1999-2007). El incremento de la vegetación leñosa ha cambiando la fisonomía de las áreas abiertas y este fenómeno se verifica en menos de 50 años. La especie colonizadora de las áreas abiertas en las sabanas chaqueñas es el arbusto Chlolorleucon chacoense que a su vez es una especie nativa y con distribución restringida. Algunos estudios preliminares de uso de fuego (Cuéllar 2011) mostraron que C. chacoense tuvo una tasa de supervivencia del 94% después de que la parte aérea de las plantas hubiese sido quemada por completo. Por un lado, estos resultados sugieren que el manejo que realizan los campos ganaderos para controlar la invasión de estos arbustos no es efectiva y se requiere de estudios especificos para lograr acciones eficientes de manejo de estas áreas. Además, en Bolivia el gobierno restringió los permisos para usar el fuego como una práctica agrícola por los graves accidentes debido a la ausencia de manejo de incendios por parte de los agricultores (Sandoval 2005).
Otro tema ligado al manejo de las sabanas y pastizales nativos en el Gran Chaco es la introducción de ganado doméstico. Por lo tanto sugerimos investigar mediante estudios experimentales, la combinación de regímenes de incendios y cargas de ganado que podrían influir en la velocidad y dirección del cambio en la estructura y composición de la vegetación.
El guanaco chaqueño
Coincidimos que el cambio en la fisonomía de las pampas chaqueñas resulta efectivamente en la pérdida o degradación del hábitat para el guanaco. Las observaciones directas de durante los censos aéreos y terrestres muestran que los guanacos seleccionan las áreas de vegetación relativamente más abiertas, tanto en escalas de paisaje como en las áreas utilizadas por los grupos familiares. Cuando se compara entre hábitats usado y disponible, las áreas con vegetación densa son las menos utilizadas en relación con su disponibilidad. Esto se debe probablemente a que estas zonas no son aptas para los desplazamientos diarios, para alimentarse o escapar de posibles depredadores. Para muchos herbívoros grandes, la distribución, disponibilidad y calidad de los recursos pueden influir en las estrategias reproductivas, la dispersión y por lo tanto la supervivencia global (Jarman 1974). La preferencia de hábitats abiertos por el guanaco combinado con los datos que muestran la tasa de cambio de vegetación de sabana abierta a arbustedas densas, sugieren que el mosaico actual de comunidades de vegetación puede ser incapaz de soportar una población más grande de guanacos. Un aspecto preocupante de cara a la conservación del guanaco es la mayor frecuencia de observaciones de individuos solos con relación a parejas o grupos familiares, lo que podria indicar que animales solitarios sub-adultos tienden a dispersarse y ser incapaces de formar nuevos grupos. Sugerimos enfáticamente la importancia de investigar la dispersión y el éxito reproductivo del guanaco.
Acciones de conservación
Es evidente que la consolidación de acuerdos para la protección del guanaco y su hábitat sólo será lograda mediante las alianzas entre los diferentes actores que se encuentran en el área de distribución de la especie (tierras privadas, comunales indígenas, municipales y el Parque Nacional Kaa Iya). Otro aspecto importante a tomar en cuenta es que la población de guanacos en Bolivia está potencialmente ligada a otra similarmente pequeña en Paraguay, por lo tanto para asegurar su supervivencia en el Chaco, también se necesitaría consolidar un programa de conservación internacional.
Esperamos que la información lograda por nuestro equipo de trabajo aporte a la confección de una agenda de investigación y conservación del guanaco en Bolivia. Además esperamos que nuestro trabajo pueda contribuir al gran vacio de información sobre los bosques tropicales secos, tan postergados por la comunidad científica.
Agradecimientos
Agradecemos a Gregorio Castro, Alberto Segundo, Carlitos Guarucupi, Claver Guarucupi, y al personal del Parque Kaa-Iya del Gran Chaco por su inestimable apoyo. Este trabajo fue financiado por la Sociedad de Conservación de la Vida Silvestre, Gordon y la Fundación Betty Moore dentro del Programa de Conservación de los Andes Amazónicos (AACP) "Conservación de Paisajes Amazónicos". Otros patrocinadores que apoyaron el proyecto fueron: Sheared Earth, WildCRU Oxford University, Fondo Whitley Fund for Nature, Fundación Kaa-Iya. A Andrew Noss por la lectura critica del manuscrito.
Referencias
Abril, A. & E.H. Bucher. 2001. Overgrazing and soil carbon dynamics in the western Chaco of Argentina. Applied Soil Ecology 16: 243-249.
Adamoli, J., E. Sennhauser, J. M. Acero & A. Rescia. 1990. Stress and disturbance-vegetation dynamics in the dry Chaco region of Argentina. Journal of Biogeography 17(4-5): 491-500.
Anderson, S. 1997. Mammals of Bolivia: taxonomy and distribution. Bulletin of the American Museum of Natural History (231): 1-652. [ Links ]
Archer, S., D.S. Schimel & E.A. Holland. 1995. Mechanisms of shrubland expansion -land use, climate or CO2. Climatic Change 29(1): 91-99.
Baldi, R.B., P. Acebes, E. Cuéllar, M. Funes, D. Hoces, S. Puig & W.L. Franklin. 2016. Lama guanicoe. The IUCN RedList of Threatened Species 2016: e.T11186A18540211. http: / / dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T11186A18540211.en.
Bank, M. S., R. J. Sarno & W. L. Franklin. 2003. Spatial distribution of guanaco mating sites in southern Chile: conservation implications. Biological Conservation 112(3): 427-434.
Barberena, R., A. F. Zangrando, A. F. Gil, G. A. Martinez, G. G. Politis, L. A. Borrero & G. A. Neme. 2009. Guanaco (Lama guanicoe) isotopic ecology in southern South America: spatial and
temporal tendencies, and archaeological implications. Journal of Archaeological Science 36(12): 2666-2675.
Barrientos, G. & S.I. Perez. 2005. Was there a population replacement during the Late mid-Holocene in the southeastern Pampas of Argentina? Archaeological evidence and Paleoecological basis. Quaternary International 132: 95-105.
Baumgartner, L. L. & A. C. Martin. 1939. Plant histology as an aid in squirrel foo-habit studies. Journal of Wildlife Management 3: 266-268.
Becerra, M. N. 2002. Guía microfotografiada del análisis histológico de estructuras utilizadas como controles en las fecas de guanaco Lama guanicoe voglii. Tomos I, II. Proyecto Kaa-Iya, Santa Cruz. 230 p.
Behling, H., V. D. Pillar, S. C. Muller & G. E. Overbeck. 2007. Late-Holocene fire history in a forest-grassland mosaic in southern Brasil: Implications for conservation. Applied Vegetation Science 10(1): 81-90.
Braun-Blanquet, J. 1979. Fitosociología. Madrid, Blume Ediciones. 820 p.
Bucher, E. H. 1982. Chaco and Caatinga, South American arid savannas, woodlands and thickets. Ecological Studies 42: 48-79. [ Links ]
Cabot-Nieves, J. 1996. La expedición zoológica hispano-boliviana al Parque Nacional de Huanchaca. Landívar SRL, Santa Cruz. 56 p. [ Links ]
Cajal, J. L. 1989. Uso de hábitat por vicuñas y guanacos en la Reserva San Guillermo. Argentina. Vida Silvestre Neotropical 2: 21-31. [ Links ]
Cardozo, A. 1954. Auquénidos. Editorial Centenario, La Paz. 284 p. [ Links ]
Cardozo, A. 1975. Origen y filogenia de los camélidos sudamericanos. ANCB, La Paz. 116 p. [ Links ]
Cabral, A. C., J. M. De Miguel, A. J. Rescia, M. F. Schmitz & F. D. Pineda. 2003. Shrub encroachment in Argentinean savannas. Journal of Vegetation Science 14(2): 145-152.
Chambers, F. M., D. Mauquoy & P. A. Todd. 1999. Recent rise to dominance of Molinia caerulea in environmentally sensitive areas: new perspectives from palaeoecological data. Journal of Applied Ecology 36(5): 719-733.
Christensen, L., M. B. Coughenour, J. E. Ellis & Z. Z. Chen. 2003. Sustainability of inner Mongolian grasslands: Application of the Savanna model. Journal of Range Management 56(4): 319-327.
Cloudsley-Thompson, J. L. 1991. Adaptations of desert organisms ecophysiology of desert arthropods and reptiles. Springer-Verlag, Nueva York. 203 p. [ Links ]
Cuéllar, E. 2011. Ecology and conservation of the guanaco Lama guanicoe in the Bolivian Chaco: habitat selection within a vegetation succession. Tesis de doctorado, University of Oxford, Oxford. 178 p.
Cuéllar, E. & A. Fuentes. 2000. Censo aéreo de guanacos Lama guanicoe en el Chaco cruceño. Revista Boliviana de Ecología y Conservación Ambiental 8: 83-90.
Cuéllar, E. & A. J. Noss. 2003. Mamíferos del Chaco y de la Chiquitanía. Capitanía de Alto y Bajo Isoso, Wildlife Conservation Society, Fundación para la Conservación del Bosque Chiquitano, Fundación Amigos de la Naturaleza. Santa Cruz. 202 p.
Cuéllar, E., J. Segundo, G. Castro, J. Barrientos, J. Healy, A. Hesse & Andrew Noss. 2004. Jaguar and other mammal camera trap survey, Guanaco area (20°03'03"S, 62°26'04"W). Kaa-Iya del Gran Chaco National Park. Technical report. Wildlife Conservation Society, Santa Cruz. 13 p.
Cuéllar, E.& A. Núñez. 2009. Lama guanicoe (Müller, 1776): Artiodactyla-Camelidae. pp. 454-456. En: Aguirre, L.F., R. Aguayo, J. Balderrama, C. Cortéz, T. Tarifa (eds.). Libro Rojo de la Fauna Silvestre de Vertebrados de Bolivia. Ministerio de Medio Ambiente y Agua de Bolivia, La Paz.
Cuéllar, E., P. E. Cuéllar & C. Guarucupi. 2011. Evaluación de la presencia y condición del hábitat del guanaco Lama guanicoe en el altiplano tarijeño. PROMETA, Tarija. 37 p.
Cuéllar, E. & A. J. Noss. 2014. Diversidad de mamíferos y participación local en la conservación en el Gran Chaco boliviano. Therya 5(1): 39-60.
De Lamo, D.A., D. Lacolla & J. Heath. 2001. Sweating in the guanaco (Lama guanicoe). Journal of Thermal Biology 26: 77-83.
Emmons, L. H. 1993. Mammals. The lowland dry forests of Santa Cruz, Bolivia: a global conservationpriority.Pp. 101-103. En: Parker, T.., A.H. Gentry, R.B. Foster, L.H. Emmons & J. van Remsen (eds.). Conservation International, Washington D.C.
Fernandez-Gimenez, M. E. & B. Allen-Diaz. 1999. Testing a non-equilibrium model of rangeland vegetation dynamics in Mongolia. Journal of Applied Ecology 36(6): 871-885.
Franklin, W.L. 1982. Biology, ecology and relationship to man of the South American camelids. pp. 457-489. En: Mares, M.A. & H.H. Genoways (eds.). Mammalian Biology in South America. The Pymatuning Symposia in Ecology. Special Publication Series of the Pymatuning Laboratory of Ecology 6. University of Pittsburg, Linesville, Pennsylvania.
Franklin, W.L. 1983. Contrastingsocioecologies of South America's wild camelids: the vicuña and the guanaco. pp. 573-629. En: Eisenberg, J.P. & D.K. Kleinman (eds.). Advances in the Study of Mammalian Behavior. Special Publication of the American Society of Mammalogists. Pittsburg. 7. Allen Press, Lawrence, Kansas.
Franklin, W.L. & M.A. Fritz. 1991. Sustained harvesting of the Patagonia guanaco: is it possible or too late? pp. 317-336. En: Robinson, J.G. & Redford, K.H. (eds.). Neotropical Wildlife Use and Conservation. University of Chicago Press, Chicago.
Fraser, M. D. 1998. Diet composition of guanacos (Lama guanicoe) and sheep (Ovis aries) grazing in grassland communities typical of UK uplands. Small Ruminant Research 29(2):201-212. [ Links ]
Gonzalez, B. A., R. E. Palma, B. Zapata & J. C. Marin. 2006. Taxonomic and biogeographical status of guanaco Lama guanicoe (Artiodactyla, Camelidae). Mammal Review 36(2): 157-178.
Hannah, L., D. Lohse, C. Hutchinson, J. L. Carr & A. Lankerani. 1994. A preliminary inventory of human disturbance of world ecosystems. Ambio 23(4-5): 246-250.
Hofmann, R.R. 1989. Evolutionary steps of ecophysiological adaptation and diversification of ruminants - a comparative view of their digestive-system. Oecologia 78: 443-457. [ Links ]
Ibáñez, C., J. Cabot & S. Anderson. 1994. New records of Bolivian mammals in the collection of the Estación Biológica de Doñana. Acta Vertebrata 21:79-83.
Janzen, D. H. 1988. Tropical ecological and biocultural restoration. Science 239(4837): 243-244. [ Links ]
Jurgensen, T. E.1985. Seasonal territoriality in a migratory guanaco population. Tesis de maestría, Iowa State University, Iowa. 32 p.
Kostritsky, B. & S. Vilchez. 1974. Informe en extenso, proyecto Santuario Nacional del Guanaco, Calipuy. Dirección General de Forestal y Caza, Ministerio de Agricultura, Lima. 42 p.
Lepetz, S., Lefèvre, C. & E. Pellé. 2003. Los guanacos de la turbera: nota sobre un depósito natural. Magallania 31:415-18.
Lewis, J. P., S. L. Stofella, D. E. Prado, E. F. Pire, E. A. Franceschi & N. J. Carnevale. 1990. Dynamics and development of floristic richness in the vegetation of a large depressed area of the Great Chaco. Flora 184(1): 63-77.
Marín, J.C., A.E. Spotorno, B.A. González, C. Bonacic, J.C. Wheeler, C.S. Casey, M.W. Bruford, R.E. Palma & E. Poulin. 2008. Mitochondrial DNA variation and systematics of the guanaco (Lama guanicoe, Artiodactyla: Camelidae). Journal of Mammalogy 89(2): 172-184.
Marino, A. & R. Baldi. 2008. Vigilance patterns of territorial guanacos (Lama guanicoe): The role of reproductive interests and predation risk. Ethology 114(4): 413-423.
McKenna, M.C. 1966. Synopsis of Whitneyan and Arikareean camelid phylogeny. American Museum Novitates 2253:1-11. [ Links ]
Miotti, L. & M. Salemme. 1999. Biodiversity, taxonomic richness and specialists-generalists during Late Pleistocene/ Early Holocene times in Pampa and Patagonia (Argentina, Southern South America). Quaternary International 53: 54-68.
Miller, S., J. Rottman & R. Taber. 1973. Dwindling and endangered ungulates of Chile: vicugna, lama, hippocamelus, and pudu. North American Wildlife Natural Resources Conference. 38: 55-68.
Morello, J. & C. Saravia-Toledo. 1959. The Chaco Argentina forest: cattle raising and forests in eastern Salta. Revista de Agronomía del Noroeste Argentino 3: 209-258.
Navarro, G. & A. Fuentes. 1999. Geobotánica y sistemas ecológicos de paisaje en el Gran Chaco de Bolivia. Revista Boliviana de Ecología y Conservación Ambiental 5: 25-50.
Navarro, G. 2002. Ecología estructural y dinámica de áreas quemadas en el PN-ANMI Kaa-Iya del Gran Chaco. pp 5-74. En: Guerrero, J. (ed.), Ecología del Fuego en el Parque Nacional y Área Natural de Manejo Integrado Kaa-Iya del Gran Chaco. Proyecto Kaa-Iya, Santa Cruz.
Noss, A.J., E. Cuéllar S. & R.L. Cuéllar S. 2003. Hunter self-monitoring as a basis for biological research: data from the Bolivian Chaco. Mastozoologia Neotropical 10(1):49-67.
Noss, A.J., E. Cuéllar, & R.L. Cuéllar. 2004. An evaluation of hunter self-monitoring in the Bolivian Chaco. Human Ecology 32(6): 685-702.
Nuñez, A.M. 2008. El guanaco (Lama guanicoe cacsilensis) aún no está extinto en la zona alto andina de Bolivia. Ecología en Bolivia 43(1): 65-70. [ Links ]
Ortega, I. M. & W. L. Franklin. 1995. Social organization, distribution and movements of a migratory guanaco population in the Chilean Patagonia. Revista Chilena de Historia Natural 68(4): 489-500.
Parker, T. A., A. H. Gentry, R. B. Foster, L. H. Emmons & J. van Remsen. 1993. The lowland dry forests of Santa Cruz, Bolivia: a global conservation priority. Washington D.C.,Conservation International. 104 p.
Pennington, R. T., D. E. Prado & C. A. Pendry. 2000. Neotropical seasonally dry forests and Quaternary vegetation changes. Journal of Biogeography 27(2): 261-273.
Pinto, C. 2005. Análisis multitemporal de cambios de vegetación de la pampa chaqueña, en la zona de los arenales de Yanahigua, oeste del Parque Nacional Kaa-Iya. Informe tecnico 87, Proyecto Kaa-Iya, Santa Cruz. 61 p.
Plan de Manejo 2012. Parque Nacional y Area Natural de Manejo Kaa-Iya del Gran Chaco 2013-2022. Fundación para la Conservación del Bosque Seco Chiquitano -FCBC, Asociación para la Conservación, Investigación de la Biodiversidad y el Desarrollo Sustentable -SAVIA-, Wildlife Conservation Society -WCS-, Huellas, Bienestar y Naturaleza, Santa Cruz. 276 p. [ Links ]
Puig, S., F. Videla, M. I. Cona & S. A. Monge. 2001. Use of food availability by guanacos (Lama guanicoe) and livestock in northern Patagonia (Mendoza, Argentina). Journal of Arid Environments 47(3): 291-308.
Raedeke, K. 1979. Population dynamics and socioecology of the guanaco (Lama guanicoe) of Magallanes, Chile. University of Washington, Seattle. 409 p. [ Links ]
Raedeke, K. 1980. Food habits of the guanaco (Lama guanicoe) of Tierra del Fuego, Chile. Turrialba 30: 309-314. [ Links ]
Raedeke, K. J. & J. A. Simonetti. 1988. Food habits of Lama guanicoe in the Atacama desert in northern Chile. Journal of Mammalogy 69:198-201.
Raedeke, K.J. 1979. Population dynamics and socioecology of the guanaco (Lama guanicoe) of Magallanes, Chile. Tesis de doctorado, University of Washington, Seattle, Washington D.C. 409 p. [ Links ]
Redford, K. H., A. Taber & J. A. Simonetti. 1990. There is more to biodiversity than the tropical rain-forests. Conservation Biology 4(3): 328-330.
Sarno, R. J., M. S. Bank, H. S. Stern & W. L. Franklin. 2003. Forced dispersal of juvenile guanacos (Lama guanicoe): causes, variation, and fates of individuals dispersing at different times. Behavioral Ecology and Sociobiology 54(1): 22-29.
Sarno, R. J., M. S. Bank, H. S. Stern & W. L. Franklin. 2006. Effects of age, sex, season, and social dynamics on juvenile guanaco subordinate behavior. Journal of Mammalogy 87(1): 41-47.
Schofield, C. J. & E. H. Bucher. 1986. Industrial contributions to desertification in South America. Trends in Ecology & Evolution 1(3): 78-80.
Short, L. L. 1975. A zoo geographic analysis of the South American Chaco avifauna. Bulletin of the American Museum of Natural History 154(3): 163-352. [ Links ]
Tonni, E. P. & G. G. Politis. 1980. The distribution of the guanaco mammalia Camelidae in the Buenos Aires province Argentina during the late Pleistocene and Holocene climatic factors as cause of its retraction. Ameghiniana 17(1): 53-66.
Torres, H. 1992. Camélidos silvestres Sudamericanos: un plan de acción para su conservación. UICN/CSE Grupo Especialista en Camélidos Sudamericanos, Gland. 58 p. [ Links ]
Travaini, A., J. Bustamante, A. Rodriguez, S. Zapata, D. Procopio, J. Pedrana & R.M. Peck. 2007. An integrated framework to map animal distributions in large and remote regions. Diversity and Distributions 13(3): 289-298.
Taber, A., G. Navarro & M.A. Arribas. 1997. A new park in the Bolivian Gran Chaco - an advance in tropical dry forest conservation and community-based management. Oryx 31:189-198.
Van Auken, O.W. 2009. Causes and consequences of woody plant encroachment into western North American grasslands. Journal of Environmental Management 90: 2931-2942. [ Links ]
Van Auken, O. W. 2000. Shrub invasions of North American semiarid grasslands. Annual Review of Ecology and Systematics 31: 197-215. [ Links ]
Villalba, L. 2004. Monitoreo de la población de Lama guanicoe voglii. Loma Plata, Fundación DesdelChaco.
Villalba, M. L. 1992. The guanaco, Bolivia. South American camelids: an action plan for their conservation. Falta páginas del capítulo. En: Torres, H.. South American Camelids Specialist Group, IUCN/SSC, Gland.
Villalba, M.L., E. Cuéllar & T. Tarifa. 2010. Camelidae. Falta páginas del capítulo. En:Wallace,R.B.,H.Gómez,Z.R.Porcel& D.I. Rumiz (eds.). Distribución, Ecología y Conservación de los Mamíferos Medianos y Grandes de Bolivia. Editorial Centro de Ecología Difusión Simón I. Patiño, Santa Cruz.
Ward, D. 2010. A resource ratio model of the effects of changes in CO2 on woody plant invasion. Plant Ecology 209(1): 147-152. [ Links ]
Westoby, M., B. Walker & I. Noy-Meir. 1989. Opportunistic management for rangelands not at equilibrium. Journal of Range Management 42(4): 266-274.
Weber, J. 2000. Uso de hábitat y densidad poblacional del guanaco (Lama guanicoe voglii) en las Pampas de Guaipa y Rancho Chico, Alto Isoso, Provincia Cordillera. Santa Cruz. Universidad Gabriel René Moreno, Santa Cruz. 97 p. [ Links ]
WCMC (World Conservation Monitoring Centre). 1992. Global biodiversity: status of the Earth's living resources. W. C. M. Centre, Cambridge. 628 p. [ Links ]
Wheeler. J. C. 1995. Evolution and present situation of the South American Camelidae. Biological Journal of the Linnean Society 54: 271-295. [ Links ]
Wheeler, J. C. 1991. Origen, evolución y status actual. pp. 11-48. En: Fernández-Baca, S. (eds.). Avances y Perspectivas del Conocimiento de los Camélidos Sudamericanos. FAO, Santiago de Chile.
Williams, O. B. 1962. A technique for studying microtine food habits. Journal of Mammalogy 43: 365-368. [ Links ]
Young, J. K. & W. L. Franklin. 2004. Territorial fidelity of male Guanacos in the Patagonia of southern Chile. Journal of Mammalogy 85(1): 72-78.
Zak, M. R., M. Cabido & J. G. Hodgson. 2004. Do subtropical seasonal forests in the Gran Chaco, Argentina, have a future? Biological Conservation 120(4): 589-598.
Zak, M. R. & M. Cabido. 2002. Spatial patterns of the Chaco vegetation of central Argentina: Integrationof remote sensing and phytosociology. Applied Vegetation Science 5(2): 213-226.
Reseña recibida en: 23 de marzo de 2017
Manejada por: Luis F. Aguirre
Aceptada en: 13 de abril de 2017












 uBio
uBio 

