Ecología en Bolivia
versión impresa ISSN 1605-2528versión On-line ISSN 2075-5023
Ecología en Bolivia v.43 n.2 La Paz ago. 2008
Consideraciones sobre el zooplancton de las lagunas de Yala
(Jujuy, Argentina)
Considerations about the zooplankton of Yala lakes (Jujuy, Argentina)
Alcira Villagra de Gamundi, Cecilia Locascio de Mitrovich,
Jorgelina Juárez & Gabriela Ferrer
Instituto de Limnología del Noroeste Argentino (ILINOA) – Facultad de Ciencias Naturales e Instituto
Miguel Lillo, Universidad Nacional de Tucumán - Miguel Lillo 205, 4000, Tucumán, Argentina
Email: alcy@csnat.unt.edu.ar
Resumen
Las lagunas de Yala se encuentran ubicadas en la Cordillera Oriental en la ecoregión de Yungas de un área de reserva provincial de Jujuy, Argentina (24º S, 65º W) a 2.000 m. Su génesis se debe a procesos de remoción en masa producida por shock sísmico. Sus aguas son de tipo sulfatadas, cloruradas, cálcico-magnésicas. Se analizó el zooplancton de las lagunas Rodeo, Los Noques, Comedero, Desaguadero y Negra. Se identificaron 41 taxones de zooplancton: 18 correspondieron a rotíferos y 23 a microcrustáceos (14 cladóceros y 9 copépodos) con una mayor frecuencia de ocurrencia de Keratella cochlearis, Bosmina longirostris, Acanthocyclops robustus y Paracyclops chiltoni. La composición específica alcanzó un valor de riqueza máximo de 22 especies en la laguna Comedero, de mayor área y heterogeneidad y un mínimo de 9 en la laguna Negra, de menor tamaño, mayor homogeneidad y aislamiento. El estudio cuantitativo reflejó estructuras comunitarias diferenciales, ya que en ausencia de peces (Laguna Negra) dominaron los dáfnidos, mientras que en las restantes prevalecieron rotíferos, bosmínidos, quidóridos y ciclopoideos con tallas promedios entre 614-747 µm. La mayor similitud se registró entre las lagunas Comedero y Rodeo (40%) y las menores entre Negra y Los Noques (18%).
Palabras clave: Zooplancton, Lagunas montanas, Lagunas de Yala, NW Argentina.
Abstract
The Yala lakes are situated in the Eastern Cordillera in the Yungas ecoregion in a provincial protected area (Jujuy province, Argentina) (24ºS, 65°W) at 2,000 m. Its origin is due to a mass removal process produced by seismic shocks. The waters composition is sulphate-calciummagnesium chloride. The zooplankton of Rodeo, Los Noques, Comedero, Desaguadero, and Negra lakes was analyzed. Forty one taxa were identified: 18 were rotiferans and 23 microcrustaceans (14 cladocerans and 9 copepods) with a higher occurrence frequency of
Keratella cochlearis, Bosmina longirostris, Acanthocyclops robustus, and Paracyclops chiltoni. The specific composition reached the maximum value of 22 species in Comedero lake, with larger area and heterogeneity; and a minimum of 9 species in the lake Negra, which is smaller, and with a higher homogeneity and isolation. The quantitative study shows differential community structures: daphnids dominated in absence of fishes (Negra Lagoon), while in the remaining lakes rotifers, bosminids, quidorids and ciclopoids were dominant, with sizes averaging between 614-747 µm. The greatest similarities were registered between Comedero and Rodeo lakes (40%) and lower between Negra and Los Noques (18%)
Key words: Zooplankton, Mountain lakes, Yala lagoons, NW Argentina.
Introducción
El Noroeste argentino posee numerosos complejos lagunares de montaña de los que se tiene escasa información. Dichos ambientes se ubican en la cadena montañosa occidental y están incluidos en las ecoregiones de Yungas, prepuna, puna y altoandina. Estos humedales poseen un alto valor biológico por su particular biodiversidad y endemismos; y se encuentran amenazados por el impacto de actividades como la minería, ganadería, turismo, sobreexplotación de recursos naturales, que sumados a las características climáticas y geomorfológicas, potencian procesos de erosión, dunificación, contaminación y salinización, entre otros, haciendo prioritario encarar pautas para su conservación. Por lo mencionado anteriormente, a partir de 1998 el Instituto de Limnología del Noroeste Argentino (ILINOA -UNT) inició relevamientos limnológicos de humedales en Catamarca, Salta, Tucumán y Jujuy (Villagra de Gamundi et al. 2003, Locascio de Mitrovich & Ceraolo 2004, Locascio de Mitrovich et al. 2005, Locascio de Mitrovich et al. 2007, Seeligmann et al. 2007, Villagra de Gamundi et al. 2007).
En este trabajo se presentan los resultados preliminares del análisis de muestras puntuales de zooplancton (abril/2000) de las lagunas Rodeo, Los Noques, Comedero, Desaguadero y Negra (Del Alto). Estos humedales presentan gran belleza paisajística y fácil accesibilidad, por lo que están expuestos a una presión antrópica considerable (turismo, pesca, deportes, agricultura tradicional, cría de ganado, actividad forestal), que generan una erosión significativa del suelo y eutrofización, situación que pone en riesgo su biodiversidad.
Área de estudio
El complejo lagunar de Yala se ubica geográficamente a 26 km de la ciudad de San Salvador de Jujuy (Argentina), en la cabecera norte de la cuenca del Río Yala dentro de la serranía del Cerro Azul, sobre una superficie irregular entre 1.900-3.100 m (Camacho & Bossi 2002) (Fig. 1). El Parque Provincial Potrero de Yala es un área de reserva de 1.990 ha, creada en 1952 con la finalidad de proteger este ambiente natural y su biota. Se encuentra en la ecoregión de Yungas, en la unidad morfoestructural de la Cordillera Oriental.
El clima de la región es de tipo subtropical húmedo con precipitaciones medias anuales de 1.470 mm con períodos de alta humedad (86%) entre octubre a marzo. La temperatura media anual es de 15.9ºC con inviernos secos, fríos y con algunas heladas. A pesar de la posición latitudinal y altitudinal que determinaría una elevada transparencia atmosférica, la heliofanía relativa anual es de sólo 39% por la elevada nubosidad (Picchi 1978, 1984).
La vegetación corresponde al piso altitudinal de Yungas del bosque montano nublado (entre 1.500 y 3.000 m) con especies representativas, como el aliso (Alnus acuminata) y el pino del cerro (Podocarpus parlatorei), además de otras especies arbóreas de alto valor forestal, como el cedro (Cedrela lilloi) y el nogal (Juglans australis); también se encuentran pastizales de neblina (por encima de 2.000-3.000 m) con hierbas y pastizales de altura (Brown et al. 2002). Además se registran especies exóticas, introducidas de manera progresiva como plantaciones de frutales (ciruelos, membrillos, manzanos y duraznos, Rosenzvaig 1974) y especies de pinos (Pinus douglasiana y P. elliotis).
La génesis de las lagunas se habría producido por remoción en masa, cuya tipología correspondería a un gran deslizamiento y por su magnitud es descrita como una avalancha de rocas, promovida por un shock sísmico (González Díaz & Mon 2000). Constituyen un complejo encadenado de cuerpos de agua de diversos tamaños con un diseño de drenaje centrípeto y multicuencal con aportes de aguas superficiales e interconectadas subterráneamente por filtraciones naturales (Camacho & Bossi 2002).
Las variables fisicoquímicas de las lagunas permiten caracterizarlas como sulfatadas cloruradas o sulfatadas carbonatadas cálcicomagnésicas (Grosjean 2000), de baja transparencia, pH entre 4.7-6.8, escasa mineralización (conductividad eléctrica entre 55.2-119.8 µS cm-1) y salinidad entre 41.95-114 mg/ l (rango de aguas dulces, según Cowardin 1979).
Métodos
Se extrajeron muestras de zooplancton usando una red cónica convencional de 50 µm de abertura de malla. Para el análisis cualitativo en cada laguna se realizaron arrastres superficiales a lo largo de un transecto transversal y para el cuantitativo se filtraron 100 l superficiales. El material fue fijado in situ con formaldehido al 4%. Las observaciones, determinaciones taxonómicas (según claves de identificación de Ringuelet 1958, Smirnov 1967, 1971, Koste 1978, Smirnov & Timms 1983, Reid 1985, Hrbácek 1987, Paggi 1995) y mediciones de los especímenes se realizaron bajo microscopio óptico y lupa binocular. La revisión sobre los hábitos de diferentes grupos de zooplancton fue basada en De Manuel Barrabín (2000).
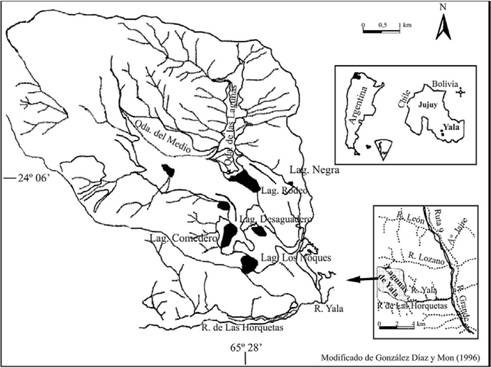
Figura 1. Ubicación del área de estudio.
Los recuentos se hicieron en base a alícuotas aplicando la fórmula de Cassie (Edmondson & Winberg 1971) con un error del 10%, en cámaras Sedgwick Rafter de 1 y 5 cm3 para microzooplancton (formas naupliares y rotíferos) y macrozooplancton (cladóceros y copépodos), respectivamente; o bien, se aplicaron recuentos totales cuando la abundancia fue muy escasa. Se consideró de manera diferencial a los copépodos tomando los estados ontogénicos y el sexo en los adultos. El índice de zooplancton de calanoideos/ ciclopoideos siguió a Coelho Bothelo (2003), considerando formas inmaduras y adultas sobre recuentos totales. Los valores de diversidad se basaron en Magurran (1988). La estimación de biomasa en peso seco se realizó mediante las fórmulas de regresión (Dumont et al. 1975) para cladóceros y copépodos y volumétricas (Bottrell & Duncan 1976) para rotíferos, midiendo de 10-30 ejemplares por cada morfo. En campo se midieron transparencia (disco de Secchi), temperatura de agua, conductividad y pH (con instrumental digital Altronix), como también profundidad de los cuerpos de agua (Tabla 1). La salinidad total fue estimada mediante fórmulas empíricas a partir de la conductividad (Dejoux 1993).
Los análisis estadísticos referidos a dendrogramas y análisis de componentes principales se realizaron con los programas SPSS 9.0 e InfoStat.
Resultados
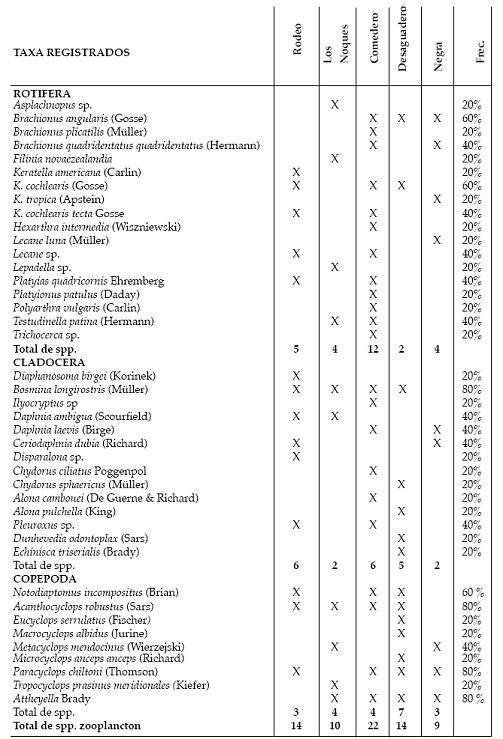
Desde el punto de vista taxonómico, se identificaron 41 taxones de zooplancton: 18 correspondieron a rotíferos y 23 a microcrustáceos (14 cladóceros y 9 copépodos) (Tabla 2). Entre los rotíferos, la mayor representatividad fue para Keratella (4 spp.) y Brachionus (3 spp.); entre los cladóceros se destacaron quidóridos (7 taxa) y dáfnidos (3 spp.) y entre los copépodos, ciclopoideos (7 spp.). Las especies de rotíferos relevadas fueron en gran proporción planctónicas: euplanctónicas
(Keratella cochlearis, K. tropica, Polyarthra vulgaris, Filinia sp. y Asplanchnopus sp, entre otros) y heleoplanctónicas (Testudinella patina, Brachionus quadridentatus, Lecane luna y Platyias quadricornis, las dos últimas litorales), entre otras. Entre los microcrustáceos se observaron especies con forma de vida planctónica limnética (Bosmina longirostris, Diaphanosoma birgei, Ceriodaphnia dubia; Notodiaptomus incompositus y Acanthocyclops robustus) y elementos litorales o de fondo, como quidóridos, macrotrícidos, algunos ciclopoideos y harpacticoideos. La riqueza específica del zooplancton para las distintas lagunas varió entre 9 spp. /ambiente en la laguna Negra y 22 spp. /ambiente en la laguna Comedero.
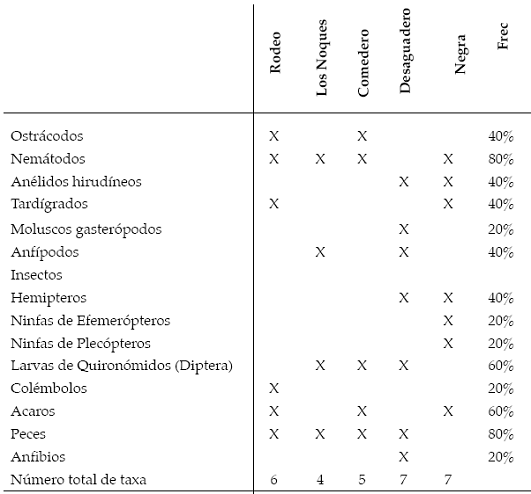
Se observaron otros grupos de invertebrados como ostrácodos, nemátodos, anfípodos, moluscos gasterópodos, ácaros, tardígrados y formas inmaduras y adultas de insectos (Tabla 3).
Las frecuencias de ocurrencia alta (80%) fueron compartidas por B. longirostris, A. robustus, Paracyclops chiltoni y Attheyella sp. Una alta proporción de especies presentó una frecuencia de ocurrencia baja (20%): 10 especies de rotíferos, nueve cladóceros y cuatro copépodos. Los ostrácodos estuvieron presentes en una frecuencia del 40%.
El estudio cuantitativo reflejó una estructura comunitaria diferencial en cada laguna (Fig. 3). La Laguna Negra presentó un microzooplancton dominado por L. luna (71%) y un macrozooplancton con predominancia de Daphnia sp. (82%); en Comedero el microzooplancton registró una alta proporción de K. cochlearis (71%) y los quidóridos (68%) dominaron en el macrozooplancton; en Los Noques la mayor proporción en el microzooplancton fue de T. patina (70%), mientras que el macrozooplancton por Daphnia sp. (50%); en Desaguadero el microzooplancton fue escaso y en el macrozooplancton predominó Microcyclops anceps (48%); por último en Rodeo, el microzooplancton mostró mayor representatividad de P. quadridentatus y T.
Tabla 2. Lista taxonómica, con riqueza y frecuencia del zooplancton en las lagunas estudiadas.
patina (39% y 34%, respectivamente), mientras P. chiltoni en el macrozooplancton (51%).
El cómputo del índice de zooplancton de calanoideos / ciclopoideos registró valores muy bajos, entre 0 y 0.06 (Fig. 4). Las densidades de micro y de macrozooplancton fueron en general bajas, con el 70% menor a 1 ind/l, a excepción de laguna Comedero, con 27 ind/l de microzooplancton y en laguna Negra con 153.4 ind/l de macrozooplancton (Fig. 5).
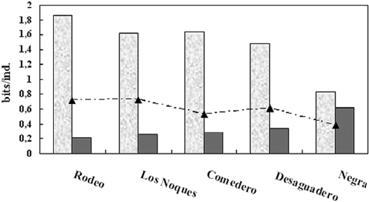
Los valores de diversidad no superaron a los Índices de Shannon Wienner de H = 1.86 bits/individuo ni de Simpson D = 0.62. Los cómputos de equitatividad más próximos a 1 se registraron en la laguna Rodeo (0.73) y Los Noques (0.72), humedales donde no se observaron abundancias relativas dominantes de algunos taxones (Fig. 6). En ausencia de peces (laguna Negra) prevaleció Daphnia sp. (2.048 µm) mientras que en las otras lagunas
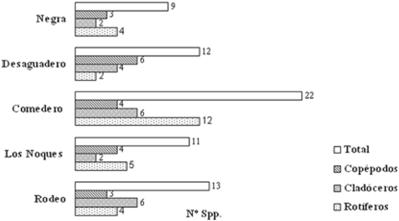
Figura 2. Riqueza Específca.
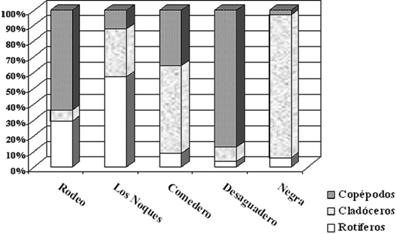
Figura 3. Proporción de rotíferos, cladóceros y copépodos en las lagunas de Yala.
Tabla 3. Lista taxonómica, riqueza y frecuencia de fauna anexa, en las lagunas estudiadas.
predominaron los ciclopoideos, bosmínidos y quidóridos con tallas promedios entre 614-747 µm (Fig. 7).
Las biomasas individuales en peso seco variaron en rotíferos con 0.003–0.16 µg, en cladóceros 0.44–28.5 µg; y en copépodos 0.11–15.22 µg. La mayor biomasa individual correspondió a morfos de hembras ovígeras de Daphnia laevis (28.5 µg) y de Macrocyclops albidus (15.22 µg).
La mayor similitud del zooplancton (Indice de Sorensen) se registró entre las lagunas Comedero y Rodeo (40%) y las menores entre laguna Negra y Los Noques (18%).
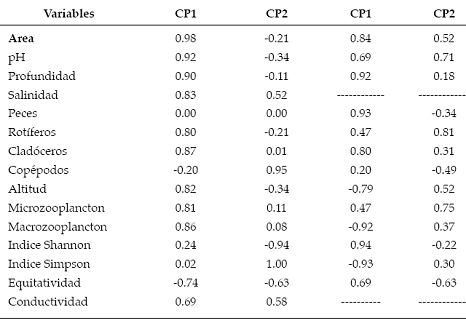
El dendrograma de variables morfométricas y biológicas en base al ligamento promedio entre grupos (Distancia euclidiana) expresa una clara diferenciación de la laguna Negra por suscaracterísticas (mayor altitud, menor tamaño y profundidad, ausencia de peces, menor riqueza zooplanctónica). Del grupo restante de humedales estudiados, se diferenció la laguna Comedero, por su mayor área y riqueza. En el análisis de componentes principales (Tabla 4 y Fig. 9) donde no se consideró a la laguna Negra por falta de datos de dos variables, el primer componente CP1 explica el 56.4% de la variabilidad existente entre las lagunas y el segundo CP2, un 29.6%.
El comportamiento de la laguna Comedero fue opuesto al de Los Noques por presentar mayores valores respecto a las variables densidad de micro y de macrozooplancton, riqueza de rotíferos y cladóceros, profundidad, área, altitud, conductividad, salinidad, a excepción de equitatividad, cuyo mayor valor
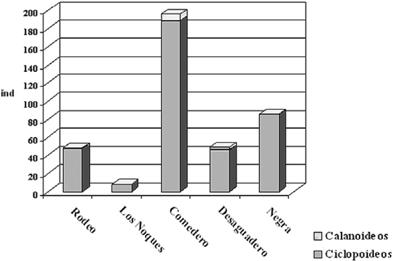
Figura 4. Relación entre calanoideos y ciclopoideos en las lagunas de Yala.
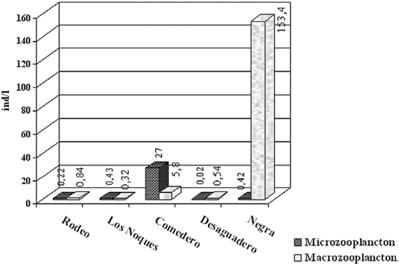
Figura 5. Densidades de micro y macrozooplancton en las lagunas de Yala.
lo presentó Los Noques. También las lagunas Desaguadero y Rodeo se comportaron en forma opuesta respecto a riqueza de copépodos e Índice de Simpson, que fueron mayores en la primera, mientras que en la segunda, el mayor valor fue el Índice de Shannon (Fig. 8).
En el análisis de componentes principales (Tabla 4 y Fig. 10) donde se incluyeron todas las lagunas, la variación explicada por los dos primeros componentes CP1 y CP2, se aproximó al 86% de la variación total, correspondiendo el 59.4% a la primera y 26.4% a la segunda. Se observó
![]()
Figura 6. Diversidad y equitatividad.
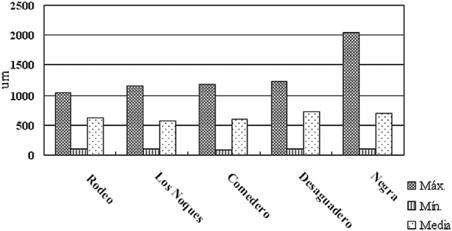
Figura 7. Tallas medias del zooplancton de lagunas de Yala: máximas, mínimas y promedio.
claramente que la laguna Negra se diferenció de las otras por ser la que se encuentra a mayor altitud, por la ausencia de peces y por la alta densidad de macrozoplancton, a lo que se agrega su Índice de Simpson, que es el mayor de los observados.
Discusión
A pesar que los resultados enunciados anteriormente responden a un muestreo puntual de otoño y por lo tanto no expresan una total representatividad de la variabilidad espacio–temporal de los humedales estudiados, estos aportes aunque subestimados son sólo una aproximación al conocimiento de la comunidad zooplanctónica de las lagunas de Yala, donde no existen antecedentes. Desde el punto de vista biogeográfico, algunas de las especies de la fauna registrada son de distribución cosmopolita (K. cochlearis, B.
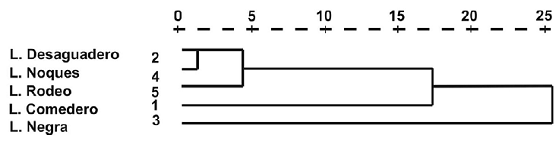
Figura 8. Dendrograma de las variables abióticas y biológicas.
Tabla 4. Correlaciones con variables originales.
angularis, B. longirostris, A. robustus y M. albidus) mientras otras, son endémicas neotropicales, en su mayoría de la subregión amazónica (N.incompositus y M. mendocinus).
La composición específica y las estructuras comunitarias analizadas podrían deberse a diversos factores. De acuerdo a los datos morfométricos y fisicoquímicos disponibles, con bajos rangos de variaciónentre las lagunas, no se pueden identificar cuáles de estas variables son de mayor importancia. La presencia o ausencia de peces planctófagos (pejerrey, mojarras, trucha) y/o de depredadores invertebrados tales como copépodos ciclopoideos, ácaros, turbelarios y anfípodos ejercerían un control desde arriba, reflejado en las tallas promedio por ambiente como también en las bajas
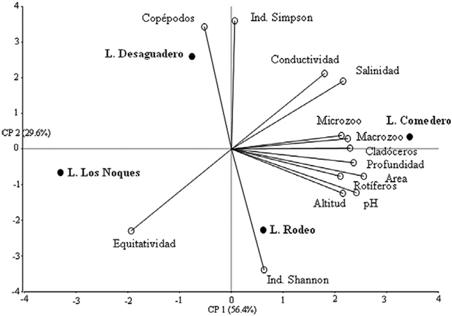
Figura 9. Componentes principales (sin incluir Laguna Negra).
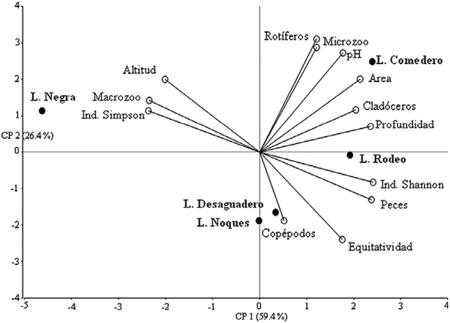
Figura 10. Componentes principales con todas las lagunas estudiadas.
densidades registradas, que podrían deberse en la hora de muestreo también a procesos migratorios de evasión descendentes. En la laguna Negra la competencia asumió el principal rol como interacción, donde Daphnia sp. manifestó su eficiencia competitiva como filtrador generalista. Esto se explica por una abundancia muy superior respecto al resto de los herbívoros (Gilbert 1988).
Existen varios elementos que indicarían posibles estados de eutrofización en algunas lagunas: La baja transparencia, la coloración verdosa y la presencia de algunos zooplanctontes, tales como Brachionus angularis, B. plicatilis, K. cochlearis, B. longirostris y especialmente copépodos ciclopoideos (organismos más eficaces y menos vulnerables a cambios del estado trófico como E. serrulatus y P. chiltoni). En este sentido, en la laguna Comedero se registró la mayor proporción de bioindicadores y la menor relación entre calanoideos y ciclopoideos (Gannon & Stemberger 1978, Harper 1992, Seda & Devetter 2000). No fue posible complementar estas observaciones con datos de densidades de fitoplancton, pero se sabe que la comunidad fitoplanctónica de las lagunas presentó diferencias en orden de predominancia de grupos (V. Mirande, com. pers. 2007): En Rodeo, Comedero, Los Noques y Desaguadero, las diatomeas (Nitzschia sp., Fragillaria sp., Diatoma sp., Gomphonema sp., Cymbella sp., Aulacoseira sp., Cocconeis sp.), clorofitas (Staurastrum sp., Cosmarium sp., Oedogonium sp.) y cianofitas (Phormidium sp., Microcystis sp., Chroococcus sp) y en la laguna Negra, las clorofitas (Scenedesmus sp., Stygoclonium sp., Oedogonium sp.), cianofitas (Phormidium sp.), euglenofitas (Phacus sp.) y diatomeas. Así mismo, se diferenciaron géneros algales dominantes (V. Mirande, com. pers. 2007): Phormidium sp. en la laguna Negra, Oedogonium sp. en Rodeo, Cocconeis sp. en Desaguadero y Staurastrum sp. en Los Noques.
Las diferencias enunciadas anteriormente, justifican continuar con el estudio limnológicoregular en estos interesantes humedales naturales, que constituyen representantes casi exclusivos de un piso altitudinal (2.000 m) de Yungas en un área de reserva. En tal sentido, su control fue catalogado como insuficiente de acuerdo a la calificación realizada por la Comisión Mundial de Áreas Protegidas de la UICN y Administración de Parques Nacionales (UICN 1998), entre otras instituciones evaluadoras, siendo necesaria la mayor participación de las provincias en los planes nacionales de conservación (González 2005). Por ello, es necesaria la profundización de su conocimiento para la evaluación de sus potencialidades y detectar las amenazas que permitirían implementar estrategias de conservación apropiadas.
Conclusiones
La riqueza total determinada en 41 taxones de zooplancton (18 rotíferos y 23 a microcrustáceos: 14 cladóceros y 9 copépodos) fue significativa para las lagunas del noroeste argentino, que presentan valores de riqueza/ambiente dentro de un rango semejante. Las lagunas de mayor área y variedad de microhábitats en Rodeo, Desaguadero y Comedero, registraron los mayores valores de riqueza específica, 14 en las dos primeras y 22 en la última, mientras que la más pequeña y alejada dentro del complejo lagunar, en la laguna Negra se observó el menor valor de nueve especies concordando con los principios de la biogeografía insular en la relación especie-área y el factor distancia. El estudio cuantitativo de morfos del zooplancton reveló distintas estructuras comunitarias de cladóceros en la laguna Negra, de rotíferos en Comedero y Los Noques; y de copépodos ciclopoideos en Rodeo y Desaguadero.
Agradecimientos
Agradecemos la subvención de la Secretaría de Ciencia y Técnica de la Universidad Nacional de Tucumán (Proyecto CIUNT 26 / G229) para realizar este trabajo.
Referencias
1.- Bottrell, A. & A. Duncan, 1976. A review of some problems in zooplankton production studies. Contribution from the lankton. DEU 20 (2): 1198-1202. [ Links ]
2.- Brown, A. D., A., Grau, T. Lomáscolo & N. Gasparri. 2002. Una estrategia de conservación para las selvas subtropicales de montaña (Yungas) de Argentina. Ecotropicos 15 (2): 147-159. [ Links ]
3.- Camacho, M. & G. Bossi. 2002. Mineralogía de los depósitos del Holoceno Medio Tardío – Actual de las lagunas de Yala: Rodeo y Comedero, en el Valle de San Salvador de Jujuy, Noroeste de Argentina. Pp. 603 - 608. Actas II del XV Congreso Geológico Argentino, Centro Nacional Patagónico – Conicet, El Calafate, Santa Cruz. [ Links ]
4.- Coelho-Botelho, M. J. 2003. Dinâmica da comunidade zooplantônica e sua relação com o grau de trofa em reservatórios. 5 p. Actas IV Simpósio e IV Reunião de Avaliação do Programa Biota, Fapesp, São Paulo. [ Links ]
5.- Cowardin, L.M., V. Carter, F.C. Golet & E.T. LaRoe.1979.Classifcation of wetlands and deepwater habitats of the United States. U.S. Department of the Interior Fish and Wildlife Service Office of Biological Services-79/31, Washington DC. 131 p. [ Links ]
6.- De Manuel Barrabín, J. 2000. The rotifer of Spanish reservoirs: ecological, systematical and zoogeographical remarks. Limnetica 19: 91-166. [ Links ]
7.- Dejoux, C. 1993. Benthic invertebrates of some saline lakes of the Sud Lipez region, Bolivia. Hydrobiologia 267: 257-267. [ Links ]
9.- Dumont, H., I. Van De Velde & S. Dumont. 1975. The dry weight estimate of biomass in a selection of Cladocera, Copepoda and
Rotifera from the plankton, periphyton and benthos of continental waters. Oecologia 19: 75-97.
10.- Edmondson, W. T. & G. G. Winberg, 1971. A manual on methods for the assesment of secondary productivity in fresh waters. IBP, Handbook 17, Blackwell, Oxford. 358 p. [ Links ]
11.- Gannon, J. E. & R. Stemberger. 1978. Zooplankton (especially Crustaceans and Rotifers) as indicators of water quality. Trans. Amer. Microsc. Soc. 97 (1): 16-35. [ Links ]
12.- Gilbert, J. J. 1988. Supression of rotifer populations by Daphnia: a review of the evidence, the mechanisms, and the effects on zooplankton community structure. Limnol. Oceanogr. 33 (6, 1): 1286-1303. [ Links ]
13.- González, J. A. 2005. Los ambientes naturales en áreas montañosas del Noroeste Argentino (NOA), su interrelación con países limítrofes y su necesidad de protección, recuperación y conservación. Serie Conservación de la Naturaleza Nº 15. Fundación Miguel Lillo, Tucumán. 28 p. [ Links ]
14.- González Díaz, E. F. & R. Mon. 2000. El origen de las lagunas de Yala, Provincia de Jujuy (24° 05 de Latitud Sur y 65° 28 de Longitud Oeste). Pp. 209–217. En: Actas IV de XIII Congreso Geológico Argentino y III Congreso de Exploración de Hidrocarburos, Asociación Geológica Argentina e Instituto Argentino del Petróleo y del Gas, Buenos Aires. [ Links ]
15.- Grosjean, M. 2000. Compilation water samples feldwork January-February 1998 and January 2000 Chile and Argentina. Manuscrito no publicado. 2 p. [ Links ]
16.- Harper, D. 1992. Eutrophication of freshwaters. Principles, problems and restoration. Chapman & Hall, Lonadres. 327 p. [ Links ]
17.- Hrbácek, J. 1987. Systematics and biogeography of Daphnia species. Pp. 30-35. En: Peters, R. H. & R. De Bernardi (eds.) Daphnia. Mem. Ist. Ital. Idrobiol. 45: 31-35. [ Links ]
18.- Koste, W. 1978. Rotatoria. Die Radertiere Mitteleuropas. Uberord nung Monogononta. Revision de M. Voigt. Borntraeger, Berlin. 2 Vols. 673 p. [ Links ]
19.- Locascio de Mitrovich, C. & M. Ceraolo, 2004. Nuevos registros de copépodos de alta montaña para la provincia de Catamarca (Argentina). Physis, Sección (B), 60 (138 -139): 25–39. [ Links ]
20.- Locascio de Mitrovich C., A. Villagra de Gamundi, J. Juárez & M. Ceraolo. 2005. Características limnológicas y zooplancton de cinco lagunas de la puna, Argentina. Ecología en Bolivia 40 (1): 10–24. [ Links ]
21.- Locascio de Mitrovich C., A.Villagra de Gamundi, C. Seeligmann, V. Mirande, B. Tracanna & N. Maidana. 2007. Resultados preliminares del plancton de algunas lagunas altoandinas, Jujuy, Argentina. Pp. 1332. En: Feyen, J., L. F. Aguirre & M. Moraes R. (eds.) Libro de Resúmenes Congreso Internacional sobre Desarrollo, Medio Ambiente y Recursos Naturales: Sostenibilidad a Múltiples Niveles y Escalas. Volumen II. Sub-tema 4: Innovaciones en pesquerías continentales y ecología acuática, Universidad Mayor de San Simón, Cochabamba. [ Links ]
22.- Lupo, L. C., M. M., Bianchi, E., Aráoz, R., Grau, C., Lucas, R., Kernd, M., Camacho, W., Tanner & M. Grosjean. 2006. Climate and human impact during the past 2000 years as recorded in the Lagunas de Yala, Jujuy, northwestern Argentina Quaternary International 158: 30–43. [ Links ]
23.- Magurran, A. E. 1988. Ecological diversity and its measurement. Princenton University Press, Nueva Jersey.192 p. [ Links ]
24.- Paggi, J. C. 1995. Biodiversidad del zooplancton en los ecosistemas acuáticos continentales de la región Neotropical: Revisión de las especies del género Notodiaptomus Kiefer (Copepoda, Calanoida). Tesis de Magíster, Universidad Nacional del Litoral Santa Fe, Santa Fe. 160 p. [ Links ]
25.- Picchi, C. G. 1978. Observaciones topomicroclimáticas en la Estación Biológica Laguna El Rodeo, Jujuy. Pp. 394-401. Em: Actas III Congreso Forestal Argentino, Asociación Forestal Argentina Tigre, Buenos Aires. [ Links ]
26.- Picchi, C. G. 1984. Balance hídrico de la Estación Biológica Laguna El Rodeo (Yala), Provincia de Jujuy. Gobierno de la Provincia de Jujuy, Secretaría de Estado de Agricultura y Ganadería, Dirección de Estaciones Experimentales, Publicación Técnica N° 1: 1–11. [ Links ]
27.- Ringuelet, R. A. 1958. Los crustáceos copépodos de las aguas continentales en la República Argentina. Sinopsis sistemática. Contr. Cient. Fac. Cs. Exact. Nat. UBA, Ser. Zool. 1(2): 1-126. [ Links ]
28.- Reid, J. W.1985. Chave de identifcaçao e lista de referencias biblográfcas para as espécies continentais sulamericanas de vida livre da ordem Cyclopoida (Crustacea, Copepoda). Boletim Zool. Univ. S. Paulo 9: 1-143. [ Links ]
29.- Rosenvaig, A. L. 1974. Contribución al conocimiento de las lagunas de Yala (Provincia de Jujuy). Instituto para la investigación de los problemas del mar. Univ. Prov. de M. del Plata. Ministerio de Educación de la Provincia de Buenos Aires, Buenos Aires. 32 p. [ Links ]
30.- Seda, J. & M. Devetter. 2000. Zooplancton community structure along a trophic gradient in a canyon-shaped dam reservoir. J. Plankton Res. 22: 1829- 1849. [ Links ]
31.-Seeligmann, C., C. Locascio de Mitrovich, A. Villagra de Gamundi, & N. Maidana. 2007. Complejo lagunar Vilama: Diatomeas, rotíferos y microcrustáceos de algunos humedales. Pp. 1323. En: Feyen, J., L. F. Aguirre & M. Moraes R. (eds.) Libro de Resúmenes Congreso Internacional sobre Desarrollo, Medio Ambiente y Recursos Naturales: Sostenibilidad a Múltiples Niveles y Escalas. Volumen II. Sub - tema 4: Innovaciones en pesquerías continentales y ecología acuática, Universidad Mayor de San Simón, Cochabamba. [ Links ]
32.- Smirnov, N. N. 1971. Chydoridae of the worlds fauna. Fauna of the USSR. Crustacea Nov. Ser. 1 (2): 1-644. [ Links ]
33.- Smirnov, N. N. 1976. Macrothricidae i Moinidae fauni mira. Fauna of the SSSR Nov. Ser. 1(3)112: 1-237. [ Links ]
34.- Smirnov, N. & B. V. Timms. 1983. A revision of the Australian Cladocera (Crustacea). Rec. Austr. Mu s. Supplement 1: 1-132. [ Links ]
35.- UICN. 1998. United Nations List of protected Areas. Prepared by World Conservation Monitoring Centre and the UICN World Comission on Protected Areas, Gland & Cambridge. 412 p. [ Links ]
36.- Villagra de Gamundi, A., C. Locascio de Mitrovich & C. Seeligmann. 2003. Biodiversidad en humedales de áreas montañosas del noroeste argentino. Pp. 185 – 272. Actas Seminario Internacional Sobre Manejo Sustentable de Humedales en América Latina y Simposio Internacional de Ecoturismo y Humedales, Fundación Proteger Santa Fe, Santa Fe. [ Links ]
37.- Villagra de Gamundi, A., C. Locascio de Mitrovich & C. Seeligmann. 2005. Consideraciones sobre la comunidad planctónica en humedales de alta montaña (Catamarca – Argentina). Simposio de Humedales Altoandinos. Línea temática nº 3: Flamencos y otras especies indicadoras. Actas (en soporte electrónico) (3). Grupo Conservación de Flamencos Altoandinos, Convención Ramsar, Salta. [ Links ]
Artículo recibido en: Abril de 2008.
Manejado por: José Clavijo.
Aceptado en: Agosto de 2008












 uBio
uBio 

