Ecología en Bolivia
versión impresa ISSN 1605-2528versión On-line ISSN 2075-5023
Ecología en Bolivia v.43 n.2 La Paz ago. 2008
Dispersi ón y remoción de semillas de Virola sebifera (Myristicaceae) en un bosque montano de Bolivia
seed dispersal and removal of Virola sebifera (Myristicaceae)in a Bolivian montane forest
Luis L. Arteaga
1Estación Biológica Tunquini, Instituto de Ecología, Universidad Mayor de San Andrés, Casilla 10077 - Correo Central, La Paz, Bolivia 2Dirección actual: Dirección General de Biodiversidad y Áreas Protegidas, Viceministerio de Biodiversidad, Recursos Forestales y Medio Ambiente, Av. Camacho 1471, La Paz, Bolivia Email: larteagabohrt@yahoo.com
Resumen
Los patrones de dispersión de semillas de Virola sebifera en un bosque húmedo montano de Bolivia sugieren que la pendiente puede influir en la distancia de las semillas en dispersióncon relación a los árboles productores de semillas. De la misma manera, en árboles con floresfemeninas, la distancia de las plántulas al conespecífico adulto más cercano muestra coherencia con lo encontrado para la dispersión de semillas, donde la distancia promedio de las plántulas a la base del árbol es mayor siguiendo el sentido de la pendiente que perpendicular a ésta. Un nexo importante entre ambos procesos es la remoción de las semillas, la cual fue mayor cerca del árbol semillero durante las dos primeras semanas. Sin embargo, con el paso del tiempo lassemillas que se encontraban lejos también fueron removidas.Palabras clave: Virola sebifera, dispersión de semillas, remoción de semillas, bosque montano, Bolivia.
Abstract Patterns of seed dispersal of Virola sebifera in a humid montane forest in Bolivia suggest that the slope can influence in the distance of dispersed seeds from adult trees. Similarly, in females trees, the distance of seedlings were congruent with the patterns of seed dispersal, since the average distance of seedlings to nearest adult tree is higher in sense of the slope that perpendicular to it. An important nexus between both processes is seed removal, which was greater near the tree during the first two weeks. However, later on seeds that were far from the tree were also removed. Key words: Virola sebifera, seed dispersal, seed removal, montane forest, Bolivia.
Introducción
La dispersión de semillas es la primera de una serie de eventos de los que depende el reclutamiento de plantas. Para especies dispersadas por vertebrados, este escenario tiene relación con la remoción de frutos, diseminaciónde semillas, depredación de semillas post dispersión, potencial de dispersión secundaria,germinación y establecimiento de plántulas(Jordano 1992, Wenny 2000). Por lo tanto, ladispersión de semillas es el proceso inicial que determinará la futura distribución espacial de las plántulas (Chesson 2000, Russo &Augspurger 2004, García et al. 2005, Norden et al. 2007). Pocos estudios han examinado la depredación de semillas como un nexo entrela dispersión de semillas y el reclutamiento deplántulas en bosques montanos (Wenny 2000,Kitamura et al. 2004). Esto es importante, ya que los patrones espaciales del reclutamiento de plántulas están fuertemente influenciadospor la dispersión y depredación de las semillas(Augspurger 1983, 1984, García et al. 2005). El reclutamiento puede además ser afectado por agentes de mortalidad que actúan de manera dependiente de la distancia con respecto alos individuos reproductivos (Janzen 1970,Connell 1971, Howe et al. 1985, Howe 1993, Peters 2003, Russo 2005). Este modelo es denominado como efecto Janzen-Connell, el cual predice que las semillas y plántulas que se encuentran cerca de los árboles adultos de la misma especie han de experimentar altosniveles de daño y mortalidad (Janzen 1970,Connell 1971, Barone 2000, Hyatt et al., 2003,Peters 2003, Adler & Muller-Landau 2005, Davidar et al. 2005, González-Martínez et al. 2006). En este sentido,en lapresente investigación analicé la dispersión y remoción de semillasde Virola sebifera Aublet (Myristicaceae), considerando la distancia al adulto conespecífico más cercano, ya que durante elproceso de dispersión, lassemillascasi siempre se concentran alrededor del árbol parental(Stiles 1992, Guariguata 1998). Adicionalmente,consideré las particularidades topográficas delbosque húmedo montano, caracterizado por laderas de fuerte pendiente (Ribera 1995), ya que este tipo de terreno podría influir sobre los patrones finales de distribución de semillas y plántulas(Westelaken&Maun1985,Chambers & MacMahon 1994). Finalmente, analicé la distancia de las plántulas al árbol conespecífico adulto, para relacionar estos resultados con loencontrado con la dispersión y depredaciónde semillas.
Área de estudio
Realicé el estudio en el bosque húmedo montañoso de la Estación Biológica Tunquini (EBT, 1.500–1.800 m de altitud), dentro del Parque Nacional y Área Natural de Manejo Integrado Cotapata (68º02´, 16º20´ SW; 68º03´, 16º05´NW; 67º43´, 16º10´ NE; 67º47´, 16º18´SE, La Paz; Ribera 1995). En la EBT, la temperaturamedia anual es de 20.4ºC y la precipitación promedio anual esde 2.900 mm(Arteaga 2007). Entre las especies arbóreas más representativasestán Hieronymia alchorneoides, Morus insignis, Licaria triandra, Ficus trigona, Virola sebifera yespecies de los géneros Ladenbergia y Bathysa(Paniagua et al. 2003).
Especie en estudio
Los árboles del género Virola presentanflores unisexuadas y son dioicos (Hinojosa1993). Las plántulas se desarrollan en claros o en sotobosque bajo dosel cerrado, siendotolerantes a la sombra (Fisher et al. 1991). Los frutos consisten de una cápsula fibrosa, la cual es dehiscente y expone una semilla grisrodeada por un arilo rojo brillante (Howe & Van de Kerckhove 1981). En la EBT, lafructificación ocurre entre octubre y febrero con periodos supra anuales (Arteaga 2007) y el peso promedio de las semillas es de 1.25 ± 0.41 g (N = 470). Estas semillas son dispersadas por primates (Ateles) (Howe et al. 1985) y aves (Trogonidae, Ramphastidae, Cracidae); en la zona además se registró consumo de frutos por Rupicola peruviana (Cotingidae; obs. pers. 2003).
Métodos
Establecimiento de transectos En mayo de 2001 elegí 20 árboles de V. sebifera,10 individuos masculinos y 10 femeninos. Considerétambiénárbolesconfloresmasculinas, yaquesibiennoproducenfrutos,sereconoceque actúan como foco de reclutamiento, gracias a laactividad de los dispersores y por la dispersión secundaria (Wheelwright & Bruneau 1992). Partiendo de la base de cada árbol, establecí dostransectos de 30 x 2 m; uno paralelo a la pendiente,desde la base del árbol hacia la ladera (vertical) y el otro de manera lateral, perpendicular a lapendiente(horizontal).Los transectos verticalespresentaron una inclinación empinada (35.4 ±7.2º) y los transectos horizontales presentaronterreno ondulado (3.5 ± 3.8º). Un requisito deldiseño fue que los árboles se encontraran a una distancia de al menos 30 m entre sí y con respecto al transecto más cercano de otro adulto conespecífico.
Dispersión de semillas
Durante la época de fructificación (diciembre 2002–enero 2003), realicé tres conteos de semillas en cada transecto cada 18 días. En cada conteo, las semillas fueron retiradas para no volverlas a contar en la siguiente revisión. Para cada semilla registré la distancia en la base del árbol y calculé un valor promedio de distancia de las semillas para cada transecto. Comparéelnúmerodesemillasdispersadas, así como la distancia promedio de las semillas entre los transectos establecidos en cada árbol adulto, utilizando pruebas de Wilcoxon (Siegel & Castellan 1995). El análisis se realizó de manera separada para árboles masculinos y femeninos, ya que sólo estos últimos son semilleros. Utiicé esta prueba ya que se tiene un factor de diseño (dirección del transecto) y dos variables de respuesta (el número de semillas por transecto y la distancia promedio de las semillas en cada transecto).
Remoción de semillas
En diciembre de 2002 colecté 560 frutos maduros y en buenas condiciones. Consideré la distancia al árbol como factor de diseño y trabajésolamenteenlosárbolesfemeninos.Para poder discriminar el daño debido a animales grandes (e.g. mamíferos) utilicé exclusiones empleando canastas cuadradas de alambre galvanizado de 20 cm de ancho, 15 cm de alto con orificios de 0.8 cm2. El 10 de diciembre de 2002 en cada árbol estudiado, coloqué 20 semillas a 2 m de la base delárbol(Tratamiento“cerca”-10conexclusión y 10 sin exclusión). De la misma manera, ubiqué 20 semillas a 30 m de la base del árbol (Tratamiento “lejos“ -10 con exclusión y 10 sin exclusión). Realicé revisiones cada semana para registrar el número de semillas removidas o dañadas (e.g. con larvas) y así obtener la proporción de semillas remanentes. Distancia de plántulas al conespecífico
adulto
Enmayode2001,enlostransectosestablecidos, registré todas las plántulas de V. sebifera < 1 m de altura. Para cada plántula registré su distancia respecto a la base del árbol. Mediante una prueba Wilcoxon comparé el número de plántulas entre transectos verticales y horizontales. Posteriormente y para comparar la distancia de las plántulas con relación al conespecífico adulto, utilicé una prueba Wilcoxon considerando la dirección del transecto como factor de diseño y la distancia promedio de las plántulas a la base del árbol en cada transecto como variable de respuesta. Realicé los análisis de manera separada para árboles masculinos y femeninos. En las pruebas estadísticas elegí un a = 0.05 para que las diferencias fueran consideradas significativas. Para cada valor medio incluyo el respectivo valor de la medida de dispersión de los datos [mediana (rango)].
Resultados Dispersión de semillas
En total contabilicé 338 semillas dispersadas, delascualessolamenteseis fueronencontradas en los transectos de los árboles masculinos. En los transectos de los árboles femeninos registré un mayor número de semillas dispersadas en los transectos verticales [26 (22)] que en los horizontales [8 (18)] (Z = -2.677, P = 0.007). Las semillasdispersadasensentidode lapendiente presentaronunadistanciapromedio mayorala base del árbol [8.2 (4.9)] que aquellas ubicadas en el transecto perpendicular a la pendiente [5 (3.6)] (Z = -2.67; P = 0.008, Fig. 1).
Remoción de semillas
El número de semillas removidas fuera de las exclusiones fue mayor cerca del árbol adulto durante la primera semana. Sin embargo, este patrón se modificó con el tiempo, ya que a la cuarta semana todas las semillas habían desaparecido, tanto cerca como lejos del árbol adulto (Fig. 2). Los agentes responsables de la remoción - identificados por huellas - fueron roedores pequeños, además de Dasyprocta variegata y Pecari tajacu. En todos los casos, las semillas fuera de las exclusionesfueronremovidasmásrápidamente que aquellas dentro de las exclusiones. En las exclusiones, el daño producido por insectos se inició en la segunda semana. Hasta la cuarta semana observé que la proporción de semillas remanentes ubicadas cerca de la base del árbol en fructificación es menor que aquellas que se encuentran lejos (Fig. 2). Sin embargo, en la décima semana todas las semillas habían sido dañadas. Ninguna semilla permaneció hasta la décima semana.
Distancia de plántulas al conespecífico adulto
En total contabilicé 178 plántulas. Bajo árboles masculinos, no encontré diferencias significativas al comparar el número de
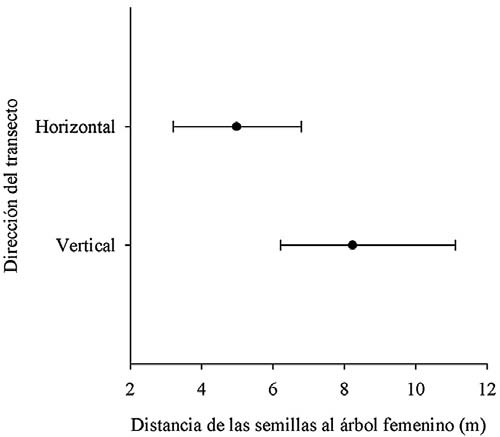
Figura 1. Distancia de las semillas de Virola sebifera a la base árbol adulto femenino, considerando transectos paralelos a la pendiente y perpendiculares a la misma (la gráfica muestra la mediana y el rango).
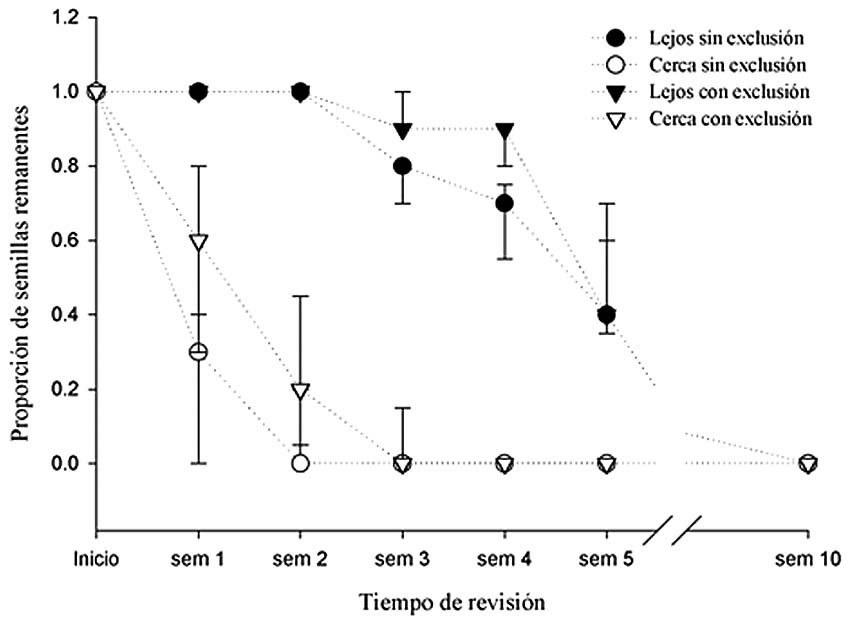
Figura 2. Proporción de semillas remanentes de Virola sebifera considerando la distancia al árbol adulto semillero y el tratamiento de exclusión (la gráfica muestra las medianas y los percentiles). plántulas entre transectos verticales [2 (6)] y horizontales [4 (7)] (Z = -1.784, P = 0.74).Por el contrario, para los árboles femeninos registré mayor cantidad de plántulas en los transectosverticales[7(11)]queenlostransectos horizontales [2 (11)] (Z = -2.013, P = 0.04). En los árboles masculinos la distancia de las plántulas al adulto más cercano no difirió significativamente entre transectos verticales [14.2 (15.8)] ni horizontales [15.9 (13.9)] (Z = -0.7; P = 0.48). Por el contrario, en el caso de los árbolesfemeninos,ladistanciapromediodelas plántulas fue mayor en los transectos verticales [21.8 (18)] que en los horizontales [14.6 (19.4)] (Z = -2.07, P = 0.038).
Discusión
Los resultados sugieren que es probable que la distancia de las semillas dispersadas y la distancia de las plántulas al conespecífico adultoesténinfluenciadasporlapendiente.Las semillas serían dispersadas a mayor distancia en el sentido de la pendiente. Por esto, es probable que la pendiente esté influyendo en la sombra de semillas. Por el contrario, en los árboles masculinos las semillas registradas en los alrededores son resultado del transporte por dispersores o por el movimiento post dispersión primaria. Cuandoseanalizanlassemillasremanentes, seobservaquelaremocióndebidaavertebrados es mucho más rápida que el daño causado por insectos. En las primeras semanas se presenta menor proporción de semillas remanentes cerca del árbol adulto, respondiendo al modelo Janzen-Connell, probablemente debido a que las semillas que se encuentran cerca del árbol semillero existe mayor actividad por los depredadores de semillas (Hyatt et al. 2003, Peters 2003, Adler & Muller-Landau 2005, Davidar et al. 2005, González-Martínez et al. 2006). Sin embargo, la diferencia de remoción entre semillas que se encuentran cerca del árbol y aquellas que se encuentran lejos desaparece con el transcurso del tiempo. Los resultados, al finalizar el estudio, son contrarios a lo registrado por Howe et al. (1985) para V. surinamensis, ya que ellos no encontraron diferencias en la depredación de las semillas con relación a la distancia del árbol durante las primeras semanas, pero en la sexta semana la sobrevivencia de semillas y plántulas(productodesemillasgerminadas)era mayor lejos del árbol parental. En el presente estudio, todas las semillas de V. sebifera fuera de la exclusión habían sido removidas hacia la quinta semana. Es probable que los patrones finales de remoción de semillas por mamíferos no dependan de la distancia de la semilla al árbol semillero, sino del comportamiento de forrajeo (Terborgh & Wright 1994, Asquith 2002). Esta podría ser la razón para que el 100% de las semillas fuera de exclusiones haya sidoremovido. Estos resultados no son inusuales, ya que Howe et al. (1985) - para V. surinamensis y Russo (2005) para V. calophylla - registraron niveles altos de mortalidad de semillas. Es claro que si las semillas de V. sebifera tienen la posibilidad de germinar durante las primeras semanasdespuésdehabersidodispersadasserá más probable que ocurra a mayor distancia del árbol adulto, ya que al principio la proporción de semillas remanentes es mayor lejos del árbol semillero. Se debe considerar que si la pendiente influye en la distancia final de las semillas al adulto conespecífico, es probable que se puedan registrar diferencias marcadas en la sobrevivencia de semillas a mayores distancias con respecto a la base del árbol semillero que las consideradas en este trabajo. En este caso, se debe considerar que el patrón Janzen-Connellpuedeocurrirsolosiladistancia media sobre la cual los depredadores están activos, es menor que aquella de las semillas dispersadas. En este sentido, se predice que el número total de semillas sobrevivientes a la depredación es menor a las distancias intermedias de movimiento, sugiriendo una depredación dependiente de la distancia (Nathan & Casagrandi 2004). Porotraparte, alanalizarlasplántulasenlas cercanías del árbol conespecífico, se consideró también la distancia de las plántulas respecto a la base del árbol, debido a que al realizar solo conteos se estaría asumiendo que la sombra de semillas era uniforme. Además, las diferencias enelnúmerodeplántulaspodríanserresultado delacargainicialdesemillasynodeladirección del transecto. En árboles femeninos, el patrón observado de la distancia de las plántulas al conespecífico adulto, comparando entre transectos verticales y horizontales, presenta resultados similares a los encontrados en la dispersión de semillas. Si bien los resultados muestran coherencia al relacionar la dispersión de semillas con la distancia de las plántulas en la base del árbol semillero, se debe tener cautela en las conclusiones finales ya que las plántulas analizadassonelresultadodevarioseventosde dispersión, los cuales pueden variar temporal y espacialmente (Wenny 2000). Sumado a esto, se debe considerar que el modelo Janzen-Connell ha sido ampliamente estudiado para varias especies, sin embargo parece que no es un fenómeno general en las comunidades tropicales, donde existe evidencia más fuerte quesoporta la hipótesisparaplántulasymenos parasemillas,registrandounmejorpatrónpara zonas templadas que para las tropicales (Hyatt et al. 2003,Peters2003).Sinembargo,losindicios del efecto que tendría la pendiente sobre los patronesdedispersióndesemillas,depredación de semillas y distancia de las plántulas es muy importanteparacomprendermejorladinámica de regeneración de esta especie en los bosques montanos.
Agradecimientos
Agradezco a F. Paredes, J. Torrez y D. Pérez, de la comunidaddeChairo,porelapoyoeneltrabajode campo.P.Feinsinger,N.Wheelwright,L.Pacheco, A. Roldán y J. Simonetti hicieron importantes sugerenciasparamejorarelpresenteartículo.Esta investigaciónfuefinanciadaporlaFundaciónJohn and Catherine MacArthur mediante el apoyo a la Estación Biológica Tunquini.
Referencias
1.- Adler, F.R. & H.C. Muller-Landau. 2005. Whendo localized natural enemies increase species richness? Ecology Letters 8(4): 438-447. [ Links ]
2.- Arteaga, L.L. 2007. Fenología y producción de semillasdeespeciesarbóreasmaderables enunbosquehúmedomontanodeBolivia (PN ANMI Cotapata). Revista Bolivianade Ecología y Conservación Ambiental 21: 55-66. [ Links ]
3.- Asquith, N. M. 2002. La dinámica del bosque yla diversidad arbórea. Pp. 377-406. En: M.Guariguata & G.Kattan(eds.).Ecologíay Conservación de Bosques Neotropicales. Libro Universitario Regional, Cartago. [ Links ]
4.- Augspurger, C. K. 1983. Seed dispersal of the tropical tree, Platypodium elegans, and the escape of its seedlings from fungalpathogens. Journal of Ecology 71: 759-771. [ Links ]
5.- Augspurger, C. K. 1984. Seedling survival among tropical tree species: interactions of dispersal distance, light-gaps, and pathogens. Ecology 65: 1705-1712. [ Links ]
6.- Barone, J.A. 2000. Comparison of herbivoresandhervibory in the canopy and understory for two tropical tree species. Biotropica 32(2): 307-317. [ Links ]
7.- Chambers, J. C. & J. A. MacMahon. 1994. A day in the life of a seed: movements and fates ofseedsandtheirimplicationsfornatural and managed systems. Annual Review ofEcology and Systematic 25: 263-292. [ Links ]
8.- Chesson, P. 2000. General theory of competitivecoexistence in spatially-varyingenvironments. Theoretical Population Biology 58: 211-237. [ Links ]
9.- Connell,J.H.1971.Ontheroleofnaturalenemies in preventing competitive exclusion in some marine animals in rain forest trees. Pp. 298-312. En: P. Den Bour & P. Gradwell(eds.).DynamicsofPopulations. Center for Agricultural Publishing and Documentation, Wageningen. [ Links ]
10.- Davidar, P., J.P. Puyravaud & E.G. Leigh. 2005.Changes in rain forest tree diversity, dominanceandrarityacrossaseasonality gradient in the Western Ghats, India.Journal of Biogeography 32(3): 493-501. [ Links ]
11.- Fisher, B. L., H. F. Howe & S. J. Wright. 1991.Survival and growth of Virola surinamensis yearlings:wateraugmentationingapand understory. Oecologia 86: 292-297. [ Links ]
12.- García,D.,J.R.Obeso&I.Martínez.2005.Spatial concordance between seed rain and seedling establishment in bird-dispersed trees: does scale matter? Journal of Ecology 93: 693-704. [ Links ]
13.- González-Martínez, S.C., J. Burczyk, R. Nathan, N. Nanos, L. Gil & R.Alía. 2006. Effective gene dispersal and female reproductive success in Mediterranean maritime pine (Pinus pinasterAiton).Molecular Ecology 15(14): 4577-4588. [ Links ]
14.- Guariguata, M. R. 1998. Consideracionesecológicas sobre la regeneración natural aplicada al manejo forestal. Colección Manejo Diversificado de Bosques Naturales Nº14, CATIE, San José. 25 p.
15.- Hinojosa,I.1993.Myristicaceae.Pp.564-568.En: T. J. Killeen, E. García, & S.G. Beck. (eds.). Guía de Árboles de Bolivia. Herbario Nacional de Bolivia, Missouri BotanicalGarden, Editorial Quipus, La Paz. [ Links ]
16.- Howe, H.F. 1993. Aspects of variation in aNeotropical seed dispersal system. Vegetatio 107/108: 149-162. [ Links ]
17.- Howe, H. F. & G. A. Van de Kerckhove. 1981. Removal of wild nutmeg (Virola surinamensis) crops by birds. Ecology 62 (4): 1093-1106. [ Links ]
18.- Howe, H. F., E. W. Schupp & L. C. Westley. 1985. Early consequences of seed dispersal for a neotropical tree (Virola surinamensis).Ecology 66: 781-791. [ Links ]
19.- Hyatt, L.A., M.S. Rosenberg, T.G. Howard, G.Bole, W. Fang, J. Anastasia, K. Brown. [ Links ]
20.- R. Grella, K. Hinman, J.P. Kurdziel & J. Gurevitch. 2003. The distance dependence prediction of the Janzen Connell hypothesis: a meta-analysis. Oikos 103(3): 590-602. [ Links ]
21.- Janzen, D. H. 1970. Herbivores and the number oftreespeciesintropicalforests.American Naturalist 104: 501-528. [ Links ]
22.- Jordano, P. 1992. Fruits and frugivory. Pp. 106-156.En: M. Fenner (ed.). Seeds: The Ecologyof Regeneration in Plant Communities.CAB International, Wallingford. [ Links ]
23.- Kitamura,S.,S.Suzuki,T.Yumoto,P.Poonswad, P. Chuailua, K. Plongmai, N. Noma, T. Murahashi & C. Suckasam. 2004. Dispersal of Aglaia spectabilis, a largeseeded tree species in a moist evergreen forest in Thailand. Journal of TropicalEcology 20: 421-427. [ Links ]
24.- Nathan, R. & R. Casagrandi. 2004. A simplemechanistic model of seed dispersal, predation and plant establishment:Janzen-Connell and beyond. Journal ofEcology 92(5): 733-746. [ Links ]
25.- Norden, N., J. Chave, A. Caubere, P. Chatelet, N. Ferroni, P.M. Forget & C. Thébaud.2007. Is temporal variation of seedlingcommunities determined by environmentor by seed arrival?Atest in a Neotropical forest. Journal of Ecology 95(3): 507-516. [ Links ]
26.- Paniagua, N., C. Maldonado & C. Chumacero.2003. Mapa de vegetación de los alrededores de la Estación Biológica deTunquini, Bolivia. Ecología en Bolivia 38(1): 15-26. [ Links ]
27.- Peters, H.A. 2003. Neighbour-regulated mortality: the influence of positive and negative density dependence on tree populations in species-rich tropical forests. Ecology Letters 6(8): 757-765. [ Links ]
28.- Ribera, M. O. 1995. Aspectos ecológicos del uso de la tierra y conservación en el Parque Nacional y Área de Manejo Integrado Cotapata. Pp. 1-84. En: C. B. Morales (ed.). Caminos de Cotapata. Instituto de Ecología, Fund-Eco, Fonama – EIA, La Paz.
29.- Russo, S.E. 2005. Linking seed fate to natural dispersal patterns: factors affectingpredation and scatter-hoarding of Virola calophyllaseedsinPeru.JournalofTropical Ecology 21: 243-253. [ Links ]
30.- Russo, S. E. & C. K. Augspurger. 2004. Aggregated seed dispersal by spider monkeys limits recruitment to clumped patterns in Virola calophylla. Ecology Letters 7: 1058-1067. [ Links ]
31.- Siegel, S. & J. Castellan. 1995. Estadística noparamétrica. Editorial Trillas, México D.F. 437 p. [ Links ]
32.- Stiles, E.W. 1992. Animals as seed dispersers.Pp. 87-104. En: M. Fenner (ed.). Seeds: The Ecology of Regeneration in Plant Communities. CAB International, Melksham. [ Links ]
33.- Terborgh, J. & S. J. Wright. 1994. Effects of mammalian herbivores on seedling recruitment and survivorship in two Neotropical forests. Ecology 75: 18291833. [ Links ]
34.- Wenny, D. G. 2000. Seed dispersal, seedpredation, and seedling recruitment of a Neotropical montane tree. Ecological Monographs 70 (2): 331-351. [ Links ]
35.- Westelaken, I. L. & M. A. Maun. 1985. Spatialpattern and seed dispersal of Lithospermum caroliniense on Lake Huron sand dunes. Canadian Journal of Botany 63: 125-132. [ Links ]
36.- Wheelwright, N. T. & A. Bruneau. 1992. Population sex-ratios and spatial distribution of Ocotea tenera (Lauraceae)trees in tropical forest. Journal of Ecology 80: 425-432. [ Links ]
Artículo recibido en: Agosto de 2008.
Manejado por: Javier Simonetti.
Aceptado en: Septiembre de 2008












 uBio
uBio 

