Ecología en Bolivia
versión impresa ISSN 1605-2528versión On-line ISSN 2075-5023
Ecología en Bolivia v.43 n.1 La Paz 2008
Estudio del oso andino (Tremarctos ornatus) como dispersor
legítimo de semillas y elementos de su dieta en la región de
Apolobamba-Bolivia
Study of the Andean bear (Tremarctos ornatus) as a legitimate seed disperser
and elements of its diet in the region of Apolobamba-Bolivia
Catalina Rivadeneira-Canedo
Instituto de Ecología- Universidad Mayor de San Andrés
Direcci ón Actual: Casilla 2564, La Paz-Bolivia. crivadeneira@uf.edu, catariva@yahoo.com
Resumen
Poco se conoce aun sobre la ecología del oso andino y el rol que cumple en los ecosistemas que habita. Este trabajo pretende contribuir al conocimiento sobre su ecología evaluando la legitimidad del oso andino como dispersor de semillas y conocer elementos de su dieta alimenticia en la región de estudio. Entre los meses de julio y octubre en 1998 y abril y junio en 1999, se recolectaron heces y otros rastros de alimentación así como semillas de las plantas. Para estimar el efecto de la ingesta se realizaron pruebas de germinación y de viabilidad. Los resultados sugieren que el oso andino es un agente dispersor legítimo de tres especies de plantas: Nectandra cf. cuneatocordata, Symplocos cf. cernua y Gaultheria vaccinioides. Sus semillas se encontraron ilesas y viables después de haber sido ingeridas. Las semillas de Gaultheria vaccinioides consumidas por el oso, germinaron en un porcentaje y tiempo similar a las muestras control. De igual forma, el porcentaje de viabilidad de las semillas de Symplocos cf. cernua no mostraron diferencias entre heces y frutos. En el caso de las semillas de Nectandra cf. cuneatocordata el porcentaje de germinaci ón fue similar a las muestras control, sin embargo las semillas ingeridas germinaron en menor tiempo. Los frutos de Gaultheria vaccinioides fueron consumidos en la zona de estudio también por otros animales como aves y zorro andino (Pseudalopex culpaeus). Comparando la germinación de las semillas de las heces de estos animales con las del oso, se encontró que no existían diferencias en el porcentaje de germinación pero sí en la rapidez. Las semillas consumidas por el oso y zorro germinaron en menos tiempo que aquellas consumidas por las aves. A partir del análisis de heces y de otros rastros indirectos de alimentación, la dieta del oso andino para la región de Apolobamba en términos de frecuencia consta en un 57,5% de especies de la familia Bromeliaceae: Puya atra, Puya sp., Tillandsia rubella; en un 34,8 % por frutos de Gaultheria vaccinioides, Symplocos cf. cernua y Nectandra cf. cuneatocordata; en 7,5% se observó el consumo de ganado (Bos taurus y Equs caballus) y en 1,5 % de aves.
Palabras clave: Dispersión de semillas, Tremarctos ornatus, Páramo, Bosque nublado.
Abstract
Little is know on Andean bear ecology and the role that this species could play in the ecosystems in which it is found. The objective of this study is to increase ecological knowledge of this species by evaluating if the Andean bear is a legitimate seed disperser and examining its dietary elements. During July and October of 1988 and April and June of 1999, seeds, plants and Andean bear feces were collected. To determine the effects of ingestion, seed germination and viability were tested. The results suggest that Andean bear is a legitimate dispersing agent of three species of plants: Nectandra cf. cuneatocordata, Symplocos cf. cernua, and Gaultheria vaccinioides, since their seeds were found unharmed and viable after having passed through the bears digestive tract. The seeds from Gaultheria vaccinioides that were consumed by the bear germinated in a similar percentage and time to those of test samples. Likewise, the percentage of viability in Symplocos cf. cernua seeds did not show any differences between those found in feces and those collected from ripe fruits. In the case of Nectandra cf. cuneatocordata seeds the percentage germination was similar to the test samples, but the time for germination of seeds that were extracted from the feces was significantly shorter. The fruits of Gaultheria vaccinioides were also consumed in the study zone by other animals such as birds and Andean foxes (Pseudalopex culpaeus). Comparing the germination of seeds from the fecal samples of these animals with those of bears, it was found that there was no difference in the percentage of germination, but there was in the speed. The seeds consumed by bears and foxes germinated in less time than those consumed by birds. Based on the feces analysis and other indirect food traces, the Andean bears diet in the Apolobamba region in terms of frequency of occurrence consists of 57.5% species from the Bromeliaceae family: Puya atra, Puya sp., Tillandsia rubella; 34.8 % of Gaultheria vaccinioides, Symplocos cf. cernua and Nectandra cf. cuneatocordata fruits; 7.5% of cattle (Bos taurus and Equs caballus), and 1.5 % of birds.
Key words: Seed dispersal, Tremarctos ornatus, Paramo, Cloud forest.
Introducción
El oso andino (Tremarctos ornatus) es el único representante de la familia Ursidae en Sudamérica, está considerado como una especie vulnerable (VU A2bc) por la IUCN (IUCN 2004) en toda el área de su distribución.
Presenta una dieta muy variada, dependiente de la oferta estacional (Peyton 1980), los componentes más importantes de su alimentación son las especies de la familia bromeliáceas, en especial el género Puya, las cuales son esenciales en el ambiente de páramo (Goldstein & Salas 1993). El consumo de esta familia fue encontrado en la mayoría de los estudios como el de mayor porcentaje en términos de frecuencia (Peyton 1980, Mondolfi 1989, Suárez 1988, Azurduy 2000, Troya et al. 2004). Sin embargo, estudios realizados por Castellanos (2004) en el Ecuador sugieren que el bambú (Chusquea spp.) puede ser el recurso alimenticio más importante en la región en base a la alta frecuencia de esta especie en las fecas y por ser un recurso disponible en el bosque todo el a ño.
Los frutos constituyen una parte importante de su dieta, comprendiendo en términos de frecuencia el 58% en Perú (Peyton 1980) y 40% en Venezuela (Goldstein & Yerena 1986). A causa de su alto consumo de frutos y escasez de dispersores de semillas grandes en la fauna actual de las tierras altas de Sudamérica (Janzen & Martin 1982), algunos autores como (Peyton (1983) y Young (1990) han subrayado la necesidad de realizar estudios profundos sobre el rol ecológico que cumpliría el oso andino como dispersor de semillas. Entre algunos reportes sobre este tema se pueden mencionar a Mondolfi (1989) quien encontró en heces del oso en Venezuela semillas germinadas no identificadas de las familias Lauraceae y Myrtaceae y Young (1990) en Perú encontró en algunas heces semillas germinadas de Styrax ovatus (Styracaceae).
El consumo de frutos es común entre las especies carnívoras y en muchos casos las semillas pasan a través del tracto digestivo sin sufrir daños que impidan la germinación (Wilson 1991). Los carnívoros constituyen importantes componentes en el funcionamiento de los ecosistemas dispersando semillas viables lejos de la planta madre (Wilson 1993). La dispersión permite el escape de la semilla a sitios aptos para el crecimiento y el logro de una capacidad reproductiva (Howe & Estabrook 1977), la cual puede ser para la planta: legítima, cuando las semillas son defecadas sanas y viables (Herrera 1989, Bustamante et al. 1992); eficiente si una semilla dispersada por un vector es colocada en un lugar seguro donde germinar, o eficaz, cuando el agente dispersor es el responsable de una importante proporción de plántulas reclutadas (Bustamante & Canals 1995).
Se conoce poco sobre la ecología del oso andino y su rol dentro de los ecosistemas que habita. Por ello, este estudio pretendió contribuir con información para determinar si Tremarctos ornatus constituye un agente dispersor legítimo de semillas, depositándolas sanas y viables, e identificar además la dieta alimenticia para la región de Apolobamba.
Área de Estudio
El área de estudio está ubicada geográfcamente en el noreste del Departamento de La Paz, en el límite fronterizo del Área Natural de Manejo Integrado Apolobamba y el Parque Nacional y AMNI Madidi, en la Cordillera de Apolobamba. El área presenta un rango altitudinal desde los 2.800 m hasta los 4.000 m, abarcando así dos tipos de hábitats: Páramo yungueño y bosque nublado de ceja de Yungas.
El bosque nublado de ceja de Yungas se ubica a una altitud entre los 2.700 a 3.200 m. En esta región las nubes chocan con el bosque generando condiciones muy húmedas; se estima que recibe entre 2.500 a 3.500 mm de precipitación por año y una temperatura promedio anual de 10-14°C (Killeen et al. 1993). Esta región presenta laderas abruptas y profundos valles (Montes de Oca 1997). Los árboles son de porte bajo a mediano, siempre verdes y de hojas coriáceas. Abundan las epífitas, especialmente musgos y líquenes, formando colchones verdes que cubren desde elsuelo hasta las copas de los árboles. Las familias de leñosas más importantes son: Cunoniaceae, Clusiaceae, Ericaceae, Araliaceae, Solanaceae, Symplocaceae, Theaceae, Compositae, Clethraceae, Melastomataceae, Myricaceae (Killeen et al. 1993).
El páramo yungueño se distingue, por encima del bosque nublado de ceja entre los 3.000 y 3.700 m (en algunos casos más de los 3.800 metros), como una formación fragmentada de pajonales altos con islas y franjas de bosquecillos y matorrales de le ñosas siempreverdes. Elementos típicos de esta zona nubosa son las Bambusoideae como Chusquea tessellata (Renvoize 1998), junto con Festuca, Calamagrostis y Stipa que constituyen los géneros de gramíneas dominantes (Killeen et al. 1993).
El área de estudio en total comprende dos quebradas dentro de la Cordillera de Apolobamba, la primera se encuentra a seis horas a pie desde Pelechuco (límite Sur del área 15°12 S y 69° 7 O) y la otra a nueve horas de este pueblo, cerca a la pequeña localidad de Queara (límite Norte del área 15°9 S y 69°7 O).
Método
Trabajo de Campo
Se realizaron cuatro salidas de campo, tres en época seca y una en época húmeda (15 a 30 días cada salida) entre los meses de julio y octubre en 1998 y entre abril y junio en 1999. Se recorrió el área para buscar heces, rastros de alimentación, huellas, nidos, cuevas, siguiendo especialmente los senderos hechos por el animal. Los senderos constituyen el rastro más eficiente para encontrar las heces ya que son claramente reconocibles (Suárez 1985). Con la ayuda adicional de la telemetría realizada por Paisley (2001), se pudo contar con la ubicación aproximada de dos osos con radiocollares y encontrar sus rastros de alimentación. Juntamente a la búsqueda de heces, se recogieron frutos maduros de las especies encontradas en las heces. Así mismo, se recolectaron heces de otros animales (aves y zorros), que contenían las mismas semillas que las muestras del oso.
Las semillas de Gaultheria vaccinioides presentes en las heces llevaban diferentes tiempos de colecta, por lo cual fue importante establecer si la edad de las heces podr ía influir de alguna manera en la germinación de las semillas. Para esta comparación se trabajó con osos en cautiverio (2 individuos, hembra y macho) los cuales fueron alimentados durante una semana con frutos de Gaultheria vaccinioides traidos del campo.
Trabajo de Laboratorio
Una vez secas las heces, los componentes fueron separados. Las semillas fueron sometidas a las mismas pruebas de germinación y viabilidad, que las semillas extraidas de los frutos (muestras control). Ambos grupos se mantuvieron bajo las mismas condiciones controladas de oscuridad, humedad y temperatura (20-25°C) (International Rules for Seed Testing 1985). A las semillas de cada especie se les dio un tratamiento diferente de acuerdo a su forma de vida, ya sea árbol o arbusto. Las semillas de Gaultheria vaccinioides fueron sometidas a pruebas de germinación en un sustrato de algodón en cajas Petri, colocando 50 semillas de cada muestra fecal. Se cuantificó el porcentaje de germinación de las semillas y el tiempo de germinación tanto en las semillas de las heces, (osos silvestres, osos en cautiverio, aves, zorros) como de los frutos (muestras control). Estos datos fueron analizados mediante la prueba estadística de Kruskal-Wallis. Las semillas de Nectandra cf. cuneatocordata fueron envueltas en papel toalla a manera de sustrato, este sustrato es considerado el más apropiado para semillas de árboles (Wrangham et al. 1994). Para esta especie el porcentaje de germinación de las semillas de las heces y de los frutos fue comparada con la prueba de Chi2, mientras
que el tiempo de germinación fue comparado mediante una prueba de Mann-Whitney. Finalmente para el caso de Symplocos cf. cernua, cuyo tiempo de germinación excedía el tiempo del estudio se realizaron pruebas de viabilidad con TTC (Cloruro 2,3,5 Trifenil Tetrazolio al 1%), este reactivo permite identificar las partes vivas de las semillas, que se colorean en rojo (International Rules for Seed Testing 1985.). Para comparar la viabilidad de las semillas en las heces y en las muestras control se utiliz ó la prueba estadística de Chi2. El análisis estadístico de todas las pruebas se realizaron con el paquete computacional STATISTIX for windows 1998, bajo un nivel de rechazo de p=0.05.
Resultados
Legitimidad de la dispersión de semillas
Se colectaron en el campo 66 heces de oso andino, de ellas 23 contenían frutos y semillas, de tres especies: Gaultheria vaccinioides, Symplocos cf. cernua y Nectandra cf. cuneatocordata.
Gaultheria vaccinioides
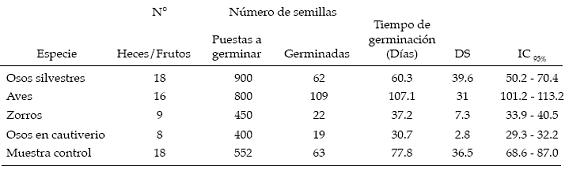
Se encontró que esta especie fue consumida no solo por el oso andino sino también por el zorro andino (Pseudalopex culpaeus) y por aves (Passeriformes). En la tabla 1 se observa el número de heces colectadas, número de semillas puestas a germinar y número de semillas germinadas, por grupo de animal. Se incluyeron en este análisis las semillas consumidas por el oso andino en cautiverio para descartar que el tiempo de conservación (de las semillas antes de someterlas a las pruebas de germinación) pudiera haber afectado viabilidad. El porcentaje de germinaci ón de las semillas no difirió significativamente (gl =4, N = 69, H = 8.5) entre los grupos (p = 0.07). Sin embargo, considerando el tiempo de germinación se advirtió que existe una diferencia significativa (gl = 4, N = 273, H= 105.28) en el tiempo de germinación entre los diferentes grupos analizados (p<0.001). Para establecer las diferencias entre grupos se utilizó la prueba a posteriori de comparación de rangos medios, el cual dio un valor crítico de Z=2.81 (á=0.05). Las semillas de las heces de los osos silvestres, zorros y muestras control no mostraron una diferencia significativa en el tiempo de germinación, al contrario de la diferencia que demostraron las semillas provenientes de heces de aves y osos en cautiverio (ver tabla 2).
Symplocos cf. cernua
Se encontró una sola hez con semillas de esta especie. Cada una de las semillas tenía más de un embrión por lo que la prueba de viabilidad fue realizada a un solo embrión, por semilla. De 70 embriones de la muestra fecal, 32 (45.7%) dieron resultados positivos a la prueba de rojo de tetrazolio (viables) y de los 63 embriones de las muestras control 27 dieron positivo (42.8%). No existieron diferencias significativas entre ambos grupos (X2 = 0.33 y á > 0.05).
Tabla 1: Porcentaje y tiempo de germinación de las semillas extraidas de las heces.
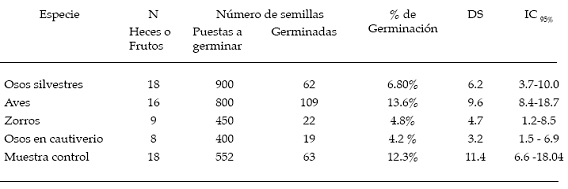
Tabla 2: Tiempo que demoraron las semillas en germinar (días).
Nectandra cf. cuneatocordata
Se colectaron 5 heces con 214 semillas en total. De este grupo de semillas germinaron 112 (52.3%), mientras que de 103 semillas de los frutos (muestras control) el número de semillas germinadas fue de 52 (50.4%). Estos porcentajes de germinación entre los dos tratamientos no tuvieron diferencias significativas (X2 = 0.14; á> 0.05). En contraste el tiempo de germinación difiere significativamente (U = 12.5; p<0,001). Las semillas de las heces de oso germinaron en un promedio de 17.3 días (DS = 3.1; IC95% [16.7-17.8]) y de los frutos en 45.4 días (DS = 10.2; IC95% [42.5-48.3]).
Dieta
El ítem alimenticio más frecuente registrado fue el de bromeliáceas (Puya atra, Tillandsia rubella: epífita, Puya sp.), se encontraron restos vegetales en las heces, como fibras y hojas. Otra parte importante de su dieta es el consumo de frutos carnosos de tres especies de plantas: Gaultheria vaccinioides (Ericaceae), Symplocos cf. cernua. (Symplocaceae) y Nectandra cf. cuneatacordata (Lauraceae), cuyas semillas se encontraron junto con hojas y frutos de las mismas especies. Un
porcentaje menor fue el consumo de ganado vacuno y equino (Bos taurus, Equs caballus), cuyos pelos aparecieron en las heces, al igual que las plumas de un ave (no identificada) (ver tabla 3).
Discusión
Legitimidad de la dispersión de semillas
Los resultados de este estudio sugieren que el paso de las semillas por el tracto digestivo del oso andino no afectó la viabilidad de las mismas. No se observaron diferencias significativas en el porcentaje de germinación de las semillas de las heces y de frutos, tanto para Gaultheria vaccinioides como para Nectandra cf. cuneatocordata. Así mismo no se identificaron diferencias en el porcentaje de viabilidad entre ambas pruebas en las semillas de Symplocos cf. cernua.
Las semillas al ser sometidas al proceso de digestión sufren efectos tanto mecánicos de corte y trituración que realizan los dientes, como procesos químicos que reducen los alimentos a unidades pequeñas y absorbibles gracias a las enzimas (Hickman et al. 1998). Las semillas de Gaultheria vaccinioides al ser lisas, duras y no
Tabla 3: Composición de la dieta del osos andino en la región de Apolobamba.

Sin embargo, para las semillas de Nectandra cf. cuneatocordata, este proceso digestivo permitió a las semillas germinar en un tiempo significativamente menor a las muestras control. En caso de la endocoria, la germinación puede adelantarse en tiempo debido a que puede interrumpirse la dormancia o se puede afectar la viabilidad de la semilla (Dirzo & Domínguez 1986, Vásquez-Yañes & OrozcoSegovia 1986, Stiles 1992). En este caso, se cree que la reducción en el tiempo de germinación se debió a que las semillas encontradas en las heces no presentaban pericarpio, el cual pudo ser removido durante la masticación, considerando su tamaño relativamente grande (ca. 3 cm) como para escapar de este proceso. La liberación del pericarpio pudo ser un factor facilitador de la germinación de estas semillas. Bustamante et. al. (1993) encontraron que el pericarpio removido por frugívoros en semillas de Cryptocarya alba, una especie de la misma familia que N. cf. cuneatocordata (Lauraceae) incrementa la cantidad y rapidez de la germinación.
Es importante mencionar que para el caso de Nectandra cf. cuneatocordata y Symplocos cf. cernua las réplicas analizadas fueron las semillas y no así el número de heces como en el caso de Gaultheria vaccinioides. Esto nos puede llevar a pensar en posibles pseudo réplicas. Sin embargo, estos datos permitieron conocer a mayor detalle el efecto del proceso digestivo del oso andino sobre el estado vital de las semillas. Por ello y a pesar de contar con un número reducido de heces con semillas, es posible bajo la definición que un dispersor legítimo por endocoria es aquel que defeca semillas sanas y viables (Herrera 1989, Bustamante et al. 1992), sugerir al oso andino como un dispersor legítimo para las semillas de las tres especies de plantas analizadas.
Tremarctos ornatus no sería el único úrsido capaz de dispersar semillas. Se conoce que el oso negro (Ursus americanus) y el oso pardo (U. arctos) son considerados como importantes dispersores de semillas en Norteamérica (Krefting & Roe 1949, Applegate et al. 1979, Maehr 1983, Traveset & Wilson 1997). Dependiendo de las especies ingeridas, la endocoria podría aumentar el porcentaje de germinación de las semillas o bien no tener mayor efecto (Garshelis 1983).
Un aspecto importante en la dispersión de semillas por carnívoros es su alta movilidad y amplio rango de recorrido, pudiendo transportar las semillas a considerable distancia (Wilson 1993). El oso andino recorre largas distancias al día, en Perú se encontró que el área mínima vital para esta especie es de 250 ha (Peyton 1983) y Castellanos (2004) encontró en el Ecuador que para un macho es de 66.62 km2 y para una hembra 14.37km2 (1km2= 100 ha). Así mismo, en la zona de Apolobamba, área de estudio de esta investigación, Paisley (2001) encontró que el valor mínimo del ámbito de hogar es de 739.5 ha para un subadulto y 709.2 ha para una adulto. Considerando este ámbito de hogar, es posible que el oso andino en su largo recorrido transporte las semillas a nuevos sitios de colonización. Sin embargo, a pesar de su preferencia de hábitat por el páramo y el bosque húmedo montano (Ríos et al. 2006), esta especie se mueve en diferentes pisos altitudinales, abarcando diferentes ecosistemas (Peyton 1980, Suarez 1985, Paisley 2001), por lo que las semillas podrían ser depositadas en condiciones ambientales muy distintas a las que las plantas necesitan para sobrevivir.
Comparación con otras especies
Las semillas de Gaultheria vaccinioides fueron encontradas en heces de otras especies como aves y zorros andinos. El consumo de estos frutos por aves y roedores fue reportado por Luteyn (1995), el cual indica que estos animales son atraidos por su color brillante y lo carnoso del fruto. Así mismo, Rechberger (1999) menciona que para la región de Lambate (Bolivia) G. vaccinioides es parte de la dieta del zorro andino (Pseudalopex culpaeus). Los frutos de esta especie son además consumidos por los pobladores de la zona y vendidos en sus tiendas locales (obs. pers.).
El porcentaje y tiempo de germinación de las semillas de las heces del oso y zorro no fue estadísticamente diferente entre ellos ni con las muestras control. Es probable que osos y zorros al ser ambos carnívoros causen durante el proceso digestivo un efecto similar en las semillas de G. vaccinioides. Sin embargo, comparando las semillas de las heces de las aves con aquellas provenientes de aves tardaron mucho m ás tiempo. Estudios similares realizados en Norteamérica con osos (Ursus americanus y U. arctos) y aves mostraron diferentes efectos en la germinación dependiendo de la especie ingerida (Traveset & Wilson 1997). Algunos factores determinaron estas diferencias, por ejemplo el tamaño de la semilla, el espesor de la cubierta de la semilla, el contenido químico de la pulpa del fruto y la composición nutricional del alimento ingerido. Así mismo, los distintos tiempos de retención de las semillas en el sistema digestivo. El efecto del tracto digestivo en la germinación de las semillas fue similar entre osos de Norteamérica y aves; sin embargo, el efecto en el establecimiento es algo diferente porque el número y la densidad de las semillas en las heces difieren enormemente (Traveset & Wilson 1997).
Si bien este estudio solo consideró la viabilidad de las semillas, se observó unagran diferencia en el número de semillas encontradas en las heces de los tres animales. Se encontró un promedio mayor a 15000 semillas por cada deposición en heces de oso y de aproximadamente 100 semillas en heces de aves, lo cual podría sugerir que después de la germinación las plántulas compiten por los recursos. Altas densidades de semillas incrementan la competencia y las vuelven susceptibles a la depredación (Traveset & Wilson 1997). Se sugiere realizar más estudios sobre el rol ecológico del oso andino, que consideren analizar, no solo su legitimidad como dispersor sino su eficiencia o quizás eficacia.
Dieta
La importancia de las bromeliáceas en la dieta fue reportada por la mayoría de los trabajos realizados con esta especie (Peyton 1980, Suarez 1988, Azurduy 2000). Las especies de esta familia, en especial el género Puya son de mucha importancia en la dieta del oso (Peyton 1980, Goldstein & Salas 1993).
Es probable que el oso andino en la región de Apolobamba se alimente de otras especies de frutos considerando que algunas de las especies reportadas en los estudios previos están presentes en el área como es el caso de Pernettya prostrata (Peyton 1980, Suárez 1988, Azurduy 2000) y Vaccinium floribundum (Azurduy 2000).
Si bien el oso andino es mayormente vegetariano, los animales son parte de su dieta aunque en un menor porcentaje como muestra este trabajo y otros estudios (Peyton 1980, Azurduy 2000). Aproximadamente el 7% de la dieta consistió en presas de ganado. Si bien, existe un trabajo en el Ecuador, que confirma el ataque del oso al ganado, en este estudio no se pudo determinar si el oso mató a los animales que consumió o si actuó como carroñero. Sin embargo, los lugareños aseguran que el oso andino es el que mata su ganado, siendo un peligro incluso mayor que el puma.
Conclusiones
Las semillas sanas y viables de Gaultheria vaccinioides, Nectandra cf. cuneatocordata y Symplocos cf. cernua, después de ser consumidas por el oso andino sugieren un rol ecológico de Tremarctos ornatus como dispersor legítimo de estas especies. El porcentaje de germinación y el tiempo no se vieron afectados en las semillas de Gaultheria vaccinioides que atravesaron el tracto digestivo del oso andino. El paso de las semillas de Nectandra cf. cuneatocordata a través del sistema digestivo afectó la velocidad de germinación, germinando en menor tiempo. Gaultheria vaccinioides es consumida también por otras especies como ser: zorros andinos (Pseudalopex culpaeus) y aves passeriformes en la región, las cuales depositan de igual forma semillas viables, sugiriendo ser dispersores legítimos.
La dieta del oso andino fue básicamente vegetariana incluyendo bromelias: Puya atra, Puya sp., Tillandsia rubella; frutos de Gaultheria vaccinioides, Nectandra cf. cuneatocordata y Symplocos cf. cernua; y en menor porcentaje animales, como ganado y aves.
Agradecimientos
Quiero expresar mi más profundo agradecimiento a todas las instituciones y personas que han colaborado en la elaboración de esta investigación: al Instituto de Ecología, Laboratorio de Semillas La Paz, Herbario Nacional de Bolivia, Wildlife Conservation Society, Alejandra Roldán, Sussana Paisley, Emilia García, Raul Rivadeneira, Carmen Canedo, Alvaro Villegas, Humberto Gómez, Luis Pacheco, Ramiro Bustamante, Javier Simonetti, Rene Pari, Natalia Trepp, Josef Rechberger y Javier Flores.
Referencias
1.- Azurduy, C. 2000.Variación y composición alimentaria del oso andino (Tremarctos ornatus Cuvier, 1825) en época seca y lluviosa en la cuenca alta del río Cañón y zonas adyacentes. Tesis de grado para licenciatura en biología, Universidad Mayor de San Simón, Cochabamba. 74 p. [ Links ]
2.- Applegate, R., L. Rogers, D. Castell & J. Novak. 1979. Germination of cow parsnip from gryzzly bear feces. Journal of Mammalogy 60(3): 655. [ Links ]
3.- Bustamante, R., J. Simonetti & J. Mella. 1992. Are foxes legitimate and effcient seed dispersers? A feld test. Acta Ecologica 13(2): 203-208. [ Links ]
4.- Bustamante, R., A. Grez, J. Simonetti, R. Vásquez & M. Walkowiak. 1993. Antagonistic effects of frugivores on seeds of Cryptocarya alba (Mol) Looser (Lauraceae): consequence on seedling recruitment. Acta ecológica 14(6): 739- 745. [ Links ]
5.- Bustamante, R. & M. Canals 1995. Dispersal quality in plants: how to measure effciency and effectiveness of a seed disperser. Oikos 73(1):133-136 [ Links ]
6.- Castellanos A. 2004. Andean bear research in the Intag region, Ecuador. International Bear News, Quarterly Newsletter of the International Association for Bear Research and Management (IBA) and the IUCN/SSC Bear Specialist Group 13(2): 25-26. [ Links ]
7.- Dirzo, R. & C. A. Dominguez.1986. Seed shadow, seed predation and the advantages of dispersal. Pp. 237-249. En: Estrada, A. & Fleming,T. H. (eds). Frugivores and seed dispersal. Junk, Dordrecht. [ Links ]
8.- Garshelis, D. 1983. Dispersal of fruit seeds by the black bear. Journal of Mammalogy 64(2): 310-311. [ Links ]
9.- Goldstein, I. & E. Yerena 1986. Patrones de utilización del páramo por Tremactos ornatus. Programa Científco y Resúmenes de Simposios y Comunicaciones Libres del X Congreso Latinoamericano de Zoología, Viña del Mar. [ Links ]
10.- Goldstein, I. & L. Salas. 1993. Patrón de explotación de Puya sp. (Bromeliaceae) por Tremarctos ornatus (Ursidae) en el páramo El Tambor, Venezuela. Ecotropicos 6(2): 1-9. [ Links ]
11.- Herrera, C. 1989. Frugivory and seed dispersal by carnivorous mammals and associated fruit characteristics, in undisturbed mediterranean habitats. Oikos 55: 250- 262. [ Links ]
12.- Hickman C.P, Jr. L. S. Roberts & A. Larson. 1998. Principios integrales de zoología. Mac Graw-Hill-Interamericana. Madrid. 921 p. [ Links ]
13.- Howe, H. & G. Estabrook. 1977. On intraspecifc competition for avian dispersers in tropical trees. The American Naturalist 111(981): 817-832 . [ Links ]
14.- ISTA (International Rules for Seed Testing Association). 1985. Seed Science and Technology 13(2), Zürich, 153 p. [ Links ]
15.- Janzen, D. & P. Martin. 1982. Neotropical anachronisms: what the Gomphotheres ate. Science 215: 19-27. [ Links ]
16.- Killen, T., E. Garcia & S. Beck (eds).1993. Guía de árboles de Bolivia. Herbario Nacional de Bolivia-Missouri Botanical Garden. Quipus S.R.L., La Paz Bolivia. 958 p. [ Links ]
17.- Krefting, L. & E. Roe. 1949. The role of some bird and mammals in seed germination. Ecological Monographs 19: 271-286. [ Links ]
18.- Luteyn, J. (ed). 1995. Ericaceae. Part II, the superior ovaried genera. Flora Neotropica, Monograph 66: 1-560. Maehr, D. 1984. Black bear as seed disperser in Florida. Florida Field Naturalist 12: 40-42. [ Links ]
19.- Mondolf, E. 1989. Notes on the distribution, habitat, food habitats, status and conservation on the Spectacled Bear (Tremarctos ornatus Cuvier) in Venezuela. Mammalia 53 (4): 525-543. [ Links ]
20.- Montes De Oca, I. 1997. Geografía y recursos naturales de Bolivia. EDOBOL, La Paz. 614 p. [ Links ]
21.- Paisley, S. 2001. Andean bear and people in Apolobamba, Bolivia: culture, conflict and conservation. Tesis de de doctorado. University of Kent, Canterbury. 352 p. [ Links ]
22.- Peyton, B.1980. Ecology, distribution, and food habits of spectacled bears, Tremarctos ornatus, in Peru. Journal of Mammalogy 61(4): 638-652. [ Links ]
23.- Peyton, B. 1983.Uso de hábitat por el oso frontino en el santuario histórico de Machu Pichu y zonas adyacentes en el Perú. pp. 23-30. En: Simposio de Conservación y Manejo de Fauna Silvestre Neotropical, IX Congreso Latinoamericano de Zoología, Arequipa. [ Links ]
24.- Rechberger, J.1999. Patrones de movimiento y dieta alimenticia del zorro andino (Pseudalopex culpaeus) en el cantón Lambate, Prov. Sud Yungas, del departamento de La Paz. Tesis para optar al título de licenciatura en biología. Universidad Mayor de San Andrés, La Paz. 86 p. [ Links ]
25.- Renvoize, S. 1998. Gramíneas de Bolivia. The Royal Botanic Gardens, Kew. 642 p. [ Links ]
26.- Ríos-Uzeda, B., H.Gómez & R.B.Wallace. 2006. Habitat preferences of the Andean bear (Tremarctos ornatus) in the Bolivian Andes. Journal of Zoology 268: 271–278. [ Links ]
27.- Stiles, E. 1992. Animals as seed dispersers. p. 87-104. En: Fenner, M. (ed.). Seeds. The Ecology of Regeneration in Plant Communities. CABI Publishing, Wallingford, Oxon. [ Links ]
28.- Suárez, L.1985. Hábitos alimenticios y distribución estacional del oso de anteojos, en el páramo Suboriental de Volcán Antisana, Ecuador. Tesis previa a la obtención del título de licenciado en ciencias biológicas, Pontificia Universidad Católica del Ecuador, Quito. 60 p. [ Links ]
29.- Su árez, L. 1988. Seasonal distribution and food habits of spectacled bears Tremarctos ornatus in the highlands of Ecuador. Studies on Neotropical Fauna and Environment 23(3): 133-136. [ Links ]
30.- Traveset A. & M. Wilson.1997. Effect of birds and bears on seed germination of feshyfruited plants in temperate rainforest of southeast Alaska. Oikos. 80: 89-95. [ Links ]
31.- Troya V., F. Cuesta & M. Peralvo. 2004. Food habitat of Andean bears in the Oyacachi River Basin Ecuador. Ursus 15(1): 57- 60. [ Links ]
32.- IUCN 2004. 2004 IUCN Red list of threatened species. <www.iucnredlist.org>. 04 enero 2008. [ Links ]
33.- Vasques-Yañes C. & A. Orozco-Segovia. 1986. Dispersal of seed by animals: effect on light controlled dormancy in Cecropia obtusifolia. p. 71-77. En: Estrada, A. & T.H. Fleming (eds.) Frugivores and Seed Dispersal. Junk, Dordrecht. [ Links ]
34.- Wilson, M. 1991. Dispersal of seeds by frugivorous animals in temperate forests. Rev. Chilena de Historia Natural 64: 537-554. [ Links ]
35.- Wilson, M. 1993. Mammals as seed-dispersal mutualists in North America. Oikos Copenhagen 67: 159-176. [ Links ]
36.- Wrangham R., C. Chapman & L. Chapman. 1994. Seed dispersal by forest chimpanzees in Uganda. Journal of Tropical Ecology 10: 355-368. [ Links ]
37.- Young, K. 1990. Dispersal of Styrax ovatus seeds by the spectacled bear(Tremarctos ornatus).Vida Silvestre Neotropical 2(2): 68-69. [ Links ]
Artículo recibido en: Octubre de 2007
Manejado por: Lilian Painter
Aceptado en: Enero de 2008












 uBio
uBio 

