Ecología en Bolivia
versão impressa ISSN 1605-2528versão On-line ISSN 2075-5023
Ecología en Bolivia v.43 n.1 La Paz 2008
original
Variaciones fenológicas de especies de Podocarpaceae en estación
seca de los Yungas (Cochabamba, Bolivia)
Phenological variations of species Podocarpaceae in dry season
in the Yungas (Cochabamba, Bolivia)
Ariel I. Ayma-Romay, E. S. Sanzetenea
Escuela de Ciencias Forestales, Universidad Mayor de San Simón, A. P. 447, Cochabamba, Bolivia.
e-mail: nuestros_montes@yahoo.es, e.sanzetenea@umss.edu.bo.
Dirección actual: Programa Regional de Ecosistemas Forestales Nativos Andinos – ECOBONA,
Cochabamba, Bolivia. e-mail: ariel.isaias.aymar@gmail.com
Resumen
Los árboles de Podocarpaceae son propios de las montañas tropicales. En Cochabamba se distribuyen formando pequeños remanentes de bosque, bajo diferentes tipos de clima. Se estudió la variación de fenofases reproductivas de cuatro especies de coníferas nativas Podocarpus parlatorei, P. glomeratus, P. oleifolius y Prumnopitys exigua en cuatro localidades, durante el periodo seco de 2006. También se analizó la influencia de luz y el tamaño del árbol sobre la dispersión de semillas. Los resultados sugieren que las especies de Podocarpus sincronizan su dispersión de semillas y liberación de polen alrededor de la época seca, en cambio Prumnopitys no. En sitios más secos las especies Podocarpus son más activas reproductivamente; aumentando la densidad de individuos reproductivos, intensidad de las fenofases reproductivas y sincronización entre individuos de las poblaciones. La influencia del tamaño de los árboles y la posición de su copa en el dosel, es un factor relativo en la dispersión de semilla; algunos responden al efecto y otros no. La alta variabilidad sugiere mayores estudios para comprender la ecología de estas especies.
Palabras clave: Dispersión semillas, Sincronización, Podocarpus, Prumnopitys.
Abstract
The native trees of Podocarpaceae are found in the mountainous tropics, or Yungas, of Cochabamba in a variety of different climate types. We studied the variation of reproductive phenophases of four conifers, Podocarpus parlatorei, P. glomeratus, P. oleifolius and Prumnopitys exigua, in four sites over the dry season in 2006. We also analyzed the influence of light and tree size on seed dispersal. The results suggest that Podocarpus spp. synchronize the period of seed dispersion and pollen release in the dry season, whilst Prumnopitys does not. At drier sites Podocarpus individuals are more reproductively active, increasing the abundance of reproductive individuals, the intensity of the reproductive phenophases and the synchronization among individuals. The influence of size and position of trees on seed dispersal is relative and variable within species of Podocarpus. The high variability underlines the need for more studies to understand the ecology of these species.
Keywords: Seed dispersal, Synchronization, Podocarpus, Prumnopitys.
Introducción
Los bosques de Podocarpaceae cumplen valiosos servicios ambientales y socioeconómicos en ecosistemas montanos húmedos (Anze 1993, Zarate et al. 1999). Protegen las principales fuentes de agua para comunidades locales, aportan materia orgánica al suelo y proporcionan excelente leña y madera para las poblaciones. Debido a su larga historia de tala irracional, la mayoría se encuentran en estado en peligro y vulnerable a la extinción (Meneses & Beck 2005). Desde este punto de vista, la fenología podría proporcionar valiosos conocimientos sobre su comportamiento, las cuales pueden ser aplicadas en acciones de conservación y manejo forestal.
Se sugiere que los patrones fenológicos en bosques montanos tropicales con clima estacional, se organizan en torno a la estación seca, que se forma debido a la reducción de las precipitaciones verticales (Frankie et al. 1974, Hilty 1980, Borchert 1983, Brown 1986, Kaul et al. 1986, Brown 1995). Se ha observado, que la existencia de un periodo seco durante el año favorece significativamente la sincronización y floración de especies arbóreas (Augspurger 1990, Borchert et al. 2004). Incluso se da en algunos casos también la producción de semillas de especies arbóreas, p.e.: Cedrela lilloi en bosques montanos del norte de Argentina (Brown 1995), Araucaria angustifolia en Brasil (Mantovani et al. 2004) o Podocarpus parlatorei en los bosques montanos de Ayopaya (Peña & Morales 1999).
La floración de muchas especies presenta un patrón más regular que la fructificación. Algunos sugieren que la escasez de precipitación estimula directamente la formación de estructuras florales, tanto en bosques tropicales de tierras bajas (Reich & Borchert 1984, Justiniano & Fredericksen 2000) como la floración en bosques montanos (Kikim & Yadava 2001, Aguilar 2004, Pino & Mosquera 2004). Sin embargo, enbosques tropicales la producción de frutos ó semillas es altamente variable en espacio y tiempo, incluso en ambientes casi uniformes (Terborgh 1986). La relación de la ocurrencia de frutos y semillas con la estacionalidad de las precipitaciones es controversial; generalmente en época seca, algunos bosques montanos húmedos manifiestan pequeñas ocurrencias de producción de frutos y dispersión de semillas (Roldán & Larrea 2003, Pino & Mosquera 2004), siendo más regular la fructificación en periodos lluviosos (Camacho & Orozco 1998, Roldán & Larrea 2003). Sin embargo, en otros bosques montanos se muestran altos picos de fructificación (Leigh & Windsor 1985, Sobral & Machado 2001, Stevenson 2004).
Si bien los bosques tropicales tienen estas tendencias, se ha comprobado la baja sincronización de la floración (Janzen 1967, Newstrom et al. 1994, San Martin & Morellato 2003) y la fructificación a nivel de poblaciones e individuos de la misma especie. Los factores más sobresalientes que inducen estas variaciones son: a) Distancia entre las poblaciones, caso Podocarpus totara (Bergin & Kimberley 1992), b) factores endógenos entre individuos (Borchert 1983, San Martin & Morellato 2003), c) diferentes estrategias de dispersión de semillas asociados a patrones alimenticios de predadores y dispersores (Janzen 1971), d) periodicidad de ocurrencia de flores y / o frutos entre años (Newstrom et al. 1994), e) tamaño del árbol (Rozo & Parrado 2004), f) limitaciones en la disponibilidad de luz (Newstrom et al. 1994, Richards 1996, Pinard et al. 1999) y g) oscilaciones en la intensidad de radiación solar (Wright & van Schaik 1994, Berlin et al. 2000).
En cuanto a la fructificación y la floración de algunas especies de Podocarpus se sugiere que la dispersión de semillas es anual, intermedia entre dos y cuatro meses, con muy escasa producción de semillas (Peña & Morales 1999, Ayma-Romay 2005). En P. glomeratus se ha observado que la baja productividad de semillas se debe a la alta depredación de semillas por loros (Aratinga mitrata), la infestación de la semilla por hemípteros, el aborto de los óvulos en época seca y la baja densidad de árboles productores de semillas (Ayma-Romay 2005). Por otra parte, su floración corresponde al desarrollo de estróbilos femeninos (ginoestróbilos) y masculinos (androestróbilos), los cuales generalmente ocurren con valores de >50% de forma extendida y continua durante todo el año. La liberación de polen coincide con el inicio de estructuras femeninas, siendo breve y abundante durante la época seca (Ayma-Romay 2005).
El objetivo de este trabajo fue proporcionar datos sobre la dinámica de fenofases reproductivas de cuatro especies de la familia Podocarpaceae: Podocarpus parlatorei, P. glomeratus, P. oleifolius y Prumnopitys exigua en cuatro diferentes provincias biogeográficas de los Yungas de Cochabamba durante la época seca. Se analizó la fenología entre especies y poblaciones, sincronización entre individuos, localidades y la influencia del tamaño del árbol y la disponibilidad de la luz sobre la dispersión de semillas.
Área de estudio
El estudio se realizó en las localidades de Pajchanti, Villa Naranjitos, Jukumari y Meruvia del departamento de Cochabamba; éstas se ubican en cuatro diferentes provincias biogeográficas de los Yungas, denominadas Yungas del Cotacajes, Yungas del Amboró, Yungas del Altamachi-Corani y Yungas del Chapare respectivamente, todas muy contrastantes en cuanto a condiciones climáticas (Navarro 2005). Las comunidades de Villa Naranjitos y Meruvia se encuentran al lado Sur del Parque Nacional Carrasco y las otras dos se encuentran en territorios comunales de campesinos (Fig. 1).
Si se analizan los registros de precipitación de estaciones climatológicas próximas a las localidades del Servicio Nacional de Meteorología (SENAMHI Regional Cochabamba), se observa claramente que durante cinco a seis meses del año (mayo – octubre), en todas las localidades se reduce considerablemente la precipitación pluvial, estableciendo claramente una época seca (Tabla 1). Sin embargo, algunas localidades tienen un periodo seco más intenso que otras. Por consiguiente, se agrupó el área de estudio en localidades más húmedas, denominadas de época seca intermedia y localidades más secas, denominadas de época seca marcada. De acuerdo a esta agrupación, las localidades de Jukumari y Meruvia pertenecerían a la primera y las localidades de Pajchanti y Villa Naranjitos a la segunda. Las dos primeras (Meruvia y Jukumari), son localidades que acumulan tres veces mayor precipitación vertical durante el año que las localidades más secas. Además presentan mayor frecuencia de nubes durante el día y noche, lo que reduce la radiación solar, incrementa la humedad del suelo por la caída de gotas de agua, al condensarse la niebla y reduce la evapotranspiración. Todo lo contrario ocurre en las localidades de época seca marcada, donde las nubes son poco frecuentes durante el día y la noche, la precipitación es menos abundante, la radiación solar es más intensa, existe menos humedad en el suelo y mayor estrés hídrico en las plantas (Tabla 1).
Los remanentes de las poblaciones de Podocarpus spp. y Prumnopitys exigua fueron muy difíciles de ubicar, básicamente debido a que la mayoría de las zonas exploradas presentaba individuos aislados en largas distancias, a consecuencia de la fuerte presión humana de tala y chaqueo. Las áreas seleccionadas fueron las que todavía mejor conservan su estructura, sin embargo, se encuentran en lugares lejanos, muy poco accesibles, de pendientes fuertes, a 4-5 horas de caminata de las rutas de transporte terrestre.
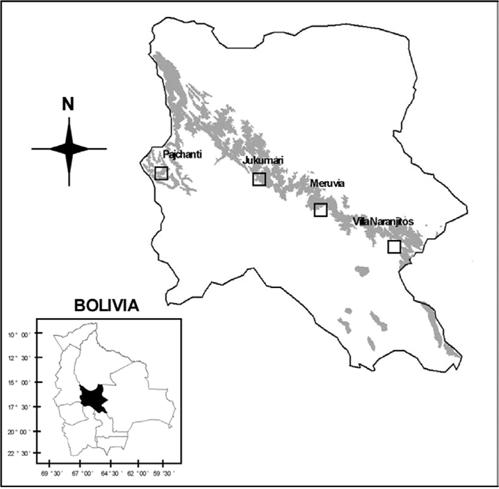
Fig. 1: Ubicación de las cuatro localidades de estudio en el departamento de Cochabamba. Las manchas oscuras representan la distribución potencial de bosques montanos húmedos con presencia de especies de Podocarpaceae (Navarro 2005).
Métodos
Ubicación y marcación de árboles
En mayo de 2006 se encontraron pequeños relictos de poblaciones de Podocarpus spp. y Prumnopitys exigua (Tabla 1), generalmente dominantes y mezcladas con especies arbustivas y arbóreas de latifoliadas. En
las áreas seleccionadas, se determinaron sitios donde los individuos se encontraban más cercanos unos a otros. Luego elegimos y marcamos todos los árboles mayor a seis cm de diámetro de fuste a una altura de 0.5 m del suelo, independientemente de su sexo - caso Podocarpus - estado fenológico, tamaño del árbol y exposición de la copa respecto al sol.
Observación de fenofases
Las observaciones se realizaron mensualmente para cada una de las poblaciones. Las observaciones desde el suelo se realizaron con la ayuda de unos binoculares Bushnell (7 x 35), la distancia de observación para cada individuo fue de 3-7 m de su fuste, según el tamaño del árbol. Para tener una mejor valoración de las fenofases, observamos la copa del árbol girando por todo su alrededor, con el propósito de evitar valorar sólo una parte del árbol. Cuando existía duda o poca visualización de las estructuras reproductivas, se recolectó y verificó el desarrollo de las estructuras directamente desde las ramas y trepando a cada árbol.
En especies de Podocarpus se identificaron seis fenofases. En árboles femeninos: a) Ginoestróbilo <50% (epimacio verde < 0.25 cm de tamaño con un polvo blanquecino en la superficie), b) ginoestróbilo >50% (epimacio > 0.25 cm y menor a 0.5 cm, acompañado de un pseudofruto verde duro), c) dispersión de semillas (epimacio verde acompañado de un pseudofruto de consistencia blanda, color rojo, morado o negro); por otra parte, en árboles masculinos:
d) inicio de formación de androestróbilos (androestróbilo parecido a botones florales pequeños < 0.25 cm de consistencia frágil con un polvo blanquecino en la superficie),
e) androestróbilo en latencia (estructura de tamaño doble del anterior y con escamas cerradas) y f) androestróbilo con dispersión de polen (de uno a 1.5 cm de largo, con escamas parcialmente o totalmente abiertas con abundante polen). En Prumnopitys exigua el tamaño máximo del ginoestróbilo fue de 1 cm, la presencia de un arilo carnoso amarillo en el estróbilo indicó la ocurrencia de dispersión de semilla y las estructuras masculinas fueron 1/3 más pequeños que en Podocarpus (Fig.2).
Evaluación de los patrones fenológicos
Durante cinco meses (junio a octubre de 2006), se determinó el porcentaje de intensidad de las fenofases, relacionando el porcentaje del espacio de la copa del árbol con el espacio que ocupan las estructuras reproductivas de una o varias fenofases (Fournier 1978); dependiendo de esta proporción se asignó valores de cero a diez. Debido a que las especies tenían más de una fenofase por individuo, la suma de los valores no excedió de diez.
En cada evaluación fenológica se calificó a) El estado fenofásico de los árboles reproductivos y vegetativos dependiendo su condición; se consideraron árboles reproductivos, aquellos que presentaron estructuras reproductivas en cualquier estado de desarrollo en algún momento dado y árboles vegetativos aquellos que presentaron sólo follaje. b) La ocurrencia o no ocurrencia de dispersión de semillas de cada individuo se consideraron árboles en dispersión de semillas cuando presentaban algunos ginostróbilos con pseudofruto dulce (en Podocarpus) y arilos carnosos amarillos (en Prumnopitys exigua). c) La influencia de la luz en la dispersión de semillas en árboles con mayor y menor exposición solar, los primeros fueron aquellos árboles dominantes en el estrato del dosel del bosque y otros árboles pequeños en áreas abiertas de pastizales y matorrales; y los segundos fueron los que tenían copa codominante en el dosel del bosque y los que se encuentran debajo del dosel.
Análisis de datos
Para representar la intensidad de las fenofases reproductivas de las especies, localidades e individuos se sacó un porcentaje promedio de los valores registrados de cero a diez, de todos los individuos reproductivos, descartando los que permanecieron vegetativos. Para caracterizar la asincronía de la población entre los individuos reproductivos y vegetativos, se
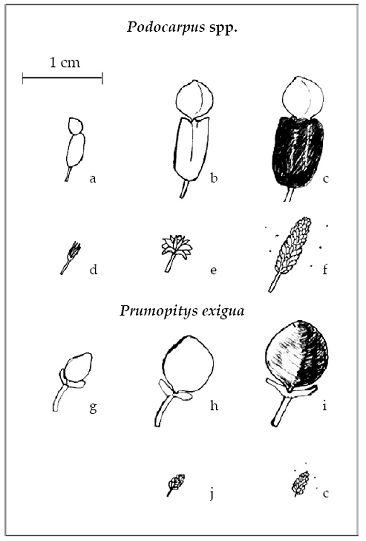
Fig. 2: Fenofases observadas en Podocarpaceae. Podocarpus spp.: a) Ginoestróbilo <50%, b) ginoestróbilo >50%, c) dispersión de semilla, d) inicio de formación de androestróbilo, e) androestróbilo en latencia, f) liberación de polen. Prumopitys exigua: g) ginoestróbilo <50%, h) ginoestróbilo >50%, i) dispersión de semilla, j) androestróbilo en latencia, k) androestróbilo con liberación de polen obtuvó para cada mes, la densidad relativa del número de individuos reproductivos en proporción a los vegetativos.
Con un análisis de regresión logística múltiple al 95% de nivel de confianza, se analizó la influencia de la exposición de la copa y el tamaño del árbol sobre la dispersión de semillas. El diámetro de fuste fue medido en cm. La exposición solar fue categorizada (menor exposición= 0; mayor exposición= 1), al igual que la dispersión de semillas (ausencia de semillas= 0; y presencia de semillas= 1).
Resultados
Patrones de estróbilos y dispersión de semillas
La fenofase de ginoestróbilos <50% en los Podocarpus y Prumnopitys fue diferente. En P. parlatorei se mostró un claro pico a fines de época seca (8%) con una duración de tres meses, los otros Podocarpus no presentaron esta fenofase. Por otra parte, ésta fenofase en Prumnopitys exigua mostró de forma continua a extendida durante los cinco meses de la época seca, sin tendencias claras de picos (<12%).
La fenofase de ginoestróbilos >50% en Podocarpus spp. y Prumnopitys exigua se manifestó de manera continua durante toda la estación seca, sin mostrar altos picos. Se observó valores de 10-40% para P. parlatorei, P. glomeratus y Prumnopitys de las de época seca marcada y de manera más escasa (<15%) en las de época seca intermedia.
Existen diferencias en la dispersión de semillas entre Podocarpus spp. y Prumnopitys exigua. La dispersión de P. glomeratus y P. parlatorei en las localidades de estación seca marcada es anual con duración intermedia de 2-4 meses, con un pico de 10-25% a la mitad de la época seca. Por otra parte, P. oleifolius y P. glomeratus de las localidades con época seca intermedia no mostraron ningún signo de dispersión. Por otro lado, Prumnopitys exigua no muestra diferencias de patrón entre localidades, sugiriendo un patrón anual extendido (>cinco meses), ofertando semillas de regular manera (<15%) durante toda la época seca.
El inicio de androestróbilos sólo se manifestó en P. parlatorei, siendo de tres meses a principios de estación seca con un máximo del 38%. Posteriormente esta fenofase desapareció, ya que al desarrollarse en tamaño, dio paso a la fenofase de androestróbilo en latencia.
Los androstróbilos en latencia de P. parlatorei y P. glomeratus ocurrieron con un patrón continuo a extendido durante toda la estaciónseca (>cinco meses), mostrando pequeños declives al final de la época seca.
La liberación de polen en especies de Podocarpus se dio a fines de la estación seca (octubre), sugiriendo un patrón anual a intermedio de un mes. Esta ocurre de manera muy sincronizada entre árboles y localidades de P. glomeratus y P. parlatorei con valores de 10- 30%. En Prumnopitys esta fenofase fue poco perceptible, debido a que los androestróbilos son muy pequeños.
Sincronización entre poblaciones e individuos
Las poblaciones e individuos de localidades más secas (Pajchanti y Villa Naranjitos) mostraron mayor sincronización de fenofases reproductivas, a comparación de las que se encuentran en localidades más húmedas (Meruvia y Jukumari). Por un lado, los valores de ocurrencia de las fenofases son más altos en las localidades más secas que en las más húmedas, afectando más a especies de Podocarpus que a Prumnopitys.
Asimismo, la densidad de individuos reproductivos es mayor en las localidades más secas y menor en las más húmedas. Poblaciones de P. glomeratus en Pajchanti y P. parlatorei en Villa Naranjitos presentaron mayor densidad de árboles reproductivos de 60-65% y de 90-95% respectivamente. Por otra parte, las poblaciones de P. oleifolius y P. glomeratus en las localidades más húmedas, mostraron mayor cantidad de árboles vegetativos que reproductivos de 80- 100% y de 60-70%, respectivamente.
Efecto de la exposición solar y tamaño del árbol sobre la dispersión de semillas
La dispersión de semillas de cada especie responde de diferente forma al efecto de la luz y el tamaño del árbol. Podocarpus glomeratus en Pajchanti es influido por la luz (p=0.029, odd ratio = 2.93, n=140) y no por el tamaño; es decir, la probabilidad de dispersión de semillas aumenta a mayor exposición solar (lugares abiertos o cuando es dominante), disminuye cuando se encuentra en lugares sombreados o es co-dominante y es la misma en un árbol grande o pequeño. Por otra parte, P. parlatorei no responde a ninguna de estas variables; la posibilidad de encontrar un árbol dispersando semillas es la misma con menor o mayor disponibilidad de luz o si es pequeño o grande. Por último, Prumnopitys exigua pese a que el efecto del tamaño es significativo (p = 0.0002, odd ratio =1.06, n = 301), el odd ratio es prácticamente 1, lo que significa que existe una mínima probabilidad de que esta variable afecte a la probabilidad de dispersión de semillas. Así mismo, tampoco muestra dependencia con la luz; la especie puede fructificar por debajo o encima del dosel.
Discusión
Patrones fenológicos
La fenofase de inicio de los androestróbilos y ginoestróbilos < 50% no se da en época seca, suponemos que se da a principios de época húmeda. Corroboramos personalmente esto en P. glomeratus en noviembre y diciembre del mismo año, la misma ocurrió en un 80% durante dos meses, lo que sugiere un patrón anual intermedio. Este patrón también es corroborado en otras observaciones de P. glomeratus en la misma localidad de Pajchanti (Peña & Morales 1999) y en la localidad de Sailapata, al noroeste de Cochabamba (Ayma-Romay 2005).
En Podocarpus spp. las fenofases de androestróbilos en latencia y ginóstrobilos > 50% ocurren de manera continua a extendida > 5 meses con tendencias a continuar en época húmeda. Este patrón fue también observado en otra población de P. glomeratus al noroeste de Cochabamba (Ayma-Romay 2005) y P. oleifolius en Ecuador (CESA 1998), sugiriendo que estas fenofases ocurren durante todo el año. Este patrón está muy relacionado a la biologíareproductiva de Podocarpus, por ejemplo, en Podocarpus totara la fenofase de ginoestróbilo >50% tiene una duración de nueve meses hasta llegar a la maduración del óvulo y una fenofase de androestróbilos en latencia de ocho meses hasta llegar a la liberación de polen (Wilson & Owens 1999). En Prumnopitys notamos lo mismo, sin embargo, estas estructuras se renuevan constantemente en un ciclo reproductivo de menor tiempo (ca. 2 meses).
En poblaciones de P. parlatorei y P. glomeratus la liberación de polen se manifiesta a fines de la estación seca, con sincronización entre poblaciones e individuos. Es probable que Podocarpus prefiera la época seca para la polinización, ya que algunos trabajos sugieren que así se favorece la polinización anemófila de muchas especies de coníferas, ya que la precipitación y humedad desfavorecen los procesos de polinización y fecundación (Kaul et al. 1986, Jordano 1998, Wilson & Owens 1999). Por otra parte, en las localidades más húmedas esta fenofase tiene menor ocurrencia, probablemente debido a que la permanente niebla, típica de los bosques montanos húmedos (Navarro 2005), perjudica los procesos de reproducción (Jordano 1998).
La dispersión de semillas de P. parlatorei y P. glomeratus es dirigida por la época seca, sugiriendo un patrón anual intermedio de 2 a 4 meses con un inicio, pico y final muy marcados en la mitad de la época seca. Este patrón también se ha observado en especies arbóreas, de bosques montanos con época seca marcada y que además presentan frutos carnosos, sugiriendo que el estrés hídrico estimula la fructificación en este tipo de ambientes (Brown 1995, Sobral & Machado 2001, Stevenson 2004). Por otra parte, la dispersión de semillas en Prumnopi tys exigua presentó un patrón continuo a extendido sin picos, similar a lo que ocurre en otras especies de frutos carnosos de bosques montanos más húmedos, las cuales dispersan semillas regularmente durante todo el año (Terborgh 1986, Morellato et al. 2000, Roldán & Larrea 2003, Pino & Mosquera 2004).
La dispersión de semillas de Podocarpus spp. y Prumnopitys es escasa. Este patrón también fue identificado en P. glomeratus de AyopayaCochabamba (Peña & Morales 1999, AymaRomay 2005), P. oleifolius en Ecuador (CESA 1998) y P. parlatorei en Chuquisaca (PLAFOR 1999). Este patrón también sucede en muchos árboles de montaña de vida muy larga y varias oportunidades para producir propágulos (Callaghan & Emanuelsson 1985). Aunque también tendría que ver con estrategias de dispersión de semillas, asociadas a interacciones con animales, ya que la baja producción de semillas permitiría atraer aves o mamíferos especialistas. No siendo así se atraería mayor cantidad de depredadores generalistas, lo que aumentaría las tasas de depredación de las semillas y oportunidades de establecimiento de la especie (Janzen 1971, Terborgh 1986).
También se debe destacar que la fructificación de las Podocarpaceae en estación seca es de vital importancia para las comunidades de aves en los bosques de neblina. La baja oferta de frutos durante la época seca, típico de este tipo de bosque (Roldán & Larrea 2003) es compensada por la fructificación de las especies en estudio. Se evidenció en campo que aves se alimentaron del pseudofruto carnoso y dulce de los conos de Podocarpus, p. e. los loros (Aratinga mitrata).
Asincronía entre individuos y poblaciones
La sincronización entre individuos y las poblaciones respecto a su estado fenofásico (reproductivo o vegetativo) es controlada por el rigor de la época seca. Las especies de Podocarpus de las localidades más humedas fueron las más asincrónicas y menos reproductivas afectando más a P. oleifolius y P. glomeratus. En tanto, los Podocarpus de localidades más secas presentaron mayor cantidad de individuos reproductivos.
Es probable que las poblaciones más reproductivas y menos asincrónicas de Podocarpus spp. se encuentren en el clímax de su distribución natural y aquellas menosreproductivas se encuentren al margen. Por ejemplo, los P. glomeratus de la localidad húmeda (Meruvia) se encuentran al margen de su distribución, mientras que, los de la localidad más seca (Pajchanti) se encuentran en el clímax de su distribución. Asimismo, en poblaciones de P. totara encontraron que las poblaciones de sitios más aislados de su distribución natural tenían menor productividad de semillas (Bergin & Kimberley 1992), al igual que otras poblaciones de Juniperus communis en Europa, que se atribuyeron a la influencia de los límites latitudinales de la especie (García et al. 2002).
Infuencia del tamaño del árbol y luz sobre la dispersión de semillas
Algunos otros estudios encontraron evidencias de que la producción de semillas, aumenta con el tamaño de los árboles y su posición en lugares abiertos (p. e. Newstrom et al. 1994, Pinard et al. 1999). En Podocarpus spp. y Prumnopitys exigua la influencia es relativa, por lo que la producción de semillas está sujeta a la influencia de otras variables ambientales o fisiológicas de cada individuo o población. Para lo cual sugerimos, indagar en investigaciones que estudien la influencia del micro-sitio entre individuos, interacciones planta–animal con énfasis en aves y estudiar con mayor profundidad el efecto de la variabilidad de los sitios con diferentes condiciones ambientales debido a la altitud, clima y latitud.
Conclusión
Las fenofases reproductivas de las especies de Podocarpus se manifiestan mejor en lugares con época seca marcada; en tanto, las fenofases reproductivas de Prumnopitys se muestran mejor en ambientes más húmedos. Existe poca sincronización en el tiempo e intensidad de ocurrencias de las fenofases entre poblaciones e individuos. La influencia de la luz y el tamaño del árbol no son factores determinantes para la dispersión de semillas en las especies.
Agradecimientos
Agradecemos la generosa contribución financiera para realizar la investigación del Proyecto de Manejo de Bosques Tropicales FOMABO-ESFOR-UMSS, la cooperación de las familias campesinas en la ubicación de los relictos de Podocarpaceae, las enseñanzas del Dr. Bonifacio Mostacedo durante la investigación, redacción del manuscrito, a los guardaparques del Parque Nacional Carrasco quienes ayudaron a ubicar los Prumnopitys y P. parlatorei, a Elsa Padilla y Gerardo Veizaga por haber ayudado en el trabajo de campo y a los revisores anónimos de la revista que contribuyeron cuantiosamente para mejorar el artículo.
Referencias
1.- Augspurger, K. C. 1990. Una señal para la foración sincrónica. pp. 201-218. En: E. G. Leigh, A. S Rand, y D. Windsor (eds.). Ecología de un Bosque Tropical. Smithsonian Tropical Research Institute, Panamá. [ Links ]
2.- Aguilar, Z. 2004. Flowering on community level in a terra frme forest in Ecuadorian Amazon. Journal Lyonia 7: 115-123. [ Links ]
3.- Anze, R. 1993. Podocarpaceae. pp. 641-645. En: T. J. Killeen, E. E. García & S. Beck (eds.). Guía de árboles de Bolivia. Herbario Nacional de Bolivia y Missouri Botanical Garden, La Paz. [ Links ]
4.- Ayma-Romay, A. I. 2005. Estudio de propagación sexual de Pino de monte (Podocarpus glomeratus D. Don) en la comunidad de Sailapata - Independencia. Tesis de licenciatura en Ingeniería Forestal, Universidad Mayor de San Simón, Cochabamba. 54 p. [ Links ]
5.- Bergin, D. O. & M. O. Kimberley. 1992. Provenance variation in Podocarpus
totara. New Zealand Journal of Ecology 16: 5-13.
6.- Berlin, K. E., T. K. Pratt, J. C. Simon & J. R. Kowalsky. 2000. Plant phenology in a cloud forest on the Island of Maui, Hawaii. Biotropica 32: 90-99. [ Links ]
7.- Borchert, R. 1983. Phenology and control of fowering in tropical trees. Biotropica 15: 81-89. [ Links ]
8.- Borchert, R., S. A. Meyer, R. S. Felger & L. Porter-Bolland. 2004. Environmental control of fowering periodicity in Costa Rican and Mexican tropical dry forests. Global Ecology and Biogeography 13: 409-425. [ Links ]
9.- Brown, A. D. 1986. Autoecología de bromeliáceas epiftas del noroeste argentino y su relación con Cebus apella (Primates). Tesis de Doctorado, Universidad Nacional de La Plata, La Plata. 474 p. [ Links ]
10.- Brown, A. D. 1995. Fenología y caída de hojarasca en las selvas montanas del Parque Nacional El Rey, Argentina. pp. 93-102. En: A. D. Brown y H. R. Grau (eds). Investigación, Conservación y Desarrollo en Selvas Subtropicales de Montaña. LIEY. Tucumán. [ Links ]
11.- Callaghan, T. V. & U. Emanuelsson. 1985. Population structure and processes of tundra plants and vegetation. pp. 399-439. En: J. White (ed.). The Population Structure of Vegetation. Junk, Dordrecht. [ Links ]
12.- Camacho, M. & L. Orozco. 1998. Patrones fenológicos de doce especies arbóreas del bosque montano de la cordillera de Talamanca, Costa Rica. Revista Biología Tropical 46: 533-542. [ Links ]
13.- CESA – Central Ecuatoriana de Servicios Agrícolas, 1998. Podocarpus oleifolius. pp: 122-124. En: L. Prado & H. Valdebenito (eds.). Contribución a la Fenología de Especies Forestales Nativas Andinas. FOSEFOR, Quito. [ Links ]
14.- Fournier, L. A. 1974. Un método cuantitativo para la medición de características fenológicas en árboles. Turrialba 24: 422-423. [ Links ]
15.- Frankie, G. W., H. G. Baker & P. A. Opler. 1974. Comparative phenological studies of trees tropical wet and dry forest in the lowlands of Costa Rica. Journal of Ecology 62: 881-919. [ Links ]
16.- García, D., R. Zamora, J. M. Gómez, P. Jordano & J. A. Hódar. 2000. Geographical variation in seed production, predation and abortion in Juniperus communis throughout its range in Europe. Journal of Ecology 88: 435–446. [ Links ]
17.- Hilty, S. L. 1980. Flowering and fruiting periodicity in a pre-montane rain forest in Pacifc Colombia. Biotropica 12: 292- 306. [ Links ]
18.- Janzen, D. 1967. Synchronization of sexual reproduction of trees within the dry season in Central America. Evolution 21: 620-637. [ Links ]
19.- Janzen, D. 1971. Seed predation by animals. Annual Review of Ecology and Systematics 2: 465-492. [ Links ]
20.- Jordano, P. 1998. Polinización y variabilidad de la producción de semillas en Pistacia lentiscos L. (Anacardiaceae). Anales Jard. Bot. Madrid 45: 213-231. [ Links ]
21.- Justiniano, M. J. & T. S. Fredericksen. 2000. Phenology of tree species in Bolivian dry forests. Biotropica 32: 276-281. [ Links ]
22.- Kaul, R. B., E. C. Abbe & L. B. Abbe. 1986. Reproductive phenology of the oak family (Fagaceae) in the lowland rain forest of Borneo. Biotropica 18: 51-55. [ Links ]
23.- Kikim, A. & P. S. Yadava. 2001. Phenology of tree species in subtropical forest of Manipur in north eastern India. Tropical Ecology 42: 269 – 276. [ Links ]
24.- Mantovani , A., L. P. Morellato & M. S. Dos Reis. 2004. Fenologia reprodutiva e produção de sementes em Araucaria angustifolia (Bert.) O. Kuntze. Revista Brasil. Bot. 27: 787-796. [ Links ]
25.- Meneses, R. & S. Beck. 2005. Especies amenazadas de la flora de Bolivia.
Herbario Nacional de Bolivia. Informe técnico. La Paz. 34 p.
26.- Morellato, P. L., D. T. Talora, A. Takahasi, C. C. Bencke, E. C. Romera & V. B. Ziparro. 2000. Phenology of Atlantic rain forest trees: A comparative study. Biotropica 32: 811-823. [ Links ]
27.- Navarro, G. 2005. Provincia biogeográfca de los Yungas. pp. 278 - 348. En: G. Navarro & M. Maldonado (eds.). Geografía ecológica de Bolivia. Centro de Ecología y Difusión Simón I. Patiño, Santa Cruz. [ Links ]
28.- Newstrom, L. E., G. W. Frankie & H. G. Baker. 1994. A new classification for plant phenology based on fowering patterns in lowland tropical rain forest trees at La Selva, Costa Rica. Biotropica 26: 141-159. [ Links ]
29.- Peña, J & I. Morales. 1999. Avances en fenología del Podocarpus parlatorei del bosque de Pajchanti-Cochabamba. pp. 128-130. En: L. Prado & H. Valdebenito (eds.). Contribución a la Fenología de Especies Forestales Nativas Andinas de Bolivia y Ecuador. Quito. [ Links ]
30.- Pinard, M. A., F. E. Putz, D. Rumíz, R. Guzmán & A. Jardim. 1999. Ecological characterization of tree species for guiding forest management decisions in seasonally dry forests in Lomerío, Bolivia. Forest Ecology and Management 113: 201-213. [ Links ]
31.- Pino, N. & H. R. Mosquera. 2004. Phenology of three timber species in risk of extinction in Colombia and high indices of exploitation in the Choco: Huberodendron patinoi Carrá, Cariniana pyriformis Miers Abarco y Humiriastrum procerum Little Chanó. Journal Lyonia 7: 107-114. [ Links ]
32.- PLAFOR (Plan Agroforestal de Chuquisaca). 1999. Podocarpus parlatorei. pp. 125-127. En: L. Prado & H. [ Links ]
33.- Valdebenito (eds.). Contribución a la Fenología de Especies Forestales Nativas Andinas de Bolivia y Ecuador. Quito. [ Links ]
34.- Reich, P. B. & R. Borchert. 1984. Water stress and tree phenology in a tropical dry forest in lowlands of Costa Rica. Journal of Ecology 72: 61-64. [ Links ]
35.- Roldán, A. I. & D. M. Larrea. 2003. Fenología de 14 especies arbóreas y zoócoras de un bosque yungueño en Bolivia. Ecología en Bolivia 38: 125-140. [ Links ]
36.- Rozo, M. C. & A. Parrado. 2004. Dispersión primaria diurna de semillas de Dacryodes chimantensis y Protium paniculatum (Burseraceae) en un bosque de tierra firme de la amazonía colombiana. Caldasia 26: 111-124. [ Links ]
37.- SanMartin, I. & L. P. C. Morellato. 2003. Inter and intraspecifc variation on reproductive phenology of the Brazilian Atlantic forest Rubiaceae: ecology and phylogenetic constraints. Rev. Biol. Trop. 51: 691-698. [ Links ]
38.- Sobral, L. M & I. C. S. Machado. 2001. Fruiting phenology and seed dispersal syndromes in Caatinga, a tropical dry forest in the northeast of Brazil. Journal of Tropical Ecology 17: 303-321. [ Links ]
39.- Stevenson, P. R. 2004. Phenological patterns of woody vegetation at Tinigua Park, Colombia: methodological comparisons with emphasis on fruit production. Caldasia 26: 125-150. [ Links ]
40.- Terborgh, J. 1986. Community aspects of frugivory in tropical forests. pp. 371-384. En: A. Estrada & T. H. Fleming (eds.). Frugivores and seed dispersal. Junk, Publishers Dordrecht. [ Links ]
41.- Wilson, V. R. & J. N. Owens. 1999. The reproductive biology of totara (Podocarpus totara) (Podocarpaceae). Annals of Botany 83: 401-411. [ Links ]
42.- Wright, S. J. & C. P. van Schaik. 1994. Light and the phenology of tropical trees. American Naturalist 143: 192-199. [ Links ]
43.- Zarate, M., D. Goitia & G. Lazarte. 1999. Estudio estructural y ecológico de los bosques relictos de tres especies de Pinos de monte (Podocarpus spp., Podocarpaceae) en Cochabamba, Bolivia. Rev. Bol. Ecol. 5: 51-59. [ Links ]
Artículo recibido en: Septiembre de 2007
Manejado por: Robert Wallace
Aceptado en: Diciembre de 2007











 uBio
uBio