Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Ecología en Bolivia
Print version ISSN 1605-2528On-line version ISSN 2075-5023
Ecología en Bolivia vol.38 no.2 La Paz Oct. 2003
ARTÍCULO
Fenología de 14 especies arbóreas y zoócoras de un bosque yungeño en Bolivia
Phenology of 14 zoochoric tree species in a Yungas forest of Bolivia
Alejandra I. Roldán1 & Daniel M. Larrea2
1Centro de Estudios en Biología Teórica y Aplicada (BIOTA).
Casilla 9641. La Paz. Bolivia / Correo electrónico: aleiroldan@hotmail.com
2Herbario Nacional de Bolivia. Instituto de Ecología. Casilla 10077. La Paz. Bolivia.
Dirección actual: Lab. de Ecología Terrestre, Fac. de Ciencias, Univ. de Chile. A.P. 653, Santiago, Chile
Resumen
Presentamos información fenológica registrada durante dos años (octubre de 1998 - octubre de 2000) de 14 especies arbóreas cuyos frutos son consumidos por frugívoros, como una primera parte de un estudio mayor de fenología que se está realizando en el bosque yungueño del Parque Nacional y Área Natural de Manejo Integrado Cotapata (Bolivia). Realizamos registros quincenales o mensuales del porcentaje de botones florales, flores, frutos en estado de pre-dispersión, frutos en estado de dispersión y hojas. La producción de estructuras reproductivas estuvo asociada a la estacionalidad determinada por las precipitaciones. Los botones florales de la mayoría de las especies estudiadas estuvieron presentes en el período seco, la floración ocurrió principalmente desde fines de la época seca y la primera mitad de la época húmeda. La fructificación ocurrió en la mayoría de las especies durante la época húmeda. A pesar de que hubo algún grado de asociación de la floración y fructificación con las precipitaciones, durante todos los meses del año se registraron estructuras reproductivas. Para definir más claramente los patrones fenológicos es necesario incrementar el número de especies estudiadas y la escala temporal de las observaciones.
Palabras clave: fenología, Yungas, Cotapata, floración, fructificación.
Abstract
We present two years (October 1998 – October 2000) of phenological data for 14 arboreal species whose fruits are consumed by frugivores, as the first phase of a larger phenological study underway in the Yungas Forest of the Parque Nacional y Área Natural de Manejo Integrado Cotapata (Bolivia). We recorded percentage of flower buds, flowers, predispersal fruits, dispersing fruits and leaves at biweekly or monthly intervals. Reproductive structures’ production was associated with seasonal patterns of precipitation. Inmature flowers were present mainly during the dry season, anthesis occured mainly during late dry season and the first half of the wet season. Most of the species had fruits during the wet season. In spite of this loose association of flowering and fruiting with precipitation, reproductive structures were recorded all year round. To have a clearer picture of the phenological patterns, it is necessary to increase the number of species studied and also the period of data collection.
Keywords: phenology, Yungas, Cotapata, flowering, fruiting.
Introducción
Estudios descriptivos de la fenología de plantas son fundamentales para comprender la dinámica de los recursos de las poblaciones, comunidades o ecosistemas (Bullock & Solis-Magallanes 1990). La actividad de polinizadores, frugívoros, depredadores y dispersores de semillas, así como el período de reproducción de muchos animales depende directa o indirectamente de la producción de flores y frutos en una comunidad vegetal (Terborgh 1986, Jordano 1992, Smith-Ramírez & Armesto 1994). De manera similar, los cambios estacionales en abundancia de numerosos grupos tróficos son el reflejo de los patrones de abundancia de los recursos alimenticios (Boletta et al. 1995). De este modo, el estudio de la fenología de especies consumidas por vertebrados permite lograr un acercamiento al conocimiento de la dinámica estacional de este grupo (Wallace & Painter 2002).
Con respecto a la formación de flores, la bibliografía existente indica que la mayor parte de la floración en bosques estacionales ocurre al final de la estación seca (Reich & Borchert 1984, Mabberley 1992). También, en bosques tropicales de tierras bajas, el pico de floración de árboles y arbustos frecuentemente coincide con la estación seca (Howe & Westley 1997). En bosques tropicales de tierras bajas, se han registrado dos períodos de intensa floración, uno en la mitad o a finales de la estación seca y un segundo, siguiendo el inicio de las fuertes lluvias (Terborgh 1986, Justiniano & Fredericksen 2000). En relación a la fructificación, se ha observado que en los bosques tropicales la disponibilidad de frutos es altamente variable en espacio y tiempo, aún en ambientes uniformes como aquellos que están cercanos a la línea del Ecuador (Terborgh 1986). Estudios de fenología en ambientes con una estación seca (o menos húmeda) y una estación lluviosa, han indicado uno o dos picos de fructificación que ocurren durante la época más húmeda y un período relativamente más corto de baja disponibilidad de frutos durante la estación seca, momento en el cual se ha detectado la presencia de especies vegetales claves que mantienen a la comunidad de frugívoros residentes (Leigh & Windsor 1985, Terborgh 1986, Boletta et al. 1995, Brown 1995, Justiniano & Fredericksen 2000, Wallace & Painter 2002). Se ha visto también que la fructificación de las especies con dispersión zoócora se encuentran concentradas en la época húmeda (Sobral & Machado 2001).
Los bosques de montaña de los Yungas del Parque Nacional Cotapata presentan una estacionalidad determinada por las precipitaciones, puesto que presentan meses con valores menores de 60 mm de precipitación (Wright & Schaik 1994). Entonces, se podría esperar que los patrones temporales de floración y/o fructificación estén asociados a esta estacionalidad, sin embargo no se dispone de información alguna para corroborarlo. El presente estudio es la primera parte de un estudio más grande de fenología del bosque yungueño en el Parque Nacional y Área Natural de Manejo Integrado Cotapata. Aquí se presenta información fenológica de 14 especies arbóreas (casi el 20% de las especies arbóreas registradas en el área) y cuyos frutos son consumidos por aves y mamíferos de los Yungas de Bolivia.
Área de estudio
El estudio se realizó en el Parque Nacional y Área Natural de Manejo Integrado Cotapata (PNANMI Cotapata), Bolivia, localizado en el Departamento de la Paz dentro de las provincias Nor Yungas (Cantón Pacollo) y Murillo (Cantón Zongo) (68A02’W y 16A20’S al SO, 68A03’W y 16A05’S al NO, 67A43’W y 16A10’S al NE, 67A47’W y 16A18’S al SE) (Fig. 1). La superficie del PNANMI Cotapata es de 58.620 hectáreas y el intervalo altitudinal es 1.100-5.600 m, abarcando cuatro pisos altitudinales con vegetación: Pradera Altoandina, Páramo Yungueño, Bosque Nublado de Ceja y Bosque Húmedo de Yungas (Ribera 1995).
El trabajo de campo tuvo lugar en el cerro Hornuni, a lo largo de una senda utilizada por los pobladores de aproximadamente 5 km de longitud, y altitud entre 1.600 y 1.800 m. La vegetación circundante a la senda es un bosque secundario en distintas etapas de sucesión, resultado de la actividad agrícola de la zona, alternado con algunas áreas cultivadas con café y cítricos. La vegetación original corresponde al bosque húmedo de Yungas (1.200-2.400 m), el cual se distribuye sobre laderas de fuerte pendiente, en valles aluviales y quebradas profundas y representa el 15% del área del PNANMI Cotapata (Ribera 1995).
El bosque de Yungas constituye el ecosistema más intervenido y más amenazado por la actividad humana en el Parque (principalmente agricultura). Sin embargo, existen zonas todavía representativas del bosque primario poco o nada intervenido, lo cual se debe a que son zonas de difícil acceso (Ribera 1995, L. Pacheco, com. pers. 2000). El bosque húmedo de Yungas está representado por emergentes de 30 metros como Ficus spp. y Aniba spp. y las especies más importantes de los estratos arbóreos y arbustivos son Juglans spp., Brunellia boliviana, Podocarpus spp., Clusia pseudomangle, Byrsonima indorum, Cinchona calisaya, Myricapubescens, Myroxylonbalsamum, Protium bangii, Tetragastris altissima, Anadenanthera colubrina, Meliosma boliviensis, Pourouma sp., Cecropia spp., Inga velutina, Palicoureabryophila, Psychotriatrichotoma, Cedrela odorata, Triplaris sp., Nectandra spp., Ocotea spp. entre muchas otras. También son comunes los helechos arborescentes de los géneros Nephelea y Cyathea (Ribera 1995).
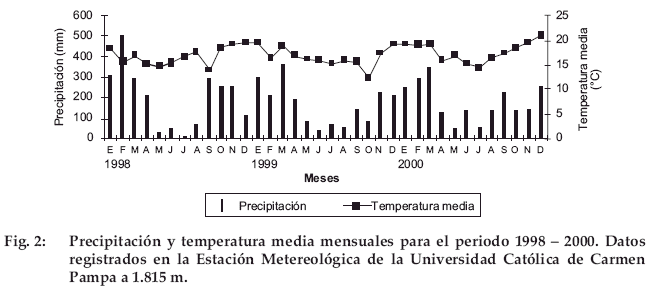
El clima de la región es tropical húmedo con temperaturas medias anuales entre 12 y 17 AC y precipitación anual inferior a 2.000 mm (Ribera 1995). Las precipitaciones son estacionales, con una época seca entre abril septiembre con aproximadamente 400 mm de precipitación y una época húmeda entre octubre-marzo, con aproximadamente 1.600 mm de precipitación. Ambos valores son promedio de 26 años de registro en la Estación Sainani con altitud de 2.210 m (ENERGO PROJEKT HIDROINZENJERIN 1998). Para los años en que se realizó el estudio (1998-2000), se dispone de datos de temperatura y precipitación de la Estación Metereológica de la Universidad Católica de Carmen Pampa a 1.815 m s.n.m. de altitud (a 12 km de Coroico en dirección a Chovacollo); cedidos gentilmente por el Ing. Manuel Chino (Fig. 2).
Metodología
Durante dos años, en el período comprendido entre octubre de 1998 a octubre de 2000, realizamos observaciones fenológicas en cinco individuos de cada una de 14 especies de arbóreas de dispersión zoocora, ubicadas a lo largo de la senda mencionada en área de estudio (Tabla 1). Las especies arbóreas fueron seleccionadas por considerarse que sus frutos eran consumidos por aves y/o mamíferos (D. Pérez, com. pers. 1998) (Tabla 1).

Las observaciones fueron realizadas con binoculares y por un observador distinto en cada año. La frecuencia de observación fue de 15 días en el primer año y una vez al mes en el segundo año de observación. Para el registro fenológico, consideramos las siguientes fenofases: botones florales, flores abiertas, frutos en estado de pre-dispersión (inmaduros), frutos en estado de dispersión (maduros) y hojas. Para cada fenofase consideramos cinco categorías: 1 (0%), 2 (1-25%), 3 (26-50%), 4 (5175%) y 5 (76-100%), las cuales representaron el porcentaje de, por ejemplo, flores con respecto al área total de la copa de cada individuo arbóreo (Smith-Ramírez & Armesto 1994).
Con el fin de incrementar el número de individuos considerados por especie, incluimos en este trabajo la información fenológica para ocho de las 14 especies bajo estudio (Guatteria sp., Alchornea glandulosa, Vismia tomentosa, Nectandra sp. Pouroma minor, Ladenbergia cf. oblongifolia, Solanum sp., Trema micrantha), obtenida a partir de registros mensuales en 10 parcelas permanentes de 10 x 100 m que establecimos entre los 1.600-1.900 m del Cerro Hornuni (PNANMI Cotapata). En las parcelas permanentes registramos los cambios fenológicos de todos los árboles mayores a 10 cm de diámetro a la altura del pecho (DAP) entre diciembre de 1999 a noviembre de 2001, utilizando la misma metodología mencionada para el presente estudio. Debido a que incluimos la información de las parcelas permanentes, durante el período de solape de ambos estudios (diciembre de 1999 a octubre de 2000), el número de individuos analizados para esas ocho especies es mayor a cinco (ver detalle en Resultados).
Para seis de las 14 especies, la información es presentada en gráficos, que muestran los valores mensuales promedio del total de árboles observados para las categorías de las distintas fenofases, durante los dos años de observación. En este caso, los dos registros por mes que se obtuvieron para el primer año de observación fueron promediados, debido a que no añadían más información.
Para las restantes ocho especies, se presentan sólo los períodos de tiempo en que ocurre cada fenofase, lo cual se debió a diferentes razones:
1) Dificultad en diferenciar entre las distintas fenofases en algunas fechas de registro (Guatteria sp., Vismia tomentosa).
2) Idem al punto anterior sumado a la inexistencia de estructuras reproductivas durante el primer año de observación (Alchornea glandulosa, Nectandra sp., Cecropia cf. angustifolia).
3) De los cinco individuos observados, uno se identificó hacia el final del estudio como perteneciente a otra especie (Solanum leucocarpon, Myrsine cf. oligophylla, Solanum lindenii).
Resultados
Información detallada de los cambios fenológicos
Las especies de las que que se dispone información detallada de las categorías de las distintas fenofases son las siguientes :
Clusia spp.
Las identificaciones taxonómicas realizadas por la Lic. Emilia García (Herbario Nacional de Bolivia) indican que los siete individuos observados pertenecen a cuatro especies distintas (Clusia aff. flaviflora, Clusia aff. lechleri, Clusia cf. trochiformis y Clusia cf. sphaerocarpa), por lo que las curvas fenológicas observadas en la figura 3 deben considerarse para el grupo de estas cuatro especies.

En algunos casos, hubo solapamiento entre los períodos de las fenofases fértiles de especies distintas. Esto explica la gran amplitud de los períodos de las distintas fenofases.
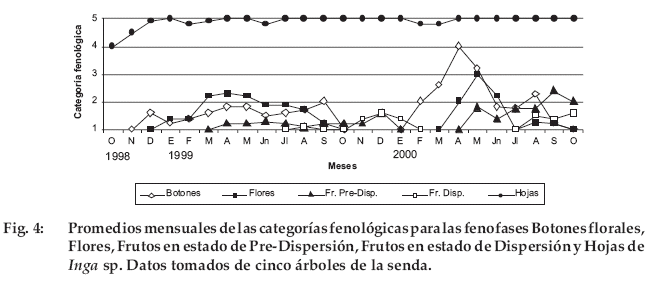
Inga sp.
Tanto la floración como la fructificación ocurrió en forma sincrónica entre los individuos observados (Fig. 4). La abundancia de frutos en dispersión posiblemente se ve disminuida por el consumo de C. apella (F. Condori, com. pers. 1998). Si bien se registró que la abundancia de hojas siempre estuvo cerca al 100%, observaciones en otros árboles no marcados durante el año 2001 indicaron que en el momento de la producción de botones florales (febrero) algunos perdieron hojas en un 25%, mientras que otros mantuvieron el 100% de sus hojas.
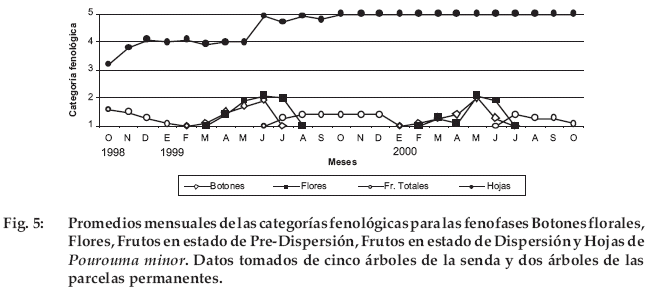
Pourouma minor
Hubo dificultad en distinguir entre frutos en estado de pre-dispersión y en dispersión, por lo que se consideraron sólo como frutos totales (Fig. 5). Los frutos fueron producidos en la época seca. Algunos de los individuos observados produjeron estructuras reproductivas los dos años, mientras que otros sólo en un año de los que duró el estudio. Tanto la floracióncantidad de hojas observadas en el primer año con respecto al segundo se deban a diferencias en la percepción del observador.
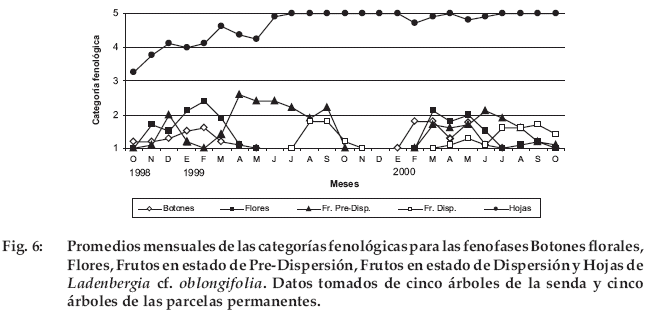
Ladenbergia cf. oblongifolia
La oferta de frutos en dispersión difirió entre años, para el primer año estuvo restringida al periodo seco, mientras que en el segundo se extendió también a la época húmeda. Tanto la floración como la fructificación ocurrió en forma sincrónica entre los individuos observados (Fig. 6).
Solanum sp.
El período reproductivo de Solanum sp. abarca casi el año completo, entre abril y febrero (Fig. 7). El inicio de botones florales puede ocurrir en abril o julio finalizando en agosto u octubre, según el año. Las flores se presentan en la época seca. Los frutos en dispersión se encuentran en la época con mayores precipitaciones, entre octubre y febrero. Tanto la floración como la fructificación ocurrió en forma sincrónica entre los individuos observados. Con respecto a la presencia de hojas, casi en todo el período de observación se registró pérdida de hojas, siendo más notoria antes del período de floración para el año 1999. En este momento los árboles perdieron entre el 25 y 75% de sus hojas.

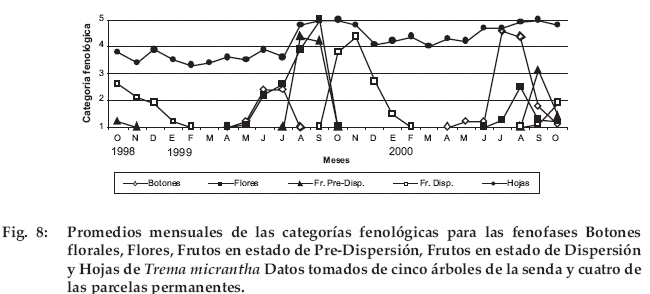
Trema micrantha
La presencia de botones y flores ocurre principalmente en la época seca, mientras que los frutos en dispersión estuvieron presentes en la época húmeda, extendiéndose en algunos casos hasta febrero. Tanto la floración como la fructificación ocurrieron en forma sincrónica entre los individuos observados. Casi en todo el período de observación, se registró pérdidas de hojas, siendo más notoria antes la floración para 1999 (Fig. 8). En este momento los árboles perdieron entre 0–100% según el individuo arbóreo.
Periodo de cada fenofase para las restantes especies
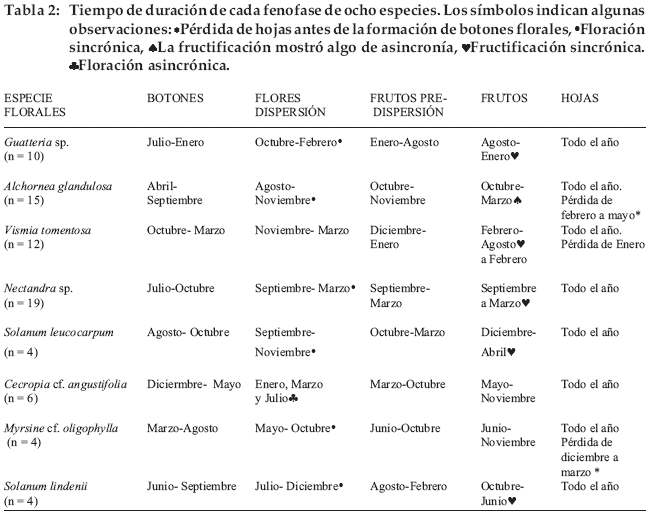
En la Tabla 2 se puede observar el período para cada fenofase para las restantes ocho especies, y la presencia o no de sincronía de los periodos reproductivos entre los individuos observados de cada especie.
Agrupando a todas las especies
Un análisis de las 14 especies muestra alguna tendencia con respecto a la producción de estructuras reproductivas durante las estaciones seca y lluviosa.
Botones florales: Los botones florales se presentaron durante todos los meses del año (Fig. 9). Ocho de las especies estudiadas (Alchornea glandulosa, Nectandra sp., Pourouma minor, Myrsine cf. oligophylla, Solanum sp., Solanum lindenii, Solanum leucocarpon y Trema micrantha) presentaron botones florales sólo durante la época seca. Cuatro especies (Guatteria sp., Inga sp.,Cecropia cf. angustifolia y Ladenbergia cf. oblongifolia) presentaron botones florales tanto durante la época húmeda como la seca.

Una especie y un grupo de cuatro especies (Vismia tomentosa y Clusia spp.) produjeron botones florales en la época húmeda.
El número de especies con botones florales por mes varía de cuatro a nueve especies. Durante la época seca, el número de especies con botones florales es algo mayor (de siete a
nueve especies) que durante la época húmeda (de cuatro a siete especies) (Fig. 9). Todo esto indica una tendencia a presentarse más botones florales durante la época seca.
Flores abiertas: Las flores también fueron registradas en todos los meses del año (Fig. 10). Tres especies (Pourouma minor, Myrsine cf. oligophylla y Trema micrantha) presentan su floración restringida a la época seca. Cinco especies y un grupo de cuatro especies (Alchornea glandulosa, Inga sp., Ladenbergia cf. oblongifolia,Solanum sp., Solanum lindenii y Clusia spp.) presentan flores tanto durante la época húmeda como la seca. Cuatro especies (Guatteria sp., Vismia tomentosa, Nectandra sp. y Solanum leucocarpon) presentan flores en la época húmeda. La especie Cecropia cf. angustifolia floreció en forma discontinua en los meses de enero, marzo y julio, esto se debió a asincronía en la floración entre los individuos observados.

El número de especies en flor por mes fue de siete a ocho para todos los meses, salvo para abril y agosto donde el número de especies con flor fue de cuatro y seis respectivamente (Fig. 10). No se observa una relación clara entre las precipitaciones y la floración, sin embargo se puede ver que un número algo mayor de especies florecen en la transición de la época seca a la húmeda.
Frutos en estado de dispersión: Los frutos maduros también fueron registrados durante todo el año (Fig.11). Una sola especie (Ladenbergia cf. oblongifolia) presentó frutos maduros sólo en la época seca. Siete especies y un grupo de cuatro especies (Guatteria sp., Vismia tomentosa, Inga sp., Cecropia cf. angustifolia, Myrsine cf. oligophylla, Solanumlindenii, Solanum leucoparpon y Clusia spp.) fructificaron tanto durante el periodo seco como húmedo. Por último, cinco especies (Alchornea glandulosa, Nectandra sp., Pourouma minor, Solanum sp. y Trema micrantha) presentaron frutos maduros en la época húmeda.

El mayor número de especies con frutos maduros fue registrado en las 2/3 partes iniciales de la época húmeda (10 a 12 especies), disminuyendo notoriamente entre los meses de febrero a julio (4 a 6 especies) (Fig. 11). Esto sugiere una tendencia a una mayor oferta de frutos maduros durante fines de la época seca y gran parte de la húmeda.
Hojas: Todas las especies presentaron hojas a lo largo del año. El valor promedio de hojas fluctuó entre las categorías 4 y 5 (mayor al 50%) a lo largo de todo el año, lo cual indica una alta cobertura de hojas en general. Algunas especies mostraron una clara pérdida de hojas (Solanum leucocarpon, Solanum sp., Solanum lindenii, Trema micrantha, Guatteria sp., Alchornea glandulosa, y Myrsine cf. oligophylla), pero nunca la pérdida fue mayor al 50%. Sólo en casos aislados, hubo individuos que perdieron sus hojas completamente por causas no identificadas.
Discusión
El estudio de la fenología de las 14 especies arbóreas mostró la presencia de botones florales, flores abiertas y frutos en estado de dispersión durante todos los meses del año, solapándose parcialmente los períodos de duración de cada fenofase entre las especies. Si bien resulta difícil ver claramente un patrón relacionado con la estacionalidad definida por las precipitaciones, es posible observar algunas tendencias.
En nuestro estudio la producción de botones florales fue mayor durante la época seca. Algunos autores indican que la floración es estimulada por el estrés hídrico (Reich & Borchert 1984, Mabberley 1992), lo cual explicaría que la formación de botones florales ocurra principalmente durante la época con menores precipitaciones.
La formación de botones florales en la época seca determinó que las flores abrieran principalmente durante la transición seca-húmeda. Esto coincide con lo encontrado en la mayoría de los bosques estacionales, donde la floración ocurre al final de la época seca (Reich & Borchert 1984, Mabberley 1992, Wright & van Schaik 1994), momento en que se ve favorecido el forrajeo de insectos en las flores (Howe & Westley 1997).
Los períodos de floración que observamos para las especies de este estudio, mostraron poco solapamiento, lo cual podría ser el resultado de la competencia interespecífica de las plantas por sus polinizadores (Heinrich 1976, Cole 1981, Gross & Werner 1983, Anker 1990). Es posible que este patrón cambie al aumentar el número de especies bajo estudio. Por otro lado, los individuos de las especies estudiadas, en general evidenciaron sincronía en la floración. Los períodos de floración sincrónicos, pueden ser ventajosos o desventajosos dependiendo de las interacciones denso - dependientes con los polinizadores. En algunas especies, floraciones sincrónicas pueden atraer mayor número de polinizadores y así lograr una mayor producción de frutos; en otras especies una floración asincrónica puede ser más ventajosa, puesto que una masiva producción de flores agotaría a la comunidad de polinizadores (Howe & Westley 1997).
En el caso de la fructificación de las especies que estudiamos, esta se caracteriza por su larga duración, observándose un promedio de 6 meses [rango 4-9, n=13 especies (excluyendo a Clusia spp.)], que es mayor a la duración promedio de la disponibilidad de frutos para especies que crecen en bosques templados (1,5 meses) y en arbustales mediterráneos de tierras bajas (2,2 meses), pero coincide con aquellas que crecen en zonas tropicales incluyendo bosques de montaña (más de 4 meses) (Jordano 1992, Pavajeau 1993, MacCarty et al. 2002). La tendencia a presentarse un mayor número de especies con frutos durante la época húmeda coincide con lo reportado en otros trabajos que también indican que la fructificación de las especies con dispersión zoócora se concentran en la época más lluviosa (Sobral & Machado 2001). La única especie que presentó su fructificación limitada al periodo seco fue Ladenbergia cf. oblongifolia, lo cual puede deberse a que su fruto es una cápsula, cuya dispersión de sus semillas aladas seguramente se ve beneficiada durante el período de menor precipitación (Sobral & Machado 2001).
A pesar de que la mayoría de las especies estudiadas presentaron frutos durante la época húmeda, también hubo frutos apetecibles para frugívoros durante la época seca. Además debemos tener en cuenta que existen especies del género Ficus sp. que presentan frutos a lo largo de todo el año (A. Apaza, com. pers. 2001). Este patrón en la disponibilidad de frutos se asemeja al encontrado en bosques montañosos de latitudes bajas como ocurre en Colombia (Pavajeau 1993) y difiere del encontrado en otros bosques de montaña de latitudes mayores, como en las Yungas de Argentina (Boletta et al. 1995). En este último caso, se presenta mayor oferta de frutos carnosos en época húmeda, mientras que en época seca sólo una especie arbórea ofrece frutos apetecibles para frugívoros. Esto puede tener relación con que las precipitaciones en esos bosques durante los meses secos son menores a las de nuestra área de estudio (Boletta et al. 1995).
El hecho que algunas especies como Alchornea glandulosa, Cecropia cf. angustifolia y Nectandra sp., presentaron frutos sólo en uno de los dos años de observación coincide con lo encontrado en especies de la familia Lauraceae en Costa Rica (Wheelwright 1986), donde se observaron que los individuos que produjeron muchos frutos un año produjeron pocos frutos en el siguiente. Esto sugiere la posibilidad de trade-offs en la asignación de recursos para reproducción entre años distintos.
El mantenimiento de al menos el 50% de la cobertura foliar en los individuos arbóreos estudiados refuerza la clasificación de esta zona como un bosque siempre verde. Además, coincide con los registros de fenología en las parcelas permanentes, donde sólo cinco especies de las 70 en estudio presentaron pérdida total de hojas (A. Roldán, datos no publicados).
El análisis de la fenología de las parcelas permanentes establecidas en el PNANMI Cotapata nos permitirá conocer con mayor precisión los patrones estacionales en el bosque yungueño. El presente trabajo con una muestra del 20% de las especies encontradas en las parcelas, nos da algunas ideas sobre el comportamiento fenológico de las especies zoócoras y nos advierte sobre la importancia de que este tipo de estudio presenten una mayor escala temporal.
Conclusión
El bosque yungueño del Parque Nacional Cotapata es un bosque estacional. Esta estacionalidad indicaría que el estrés hídrico es un factor importante que estimularía la formación de botones florales, conduciendo a que la floración de la mayoría de las especies estudiadas ocurra en los meses de transición entre las épocas seca y húmeda. La mayor parte de la fructificación de las especies ocurrió en la época húmeda. A pesar de observarse patrones estacionales en la producción de las distintas estructuras reproductivas, durante todo el año se observaron flores y frutos, lo cual sugiere que la estacionalidad determinada por las precipitaciones no es muy marcada. Los patrones mencionados deben confirmarse con estudios que involucren mayor número de especies y más amplios periodos de tiempo de observación.
Agradecimientos
Manuel Chino nos facilitó los datos meteorológicos de la estación de Carmen Pampa. María Sol Aguilar colaboró con la toma de datos. Faustino Condori, Pedro Callisaya y Dionicio Pérez fueron nuestros guías y referencias locales. Emilia García del Herbario Nacional de Bolivia identificó las especies. El presente trabajo se realizó gracias al apoyo de Wildlife Conservation Society. D.M. Larrea es becario de la Red Latinoamericana de Botánica (Beca RLB-01-M1). Agradecemos los comentarios de Bonifacio Mostacedo y dos revisores anónimos que ayudaron a mejorar este trabajo.
Referencias
Anker, R. 1990. The ecology and evolution of reproductive syncrony. Tree 5: 135-140.
Boletta, P.E., R. Vides-Almonacid, R.E. Figueroa & M.T. Fernández. 1995. Cambios fenológicos de la selva basal de Yungas en la Sierra de San Javier (Tucumán, Argentina) y su relación con la organización estacional de las comunidades de aves. pp. 103-114. En: A.D. Brown & H.R. Grau (eds.). Investigación, Conservación y Desarrollo en Selvas Subtropicales de Montaña. Universidad Nacional de Tucumán, Argentina. [ Links ]
Brown, A.D. 1995. Fenología y caída de hojarasca en las selvas montanas del Parque Nacional El Rey, Argentina. pp. 93-102. En: A.D. Brown & H.R. Grau (eds.). Investigación, Conservación y Desarrollo en Selvas Subtropicales de Montaña. Universidad Nacional de Tucumán, Argentina. [ Links ]
Bullock, S.H. & A. Solis-Magallanes. 1990. Phenology of canopy trees of a tropical deciduous forest in México. Biotropica 22: 22-35.
Cole, B.J. 1981. Overlap, regulariry, and flowering phenologies. American Naturalist 117: 993-997.
ENERGO PROJEKT-HIDROINZENJERIN. 1998. Estudio de factibilidad generación hidráulica, Proyecto Coroico. Informe Final. Anexo 4: Estudio de evaluación de impacto ambiental. Electropaz. Grupo Iberdrola. 340 p. [ Links ]
Gross, R.S. & P.A. Werner. 1983. Relationship among flowering phenology insect visitors, and seed-set of individuals: experimental studies on four cooccurring species of goldenrod (Solidago, Compositae). Ecological Monographs 53: 95-117.
Heinrich, B. 1976. Flowering phenologies: bog, woodland, and disturbed habitats. Ecology 57: 890-899.
Howe, H.F. & L.C. Westley. 1997. Ecology of pollination and seed dispersal. pp. 262-283. En: M.J. Crawley (ed.). Plant Ecology. Blackwell Science Ltd. Oxford. [ Links ]
Jordano, P. 1992. Fruits and frugivory. pp. 105-156. En: M. Fenner (ed.). Seeds. The Ecology of Regeneration in Plant Communities. [ Links ]
Justiniano, M.J. & T.S. Fredericksen. 2000 Phenology of tree species in Bolivian dry forests. Biotropica 32: 276-281.
Killeen, T.J., E. García E. & S.G. Beck, 1993. Guía de Árboles de Bolivia. Herbario Nacional de Bolivia. Missouri Botanical Garden. La Paz. Bolivia. 958 p. [ Links ]
Leigh, E.G. & D.M. Windsor. 1985. Forest production and regulation of primary consumers on Barro Colorado Island. pp. 11-122. En: E.G. Leigh, A. Stanley Rand & D.M. Windsor (eds.). The Ecology of a Tropical Forest. Seasonal Rhythms and Long-Term Changes. Smithsonian Institution Press. Washington, D.C. [ Links ]
Mabberley, D.J. 1992. Tropical Rain Forest Ecology. Chapman & Hall. New York. 300 p. [ Links ]
McCarty, J.P., D.J. Levey, C.H. Greenberg & S. Sargent. 2002. Spatial and temporal variation in fruit use by wildlife in a forested landscape. Forest Ecology and Management 164: 277–291.
Pavajeau, L. 1993. Características morfológicas y oferta de frutos para el consumo de las aves del Bosque Andino de Carpanta. pp. 97-125. En: G.I. Andrade (ed.). Carpanta. Selva Nublada y Páramo. Editorial Presencia. Bogotá. [ Links ]
Reich, P.B. & R. Borchert. 1984. Water stress and tree phenology in a tropical dry forest in the lowlands of Costa Rica. Journal of Ecology 72: 61-74.
Ribera, M. O. 1995. Aspectos ecológicos del uso de la tierra y conservación en el Parque Nacional y Área Natural de Manejo Integrado Cotapata. pp. 1-82. En: C. B. Morales (ed.). Caminos de Cotapata. Instituto de Ecología, FUNDECO, FONAMA – EIA., La Paz.
Smith-Ramírez, C. & J.J. Armesto. 1994. Flowering and fruiting patterns in the temperate rainforest of Chiloé, Chile – ecologies and climatic constraints. Journal of Ecology 82: 353-365.
Sobral Griz, L.M & I.C. S. Machado. 2001. Fruiting phenology and seed dispersal syndromes in caatinga, a tropical dry forest in the northeast of Brazil. Journal of Tropical Ecology 17: 303-321.
Terborgh, J. 1986. Community aspects of frugivory in tropical forests. pp. 371-384. En: A. Estrada & T.H. Fleming (eds.). Frugivores and Seed Dispersal. Dr. W. Junk Publishers. Dordrecht. [ Links ]
Wallace, R.B. & R.L.E. Painter. 2002. Phenological patterns in a southern amazonian tropical forest: implication for sustainable management. Forest Ecology and Management 160: 19-33.
Wheelwright, N.T. 1986. A seven-year study of individual variation in fruit production in tropical bird-dispersed tree species in the family Lauraceae. pp. 19-35. En: Estrada, A. & T.H. Fleming (eds.). Frugivores and Seed Dispersal. Dr. W. Junk Publishers. Dordrecht. [ Links ]
Wright, S.J. & C.P. van Schaik. 1994. Light and the phenology of tropical trees. American Naturalist 143: 192-199.
Artículo manejado por: Bonifacio Mostacedo
Recibido en: Febrero de 2002.
Aceptado en: Abril de 2003.















