Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Ecología en Bolivia
versión impresa ISSN 1605-2528versión On-line ISSN 2075-5023
Ecología en Bolivia v.38 n.2 La Paz oct. 2003
ARTÍCULO
Composición por especies y uso de sustratos por las bandadas mixtas de aves en un bosque nublado andino de Bolivia
Species composition and substrate use by mixed-species bird flocks in an Andean cloud forest of Bolivia
Omar Martínez
Colección Boliviana de Fauna, Museo Nacional de Historia Natural,
Casilla 8706, La Paz - Bolivia. E-mail: o_martinez25@hotmail.com
Resumen
Mediante métodos de captura-recaptura, anillamiento, conteo por puntos y caminatas se estudió la composición específica de las bandadas mixtas y el uso de los sustratos de forrajeo por las aves en un bosque nublado de la Mina Copacabana, Cotapata (La Paz, Bolivia). Se observaron 25 bandadas mixtas completas y 32 incompletas durante 6 meses (abril a septiembre de 1997). Un total de 73 especies de aves de 9 familias fueron registradas, 33 (45%) integraban bandadas mixtas y 40 (55%) fueron solitarias. Las familias Thraupidae y Tyrannidae fueron las más representativas en los grupos mixtos con 13 y 5 especies, respectivamente. La tangara Anisognathus igniventris fue la especie más frecuente en la composición específica de las bandadas (en 16 de las 25 bandadas), mientras que el furnárido Margarornis squamiger estuvo en 10 bandadas. La tangara Buthraupis montana fue la especie más numerosa (45 individuos en 6 bandadas), seguido por el parúlido Myioborus melanocephalus (33 individuos en 9 bandadas). El dosel fue el estrato de forrajeo frecuentado por más especies en bandadas (22 en total, 12 exclusivas; 66.7%), seguido por el estrato medio (8; 24.2%) y el nivel bajo del bosque (3; 9.1%). Siete especies fueron clasificadas como parte del núcleo activo de la bandada, 7 del núcleo pasivo y 19 como acompañantes. Veinte (60.6%) de las 33 especies integrantes de las bandadas presentaron colores vivos y brillantes. El uso de substratos por las bandadas estuvo influenciado por las categorías hojas-ramas y epífitas con 26 y 16 especies, respectivamente. Siete especies de aves frecuentaron el substrato de bambú, de las cuales dos (Amblycercus holosericeus y Catamblyrhynchus diadema) fueron especialistas de este recurso. Encontramos mayor número de especies (33) en bandadas en la Mina Copacabana con relación a otros bosques como el de Cotapata (21 especies), Chuspipata (27) y los Montes Carpish (24). Nueve especies (p.e. Pseudocolaptes boissonneautii, Pyrrhomyias cinnamomea) integrantes de bandadas mixtas fueron comunes en la Mina Copacabana y los Montes Carpish. En general, encontramos mayor similitud entre las bandadas de la Mina Copacabana y Chuspipata.
Palabras claves: Aves, bandadas mixtas, bosque nublado, Bolivia, especies nucleares y acompañantes.
Abstract
Based on capture-recapture, color-banding, point counts, and random walk methods, the species composition of mixed-species feeding flocks and the relative use of various foraging substrates were studied in the cloud forest of the Mina Copacabana, Cotapata (La Paz, Bolivia). A total of 25 complete and 32 incomplete, mixed-species flocks were observed during a period of 6 months (April to September of 1997). A total of 73 species belonging to 9 families were registered, 33 (45%) formed mixed-species flocks and 40 (55%) were solitaries. Thraupids and Tyrannids were the best represented groups in the mixed-species flocks, with 13 and 5 species, respectively. The Scarletbellied Mountain-Tanager (Anisognathus igniventris) was the species most often observed in mixed-species flocks (being present in 16 of the 25 flocks) whilst the Pearled Treerunner (Margarornis squamiger) was present in 10 of the flocks. The Hooded Mountain-Tanager (Buthraupis montana) was the most numerous species (with a total of 45 individuals in 6 flocks) followed by the Spectacled Whitestart (Myioborus melanocephalus) with 33 individuals in 9 flocks. The canopy was the most frequently used foraging stratum (with a total of 22 species, 12 or 66.7% of which were exclusive to that stratum) followed by the midstory (8 species, 24.2%) and the lower strata (3 species, 9.1%). Seven species were classified as part of the active nucleus of the flock, 7 as to the passive nucleus and 19 as attendants. Twenty (60.6%) of the 33 species observed in the mixedspecies flocks were brightly coloured. The substrate use was influenced by the leaf-branch and the epiphyte categories, 26 and 16 species, respectively. Seven species used the bamboo substrate, two of which, the Yellow-billed Cacique (Amblycercus holosericeus) and the Plush-capped Finch (Catamblyrhynchus diadema) were bamboo specialists. A higher number of species forming mixedspecies flocks was found at the Mina Copacabana site (33 species) compared to the Cotapata (21), Chuspipata (27), and Montes Carpish (24) sites. Nine species (e.g. Pseudocolaptes boissonneautii, Pyrrhomyias cinnamomea) were frequent members of mixed-species flocks in both Mina Copacabana and Montes Carpish sites. In general, we encountered more similarities between Mina Copacabana and Chuspipata flocks.
Key words: Birds, mixed-species flocks, cloud forest, Bolivia, nuclear and attendant species.
Introducción
Los grupos o bandadas mixtas de aves se desarrollan principalmente en los bosques, ocurriendo desde los bosques tropicales más diversos hasta los bosques pobres en especies como la taiga. En los bosques montanos de Bolivia de la Cordillera Oriental de los Andes existen bandadas mixtas, que varían en composición y estructura con respecto a los bosques de tierras bajas amazónicas. Durante la temporada no reproductiva en particular, la mayoría de las especies de aves participan en bandadas mixtas y algunos individuos se unen a grupos solamente cuando un grupo mixto se encuentra alimentándose en su territorio. Hutto (1987) define a las bandadas mixtas de aves como un grupo de dos o más especies que ocurre dentro de un radio de 25 m y que se mueve en concierto, formando grupos de forrajeo que mantienen cohesión. La cohesión de los grupos mixtos es debida a las constantes interacciones entre individuos de diferentes especies. Estas interacciones incluyen señales visuales (movimientos o posturas que muestran colores notorios o brillantes del plumaje) y vocalizaciones (Vuilleumier 1970, Villaseñor 1995).
Moynihan (1962), Faaborg (1988), Villaseñor (1995) y Greenberg (2000) dan una clasificación para los diversos roles sociales que desempeñan las especies que forman parte de las bandadas mixtas de aves, agrupándolas en dos categorías: especies nucleares y especies acompañantes (de presencia regular e irregular). Las especies nucleares son aquellas cuyo comportamiento estimula la formación de la bandada o mantiene la cohesión entre sus individuos y se subdividen en dos grupos: activas y pasivas. Los individuos de las especies nucleares activas juntan y dispersan a los otros individuos y son los primeros en arribar a un determinado territorio. Allí se desplazan ágilmente por el dosel o sotobosque para luego llamar a los demás componentes. Las especies nucleares pasivas, en cambio, perchean en árboles emergentes a manera de centinelas, desde donde promueven el arribo del resto de los miembros acompañantes. Las especies acompañantes (o accidentales) aumentan el número de individuos de la bandada para evitar efectos de la depredación e incrementar la eficiencia alimentaria (Hutto 1988, Terborgh 1990). El comportamiento de centinela constituye una de las formas altamente evolucionadas de vigilancia y está asociada con la división de labor dentro del grupo. Munn (1984, 1985) distingue dos categorías de bandadas mixtas que habitan las zonas bajas del bosque amazónico lluvioso del Perú: las bandadas que viven en doseles de los árboles (canopy) y las que están en la vegetación interior del sotobosque (understory), donde cada tipo de bandada tiene un componente básico (núcleo) que varía entre 5 a 10 especies, mayormente aves insectívoras y cada especie está representada por un único individuo, una pareja o un grupo familiar.
Las hipótesis que explican el significado adaptativo de formar bandadas mixtas aducen ventajas en la eficiencia del forrajeo o la reducción de presiones de la depredación. Los análisis del uso espacial y de las características de los nichos ecológicos de forrajeo de las especies en bandadas, apoyan parcialmente ambas hipótesis. El presente estudio hace referencia a estos aspectos ecológicos y propone: i) determinar la composición específica en los grupos mixtos de aves del bosque húmedo (3.170-2.800 m) de la ceja de monte en la Mina Copacabana, Cotapata (La Paz) y ii) describir las posiciones de forrajeo, el uso de substratos y el posible rol social de las especies integrantes de las bandadas mixtas.
Área de estudio
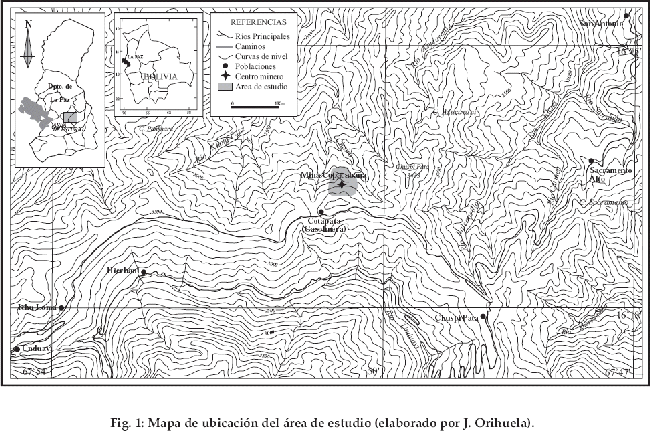
El área de estudio se ubica en la provincia Nor Yungas del departamento de La Paz y comprende a la ceja de montaña de la Mina Copacabana (16º17´S y 67º50´O) desde los 3.170 a 2.800 m (Fig. 1). El clima de la región es del tipo mesotérmico húmedo con lluvias permanentes, totalizando unos 3.120 mm anuales de precipitación (datos de SENAHMI para la localidad vecina de Unduavi a 3.022 m). El promedio de temperaturas a 3.010 m es de 10.1ºC, una humedad relativa del 97.5% y una evapotranspiración potencial de 41.23 mm para un bosque altimontano del Parque Nacional Cotapata (Bach et al. 2003). La estación seca (junio y julio) no es muy marcada en la región, pero presenta días despejados y secos que se alternan con días de neblinas mojadoras y lloviznas orográficas (localmente referido como chilchi) (Ribera 1995, Martínez 1999).
La vegetación del área de estudio se caracteriza por elementos transicionales del bosque montano y la ceja de montaña (2.800-3.400 m), cuya altura del dosel es 5-8 m en el límite superior y de 12-15 m en el inferior. Está caracterizada por un denso estrato inferior, cuyo elemento vegetal indicador es el bambú (Chusquea delicatula) (Ergueta 1993). En el estrato arbóreo abundan las epífitas como los musgos, aráceas, bromelias, helechos, orquídeas y líquenes. El dosel se encuentra dominado por especies siempreverdes como Clusia flaviflora, Clethra scabra, Weinmannia boliviana y Myrsine coriacea, así como de varias especies de Miconia que alcanzan alturas entre 8-10 m (Paniagua et al. 2003). Especies de árboles comunes en Cotapata son Myrica pubescens (Myricaceae), Brunellia sp. (Brunelliaceae) y Clusia (Clusiaceae), también están presentes dos especies de Weinmania (Cunnoniaceae), Freziera sp. (Theaceae) y muchas especies de Solanum (Solanaceae), Schefflera sp. (Araliaceae) y Gaiadendron sp. (Loranthaceae) (Remsen 1985).
Las actividades humanas en la región están relacionadas con la minería donde se explota el oro, wolfram, antimonio y bismuto. La utilización del mercurio para la amalgamación del oro en la Mina Copacabana es una práctica muy común en las pequeñas cooperativas. La extracción forestal en el área es evidente y la madera es destinada a la construcción de andamios, soportes de bocaminas y viviendas de los mineros. Por otra parte, es muy importante la recolección de leña para la cocina. Los pobladores de Chucura y Choro utilizan la madera del lambrán o aliso (Alnus acuminata) para mangos de picota y la yarisana (Befaria aestuans) para el labrado de manceras de arado y artesanías, entre otros (Cuellar et al. 1995, Martínez 1999).
Métodos
Composición específica de los grupos mixtos
Esfuerzo de capturas y anillamiento de aves
El esfuerzo de trampeo se expresó en unidades de horas-red niebla (HRN), igual a la apertura de una red niebla de 12 m durante una hora (Ralph et al. 1994). Se totalizó 1.267 HRN distribuidos en 3 días por mes y durante 6 meses. La distribución del esfuerzo de capturas en redes por mes fue de 219.3 HRN (abril), 197.5 (mayo), 233.15 (junio), 222.55 (julio), 195.7 (agosto) y 198.9 (septiembre) de 1997. Las aves capturadas fueron registradas en formularios que incluyeron datos biométricos (largo total, largo del ala, largo de la cola, tarso, pico, envergadura y peso), observaciones generales sobre el estado de desarrollo de los individuos y características anatómicas (muda, presencia de grasa, protuberancia cloacal, parche de incubación y otros). Para establecer cambios en la composición de bandadas particulares (Hutto 1987), se marcó con anillos plásticos de color en combinaciones únicas de colores a 155 individuos, de los cuales 83 fueron integrantes de bandadas mixtas.
Conteo por puntos
Dentro de la parcela de estudio (12 ha) se seleccionaron ocho sitios que por su topografía (riscos, abras y filos de las laderas) permitían mejor visualización y desde donde se realizó los conteos por puntos (point counts) de las aves componentes de grupos mixtos usando binoculares Bushnell 8x35 y Samsung 10x25. Ralph et al. (1993, 1994), indican que la distancia mínima entre los puntos de conteo debe ser de 250 m y un radio de observación de 50 m adecuado para bosques templados o zonas abiertas. En este estudio, se consideró una distancia aproximada de 200 m entre puntos y un radio de 25 m con relación a Hutto et al. (1986), debido a las condiciones topográficas del lugar y la espesura del bosque. En cada sitio, se observó durante un período de tres minutos desde el arribo de la bandada para registrar el número de individuos y especies (un lapso mayor de tiempo tiende a contar un individuo dos veces produciendo un sesgo en las estimaciones) y de 15 minutos con el fin de estimar el uso de estratos (niveles), substratos y el rol social de las especies. Se realizó dos sesiones diarias (15 minutos por sitio), una en la mañana (06:30-08:30) y otra en la tarde (16:0018:00) con un esfuerzo de muestreo diario de 4 horas, 12 horas/mes, totalizando 72 horas en 6 meses.
Caminatas aleatorias
Durante el trabajo de campo, se realizaron caminatas aleatorias (random walks) cubriendo todos los lugares posibles de la parcela de estudio para monitorear a las aves anilladas, revisar las redes abiertas, complementar inventarios y registrar la distribución espacial en los diferentes estratos. El esfuerzo de muestreo de las caminatas aleatorias fue de seis horas diarias, distribuidas en tres horas por la mañana (09:00 – 12:00) y tres por la tarde (13:00 – 16:00), totalizando 18 horas/mes y 108 horas durante los seis meses de muestreo.
Estratificación vertical del bosque
La evaluación del uso de los estratos del bosque por las especies de aves integrantes de las bandadas mixtas se realizó en base a dos parámetros. Por un lado, se dividió el perfil del bosque en cinco niveles: suelo del bosque, estrato más bajo (0.1-2 m), medio (2-5 m), sub-dosel (5-8 m) y dosel (>8m) para hacer comparaciones con los datos para Carpish (Perú) de Vuilleumier (1970) y los datos para Cotapata y Chuspipata de Remsen (1985). Además, se calculó la posición relativa en el perfil para cada especie integrante de bandadas mixtas a partir de la relación = altura desde el suelo hasta el individuo observado/altura desde el suelo + distancia al dosel, de manera que especies con valores cercanos a 1.0 son propias del dosel y aquellas con valores tendientes a cero usan principalmente el suelo del bosque (Remsen 1985).
Uso de los substratos del bosque por las aves en bandadas mixtas
Las observaciones de aves integrantes de bandadas mixtas fueron asignadas a siete categorías de substratos de forrajeo: bambú, musgo, corteza, aire, hojas-ramas, epífitas y hojarasca siguiendo a Remsen (1985). La categoría de epífitas incluyó a las bromelias (Guzmania, Racinaea y Tillandsia en Paniagua et al. 2003), líquenes fruticosos (Hypotrachyna, Usnea y Stereocaulon en Anze 1996) y líquenes foliosos (Ramalina, Umbilicaria y Parmelia, estas dos últimas en Beck & García 1991). En la categoría de hojarasca, también se consideró a las hojas muertas suspendidas o follaje seco del bosque. Se consideró el grado de afinidad de las aves por cierto substrato sobre la base del porcentaje de registros para cada especie. Una especie fue considerada especialista, sólo si el uso de un substrato fue en al menos el 75% de sus intentos de forrajeo (Sillett 1994).
Rol social de las especies en bandadas mixtas
En base a las definiciones de especies nucleares activas, pasivas y las acompañantes (Moynihan 1962, Vuilleumier 1970, Greenberg 2000) se examinó la frecuencia de participación de las distintas especies en las bandadas. Las especies fueron clasificadas de acuerdo al grado de participación en bandadas: las nucleares activas están en la mayoría (>60% de los registros) de las bandadas, las pasivas en una proporción intermedia (30-60%) y las acompañantes (ocasionales) en una proporción baja (<30%). Además, se evaluó la contribución en número de individuos, el color y el tipo de vocalización de cada especie en relación a la clasificación propuesta.
Resultados
Composición numérica y específica de las bandadas mixtas
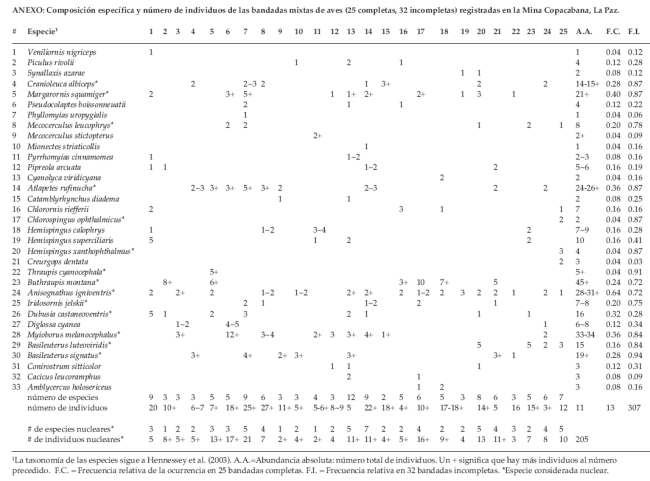
Luego de un esfuerzo de muestreo de 1.267 horas-red niebla, 108 horas de caminatas y 72 horas de conteo por puntos, se produjo el registro de 25 bandadas mixtas completas (más 32 incompletas) y la captura de 199 individuos en la parcela de estudio (Tabla 1 y Anexo).

Se determinó que de 73 especies de aves registradas (39 confirmadas por capturas), 33 (45%) especies integraron los grupos mixtos y 40 (55%) fueron consideradas solitarias (Fig. 2).
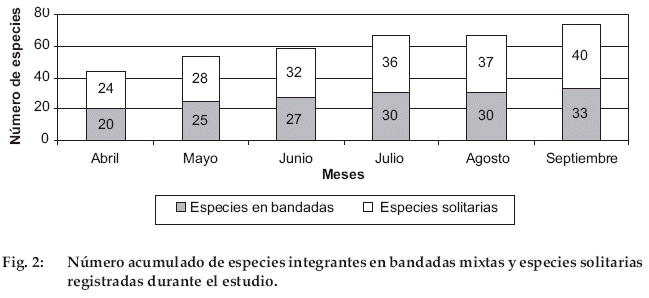
Las especies solitarias se incrementaron en una proporción de cuatro especies por mes durante los cuatro primeros meses y un promedio de 3.2 durante las seis campañas, mientras que las especies en bandadas en una proporción de 2.6 por mes (entre julio y agosto no hubo incremento de especies, Fig. 2). La familia Thraupidae fue la más rica en especies participantes con 13, seguida por Tyrannidae con cinco; mientras que en las especies solitarias, la más numerosa fue Tyrannidae con ocho especies, seguida de Trochilidae con seis; así mismo, siete especies descritas para el suelo del bosque (Grallaria erythrotis, G. rufula, Grallaricula ferrugineipectus, Scytalopus simonsi, S. parvirostris, S. schulenbergi y S. bolivianus) fueron solitarias (Fig. 3).

Entre las especies solitarias, también se incluyen a las familias Accipitridae, Ramphastidae, Cracidae, Phasianidae, Caprimulgidae, Falconidae, Strigidae e Hirundinidae presentes en el área (Martínez, datos no publicados). La curva acumulativa de especies de aves integrantes de bandadas mixtas muestra un comportamiento que tiende a una asíntota hacia las 30 especies (Fig. 4).
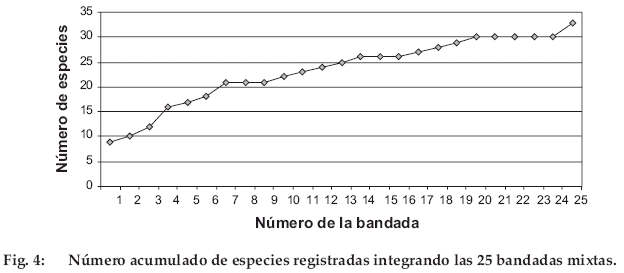
Las bandadas más diversas fueron la 13 y 14 con 12 y 9 especies, respectivamente. Las bandadas más numerosas fueron la 6 y 7 con 25+ y 27+ individuos, respectivamente. Anisognathus igniventris y Margarornis squamiger fueron las especies más frecuentes en las bandadas, estuvieron en 16 (64%) y 10 (40%) de las 25 bandadas completas, respectivamente. Basileuterus signatus y Thraupis cyanocephala estuvieron en el 94 y 91% de las bandadas incompletas (Anexo). Buthraupis montana (Thraupidae), Myioborus melanocephalus (Parulidae), Anisognathus igniventris (Thraupidae) y Atlapetes rufinucha (Emberizidae) fueron las especies más abundantes con 45+, 33-34, 28-31 y 24-26+ individuos totales en 6, 9, 16 y 9 bandadas presentes, respectivamente (Anexo).
En base a la composición específica (Anexo), pueden diferenciarse cuatro tipos de bandadas mixtas dominadas por: A) insectívoros pequeños en el dosel, B) frugívoros pequeños en el dosel, C) insectívoros pequeños en el sotobosque y D) omnívoros grandes en el dosel.
Una bandada de tipo A consiste en Hemispingus superciliaris (4-6 individuos),H. xanthophthalmus (2-4), Chlorospingus ophthalmicus (2-5), Conirostrum sitticolor (2), Margarornis squamiger (2-3), Myioborus melanocephalus (4-5), Dubusia castaneoventris (1), Mecocerculus leucophrys (1), M. stictopterus (2), Pseudocolaptes boissonneautii (1-2), Chlorornis riefferii (1-2), Veniliornis nigriceps (2) y a veces Creurgops dentata (2-3). Una bandada de tipo B incluye a Anisognathus igniventris (4-6), Iridosornis jelskii (2), Thraupis cyanocephala (4-6), Diglossa cyanea (1-4) y Mionectes striaticollis (1). Una bandada de tipo C incluye a Basileuterus luteoviridis (4), Atlapetes rufinucha (4), Cranioleuca albiceps (2) y Catamblyrhynchus diadema (2-4), a veces Hemispingus caloprhys (4-8). Finalmente, una bandada de tipo D típica incluye a Buthraupis montana (6-12), Cacicus leucoramphus (4-6), Piculus rivolii (1) y a menudo Cyanolyca viridicyana (2-4). En este último grupo, a veces Buthraupis montana y Piculus rivolii ocurren en bandadas monoespecíficas.
Las aves anilladas de bandadas mixtas demostraron ser: 1) residentes de un determinado territorio (Basileuterus signatus, Atlapetes rufinucha), 2) integrantes regulares de las bandadas (Anisognathus igniventris, Margarornis squamiger) y 3) especies que cambian temporalmente de acuerdo con la época reproductiva (Hemispingus xanthophthalmus, Chlorospingus ophthalmicus).
Estratificación vertical del bosque
Tres especies de aves forrajearon consistentemente a grandes alturas (Hemispingus superciliaris, Dubusia castaneoventris y Cacicus leucoramphus), y otras tres especies fueron las más representativas de los niveles bajos del bosque (Synallaxis azarae, Catamblyrhynchus diadema y Basileuterus signatus). Las especies con distancia promedio más corta al dosel fueron Pipreola arcuata, Piculus rivolii y Mionectes striaticollis (Tabla 2).
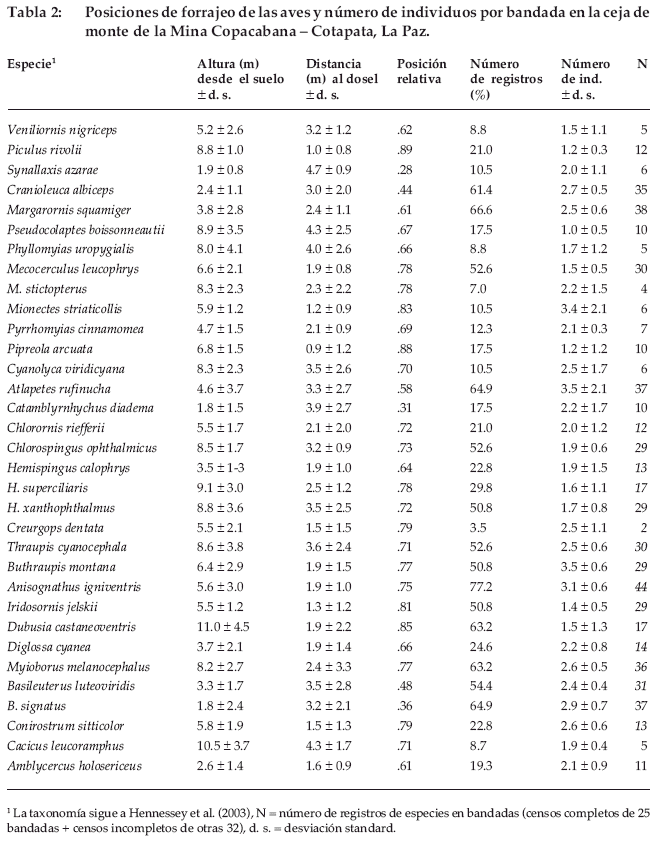
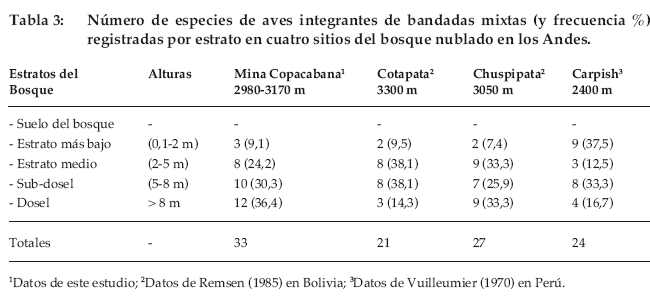
La posición relativa en la distribución vertical del bosque fluctuó en el rango de 0.67 a 0.89 para las 22 especies del dosel, entre 0.44 a 0.66 para las ocho especies del estrato medio y entre 0.28 a 0.36 para las tres especies de los estratos bajos (Tabla 2). Al asignar las 33 especies registradas en bandadas a cinco estratos verticales, vemos que la mayor parte de las especies usaba el dosel y subdosel (Tabla 3). Esta distinción se compara con otros estudios similares más adelante (ver Discusión).
La vegetación donde se ha observado forrajeando a los grupos mixtos de aves está representada por las especies arbóreas: Tibouchina cf. bicolor y Miconia boliviensis (Melastomataceae); entre las especies arbustivas: Siphocampylus aff. boliviensis (Campanulaceae), Monnina cf. bridgesii (Polygalaceae), Symbolanthus calygonus (Gentianeaceae), Agalinis cf. lanceolata (Scrophulariaceae), Cavendishia bracteata y Gaultheria bracteata (Ericaceae), Fuchsia boliviana y F. cf. sanctae-rosae (Onagraceae), entre las epífitas y lianescentes: Sobralia cattleya (Orchidaceae) y Passiflora insignis (Passifloraceae) (E. García, 1998 com. pers.; Martínez 1998). La tangara, Thraupis cyanocephala, forrajea activamente en Monnina cf. bridgesii y Chlorospingus ophthalmicus en Bocconia cf. integrifolia (Papaveraceae).
Uso del sustrato
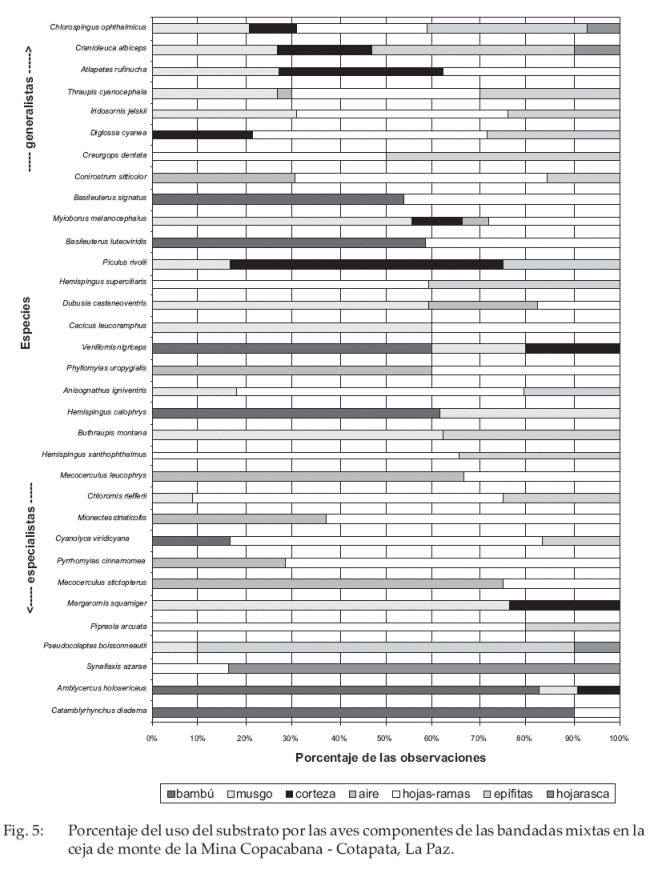
El uso del sustrato por las aves estuvo influenciado por la categoría hojas-ramas y epífitas (bromelias, musgos y líquenes) con 26 y 16 especies, respectivamente. Seis especies (p. e. Pseudocolaptes boissoneautii, Margarornis squamiger, con 10 y 38 registros de uso de substratos por especie, respectivamente) estuvieron presentes en > 75% de los registros y fueron consideradas especialistas (Fig. 5).
Al sustrato de bambú se encontraron asociadas siete especies, dos fueron consideradas especialistas (Catamblyrhynchus diadema y Amblycercus holosericeus) de este recurso. Al sustrato de musgos se asociaron 17 especies, de las que Margarornis squamiger (Furnariidae) fue especialista en picotear musgos. Dubusia castaneoventris y Buthraupis montana (Thraupidae) también forrajearon en ramas cubiertas por musgos. Las especies encontradas con preferencia en las epífitas fueron 16, el furnárido Pseudocolaptes boissonneautii fue considerado especialista en epífitas con relativa frecuencia, forrajeando en bromelias tanque para buscar insectos. En la hojarasca (junto al follaje seco suspendido) se asociaron dos especies propias de los estratos inferiores del bosque, Cranioleuca albiceps y Synallaxis azarae; esta última fue considerada especialista de este recurso, cuyos intentos de forrajeo alcanzaron el 83% de los registros. Pipreola arcuata fue el único especialista en hojas-ramas, frecuentemente buscando bayas y frutos de Moraceae y Melastomataceae en una posición horizontal media a externa de las ramas laterales de los árboles (ver Fig. 5).
Asociadas a la corteza se encontraron tres especies, Cranioleuca albiceps, Margarornis squamiger y Atlapetes rufinucha.Las dos primeras especies trepan ágilmente muy adheridas a la corteza de los troncos, a manera de un trepatroncos (Dendrocolaptidae). Al espacio aéreo estuvieron asociadas 10 especies: i) cinco de Tyrannidae, Mecocerculus leucophrys, M. stictopterus, Phyllomyias uropygialis, Mionectes striaticollis y Pyrrhomyias cinnamomea, las cuales primariamente “perchean” en ramas y atrapan insectos en pleno vuelo acrobático, ii) las tangaras Dubusia castaneoventris, Chlorospingus ophthalmicus y Thraupis cyanocephala y iii) los parúlidos Myioborus melanocephalus y Conirostrum sitticolor, exclusivos del dosel. En el sustrato de hojas-ramas, registramos 26 especies, dos tangaras (Hemispingus xanthopthalmus y Creurgops dentata), que frecuentan regularmente este substrato.
Posibles roles de las especies integrantes en bandadas
Las bandadas mixtas de aves de la ceja de monte en la Mina Copacabana (Cotapata) parecen estar estructuradas principalmente por la familia Thraupidae (13 especies), de las cuales siete tangaras fueron aparentemente nucleares. Sin embargo, siete especies de aves de varias familias (p. e. Atlapetes rufinucha, Myioborus melanocephalus) también estuvieron presentes en > 60% de las bandadas mixtas y fueron consideradas como especies nucleares activas. Igualmente, siete especies (p. e. Mecocerculus leucophrys, Basileuterus luteoviridis) entre el 50.8-54.4%, fueron consideradas nucleares pasivas y 19 especies (p. e. Diglossa cyanea, Conirostrum sitticolor) en < 30%, fueron probablemente acompañantes (Tabla 2). Anisognathus igniventris y Margarornis squamiger alcanzaron los porcentajes más altos en los registros de especies en bandadas con 77.2 y 66.6%, respectivamente. Los porcentajes más bajos en los registros fueron para Mecocerculus stictopterus y Creurgops dentata con 7 y 3.5%, respectivamente; aunque esto puede ser un artefacto de muestreo, puesto que la primera ave es muy difícil de detectar visualmente y la segunda fue visitante en la zona (2.800 m), dado que ocurre por debajo de los 2.500 m.
Veinte (61%) de las 33 especies integrantes de las bandadas mixtas presentan colores vivos y brillantes, de igual forma 19 (58%) vocalizan ruidosamente. Por el contrario, 13 (39%) presentan color neutro y 14 (42%) vocalizan moderadamente. Comparando el rol social (basado en % de presencia en bandadas) con el uso del dosel, color y vocalizaciones de las aves, resultó que nueve especies consideradas nucleares fueron exclusivas del dosel, 10 tenían color vivo y cuatro neutro, de las cuales, nueve se consideraron ruidosas y cinco de vocalización moderada. En el caso de las 19 especies acompañantes, 13 frecuentaron la copa de los árboles, 10 eran de color vivo y nueve de color neutro. Si bien siete especies nucleares (p. e. Anisognathus igniventris, Iridosornis jelskii) eran de coloración viva y exclusivas del dosel, también siete son acompañantes (p. e.Cyanolyca viridicyana, Chlorornis riefferii).
Discusión
Composición de las bandadas mixtas
La composición de una bandada mixta está estrechamente relacionada con el tipo de hábitat donde interactúa. Aunque existe un recambio en la cantidad de individuos y especies a través del tiempo y el espacio, la mayoría de los integrantes ocupan el rango entero de desplazamiento de la bandada. Este patrón es similar a las bandadas mixtas descritas en Perú por Munn & Terborgh (1979), donde 12 especies fueron conocidas por defender un territorio común. Herzog et al. (2000, 2002) determinaron que las bandadas de un bosque de Polylepis (3.710 m) en Cochabamba (Bolivia) no fueron territoriales y que la estructura fue mucho más disgregada, que las bandadas de tierras bajas. En nuestro estudio, la composición de especies fue estable, el marcaje con anillos (a partir de los individuos recapturados) demostró fidelidad en los sitios de forrajeo y los patrones de agrupamiento no fueron aleatorios, sino que responden a ciertos patrones etológicos propiciados por ciertas especies nucleares (p. e. Myioborus melanocephalus, Anisognathus igniventris). Estudios de bandadas mixtas con anillos de color han revelado importantes distinciones entre bandadas de especies mixtas y el rol de las tangaras en ellas (Isler & Isler 1987). En la Mina Copacabana, se ha determinado la influencia muy marcada de las tangaras (Thraupidae) en la composición de las bandadas con 13 1especies (36%) con relación a Tyrannidae con 5 especies (15%) , mientras que Furnariidae y Parulidae, ambos con 4 especies (12%). Las bandadas mixtas de aves en formaciones boscosas son típicamente grandes y se desarrollan a partir de individuos integrantes regulares, como ha sido demostrado por estudios con anillos de colores (Gradwohl & Greenberg 1980, Munn 1985, Hutto 1988). Munn & Terborgh (1979) y Greenberg (2000) indican que la riqueza de las bandadas del sotobosque amazónico fluctúa entre 30-35 especies, así mismo Villaseñor (1995) indica que los grupos mas ricos en especies en México corresponden al bosque de pino-encino en las tierras altas del Oeste con un promedio de 18.6 especies. Nuestros datos (33 especies) están dentro del rango para las bandadas del sotobosque amazónico y el promedio de 8.7 especies para la Mina Copacabana se encuentra por debajo de los bosques de tierras altas de México. El número de individuos en las bandadas mixtas no siempre aumenta en una proporción directa al número de especies por bandada, en el estudio se determinó que algunas bandadas como la # 5 con cinco especies, presentó 18 individuos, seis de los cuales pertenecieron a Buthraupis montana; esta especie es común observarla en grandes grupos de 812 individuos (en una ocasión [13 junio 1997] a horas 16:15 se capturaron cuatro individuos en una sola red niebla de 12 m). Es decir, algunas especies aportan al total con más individuos que otras especies, pero en general, las bandadas en la Mina Copacabana estuvieron compuestas por pocos individuos por especie.
Cambios estacionales en la composición de las bandadas parecen ser patrones poco frecuentes. No obstante, tres especies de tangaras en bandadas (Chlorospingus ophthalmicus, Hemispingus xanthopthalmus y Creurgops dentata) aparecieron en el último mes de muestreo (septiembre), después de casi una constante de 30 especies (ver Fig. 4). La tangara C. dentata fue observada en solo dos ocasiones: i) el 14 de septiembre de 1997 a 2.750 m, una pareja asociada con Chlorospingus ophthalmicus, Atlapetes rufinucha, Dubusia castaneoventris y Myioborus melanocephalus, ii) 2-3 individuos fueron observados el 31 de mayo de 1999 a 2.750 m, forrajeando en una bandada mixta junto con Chlorospingus ophthalmicus, Hemispingus xanthopthalmus, Conirostrum sitticolor y otros. Creurgops dentata ocurre entre los 1.500-2.150 m (Isler & Isler 1987, Fjeldså & Krabbe 1990). En Bolivia esta especie se encuentra entre los 1.600-2.200 m (Arribas et al. 1995). Los registros podrían ser los de mayor altitud (2.750 m) para la especie. Ciertas especies como Hemispingus superciliaris son comunes en el límite superior del transecto (3.170 m) y son observados en bandadas, pero en el límite inferior (2.800 m) parecen interactuar con H. trifasciatus a diferentes alturas del bosque, tal como lo afirma Remsen (1985), pero nuestras observaciones sobre este aspecto fueron muy pocas para confirmar este hecho.
Análisis comparativo de las bandadas mixtas de la Mina Copacabana con otros sitios similares
En la ceja de monte de la Mina Copacabana (3.170-2.800), 33 especies (de un total de 73 registradas) fueron observadas en bandadas mixtas durante seis meses de muestreo. Se trata de un número relativamente alto, si comparamos con los datos de Remsen (1985) para las regiones de Cotapata (3.300 m) y Chuspipata (3.050 m), aledañas a la anterior, donde este autor encontró 21 (de un total de 48 especies registradas en 28 días de muestreo) y 27 especies (de 74 especies en 14 días de muestreo) en bandadas mixtas, respectivamente. De igual forma, Vuilleumier (1970) determinó 24 especies en bandadas mixtas en los Montes Carpish (2.670 m) de Huánuco, Perú. En la Mina Copacabana, 12 (36%) especies asociadas a bandadas mixtas se encuentran en el dosel del bosque, a diferencia de Cotapata, ubicado a 2.5 km de nuestra área de estudio, donde Remsen (1985) solo encontró tres (14%) especies para este estrato. Asimismo, 10 especies (30%) frecuentan el sub-dosel y entre los dos estratos representan el 67%, indicando una preferencia muy marcada por los niveles altos del bosque. De la misma forma, ocho especies (24%) se encuentran en el estrato medio y tres (9%) frecuentan los niveles bajos del bosque (ver Tabla 3).
Las bandadas mixtas de tipo A de la Mina Copacabana son casi similares a las reportadas por Remsen (1985) para Chuspipata (3.050 m), a excepción de Conirostrum sitticolor que no forma parte de las bandadas en Chuspipata y contrariamente Lepidocolaptes affinis y Troglodytes solstitialis no integraron bandadas en la Mina Copacabana. Las bandadas de tipo B de la Mina Copacabana incluyen a Iridosornis jelskii y Mionectes striaticollis, no presentes en Chuspipata, pero sí en Cotapata (3.330 m) (Remsen 1985). Las tangaras Tangara vassorii y Thlypopsis ruficeps incluidas en algún tipo de bandadas para Chuspipata (Martínez, obs. pers.) no han sido observadas en grupos mixtos en la Mina Copacabana, son visitantes en el área. Las bandadas del sotobosque (Tipo C) de la Mina Copacabana son virtualmente similares a las de Cotapata y Chuspipata, a excepción de Ochthoeca rufipectoralis que no forma grupos mixtos en nuestra área de estudio. Los grandes omnívoros del dosel (Tipo D) son idénticos en la Mina Copacabana con respecto a Cotapata y Chuspipata. Remsen (1985) incluye a los tiránidos: Myiophobus ochraceiventris y Elaenia albiceps en grupos mixtos de los tipos A y C, respectivamente; en nuestro estudio estas especies no fueron observadas en grupos mixtos. En general, encontramos mayor similitud entre las bandadas de la Mina Copacabana y Chuspipata.
Vuilleumier (1970) indica que las especies Cyanolyca viridicyana (Corvidae) y Cacicus leucoramphus (Icteridae) forman bandadas monoespecíficas; Mecocerculus stictopterus y Mionectes striaticollis(Tyrannidae) no muestran comportamiento gregario alguno en los Montes Carpish de Huánuco (Perú). No obstante, en nuestro estudio se ha podido evidenciar que las cuatro especies muestran cierto grado de asociación a los grupos mixtos en la categoría de acompañantes. Vuilleumier indica que Entomodestes leucotis y Diglossa caerulescens son miembros de bandadas mixtas en los Montes Carpish, pero en nuestra área de estudio estas especies son solitarias. En el caso de Margarornis squamiger y Chlorornis riefferii en Perú Central, Ecuador y Colombia están frecuentemente en pequeñas bandadas mixtas (Remsen 1985). En nuestro estudio, estas especies ocurren primariamente como parejas o son solitarios. De las 24 especies de aves integrantes en bandadas mixtas en los bosques montanos del Carpish (Perú), nueve especies (Pseudocolaptes boissonneautii, Pyrrhomyias cinnamomea, Pipreola arcuata, Catamblyrhynchus diadema, Chlorornis riefferii, Thraupis cyanocephala, Buthraupis montana, Myioborus melanocephalus y Basileuterus luteoviridis) son integrantes de grupos mixtos en la ceja de monte de la Mina Copacabana.
Las aves integrantes de bandadas mixtas exclusivas del dosel fueron muy representativas en la Mina Copacabana con 12 especies (36%), con relación a Remsen (1985), quién solo encontró tres (14%, ninguna fue insectívora) en un bosque húmedo de Cotapata ubicado a 2.5 km de nuestra área de estudio y nueve (33%) especies en Chuspipata a 7.5 km (ver Tabla 3). Esto podría deberse al efecto de borde influenciado por la carretera que discurre por estas localidades ubicadas en la meseta de los cerros Cotapata (3.300 m) y Chuspipata
(3.050 m), donde la altura del bosque es más baja (8-10 m). Young (1994) ha discutido el impacto de las carreteras sobre la zona del bosque tropical montañoso húmedo de los Andes, indicando que las mismas aumentan frecuentemente la inestabilidad d e las laderas, una limitada capacidad de la vegetación para recuperarse (resiliencia limitada) y sus efectos sobre numerosas especies de aves que son especialistas altitudinales o de rango de distribución restringida. En nuestra área de estudio, el bosque es más alto (10–15 m) y el impacto del ruido de las movilidades y maquinas de la gasolinera y constructoras de caminos tiene menor incidencia debido a la distancia (5 km) a la cual se encuentra, cuyo acceso solo es posible a través de senderos.
Uso de los sustratos
Ciertas especies en bandadas mixtas han demostrado ser especialistas de algunos recursos alimenticios. Formaciones vegetales con bambú (Chusquea sp.) en los bosques neotropicales soportan una avifauna única (Remsen 1985). En nuestro estudio, especialistas del bambú resultaron ser dos especies: Catamblyrhynchus diadema (Thraupidae) y Amblycercus holosericeus australis (Icteridae) con 90 y 81.8% de los registros de uso, respectivamente. Catamblyrhynchus diadema disgrega insistentemente a nivel de los nodos del tallo de bambúes, presumiblemente para descubrir insectos en la típica maniobra “pull” descrito por Remsen & Robinson (1990). Kratter (1993) describe poblaciones de A. h. holosericeus, especialistas de bambú en tierras altas de Costa Rica y reconoce a A. h. australis, también especialista de este recurso en los Andes. En la parcela de estudio A. h. australis ha sido observada en el bosque de neblina (2.850-3.100) con predominancia de bambú (Chusquea delicatula). En el substrato de epífitas, 16 especies han sido encontradas en algún grado de preferencia, pero Pseudocolaptes boissonneautii ha sido considerada especialista de epífitas, cuyos intentos de forrajeo (80%) en bromelias fueron considerablemente frecuentes. Sillett (1994) y Sillett et al. (1997) describieron la especialización del forrajeo en bromelias por Pseudocolaptes lawrencii (Furnariidae) en Costa Rica y encontraron que el 74% de los intentos de forrajeo fueron en bromelias epifíticas y las presas preferidas fueron insectos (dermápteros, ortópteros, coleópteros) y arácnidos. Nadkarni & Matelson (1989) indican que Piculus rivolii, Pseudocolaptes boissonnautii, Myioborus melanocephalus, Buthraupis montana, Chlorornis riefferii, Atlapetes rufinucha y Cacicus leucorhamphus forrajean en musgos y briófitas. En nuestro estudio, estas especies también fueron observadas forrajeando en musgos y briófitas, a excepción de Atlapetes rufinucha. Remsen (1985) indica que Cranioleuca albiceps y Atlapetes rufinucha usan una combinación de substratos (hojas muertas, musgos, corteza y hojas verdes), mientras que en nuestro estudio Cranioleuca albiceps y Synallaxis azarae frecuentan la hojarasca y hojas muertas suspendidas; Atlapetes rufinucha usa una combinación de substratos (corteza de los árboles, musgos, hojas y ramas).
Rol de las especies en bandadas versus uso de estratos, vocalizaciones y colores de las aves
Greig-Smith (1978) y Greenberg (2000) indican la importancia de las vocalizaciones en las especies nucleares para promover la cohesión de las bandadas mixtas. Powell (1979) sugiere que ciertas vocalizaciones (cantos y llamadas en pleno vuelo) de Basileuterus tristriatus promueven la agrupación de especies acompañantes. Por otra parte, muchos autores han apuntado la importancia de las características del plumaje de las aves para promover agrupaciones interespecíficas (Greenberg 2000). En el estudio, tres especies de tangaras (Thraupis cyanocephala, Buthraupis montana e Iridosornis jelskii), consideradas nucleares y exclusivas del dosel del bosque, tienen colores vivos, pero sólo las dos primeras especies tienen vocalizaciones ruidosas. Buthraupis montana puede reunir individuos de su especie y también promover la cohesión intra e interespecífica por sus vocalizaciones en coro y llamadas en pleno vuelo. Sólo una especie nuclear Margarornis squamiger presenta coloración neutra y vocalización discreta, pero sus movimientos activos entre troncos y cortezas en el sotobosque parecen estimular el arribo de especies acompañantes. En la ceja de monte de la Mina Copacabana, 20 especies (61%) de las 33 en bandadas mixtas presentan colores vivos y brillantes. En los bosques húmedos del Carpish en Perú, 16 especies (67%) de las 24 muestran colores brillantes (Vuilleumier 1970, Villaseñor 1995). En los grupos descritos en Ghana (Africa), la especie nuclear, Parus leucomelas atrae a otras especies de aves debido a sus barras alares conspicuas, sus movimientos activos y vocalización fuerte (Greig-Smith 1978, Villaseñor 1995). En el estudio, las especies Anisognathus igniventris (Thraupidae) y Myioborus melanocephalus (Parulidae) atraen a otras especies de aves debido al color rojo brillante en el vientre de la tangara y el color amarillo intenso más las vocalizaciones fuertes en el caso del parúlido y en ambos sus movimientos activos, así mismo estas especies fueron frecuentes en el 77.2 y 63.2% de las bandadas y fueron consideradas nucleares.
Algunas especies aparentemente acompañantes (Cyanolyca viridicyana, Piculus rivolii, Chlorornis riefferii, Catamblyrhynchus diadema y Cacicus leucoramphus) también presentan colores de plumaje brillantes y vocalizan ruidosamente, pero la mayoría de estas especies forman primariamente bandadas monoespecíficas. Cacicus leucoramphus suele asociarse con Buthraupis montana en el dosel del bosque para alimentarse de bayas, insectos y néctar; pero a menudo forrajea en bandadas monoespecíficas, ejecutando fuertes vocalizaciones y el plumaje amarillo brillante del dorso inferior sólo se hace notorio en pleno vuelo. Otras especies asignadas como acompañantes con plumaje vistoso pero con vocalización moderada (Pipreola arcuata, Diglossa cyanea, Hemispingus calophrys, H. superciliaris, Conirostrum sitticolor) son ocasionales o poco frecuentes en bandadas mixtas. Fjeldså & Krabbe (1990) indican que P. arcuata se encuentra solitario o en pareja y a veces ocurre en bandadas mixtas. Pipreola arcuata pese a tener un color brillante (verde en el dorso y amarillo en el vientre), las barras negras ventrales en forma listada le proporcionan cierto camuflaje en el denso follaje del bosque nublado.
El rol de las diferentes especies en bandadas mixtas puede variar con relación a la estación o localidad (Isler & Isler 1987). Buskirk et al. (1972) han determinado como especie nuclear a Chlorospingus ophthalmicus en bosques montanos de Panamá, pero en otra localidad de Panamá con bosques similares al anterior, C. ophthalmicus es tan solo una especie acompañante (Powell 1979). En la Mina Copacabana, la especie en cuestión ha sido considerada nuclear. En San Vicente (a 2 km de Chuspipata, a 2.700 m) observamos una bandada del interior del bosque compuesto por las tangaras Dubusia castaneoventris (solitario), Thlypopsis ruficeps (3 individuos) y Chlorospingus ophthalmicus (2-3), el emberízido Atlapetes rufinucha (5-7), el tiránido Mecocerculus leucophrys (2-5) y el parúlido Myioborus melanocephalus (3), donde C. ophthalmicus parecía actuar también como especie nuclear (Martínez, datos no publicados).
En definitiva, parece existir poca consistencia entre los atributos de las especies clasificadas como nucleares activas, pasivas y las acompañantes con relación a los atributos morfológicos o de comportamiento de las especies, por lo que se recomienda la realización de análisis más detallados para comprender el rol de las especies en los sistemas sociales de forrajeo de las aves.
Agradecimientos
El presente trabajo fue posible con el apoyo financiero de la Liga de Defensa del Medio Ambiente (LIDEMA) a quién expreso mi enorme gratitud. A Mario Baudoin, Susan E. Davis y Marco Octavio Ribera por supervisar el proyecto. A Byron Swift del Law Environmental Institute (Washington) por su contribución bibliográfica y por su colaboración en campañas de campo en Cotapata. A la Colección Boliviana de Fauna (CBF) por su apoyo brindado, tanto por ofrecerme un espacio de trabajo como por proporcionarme materiales y acceso a la bibliografía necesaria. Mi agradecimiento a Carmen Quiroga por sus atenciones con el equipo y material de campo. A Jon Fjeldså del Zoological Museum-University of Copenhagen (Dinamarca) por la revisión y sugerencias al proyecto. Mi reconocimiento más sincero a Damián I. Rumiz del Museo de Historia Natural Noel Kempff Mercado por su minuciosa revisión y contribución al manuscrito. A José Villaseñor de Morelia (México) por su contribución bibliográfica y por sus aportes al trabajo. Un agradecimiento especial a Emilia García del Herbario Nacional de Bolivia por su colaboración en la identificación de las colecciones botánicas. Brian Woods del Club Pro-Aves “Jamachis” contribuyó con sus observaciones y la versión en inglés del resumen. Kazuya Naoki de Louisiana State University Museum of Natural Science aportó con observaciones finales al manuscrito. A Jan Ohlson del Naturhistoriska Museet Goteborg (Suecia) por su compañía en campañas complementarias y finalmente a un revisor anónimo.
Referencias
Anze, R. 1996. Líquenes del Valle de La Paz como bioindicadoras de contaminación atmosférica. Ecología en Bolivia 28: 65-80. [ Links ]
Arribas, M.A., L. Jammes & F. Sagot. 1995. Lista de las aves de Bolivia. Armonía. Santa Cruz de la Sierra. 198 p. [ Links ]
Bach, K., M. Schawe, S. Beck, G. Gerold, S. R. Gradstein & M. Moraes R. 2003. Vegetación, suelos y clima en los diferentes pisos altitudinales de un bosque montano de Yungas, Bolivia: Primeros resultados. Ecología en Bolivia 38 (1): 3-14.
Beck, S. & E. García. 1991. Flora y vegetación en los diferentes pisos altitudinales. pp. 65108 en: E. Forno & M. Baudoin (eds.). Historia Natural de un Valle en los Andes: La Paz. Instituto de Ecología, La Paz. [ Links ]
Buskirk, W. H., G. V. N. Powell, J. F. Wittenberger, R. E. Buskirk & T. U. Powell. 1972. Interspecific bird flocks in tropical highland Panama. Auk 89: 612-624.
Cuellar, R. L., B. Jeres, X. Paredes & R. Terán. 1995. Aspectos sociales y económicos relacionados al manejo del Parque Nacional y Area Natural de Manejo Integrado Cotapata. pp. 85-113. En: C.B. Morales (ed.). Caminos de Cotapata. Instituto de Ecología. La Paz. [ Links ]
Ergueta, P. 1993. Aspectos de la biología y ecología de Phrynopus laplacai (Anura: Leptodactylidae) en un bosque nublado de altura de Yungas (La Paz, Bolivia). Ecología en Bolivia 21: 19-29.
Faaborg, J. 1988. Ornithology. An ecological approach. Prentice-Hall, Inc. Nueva Jersey. 470 p. [ Links ]
Fjeldså, J & N. Krabbe. 1990. Birds of the high Andes. Zoological Museum. University of Copenhagen. 876 p. [ Links ]
Gradwohl, J. & R. Greenberg. 1980. The formation of antwren flocks on Barro Colorado Island, Panama. Auk 97: 385-395.
Greenberg, R. 2000. Birds of many feathers. The formation and structure of mixedspecies flocks of forest birds. pp. 521-558. En: S. Boinski & P. A. Garber (eds.). On the Move: How and Why Animals Travel in Groups. University of Chicago Press. Chicago - Londres. 811 p. [ Links ]
Greig-Smith, P. W. 1978. The formation, structure and function of mixed-species insectivorous bird flocks in West African savanna woodlands. Ibis 120: 284-297.
Herzog, S. K., R. Soria A., A. Troncoso J., J. Cahill M. & E. Matthysen. 2000. Composición y estructura espacial de bandadas mixtas de aves en un bosque altoandino de Polylepis en Bolivia. pp. 9. En: S. K. Herzog, J. Cahill M. & F. Sagot (eds.). Resúmenes: I Congreso Internacional de Ecología y Conservación de bosques dePolylepis.Cochabamba. [ Links ]
Herzog, S. K., R. Soria A., A. Troncoso & E. Matthysen. 2002. Composition and structure of avian mixe-species flocks in a High-andean Polylepis forest in Bolivia. Ecotropica 8: 133-143.
Hutto, R. L. 1987. A description of mixedspecies insectivorous bird flocks in western Mexico. Condor 89: 289-292.
Hutto, R. L. 1988. Foraging behavior patterns suggest a possible cost associated with participation in mixed-species bird flocks. Oikos 51: 79-83.
Hutto, R. L., S. M. Pletschet & P. Hendricks. 1986. A fixed-radius point count method for nonbreeding and breeding season use. Auk 103: 593-602.
Isler, M. L. & P. R. Isler. 1987. The tanagers: Natural history, distribution and identification. Smithsonian Institution Press. Washington, D.C. 404 p. [ Links ]
Kratter, A. W. 1993. Geographic variation in the yellow-billed cacique, Amblycercus holosericeus, a partial bamboo specialist. Condor 95: 641-651.
Martínez, O. 1998. Observaciones preliminares sobre la historia natural del mochuelo andino Glaucidium bolivianum (jardinii) en el bosque de neblina del PN-ANMI Cotapata, Dpto. La Paz. pp. 120-123. En: F. Sagot & J. Guerrero (eds.). Aves y conservación en Bolivia Nº1. Actas del IV Encuentro Boliviano para la Conservación de las Aves, 25-27 Oct.1997. Tarija. Armonía. Santa Cruz de la Sierra, Bolivia. 140 p. [ Links ]
Martínez, O. 1999. Organización social de las bandadas mixtas y aspectos ecológicos sobre las comunidades de aves del bosque nublado en el Parque Nacional y Area Natural de Manejo Integrado Cotapata, La Paz. Tesis de licenciatura en Biología. Carrera de Biología, Universidad Mayor de San Andrés. La Paz. 154 p + anexos. [ Links ]
Moynihan, M. 1962. The organization and probable evolution of some mixed species flocks of Neotropical birds. Smithsonian Misc. Coll. 143: 1-140.
Munn, C. A. 1984. Birds of different feather also flock together. Natural history 11: 34-42.
Munn, C. A. 1985. Permanent canopy and understory flocks in Amazonia: species composition and population density. pp. 683-712. En: P.A. Buckley, M. S. Foster, E. S. Morton, R. S. Ridgely y F. G. Buckley. (eds.). Neotropical Ornithology. Ornithological Monographs 36. [ Links ]
Munn, C. A. & J. W. Terborgh. 1979. Multispecies territoriality in Neotropical foraging flocks. Condor 81: 338-347.
Nadkarni, N. M. & T. J. Matelson. 1989. Bird use of epiphyte resources in Neotropical trees. Condor 91: 891-907.
Paniagua, N., C. Maldonado & C. Chumacero. 2003. Mapa de vegetación de los alrededores de la Estación Biológica de Tunquini, Bolivia. Ecología en Bolivia 38 (1): 15-26.
Powell, G. V. N. 1979. Structure and dynamics of interspecifics flocks in a midelevational Neotropical forest. Auk 96: 375-390.
Powell, G. V. N. 1985. Sociobiology and adaptive significance of interspecific foraging flocks in the Neotropics. pp. 713-732. En: P. A. Buckley, M. S. Foster, E. S. Morton, R. S. Ridgely y F. G. Buckley. (eds.). Neotropical Ornithology. Ornithological Monographs 36. 1041 p. [ Links ]
Ralph, J., S. Droege & J. Saver. 1993. Managing and monitoring using point counts: standards and applications Research wildlife biologist. Redwood Sciences Laboratory, USDA Forest. Albany. 18 p. [ Links ]
Ralph, J., G. R. Geupel, P. Pyle, T. E. Martin, D. F. DeSante & B. Milá. 1994. Manual de métodos de campo para el monitoreo de aves terrestres. Pacific Southwest Station, Forest Service, U.S. Deparment of Agriculture. General Technical Report, Albany, 46 p. [ Links ]
Remsen, J. V. Jr. 1985. Community organization and ecology of birds of high elevational humid forest of the Bolivian Andes. pp. 733-756. En: P. A. Buckley, M. S. Foster, E. S. Morton, R. S. Ridgely & F. G. Buckley. (eds.). Neotropical Ornithology. Ornithological monographs 36. [ Links ]
Remsen, J. V. Jr. & S. K. Robinson. 1990. A classification scheme for foraging behavior of birds in terrestrial habitats. Studies in Avian Biology 13: 144-160.
Ribera, M. O. 1995. Aspectos ecológicos, del uso de la tierra y conservación en el Parque Nacional y Area Natural de Manejo Integrado Cotapata. pp. 1-84. En: C.B. Morales (ed.). Caminos de Cotapata. Instituto de Ecología. La Paz. [ Links ]
Sillett, T. S. 1994. Foraging ecology of epiphytesearching insectivorous birds in Costa Rica. Condor 96: 863-877.
Sillett, T. S., A. James & K. B. Sillett. 1997. Bromeliad foraging specialization and diet selection of Pseudocolaptes lawrencii (Furnariidae). Ornithological Monographs 48: 733-742.
Terborgh, J. 1990. Mixed flocks and polyspecific associations: costs and benefits of mixed groups to birds and monkeys. American Journal of Primatology 21: 87-100.
Villaseñor, J. 1995. Los grupos mixtos de aves en Michoacán: revisión de conceptos. Ciencia Nicolaita 10: 93-106.
Vuilleumier, F. 1970. L´organisation sociale des bandes vagabondes d´oiseaux des Andes du Pérou central. Revue Suisse de Zoologie 77: 209-235.
Vuilleumier, F. 1980. Ecological aspects of speciation in birds, with special reference to South American birds. pp. 101-148. En: Symposia. Universidad Simón Bolivar.
Young, K. R. 1994. Roads and the environmental degradation of tropical montane forest. Conservation Biology 8: 972-976.
Artículo manejado por: Damián Rumiz
Recibido en: Noviembre de 2001.
Aceptado en: Abril de 2003.












 uBio
uBio