Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Boliviana de Física
versión On-line ISSN 1562-3823
Revista Boliviana de Física vol.33 no.33 La Paz dic. 2018
A. ARTÍCULOS
Saccharomyces Cerevisiae como biocatalizador en celdas de combustible microbianas con ferricianuro de potasio
Saccharomyces Cerevisiae: a biocatalyst in biological fuel cells with potassium ferricyanide
†BRYAN Alejandro Vargas Arce1, María Teresa Álvarez Aliaga2, Flavio Ghezzi1, & Armando R.Ticona-Bustillos1
1Instituto de Investigaciones Físicas
Universidad Mayor de San Andrés c. 27 Cota-Cota, Campus Universitario, Casilla de Correos 635 La Paz - Bolivia
tbryan.vargasarce@yahoo.com
2Instituto de Investigaciones Fármaco Bioquímicas Facultad de Ciencias Farmacéuticas y Bioquímicas Universidad Mayor de San Andrés Av. Saavedra 2224 La Paz - Bolivia
(Recibido 22 de mayo de 2018; aceptado 5 de octubre de 2018)
RESUMEN
La levadura Saccharomyces Cerevisiae fue utilizada como biocatalizador dentro del ánodo microaerofílico de dos celdas de combustible microbianas. Se hallo que usando ferricianuro de potasio como aceptor final de electrones en el cátodo, las levaduras producen un voltaje de ≈ 100 mV mayor a las celdas de combustible sin levaduras luego de 1.5 días de funcionamiento, con un voltaje a circuito abierto de ≈ 150 mV. La cinética del microorganismo fue medida fuera de las celdas de combustible y comparada con el desarrollo de voltaje a través del tiempo, indicando que el crecimiento de las levaduras ayuda al incremento de voltaje.
Código(s) PACS: 82.47.Gh 87.15.v 87.17.Ee
Descriptores: Celdas de combustible PEM biomoléculas crecimiento y división celular
ABSTRACT
The yeast Saccharomyces Cerevisiae was used as a biocatalyst within a microaerophilic two-compartment microbial fuel cell anode. It was found that by using potassium ferricyanide as an electron acceptor the yeasts produce 100 mV voltage more than cells without yeast after 1.5 days of operation with a 150 mV voltage open circuit. The kinetics of the microorganism was measured outside the fuel cells and compared to the development of voltage over time, indicating that the growth of the yeasts helps increase the voltage.
Subject headings: PEM fuel cells Biomolecules Growth and division of cells
1. INTRODUCCIÓN
Las necesidades energéticas de la población mundial son cada ano mayores y los combustibles fósiles como un recurso no renovable, no podrán abastecer durante mucho tiempo esa demanda energética Mustakeem (2015). En las últimas décadas una gran variedad de fuentes de energía alternativas se estan estudiando y están siendo aplicadas. Entre ellas, las celdas de combustible microbianas ofrecen una excelente opcion debido que pueden usar aguas residuales de alto contenido orgánico como combustible para generar energía eléctrica Hubenova & Mitov (2015).
Las celdas de combustible microbianas (MFC's por sus siglas en ingles) son dispositivos bioelectroquímicos que pueden transducir la energía química en energía eléctrica gracias a la oxidación de substratos orgánicos en el metabolismo microbiano Hubenova & Mitov (2015). Se hallan compuestas por dos cámaras: i) ánodo donde microorganismos son empleados para extraer electrones de sustancias orgánicas como glucosa, fructosa, y otros, ii) cátodo donde un compuesto como peróxido de hidrógeno, oxígeno molécular o ferricianuro de potasio aceptan los electrones y moléculas de hidronio provenientes del ánodo Hubenova & Mitov (2015). Para conectar ambas cámaras eléctricamente y separar las sustancias presentes en cada una, membranas de intercambio de protones o puentes de sal usados Rahimnejad et al. (2014). Usualmente bacterias prokariotas como Geobacter Metallireducens, Geobacter Sulfurreducens Malvankar et al. (2011)
son usadas como biocatalizador ánodico en las MFC's sin embargo el uso de levaduras como Saccha-romices Cerevisiae Raghavulu et al. (2010) Rossi (2017) Wilkinson et al. (2006), Candida Melibiosica 2419 Gunawardena et al. (2008) se han estudiado con el fin de usarlos en la purificación de aguas residuales producidas por la industria de comida que aplica levaduras en sus procesos biotecnológicos Hubenova & Mitov (2015). Saccharomices Cerevisiae como biocatalizador ha sido estudiada en diferentes condiciones durante la ultima década. Se mostró que estas pueden transducir energía en condiciones anaeróbicas junto a un cátodo de aire Raghavulu et al. (2010). El uso de una concentración de 5 mM de azul de metileno en la cámara anódica, junto a un cátodo con una concentración 4.4 M de peróxido de hidrógeno, incrementa el voltaje a circuito abierto de la MFC de ≈ 100 hasta ≈ 500 mV Rossi (2017). El azul de metileno junto al rojo neutro incrementa la densidad de potencia de las MFC's desde 0.08 hasta 0.46 W/m2 junto a un cátodo de ferricianuro de potasio Wilkinson et al. (2006). El efecto del crecimiento de las poblaciones microbianas en las MFC's fue recientemente 'estudiado' (2019), estableciendo que la resistencia de transferencia de carga esta directamente relacionado con las diferentes fases de crecimiento del cultivo microbiano Arkatkar et al. (2019). En el presente estudio, la cinética de la levadura Saccharomices Cerevisiae fue medida en el medio de cultivo DSW bajo condiciones microaerofílicas para relacionarla con el voltaje a circuito abierto de las MFC's con la levadura bajo estudio como biocatalizador ánodico y ferricianuro de potasio como aceptor final de electrones en la cámara catódica.
2. MATERIALES Y MÉTODOS
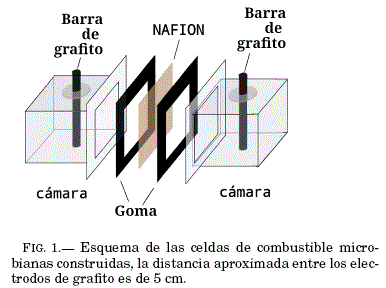
Construcción de celdas de combustible Se construyeron 3 celdas de combustible de dos cámaras, ambas de material acrílico de volumen total de 63 ml con un volumen efectivo de 60 ml FIG.1.
Pretratamiento de electrodos Barras de grafito fueron empleadas en las MFC's como electrodos. El pretratamiento de las mismas, fue someterlas a calor
de llama entre los 500 y 1000 °C, raspar la superficie con lija fina para aumentar su área efectiva Mustakeem (2015), se lavaron con agua destilada para quitar residuos del raspado. Se procedipo a esterilizarlas por calor una vez mas bajo el mismo procedimiento anterior y finalmente fueron almacenadas en agua destilada esteril, hasta el momento de usarlas.
Pretratamiento de membranas de intercambio de protones Se cortaron cuadrados de 3.95 cm de la membrana NAFION 117, estos trozos fueron almacenados en agua desionizada durante un dıa para que alcancen su tamano máximo al hidratarse. El incremento consiste en la dilatación del 12% en longitud de los cuadrados. Posteriormente las membranas fueron sometidas al pretratamiento estandar Babanova S1 (2011), mismo que consiste en mantenerla a 80 °C en los siguientes procesos: i) 1 h en peróxido de hidrógeno al 3%, ii) 2 h a en agua desionizada y iii) 1 h en ácido sulfúrico 0.1 M.
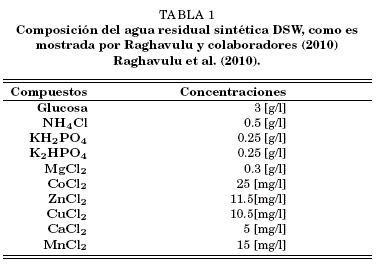
Activación de levadura Se utilizo levadura de panificación Saccharomyces Cerevisiae en forma liofilizada. Para activarlas se inoculó 0.3 g de levadura en 30 ml de medio de cultivo DSW (agua residual sintética) TABLE 1 previamente calentado a 40 °C, temperatura que fue mantenida durante 30 min.
Preparación del cátodo Se preparó una solución de concentración 1 mM de ferricianuro de potasio K3F(CN)6, que fue esterilizada a 121 °C durante 15 min. Una vez preparadas las celdas de combustible, se introdujeron 60 ml de la solución en la cámara catótica y fue cerrada herméticamente con silicona.
Preparación del ánodo Se preparó el medio DSW que fué esterilizado a 121 °C durante 15 min, una vez enfriado, se introdujeron 59 ml a la cámara anódica de las celdas de combustible en las cuales se inocularían levaduras y 60 ml en las que funcionarían como un control abiótico. Una vez selladas, las celdas de combustible fueron incubadas a 35 °C durante un día, luego de esto se inoculó 1 ml de la solución de levaduras activadas mencionado anteriormente.
Medición del voltaje La diferencia de potencial entre ánodo y cátodo fue medida con el convertidor analógico digital (ADC) de 10 bits del circuito integrado ATmega328p (Arduino UNO R3) con un voltaje de referencia de 1.1 V así la medida mas pequeña posible es de aproximadamente 1.1 mV, para estabilizar la señal adquirida por el ADC se usó una resistencia de 220 O en serie con un capacitor electrolítico de 1 μF los cuales se hallaban en paralelo con la MFC. Se tomaron 10 datos cada minuto durante 5 días, desde que el ánodo y el cátodo fueron sellados.
Medición de la cinética pH, densidad óptica y concentración de glucosa Con el fin de conocer la cinética de las levaduras Saccharomyces Cerevisiae en las condiciones a las que se hallaban sometidas en las MFC's, el pH, densidad óptica y concentración de glucosa fueron medidos en frascos de cultivo de condiciones similares a las MFC's. Solo los parámetros finales fueron medidos de muestras extraídas de las celdas de combustible microbianas.
Se prepararon 3 viales esterilizados en los cuales se introdujeron 60 ml de medio DSW, en dos de ellos se inoculó 1 ml de la solución con levaduras activadas cuya preparación se menciona previamente. Se tomaron muestras de 1.5 ml de cada frasco determinandose el pH, densidad óptica (λ600 nm) y la concentración de glucosa a través del método DNS.
3. RESULTADOS Y DISCUSIÓN
3.1. Celdas de combustible
Las fotografías en la FIG.2. muestran la celda de combustible una vez montada antes y luego de realizar las medidas. Despues de 4 días el color de la solución de ferricianuro de potasio cambia de amarillo a verde, indicando la reducción de pH y la ganancia de electrones del mismo.
3.2. Diferencia de potencial
3.2.1. Celdas de combustible abióticas
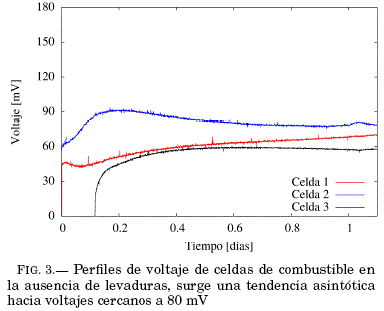
Con la finalidad de comprobar la funcionalidad de las celdas de combustible construidas, se midió la diferencia de potencial entre ánodo y cátodo en la ausencia de levaduras (control abiótico) FIG.3, durante un día antes de la inoculación de levaduras al ánodo de las celdas. Se observa de la gráfica que el comportamiento durante el primer medio día de funcionamiento se tienen ciertas variaciones de voltaje, luego se muestra tendencia a un voltaje fijo.
3.2.2. Celdas de combustible microbianas
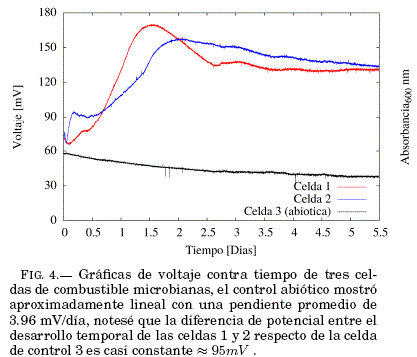
Se inocularon levaduras, en dos de las tres celdas de combustible en funcionamiento, las celdas con microorganismos comenzaron un incremento en voltaje similar a una curva de crecimiento sigmoidal FIG.4.
Desde los 0.41 hasta los 1.47 días con voltajes desde 85.66 hasta 170 mV para la celda 1, desde los 0.43 hasta los 2 días con voltajes desde 89.12 hasta 157.6 mV para la celda 2.
La variación de voltaje registrada hasta aproximadamente el segundo día de experimento TABLA2. es menor a la descrita por otros estudios Rossi (2017)Raghavulu et al. (2010) donde el voltaje a circuito abierto en ausencia de azul de metileno se incrementó hasta alcanzar un voltaje de 0.26 0.04 V luego de 30 h de funcionamiento, con oxígeno molecular disuelto como aceptor final de electrones, esta diferencia puede darse por diversos motivos como la
geometría de la MFC, la geometría del electrodo, sin embargo el factor que diferencia el presente estudio con la mencionada tesis Rossi (2017) es la condicion anaeróbica de ánodo, dado que el oxígeno presente en nuestros ánodos puede extraer los electrones generados en la MFC Hubenova & Mitov (2015).
3.3. Cinética de crecimiento y consumo de sustrato de Saccharomyces cerevisiae
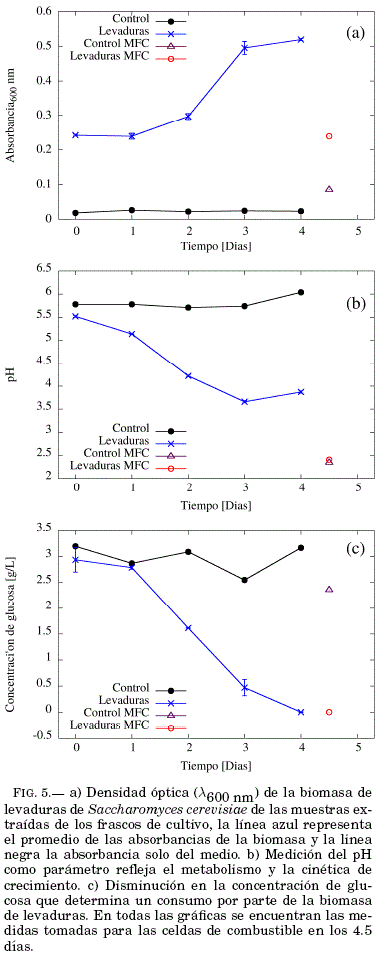
La densidad óptica, pH y concentración de glucosa fueron medidos una vez por día. A los 4.5 dıas, una medida de densidad óptica, pH y concentración de glucosa fué realizada a una muestra extraída de la celda de combustible abiótica y las MFC's respectivamente. La medición de densidad óptica FIG.5(a) indica que las levaduras dentro de la cámara anódica no pudieron multiplicarse de la misma forma que lo hacen dentro un frasco de cultivo. El pH medido en el ánodo a los 4.5 días posee un valor de 2.41 ± 0.02, este es considerado no apto para la supervivencia de Saccharomyces cerevisiae, la medición de pH en la celda de combustible abiótica posee un valor similar 2.35 ± 0.02, indicando que a diferencia del frasco del cultivo, la disminucion de pH en la celda de combustible es un proceso poco relacionado al metabolismo del microorganismo. El valor de la concentración de glucosa medida en la MFC 0.00 ± 0.22 [g/L] indica que la glucosa fue consumida en su totalidad, además el valor obtenido para la celda de combustible abiotica 2.36 ± 0.18 [g/L] indica que la reduccion de concentración de glucosa en el ánodo fue un proceso mayormente debido al microorganismo.
3.4. Comparación del desarrollo temporal del voltaje con la cinética de la levadura
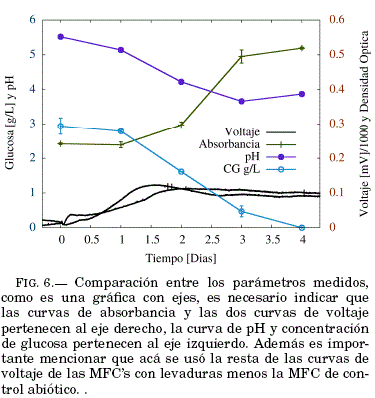
Al comparar los desarrollos temporales de cada parametro FIG.6 es observable que la población de levaduras crece a medida que la concentración de glucosa se reduce, sin embargo al compararlos con la evolución temporal del voltaje vemos que el valor máximo de voltaje (a los 1.6 y 2 días) se alcanza durante el inicio de la fase exponencial del crecimiento de las levaduras en los frascos de cultivo (entre el primer y tercer día) FIG.6(absorbancia).
Es conocido que las diferentes fases de crecimiento microbiano puede afectar en el voltaje a circuito abierto Arkatkar et al. (2019) asi estos resultados podrían indicar que la resistencia de tranferencia de carga en las levaduras Saccharomices Cerevisiae es menor al inicio de la fase exponencial. Sin embargo un estudio electroquímico con espectroscopia por impedancia electroquímica es necesario para confirmar esta afirmación.
4. CONCLUSIONES
Se utilizo la levadura Saccharomices Cerevisiae en condiciones microaerofílicas como biocatalizador ánodico para MFC's exitosamente, logrando una diferencia de 100 mV respecto del control abiotico. Sin embargo el voltaje a circuito abierto (≈ 150 mV en su fase estable) fue bajo comparado al obtenido por otros estudios Raghavulu et al. (2010) Rossi (2017) que reportaron hasta 260 mV, posiblemente debido al oxígeno presente en las condiciones microaerofílicas usadas en nuestro estudio. La comparación entre la cinética de la levadura y el desarrollo temporal del voltaje de las MFC's muestra que el incremento de voltaje es causado por el crecimiento de la levadura además el máximo de voltaje ubicado durante el inicio de la fase exponencial indica que posiblemente la levadura posee un comportamiento electroquímico diferente desde el inicio de la fase exponencial.
AGRADECIMIENTOS
Se gradece el apoyo y financiamiento de la Cooperacion Sueca ASDI.
APÉNDICE
A. ADQUISICIÓN DE DATOS DEL VOLTAJE
Las medidas hechas en la celda de combustible se hicieron con un arduino, para evitar que las celdas esten en contacto directo con los canales de entrada de arduino cuya impedancia de entrada con tierra esta entre los 15OKΩ y los 500KΩ se usaron unos interrutores que pueden ser controlados por arduino, estos son conocidos como relays magnéticos cuyo voltaje de trabajo es de 5V.
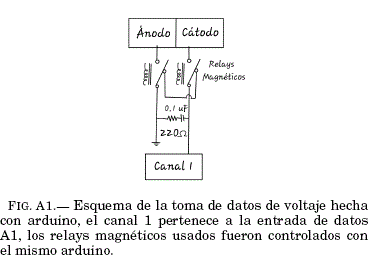
Cuando el sistema es ordenado a tomar datos, se activan estos relays, permitiendo el flujo de unos pocos microamperios al canal de medida del convertidor análogico digital del arduino. Para lograr que la señal sea medida sin ruidos significativos se usó un circuito RC en paralelo a las MFC's ver FIG.A1 Se hizo un calculo aproximado para conocer en cuanto tiempo se cargaba el circuito RC para efectuar las medidas:
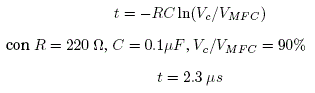
Considerando este tiempo arduino tomaba datos despues de 10 ms de conectar las terminales de las MFC's al circuito, luego de eso se tomaban 10 medidas que luego eran promediadas para reportar los puntos de las gráficas FIG.3, FIG.4 y FIG.??.La cantidad de carga que era extraída del ánodo para efectuar la medida es Q = CV = 15 nC los cuales eran transferidos al cátodo en cada medida.
REFERENCIAS
Alsuhaim, H., Vojisavljevic, V., & Pirogova, E. 2013, IFMBE Proceedings, 39, 48 [ Links ]
Arkatkar, A., Mungray, A. K., & Sharma, P. Effect of Microbial Growth on Internal Resistances in MFC: A Case Study: Proceedings of ICIIF 2018, 469-479 [ Links ]
Babanova S1, Hubenova Y, M. M. 2011, J Biosci Bioeng [ Links ]
Calabrese Barton, S., Gallaway, J., & Atanassov, P. 2004, Chemical reviews, 104, 4867 [ Links ]
Chen, C.-Y., Chen, T.-Y., & Chung, Y.-C. 2014, Environmental Technology, 35, 286, pMID: 24600867 [ Links ]
Gunawardena, D., Fernando, S., & To, R 2008, International journal of molecular sciences, 9, 1893 [ Links ]
Hubenova, Y. & Mitov, M. 2015, Bioelectrochemistry, 106, 177 , special Issue on Biological fuel cells [ Links ]
Kalantar, M. & Sedighizadeh, M. 2003, 38, 690
Kumar, R., Singh, L., Wahid, Z., & Md Din, M. R 2015, International Journal of Energy Research, 39 [ Links ]
Logan, B. E. 2007, Microbial Fuel Cells (John Wiley & Sons) [ Links ]
Logan, B. E., Hamelers, B., Rozendal, R., Schrder, U., Keller, J., Freguia, S., Aelterman, P., Verstraete, W., & Rabaey, K. 2006, Environmental Science & Technology, 40, 5181, pMID: 16999087 [ Links ]
Malvankar, N., Vargas, M., P Nevin, K., Franks, A., Leang, C., Kim, B.-C., Inoue, K., Mester, T., Covalla, S., Johnson, J., Rotello, V., Tuominen, M., & R Lovley, D. 2011, Nature nanotechnology, 6, 573 [ Links ]
Mustakeem. 2015, Materials for Renewable and Sustainable Energy, 4 [ Links ]
Najafpour, G. 2010, Effect of glucose concentration on performance of microbial fuel cell [ Links ]
OHayre, R. 2016, Fuel Cell Fundamentals, 3rd edn. (John Wiley & Sons) [ Links ]
Raghavulu, S., Goud, R., Sarma, P., & Venkata Mohan, S. 2010, Bioresour Technol, 102, 2751 [ Links ]
Rahimnejad, M., Bakeri, G., Najafpour, G., Ghasemi, M., & Oh, S.-E. 2014, Biofuel Research Journal, 1, 7 [ Links ]
Rossi, R. 2017, PhD thesis, alma
Tront, J., Fortner, J., Pltze, M., Hughes, J., & Puzrin, A. 2008, Biosensors and Bioelectronics, 24, 586 [ Links ]
Ucar, D., Zhang, Y., & Angelidaki, I. 2017
Wei, L., Han, H., & Shen, J. 2012, International Journal of Hydrogen Energy, 37, 12980 [ Links ]
Wilkinson, S., Klar, J., & Applegarth, S. 2006, Electroanalysis, 18, 2001 [ Links ]
Yan, W., Guo, Y., Xiao, Y., Wang, S., Ding, R., Jiang, J., Gang, H., Wang, H., Yang, J., & Zhao, R 2018, Water Research, 142 [ Links ]
Yang, H., Zhou, M., Liu, M., Yang, W., & Gu, T. 2015, Biotechnology letters, 37 [ Links ]