Services on Demand
Journal
Article
Indicators
-
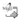 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
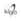 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Boliviana de Pediatría
On-line version ISSN 1024-0675
Rev. bol. ped. vol.52 no.1 La Paz 2013
ARTICULOS DEL CONO SUR - ARGENTINA(1)
Estudio de las enfermedades respiratorias por virus Influenza A H1N1 (pH1N1) en niños internados durante el año de la pandemia. Experiencia de 34 centros en la Argentina
Study of respiratory influenza A H1N1 Virus (pH1N1) in hospitalized children in the pandemic year. Experience in 34 centers in Argentina
Dra. Ángela Gentilea, Dra. Julia Bakira, Dra. Carlota Russb, Dra. Silvina Ruvinskyc, Dra. Gabriela Ensinckd, Dra. Andrea Falaschie, Dr. Alejandro Canéf, Florencia Lucióna, Miriam Brunog, Dra. Rina Morenoh, Dra Nancy Bidonei
a. Hospital de Niños Ricardo Gutiérrez.
b. Fundación Hospitalaria.
c. Hospital de Pediatría "Prof. J.P. Garrahan"
d. Hospital de Niños. "Víctor V.J. Vilela", de Rosario.
e. Hospital Pediátrico Notti de Mendoza.
f. Hospital Universitario Austral.
g. Hospital General de Agudos "Carlos G. Durand".
h. Hospital Nacional "Prof. Alejandro Posadas".
i. Sanatorio Güemes.
Correspondencia: Dra. Angela Gentile. angelagentile@fibertel.com.ar
Conflicto de interés: Ninguno que declarar.
(1) Artículo original de Argentina, publicado en Archivos Argentinos de Pediatría 2011; 109(3): 198-203 y que fue seleccionado para su reproducción en la XVII Reunión de Editores de Revistas Pediátricas del Cono Sur. Chile 2012.
Resumen
Introducción. En la Argentina, la pandemia de Influenza A pH1N1 de 2009 provocó cerca de 10 000 casos confirmados con alto impacto en pediatría.
Objetivos. Describir las características clínico epidemiológicas y analizar los factores de riesgo de letalidad en niños hospitalizados con infección confirmada por pH1N1.
Población y métodos. Se identificaron todas las fichas de casos sospechosos (según Ministerio de Salud) internados en 34 centros y se incluyeron todos los casos confirmados de 0-18 años desde el 1/4/09 al 31/8/09 en un estudio de cohorte retrospectivo. El diagnóstico viral se confirmó por método RT-PCR. Los datos se expresaron en porcentajes, media, mediana, desvío estándar e intervalo intercuartilo (IIC) según correspondiera; y como medida de asociación, Riesgo Relativo (RR), con Intervalo de Confianza 95% (IC95%). Se realizó regresión logística múltiple para determinar los predictores independientes.
Resultados. Número total de casos sospechosos: 2367; se realizó PCR al 47,8% (n: 1131) siendo positivos para pH1N1 65,5% (n: 741/1131); 57,2% varones; 61,5% <24 meses, mediana de edad: 14 meses (IIC 6-46 meses); 45,1% con enfermedad subyacente; formas clínicas de presentación más frecuentes: neumonía 39,7% y bronquiolitis 25,8%; letalidad: 5,9% (44/741).
Factores de riesgo de letalidad [RR (IC95%)]: enfermedad neurológica [5,00 (2,84-8,81)], enfermedad genética [3,67 (1,58-8,52)], desnutrición [3,07 (1,46-6,48)] y prematurez [2,28 (1,14-4,56)]. Predictor independiente de letalidad: enfermedad neurológica [3,84 (1,81-8,14)].
No se observó asociación significativa entre edad, enfermedad respiratoria crónica, inmunosupresión y coinfección viral con la letalidad.
Conclusiones. Casi la mitad de los niños con infección por pH1N1 tenía enfermedad subyacente; la enfermedad neurológica fue un predictor independiente de letalidad.
Key words:
Rev Soc Bol Ped 2013; 52 (1): 35-42: subtipo H1N1 del virus de la influenza A, epidemiología, factores de riesgo, letalidad.
Summary
Introduction. In Argentina, pandemic influenza pH1N1 caused nearly 10,000 confirmed cases with high impact in pediatrics.
Objectives. To describe clinical and epidemiological characteristics and analyse the risk factor of lethality in children hospitalized with infection pH1N1 confirmed by PCR Population and methods. We identified all suspected cases (according to Ministry of health) in 34 centers and we included all the confirmed cases of 0-18 years from 1/4/09 to 31/8/09 in a retrospective cohort study. The viral diagnosis was confirmed by RT-PCR method. Data are expres sed in percentages, average, median, standard deviation, and range (IQR) as appropriate; and as a measure of association, relative risk (RR), with 95% confidence interval (95%CI). Multiple logistic regression was conducted to determine the independent risk predictors.
Results. Total number of suspected cases were: 2367; PCR was performed to 47.8% (n: 1131) being positive for pH1N1 65.5% (n: 741/1131); 57.2% males; 61.5% <24 months, median age: 14 months (IQR 6-46 months); 45.1% with underlying disease; more frequent clinical pictures were: pneumonia (39,7%) and bronchiolitis 25.8%; Case-fatality rate: 5.9% (44/741). Mortality risk factors were [RR (95%CI)]: neurological disease [5.00 (2.84-8.81)], genetic disease [3.67 (1.58-8.52)], malnutrition [3,07 (1.46-6.48)] and prematurity [2.28 (1.14-4.56)].
Independent mortality predictor: neurological disease [3.84(1.81-8.14)].
No significant association between age, chronic respiratory disease, immunosuppression and viral co-infection with lethality was observed.
Conclusions. Almost half of children with pH1N1 infection had underlying disease; the neurological condition was a separate CFR predictor.
Key words:
Rev Soc Bol Ped 2013; 52 (1): 35-42: influenza A virus, H1N1 subtype, epidemiology, risk factors, lethality.
Introducción
En abril del año 2009 se originó un alerta en México y Estados Unidos1 por la emergencia de casos de influenza en seres humanos de un subtipo de origen porcino, por lo que se denominó inicialmente gripe porcina. Con la evaluación genética se estableció el triple origen de este nuevo subtipo viral que combina genes de virus porcino, aviario y humano, denominado actualmente Influenza A H1N1 (pH1N1) de linaje porcino o virus pandémico 2009.2
La Argentina fue uno de los países con alto impacto en la morbimortalidad por este nuevo virus. Los casos autóctonos se detectaron a partir del 17 de mayo de 2009 y el pico máximo de la transmisión se alcanzó entre el 20 de junio y el 3 de julio, con una transmisión generalizada en todo el país y cerca de 10 000 casos confirmados3.
En función de este nuevo fenómeno epidémico se plantearon como objetivos describir las características clínicas y epidemiológicas de los pacientes hospitalizados con diagnóstico confirmado de pH1N1 y analizar factores de riesgo asociados a letalidad para la misma población en estudio.
Material y métodos
Período de estudio, población y diseño
Durante el período de circulación del virus pH1N1, entre el 1 de abril y el 31 de agosto de 2009, el Ministerio de Salud de la Nación Argentina envió a las instituciones de salud una ficha epidemiológica con el objetivo de identificar casos sospechosos de acuerdo a la definición establecida por ese organismo3.
Una vez detectados los casos, los profesionales de la salud completaban datos clínico-epidemiológicos sobre ellos y se iniciaban los estudios de inmunofluorescencia indirecta para virus de Influenza A y PCR para pH1N1 en secreciones nasofaríngeas, según disponibilidad de recursos y sospecha clínica.
A los fines de identificar el grupo de niños afectados por pH1N1, inicialmente se seleccionaron todas las fichas epidemiológicas que cumplieran con la definición de caso sospechoso en las instituciones que participaron en este trabajo.
Una vez identificados estos registros se incluyeron en el estudio todos aquellos correspondientes a los niños entre 0 y 18 años hospitalizados con PCR positiva para pH1N14.
Se trató de un estudio de cohorte retrospectivo, basado en datos secundarios de hospitalización de casos confirmados de Influenza pH1N1, donde se revisaron las fichas epidemiológicas de seguimiento de pacientes desde el inicio de la hospitalización hasta el alta o defunción.
Análisis de datos
Para describir las características clínicas de la población estudiada se utilizó, media, mediana, desvío estándar (DE) e intervalo intercuartilo para las variables numéricas. Las variables categóricas se expresaron en términos de porcentaje.
Fueron identificados inicialmente los siguientes factores de riesgo potenciales de letalidad: edad, sexo, enfermedad de base y coinfección viral, y la medida de asociación utilizada fue el Riesgo Relativo (RR), con un Intervalo de Confianza del 95% (IC95%). Para el análisis descriptivo y univariado se utilizó el programa Epi-info versión 6.04 (CDC, Atlanta).
Finalmente se realizó regresión logística para determinar los predictores independientes y se incluyeron en forma manual (selección forward) aquellas variables independientes que tuvieron una p = 0,10 o menor en el estudio univariado.
Para el análisis multivariado se utilizó el programa SPSS versión 15.0.
Se consideró como significativo un valor de p menor a 0,05.
Resultados
Durante el período de circulación de pH1N1 se seleccionaron 2367 fichas que cumplían con la definición de caso sospechoso correspondientes a 34 centros: 11 de Ciudad de Buenos Aires (n: 1000; 42,2%), 8 de provincia de Buenos Aires (n: 480; 20,3%), 4 de Santa Fé (n: 307; 13,0%), 2 de Mendoza (n: 205; 8,6%), 4 de Córdoba (n: 127; 5,4%), 2 de Corrientes (n: 95; 4,0%), 1 de Jujuy (n: 83; 3,5%), 1 de Chaco (n: 65; 2,7%) y 1 de Formosa (n: 5; 0,2%).
Se realizó PCR para pH1N1 en el 47,8% (1131/2367) de los casos sospechosos seleccionados y el resultado positivo para pH1N1 fue del 65,5% (741/1131).
El 57,2% de ellos (424/741) era de sexo masculino.
La media de edad fue 37,3 meses (DE: 50,0) y la mediana de 14 meses (IIC: 6-46 meses), 337 (45,5%) eran <12 meses, 456 (61,5%) <24 meses y 557 (75,2%) <48 meses.
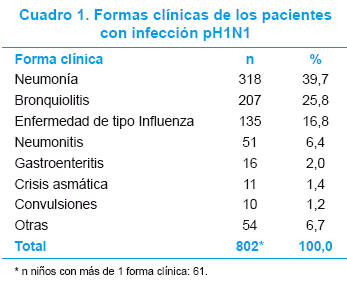
Las formas clínicas de presentación más frecuentes fueron neumonía 318 (39,7%) y bronquiolitis 207 (25,8%), 61 niños presentaron más de una forma clínica y el 7,8% (58/741) de los casos fueron infecciones adquiridas en el ámbito institucional (Cuadro 1).
El 11,6% (86/741) tenía antecedentes perinato lógicos: prematurez: 59,1% (75/127), bajo peso al nacer: 25,2% (32/127), síndrome de dificultad respiratoria: 15,7% (20/127).
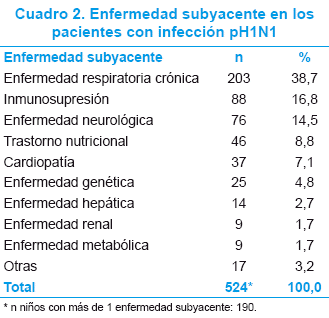
El 45,1% (334/741) presentó enfermedad subyacente; las más frecuentes se consignan en el Cuadro 2.
En relación a los signos y síntomas presentados por el total de los casos estudiados, el tiempo de evolución al ingreso fue de 3 días (IIC 1-5 días) y los síntomas más frecuentes fueron fiebre, tos, dificultad respiratoria, taquipnea y rinorrea en el 88,7%, 86,8%, 70,6%, 68,0% y 66,1% de los casos respectivamente, y la mediana de duración de estos síntomas fue de 3 días con un intervalo intercuartilo que osciló entre 2 y 5 días.
Se realizó radiografía de tórax al 95,7% (709/741) de los pacientes, que fue patológica en el 83,8% (594/709) de los casos (67 pacientes con más de un patrón radiológico). El infiltrado intersticial fue el patrón predominante [49,5% (327/661)], seguido por la condensación [47,6% (315/661)]. El 31,1 % (98/315) de éstos correspondió a la condensación algodonosa y el 8,6% (27/315) presentó derrame pleural. La atelectasia ocurrió en el 1,8% (12/661).
El 91,4% (677/741) de los pacientes recibió tratamiento antiviral (Oseltamivir). La mediana del tiempo de evolución de la enfermedad hasta el inicio del tratamiento fue de 3 días (IIC: 2-6). El 0,3% (2/677) presentó efectos adversos (diarrea) por la medicación antiviral. El 71,9% (533/741) recibió antibióticos y en 7,1% de los casos se constató la suspensión del tratamiento al recibir el resultado de la PCR positiva para pH1N1.
El 33,3% (247/741) de los pacientes presentó complicaciones y las más frecuentes fueron la insuficiencia respiratoria 37,8% y la neumonía 20,6%.
El porcentaje de coinfecciones virales fue de 10,9%, (81/741); los virus detectados fueron VSR 73 (90,1%); Adenovirus 5 (6,2%); Influenza B 2 (2,5%) y Parainfluenza 1 (1,2%).
La infección bacteriana asociada fue del 1,9% (14/741) [grampositivos (n= 7): Streptococcus pneumoniae: 2, Staphylococcus aureus meticilinoresistente: 2, Streptococcus pyogenes: 2, estreptococo viridans: 1, gramnegativos (n: 6): Pseudomonas aeruginosa: 2, Escherichia coli: 2, Klebsiella pneumoniae: 1, Enterobacter cloacae: 1 y M. tuberculosis: 1].
El 15,1% (112/741) de los pacientes requirió asistencia respiratoria mecánica (ARM). La letalidad fue del 5,9% (44/741).
Análisis del riesgo de letalidad de los pacientes con infección por virus pH1N1
La presencia de enfermedad subyacente se asoció a mayor letalidad [RR 2,97 (1,45-6,09)], correspondiendo a la enfermedad neurológica el mayor riesgo [RR 5,00 (2,84-8,81)], seguido de la enfermedad genética [RR3,67 (1,58-8,52)], la desnutrición [RR 3,07 (1,46-6,48)] y la prematurez [RR 2,28 (1,14-4,56)] (Cuadro 3).
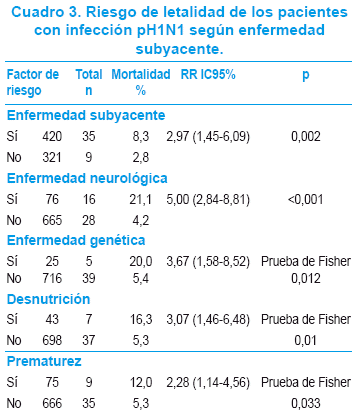
El predictor independiente de mortalidad fue la enfermedad neurológica (Cuadro 4).

El intervalo entre el comienzo de los síntomas y la internación y/o el inicio del tratamiento antiviral no presentó asociación significativa con la mortalidad. Tampoco la infección mixta viral se asoció a mayor mortalidad.
Discusión
El grupo de trabajo consideró relevante describir los patrones clínicos y epidemiológicos de la población pediátrica afectada por el nuevo virus pandémico pH1N1 y analizar los factores de riesgo asociados a letalidad. El conocer la carga de enfermedad en la población pediátrica permitió que el país estructurara mejor las políticas de vacunación e incorporará grupos no tradicionales al esquema nacional. De hecho, según las últimas recomendaciones, se debe vacunar en forma obligatoria, desde el punto de vista pediátrico, a los niños menores de 2 años y a los convivientes de los niños menores de 6 meses (población que aún no puede recibir vacuna influenza por edad)5.
Al comienzo de la pandemia, la posibilidad de realizar RT-PCR, se centralizó en el Centro Nacional de referencia, el Instituto Malbrán. Esto motivó, que se generara una sobrecarga del sistema de salud y que no todos los centros tuvieran la misma accesibilidad para realizar el diagnóstico confirmatorio en forma rápida6, condición que de alguna manera permite explicar que a sólo el 47,8% se le realizarán estudios confirmatorios. Es posible que a partir de la experiencia vivida en el año 2009, sea necesario fortalecer la red de laboratorios regionales para optimizar el diagnóstico virológico y, de esta manera, optimizar y utilizar en forma prudente los tratamientos anti virales.
La mediana de edad de la población estudiada fue similar a la descripta en otros estudios de la Argentina y fue mayor respecto de aquellos con influenza estacional internados en nuestro país en años previos7,8.
La forma clínica de presentación más frecuente fue neumonía, similar a lo reportado en otras publicaciones9-14.
La población blanco más afectada y que requirió internación estuvo representada por los pacientes con enfermedad subyacente, tal como se informara en otros estudios7,10,11-16. La enfermedad neurológica como patología de base, no había sido comunicada hasta el momento en pacientes con influenza estacional7. El porcentaje de niños internados con infección por VIH fue de tan solo el 7,8% del total de los pacientes inmunocomprometidos afectados. Este dato coincide con los de las series internacionales17, y con lo publicado para población adulta12.
En relación a los hallazgos radiológicos, en los casos confirmados por virus pandémicos, importa destacar que el 16,2% de los pacientes presentó una placa de tórax normal18. Una de las imágenes radiológicas más frecuentes fue la consolidación; llaman la atención las características algodonosas, que aparecen como un patrón característico de este virus pandémico y que no se había observado previamente con el influenza estacional18.
Un alto porcentaje de pacientes (más del 90%) recibió tratamiento antiviral en forma oportuna, dentro de las 72 h de iniciados los síntomas. Este hecho expresa la capacidad de respuesta rápida que tuvo la comunidad pediátrica, a pesar de la falta de experiencia en el uso de este anti viral, la aprobación tardía de la ANMAT para su utilización en menores de 1 año y la falta de disponibilidad de formulaciones pediátricas19,20.
En relación a otros estudios realizados en nuestro país, el porcentaje de coinfecciones virales fue bajo, probablemente porque nuestro estudio incluyó un mayor número de casos, con lo cual resultó más representativo de la realidad epidemiológica nacional9.
Por otro lado, las coinfecciones bacterianas ocuparon el segundo lugar después de las virales.
Este último dato difiere de lo hallado en México y otros países, en los cuales la infección bacteriana agregada adquirió mayor importancia10,21. Condiciones como los diferentes prioridades para establecer el diagnostico viral entre los países podrían explicar esta diferencia, además de considerar que, en la Argentina, la circulación de pH1N1 se produjo durante época la invernal, cuando normalmente existe una mayor circulación de agentes virales22,23.
En el modelo final, el factor de riesgo de mortalidad para pH1N1 fue la enfermedad neurológica, dato semejante a los de la bibliografía internacional20.
El intervalo entre el comienzo de los síntomas y la internación y/o el inicio de la toma de oseltamivir no influyó en la mortalidad24,25.
Este trabajo no está libre de sesgos vinculados al diseño retrospectivo y al uso de datos secundarios para realizar la investigación.
Contrariamente a lo expresado, su fortaleza radica en la participación de distintos centros de diferentes regiones del país, lo que aumenta la validez, contribuye a una mayor representatividad de la población pediátrica afectada por la pandemia en la Argentina y, por ende, es evidencia de que, en su momento, sirvió de base para la toma de decisiones respecto del tratamiento y la prevención en nuestros niños.
Investigadores participantes
Hospital de Niños "Ricardo Gutiérrez", Grupo de trabajo: Dra. Mónica Dastugue, Dr. Julio Farías, Dr. Jorge Grichener, Dra. Alicia Mitchenko.
Hospital de Niños "Víctor V.J. Vilela" de Rosario, Hospital N Z Norte y Hospital Provincial de Santa Fe, Grupo de trabajo: Dra. Alicia Aletti Dr. Juan Carlos Bocanera, Dra. Ana Chiossone, Dr. Santiago López Papucci, Dra. Pilar Rodríguez Alassia, Dr. Gustavo Sciolla, Dra. Silvia Villalba.
Hospital Durand, Grupo de trabajo: Dra. Laura Álvarez, Dra. Liliana Álvarez, Dr. Martín Beccaria, Dra. Norma Bolognati, Dra. Patricia Landa, Bioq. Lorena López, Dra. Ana Pota, Dra. Nuria Serrano.
Hospital Pediátrico Notti, Grupo de trabajo: Dr. Héctor. Abate, Dra. Fernanda Asenato, Dra. Lorena Dipauli, Dr. Pablo Melonari, Dra. Ana María Rosaenz, Bioq. Sandra Grucci, Bioq. Clara Pons Godoy, Enf. Carlos Acevedo, Enf. Lorena Manrrique.
Hospital Nacional Prof. Alejandro Posadas, Grupo de trabajo: Dra. Silvia Algieri, Dr. Mario Belardita, Dr. Gustavo Bravo, Dra. Gabriela Gregorio, Dra. María Inés Lutz, Dra. Cristina Rizzo, Dr. Darío Siciliani, Dra. Gabriela Tapponnier, Dra. Silvia Velozo, Dra. Lucia Villarreal.
Hospital de Pediatría Garrahan, Grupo de trabajo: Dra. Rosa Bologna, Dra. Juliana Caccavo, Dra. Regina Ercole, Dra. Laura Inda, Dr. Horacio Lopardo, Dr. Leonardo Mannino, Dra. Andrea Mónaco Dr. Hugo Paganini, Dra. Guadalupe Pérez, Dra. María Rosanova, Dra. Moira Taicz, Dra. Diana Viale.
Sanatorio Güemes, Grupo de trabajo: Dra. Silvana Bazan, Dra. Alicia Mariani, Dr. Esteban Rowestein, Dra. Viviana Sánchez, Dr. Jorge Selandari, Dra. Roxana Stratico, Dr. Fabian Vera.
Hospital Materno Infantil de San Isidro: Dra. Alejandra Gaiano. Grupo de trabajo: Dr. Milka Capurro, Dra. Nora Luedicke, Dr. Roberto Pena.
Hospital Universitario Austral, Grupo de trabajo: Dra. Victoria Ávila Diez, Dr. Enrique Casanueva, Dr. Tomás Iolster, Dra. Mercedes Rojas, Dra. Paola Soto, Dr. Nicolás Sticco.
Hospital Pediátrico Juan Pablo II y Clínica del Niño de Corrientes: Dra. Andrea Gajo Gané. Grupo de trabajo: Dra. Gladys Abreo, Dra. Blanca Alarcón, Dr. Gerardo Andino, Dra. Malena Grachot, Dr. Augusto Millán, Dra. Mirian Salmón, Dra. Claudia Inés Vrátnica, Lic. Humberto Galeano.
Hospital de Niños Dr. O. Alassia: Dra. Raquel Cociglio. Grupo de trabajo: Dra. Carolina Epelbaum, Dr. Gustavo Ezcurra.
Hospital de Niños "Dr. Héctor Quintana" de Jujuy: Dr. Martín Caruso. Grupo de trabajo: Dra. Raquel Franco, Dra. María Rosa Miranda.
Hospital Británico de Buenos Aires: Dra. Virginia Bonardo. Grupo de trabajo: Dra. Julieta Irman, Dr. Gonzalo Rojo, Dra. Gabriela Savanti.
Centro Gallego de Buenos Aires: Dra. Elizabeth Bogdanovich. Grupo de trabajo: Dra. Alejandra Costa, Dra. Gabriela Netri.
Hospital General de Niños "Dr. Pedro de Elizalde": Dr. Aldo Cancellara. Grupo de trabajo: Dra. Silvia Álvarez Ponte, Dra. Patricia Dondoglio, Dra. Claudia Ferrario, Dr. Javier Potasnik, Dra. María José Rial, Dra. Norma Schenone.
HIGA Eva Perón de San Martin: Dra. Rosana Corazza. Grupo de trabajo: Dra. María Lorena Cavalieri, Dra. Agustina Peuchot, Dr. Juan Carlos Peuchot.
Avelino Lorenzo Castelan de Resistencia Chaco: Dra. Cristina Euliarte. Grupo de trabajo: Dra. Clarisa Aguirre, Dra. Teresa Corallo, Dr. Daniel Lamberti, Dra. Sandra Morínigo.
Sanatorio Alexander Fleming de la Obra Social de Empleados Públicos: Dra. Claudia Domínguez, Grupo de trabajo: Lic. María Cabrera, Lic. Ester Coria.
Hospital Interzonal General de Agudos "Dr. Diego Paroissien" de la Matanza: Dra. Carmen Libonatti.
Hospital Carlos J. Rodríguez de Arroyito, Córdoba: Dra. Ana Ceballos, Dra. Verónica Carabajal, Dra. Luciana Ponse, Dra. Mónica Ana Rodríguez, Enf. Aux. Leticia Acevedo.
Nuevo Hospital San Antonio de Padua de Córdoba, Grupo de trabajo: Dra. María Silvia Maurizio, Dra. María Julieta Simancas.
Fundación Hospitalaria, Grupo de trabajo: Dra. Adriana Arto, Dra. María del Carmen Difabio, Dr. Raúl Gómez Traverso, Dra. Alejandra Lafont, Dra. Karina Vallone.
Sanatorio San Cayetano: Dra. Patricia Janello.
Hospital Pediátrico del Niño Jesús de Córdoba, Coordinadora de Córdoba: Dra. Ana Ceballos. Grupo de trabajo: Dra. Miriam Calvari, Dra. Liliana Cecchi, Dra. Silvia Ferreyra, Dra. Claudia Limpias.
Hospital Infantil Municipal de Córdoba: Coordinadora de Córdoba. Dra. Ana Ceballos. Grupo de Trabajo: Dr. Alberto Aird, Dra. Eugenia Tirao.
Centro Salud Norte Olivos, Hospital "San Juan de Dios", Hospital Zubizaretta: Dra. Gladys Ferrucci.
Hospital de Alta Complejidad "Juan Domingo Perón", Grupo de trabajo: Dra. Margarita Batista Dra. Alejandra Bontchef.
Hospital de Infecciosas F. Muñiz: Dr. Gabriel Saidman.
Agradecimientos
A todo el equipo de salud que con su esfuerzo, en cada institución, permitió dar lo mejor a nuestros niños en los difíciles momentos vividos en la pandemia.
Al Dr. Norberto Giglio por su asesoramiento y colaboración en la revisión del manuscrito.
Bibliografía
1. Sociedad Argentina de Infectología (SADI) Sociedad Argentina de Pediatría (SAP) (Comité Nacional de Infectología) Documento sobre Infección por virus de Influenza A (H1N1). Junio 2009. [Acceso: 6-5-11]. Disponible en: http://www.sap.org.ar/staticfiles/comunicaciones/Documento_GRIPEA_5_7_09.pdf
2. Writing Committee of the WHO Consultation on Clinical Aspects of Pandemic (H1N1) 2009 Influenza Clinical Aspects of Pandemic 2009 Influenza A (H1N1) Virus Infection. Review Article. N Engl J Med2010;362(18): 1708-19. [ Links ]
3. Ministerio de Salud, Argentina. Notificación al Sistema Nacional de Vigilancia Laboratorial SNVS-SIVILA: Actualización infecciones respiratorias agudas virales, todo el país hasta SE 29 incluyendo influenza A H1N1. Julio 29, 2009. [Acceso: 6-5-11]. Disponible en: http://www.msal.gov.ar/htm/site/pdf/Epi-29-07.pdf
4. CDC. Guía provisional para la detección del nuevo virus de la influenza A con pruebas de diagnóstico rápido de la influenza. Agosto 2009. [Acceso: 6-5-11]. Disponible en: http://espanol.cdc.gov/enes/hlnlflu/guidance/rapid_testing.htm.
5. Ministerio de Salud, Argentina. [Acceso: 6-5-11]. Disponible en: http://www.msal.gov.ar/gripe2011/3_argentina/resolucion.html
6. Shun-Shin M, Thompson M, Heneghan C, Perera R, et al. Neuraminidase inhibitors for treatment and prophylaxis of influenza in children: systematic review and meta-analysis of randomised controlled trials. BMJ 2009; 339:b3172. [ Links ]
7. Lucion MF, Bakir J, Romanin V, Gentile A, Seasonal influenza (IF) virus infection: risk factors in hospitalized children. 6o Congreso Mundial de Infectología Pediátrica. WSPID. Buenos Aires; 16-19 de Noviembre de 2009. Abstracts. Pág.446. [ Links ]
8. Sasbon J, Centeno M, García M, Boada NB, et al. Influenza A (pH1N1) infection in children admitted to a pediatric intensive care unit: Differences with other respiratory viruses. Pediatr Crit Care Med 2011;12:1-5.
9. Libster R, Bugna J, Coviello S, Hijano DR, et al. Pediatric Hospitalizations Associated with 2009 Pandemic Influenza A (H1N1) in Argentina. N Engl J Med 2010; 362:45-55. [ Links ]
10. Lister P, Reynolds F, Parlsow R, Chan A, et al. Swine-origin Influenza virus H1N1, seasonal influenza virus, and critical illness in children. Lancet 2009; 374(9690):605-7. [ Links ]
11. Ampofo K, Herbener A, Blaschke AJ, Heyrend C, et al. Association of 2009 Pandemic Influenza A (H1N1) Infection and Increased Hospitalization With Parapneumonic Empyema in Children in Utah. Pediatr Infect Dis J 2010; 29(10):905-9.
12. Comisión para la Contingencia de Influenza A (H1N1), Hospital Nacional Profesor Alejandro Posadas. Epidemia de Influenza A (H1N1) en la Argentina. Experiencia del Hospital Nacional Profesor Alejandro Posadas. Medicina (Bs. Aires) 2009; 69(4):393-423. [ Links ]
13. Kumar S, Havens P, Chusid M, Willougby RE Jr, et al. Clinical and Epidemiologic Characteristics of Children Hospitalized With 2009 Pandemic H1N1 Influenza A Infection. Pediatr Infect Dis J 2010;29(7):591-4. [ Links ]
14. Bryant P, Tebruegge M, Papadakis G, Clarke C, et al. Clinical and Microbiologic Features Associated With Novel Swine-Origin Influenza A Pandemic 2009 (H1N1) Virus in Children: aprospective cohort study. Pediatr Infect Dis J 2010; 29(8):694-8. [ Links ]
15. Gordon C, Johnson P, Permezel M, Holmes N, et al. Association between Severe Pandemic 2009 Influenza A (H1N1) Virus Infection and Inmunoglobulin G2 Subclass Deficiency. Clin Infect Dis 2010; 50(5):672-8. [ Links ]
16. Pérez-Padilla R, Fernández R, García-Sancho C, Franco-Marina F, et al. Pandemic (H1N1) 2009 Virus and Down Syndrome Patients. Emer Infect Dis 2010; 16(8): 1312-1314. [ Links ]
17. Giannattasio A, Lo Vecchio A, Russo MT, Pirozzi MR, et al. Pandemic flu: a comparative evaluation of clinical, laboratory, and radiographic findings in HIV-positive and negative children. AIDS 2010; 24(14):2292-4. [ Links ]
18. Villafuerte Delgado D, García Gómez C, Conde Cueto T, Yanes Ysray O, Rodriguez Pino MY. Influenza A (H1N1). Patrones Radiológicos. Revista de las Ciencias Médicas de Cienfuegos, Cuba. [Acceso: 6-5-11] Disponible en: http://www.medisur.sld.cu/index.php/medisur/article/view/1113/45
19. Matheson NJ, Harnden AR, Perera R, Sheikh A, Symmonds- Abrahams M. Inhibidores de la neuraminidasa para la prevención y el tratamiento de la gripe en niños (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd (Traducida de The Cochrane Library, 2008 Issue 3. Chichester: John Wiley & Sons, Ltd.). [Acceso: 12-5-2011] Disponible en: http://www.cochrane.org/reviews/es/ab002744.html
20. ANMAT. Uso del oseltamivir en menores de 1 año y embarazadas. Buenos Aires 18 de junio. [Acceso: 12-5-11] Disponible en: www.anmat.gov.ar/publicaciones/medicamentos/recomendaciones_oseltamivir_zanamivir.pdf.
21. Chowell G, Bertozzi S, Colchero M, López-Gatell H, et al. Severe Respiratory Disease Concurrent with the Circulation of H1N1 Influenza. N Engl J Med 2009; 361(7): 674-679. [ Links ]
22. Bakir J, Umido U, Romanin V, Ruttimann R, et al. Impacto del virus influenza en los niños: la realidad de un Hospital Pediátrico. Rev Hosp Niños B.Aires 2005; 47(214): 270-275. [Acceso: 6-5-11] Disponible en: http://www.revistahnrg.com.ar/pdf_contenidos/con81-270.pdf
23. Bakir J, Salvay M, Lución F, Gentile A. Factores de riesgo asociados a la infección por virus influenza en pediatría. 6° Congreso Argentino de Infectología Pediátrica. Buenos Aires; 2008. Pág.61. Resumen SP 061.Pág.97.
24. Smith JR, Ariano RE, Toovey S. The use of antiviral agents for the management of severe influenza. Crit Care Med. 2010;38(Suppl 4):e43-51.
25. Donaldson L, Rutter P, Ellis B, Greaves F, et al. Mortality from pandemic A/H1N1 2009 influenza in England: public health surveillance study. BMJ 2009;339:b5213. [ Links ]














