Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Revista de la Sociedad Boliviana de Pediatría
versión On-line ISSN 1024-0675
Rev. bol. ped. v.43 n.2 La Paz jun. 2004
CASO CLINICO Y ACTUALIZACION
Rabia humana. A propósito de un caso
Human Rabies. A case report
Drs.: Víctor Hugo Velasco*, Maria Paola Arellano Maric**, Jorge Salazar Fuentes**
* Hospital del Niño "Dr. Ovidio Aliaga Uria".
** Clínica Caja Petrolera de La Paz.
Caso clínico
Paciente femenina de 11 años de edad que fué mordida en pie derecho y mano izquierda por un cachorro con rabia confirmada. A los 8 días del incidente se inició esquema de vacunación antirrábica (vacuna extraída de cerebro de ratón lactante). No se indicó administración de inmunoglobulina específica.
Treinta y nueve días después, habiendo recibido 8 dosis de vacuna, acudió al servicio de emergencias por presentar un cuadro de 5 días de evolución caracterizado por cefalea, debilidad y parestesias, estas últimas se iniciaron en antebrazo y ascendieron progresivamente hasta la región cervical. Día antes de la consulta, el cuadro se acompañó de disartria y disfagia.
Al examen físico el paciente estaba alerta, aunque ocasionalmente pronunciaba incoherencias. Temperatura de 39° C. En el tercer dedo de la mano izquierda se encontró pequeña cicatriz producto de la mordedura de can. La movilidad de cuello era normal y presentaba dificultad en la articulación de palabras. El resto del examen sin alteraciones. Por los antecedentes y la signo-sintomatología se decidió la internación de la niña con el diagnóstico presuntivo de rabia humana.
En el segundo día de internación presentó sialorrea espesa, taquicardia, taquipnea, hiporreflexia y rigidez de cuello, además convulsiones tónico clónicas generalizadas que fueron controladas con benzodiazepinas. Se decidió su traslado a la unidad de cuidados intensivos para manejo de vía aérea y sedación.
Durante su internación se realizaron exámenes complementarios. El líquido cefalorraquídeo era cristal de roca con 21 células por campo a predominio polimorfonuclear, proteinorraquia negativa y glucorraquia de 63 mg/dL. La inmunofluorescencia directa en biopsia de piel de nuca fue altamente sugerente para el virus de rabia.
Permaneció en la unidad de cuidados intensivos bajo sedación a infusión continua y ventilación mecánica, con el paso de los días el estado general se deterioró y falleció 17 días después de su internación con datos de falla cardiaca.
Se realizó biopsia cerebral (hipocampo) para inmunoflorecencia, misma que fué positiva para rabia, confirmándose el diagnóstico.
Introducción
La primera mención de rabia se encuentra en el código Amurabi de Babilonia en el siglo 23 AC, posteriormente se describe con mayor claridad en los escritos de Democritus (500 AC) y Aristóteles (400 AC). Desde entonces, es una de las enfermedades virales que con mayor frecuencia produce muertes en el mundo.[1,2]
La rabia humana es una encefalomielitis transmitida generalmente por la contaminación de una herida con saliva de un animal enfermo. Es una enfermedad prevenible con profilaxis post-exposición, pero mortal en prácticamente el 100% de los casos una vez que se desarrollan los síntomas.[1-24]
Etiología
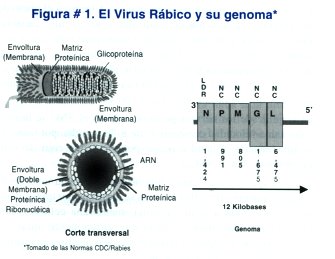
El virus de la rabia (serotipo 1) es un virus RNA de hebra simple, miembro de la familia Rhabdoviridae del género Lyssavirus (Figura #1). Tiene propiedades neurotrópicas muy particulares. [1 - 24]
Transmisión
Cualquier animal de sangre caliente puede ser infectado. El virus se mantiene por transmisión intra-especie en niveles endémicos y epidémicos en una amplia variedad de especies Carnívora y Microchiroptera. La forma más común de adquirir la enfermedad en todo el mundo es a partir de la mordedura de un perro. Sin embargo, en países desarrollados, que han eliminado la rabia de los animales domésticos, son transmisores de la infección: coyotes, lobos, zorros, castores, mapaches, ardillas, zorrillos y murciélagos.[2-5]
El contacto de la saliva contaminada con mucosas (conjuntiva, cavidad oral y genitales), durante la interacción con el animal, también debe ser considerado peligroso.[2-5]
Otra forma de transmisión de la rabia es a través de la inhalación, ya sea, de excreta de murciélago en cuevas infestadas por estos o por aerosoles producidos durante procedimientos laboratoriales.[6.7]
La transmisión entre humanos, aunque teóricamente posible, solo se ha demostrado a través del transplante de córnea de un paciente enfermo a uno sano.[6-8]
Patogenia
No todos los acontecimientos relacionados a la patogénesis están claramente explicados debido a que no existe un modelo experimental capaz de traducir la infección natural que se produce. Lo siguiente es un resumen de aspectos consensuados.[2,5,6,7]
Después de la inoculación de saliva contaminada, el virus se multiplica en el tejido muscular estriado al que se adhiere a receptores, nicotínicos y colinérgicos. Estos receptores proveen acceso al sistema nervioso periférico a través de la unión neuromuscular. Después de un tiempo asciende por los nervios periféricos, a partir de ese momento el desarrollo de la enfermedad y el desenlace fatal son inevitables. En algunos modelos experimentales el virus tomó los nervios periféricos inmediatamente y en otros después de una replicación local en tejido no-nervioso. Posteriormente el virus alcanza el sistema nervioso central (SNC) por transporte axónico retrógrado y produce encefalitis, previa nueva replicación en los ganglios dorsales.[2,5,6,7]
El periodo de tiempo entre la inoculación del virus y el inicio de los síntomas (afectación de tejido nervioso) es muy variable, puede ir desde días hasta más de 6 años, pero con mayor frecuencia es de 1 a 2 meses. Este retraso, posiblemente relacionado con la amplificación del virus en tejidos periféricos, proporciona la oportunidad de eliminarlo ya sea por el sistema inmune del individuo o por la inmunización post-exposición.[2-5]
El viaje desde los nervios periféricos hasta el SNC se lleva a cabo a una velocidad constante entre 8-20 mm/día, por tanto, el tiempo requerido esta influenciado por la distancia entre del sitio de inoculación y el SNC.[2,6]
Una vez que el virus llega a una neurona se inicia una rápida propagación por el cerebro. El virus se disemina por transmisión directa de célula a célula, plasma-membrana celular o por propagación transináptica, hasta que virtualmente todas las neuronas están afectadas. Preferentemente se localiza en tálamo, ganglios basales y médula espinal.[2,6,7]
En animales, el compromiso del SNC asegura la transmisión del virus por dos mecanismos: (1) la infección de ciertas regiones del cerebro lo vuelven agresivo y proclive a atacar sin mayor provocación y (2) el transporte centrífugo del virus desde el cerebro hasta áreas muy inervadas (glándulas salivales, córnea y la piel) lleva al virus a diseminarse.[2,6]
El componente final del ciclo del virus es su dispersión centrífuga a través de los tractos nerviosos al corazón, piel y a otros órganos.[2,6]
Epidemiología
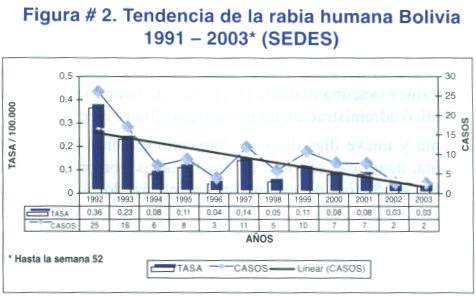
La rabia es una enfermedad prevalente en Bolivia. Aunque se observa una tendencia descendente, mucho más evidente a partir de 1999, las medidas de salud pública tomadas aun son insuficientes para erradicar la enfermedad de nuestro país, ver figura # 2.
Los reservorios para el virus de la rabia se encuentran esencialmente en todo el mundo y solamente ciertos lugares como Australia, la Antártica y Hawai están libres de ella.[1,2]
Características Clínicas
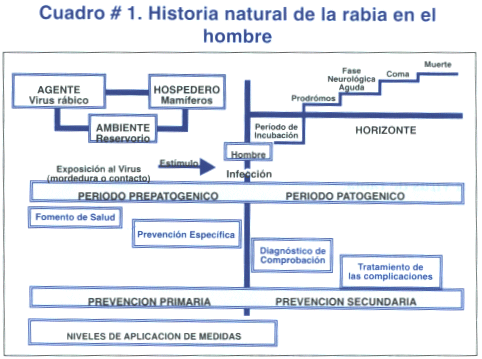
Las características clínicas se pueden dividir en cinco fases: periodo de incubación, pródromos, fase neurológica aguda, coma y muerte.[6] La historia natural de la rabia se esquematiza en el cuadro # 1.
Periodo de incubación: generalmente es de 1 a 2 meses.
Pródromos: dura 2-10 días. Se inicia cuando el virus se mueve en forma centrípeta desde la periferie hasta los ganglios de las raíces dorsales y luego al SNC. Estos cambios marcan el final del periodo de incubación y el pronóstico es fatal dentro de las siguientes 2 semanas. En esta etapa los síntomas son inespecíficos como fiebre, malestar, cefalea, anorexia, náuseas y vómito; pero también aparecen síntomas específicos en el sitio de la mordedura como dolor, prurito, parestesias que luego se distribuyen a una región más amplia reflejando ganglioneuritis.[2-6]
Fase neurológica aguda: se correlaciona con la dispersión del virus por el tejido encefálico. Se manifiesta siguiendo una de dos variedades, la encefálica (furiosa) o la paralítica (silente). Si no sobreviene la muerte por paro cardiorrespiratorio durante esta fase, se instaura la cuarta fase: coma.[5,6]
a) Rabia encefálica: la característica más temprana es la hiperactividad. Luego, dentro de las primeras 24 horas aparecen 3 signos cardinales; (1) fluctuación del estado mental, (2) fobia o espasmos respiratorios, (3) disfunción autonómica.[2,5,6]
El estado de conciencia oscila entre; periodos de hiperactividad, desorientación y alteración de la conducta alternados con periodos de lucidez.[2,5-7]
La hidrofobia, provocada al tragar líquido o con la sola idea de hacerlo, es resultado de espasmos de los músculos inspiratorios por destrucción de los segmentos cerebrales que inhiben a las neuronas del núcleo ambiguo, el cual controla la inspiración.[2,5-7]
La aerofobia, como la hidrofobia, es considerada patognomónica de rabia. Se despierta al soplar en la cara de enfermo, la maniobra produce violentos espasmos de los músculos faríngeos y del cuello.[2,5-7]
Los espasmos inspiratorios son similares a los espasmos fóbicos, pero ocurren espontáneamente sin estimulación, son menos frecuentes e intensos cuando el paciente está alerta y bien identificados una vez que sobreviene el coma.[2,5,6]
La aparición de signos de hiperactividad autonómica apoya el diagnóstico. Pueden aparecer reacciones transitorias como pupilas fijas dilatadas o contraídas, piloerección generalizada, hipersalivación, hiperhidrosis, priapismo y eyaculaciones espontáneas. En raros casos se presentan convulsiones y más raramente aun opistótomos.[2,5,6]
La mayoría de los pacientes muere dentro de los siguientes 7 días del inicio de los síntomas.[2,5,6]
b) Paralítica:
Aproximadamente el 20% de los casos de rabia desarrolla la variedad paralítica. Generalmente, está asociada a la exposición a murciélagos.[2-7]
Esta forma de la enfermedad es extremadamente difícil de diagnosticar por la ausencia de las características fobias y de la hiperactividad. Además es frecuentemente confundida con el síndrome de Guillain Barré por sus similitudes clínicas.[2-7]
La forma paralítica afecta principalmente a la médula espinal. Se presenta con debilidad que generalmente se inicia en la extremidad mordida y se extiende hasta comprometer los cuatro miembros y los músculos faciales. Luego sobreviene la parálisis simétrica ascendente con flacidez e hiporreflexia. También se evidencia mioedema (espasmo de un par de segundos en una parte del músculo, despertado con el martillo de percusión) que lo diferencia del Guillain Barré. La conciencia y la función sensorial se mantienen indemnes.[2-7]
Coma: Es el cuarto estadio de la rabia. Se correlaciona con extensa dispersión del virus por la corteza cerebral. Se reconoce por los espasmos inspiratorios. Además se acompaña de taquicardia sinusal, hipotensión y en ocasiones de arritmias; signos que traducen miocarditis e infiltración viral de los centros de control eléctrico.[5,6]
Muerte: se debe principalmente a miocarditis que produce insuficiencia circulatoria o arritmias cardiacas.[2,5,6]
Diagnóstico
El confirmar el caso de rabia humana de manera veraz y oportuna representa un reto para la vigilancia epidemiológica y es un indicador de impacto de las actividades realizadas. El disponer e interpretar estos resultados, esta condicionado al interés y al esfuerzo que se haga en hacer llegar las muestras a los laboratorios aptos para realizar el diagnóstico de rabia.[8-10]
El diagnóstico no presenta mayores dificultades cuando un paciente presenta la clínica descrita y cuenta con el antecedente de mordedura de un animal con rabia. Durante el periodo de incubación no hay ningún estudio de laboratorio útil para el diagnóstico.[9]
Las pruebas diagnósticas se dividen en; las que se realizan en el paciente vivo (intra vitam) y las que son efectuadas después de su defunción (post mortem).[9]
Muestras para diagnóstico intra vitam: las muestras se recolectan en dos ocasiones: la primera, al iniciarse los signos y síntomas; y la segunda, en las etapas finales de la enfermedad, antes de que la persona muera.[9,10]
- Impronta de córnea: Se presiona firmemente un portaobjeto, en la parte central de la córnea, operación que se repite dos veces por cada ojo. Se fijan en acetona, se identifican y empacan.[9]
Se debe colocar el portaobjetos en dos láminas de cartón rígido, procurando que la superficie donde están las células descamadas no entren en contacto con la superficie del cartón, para ello se enrolla una tira de tela adhesiva en ambos extremos de la laminilla y posteriormente se coloca el cartón protector. Esta prueba es de baja sensibilidad y en ocasiones traumática.[9]
- Saliva: Se recolecta del piso de la boca con gotero o jeringa, se vacía en un tubo de ensayo (con tapón de rosca), que contenga 2 mL de solución salina. En esta también se enjuaga el elemento de toma de muestra o se deposita el hisopo; se identifica, empaca y refrigera.[9]
- Biopsia de piel: Se toma piel de la nuca a la altura del nacimiento del cabello, de 10 mm de diámetro y que incluya dermis (folículos pilosos). Se deposita en un tubo de ensayo (con tapa de rosca), que contenga 2 ml de solución salina o solución de glicerol al 50% en solución salina. Se identifica, empaca y conserva en refrigeración. [7,9]
- Suero y líquido cefalorraquídeo (LCR): Se obtienen diez días después de iniciados los síntomas neurológicos. La detección de anticuerpos en suero solo es útil en pacientes no vacunados, este impedimento no se presenta con el LCR. La cantidad necesaria por cada muestra es de 2 mL. [2,9]
El estudio citoquímico de LCR generalmente es normal, puede presentar en una minoría de los casos los cambios típicos de una meningoencefalitis viral (linfocitosis con pleocitosis, glucosa normal y una modesta elevación de las proteínas). [2,9]
Muestras para diagnóstico postmortem: se pueden realizar en humanos y animales. Se considera como muestra ideal al encéfalo, este se envía refrigerado y sin conservantes (formol o alcohol), dentro las primeras 48 horas.[9,24]
En caso de que la muestra se conserve por más tiempo, se sumerge en solución de glicerol al 50%. Si se utilizan otras sustancias fijadoras, indicarlo por escrito al laboratorio.[9,24]
En el ser humano se extraen muestras de cerebelo, tallo encefálico e hipocampo (asta de Ammon) en trozos de 2 x 2 cm, estructuras en las que aumenta la sensibilidad de las pruebas.[9,24]
Técnicas y pruebas
En orden de importancia, corresponden a:
a) La inmunoflorescencia directa continúa siendo, desde finales de 1950, el estándar de oro. Las pruebas de titulación de anticuerpos neutralizantes en suero de ratón (MNT) y la técnica rápida de inhibición de focos fluorescentes (RFFIT) a cualquier título, ponen de manifiesto la infección.[1,9,23]
b) El aislamiento del virus por inoculación en ratón lactante, o en células de neuroblastomas. Se considera confirmatoria de las pruebas de detección de antígeno.[9]
c) El examen histopatológico evidencia encefalomielitis. Los cuerpos de Negri, descritos por Adelchi Negri en 1903, son patognomónicos de la enfermedad pero su presencia es variable, solamente se evidencian en el 50 a 80% de las muestras positivas con inmunofluoresencia directa, por ello ya no se utiliza como procedimiento diagnóstico.[2-5,922]
d) Estudios de imagenología son absolutamente normales[9]
Manejo
Con el advenimiento de los cuidados intensivos modernos la vida del paciente con rabia puede ser prolongada. Sin embargo, este hecho propicia a la aparición de muchas complicaciones. La más significativa es la miocarditis. También puede desarrollarse diabetes insípida, por infiltración de la hipófisis.[6]
Prevención
La prevención de la enfermedad está directamente relacionada con el grado de educación de la población, la atención primaria que reciba el paciente y la disponibilidad de agentes biológicos modernos. Cuando el tratamiento está indicado debe iniciarse lo más pronto posible (dentro de las 24 a 48 horas).[18,25-27]
Se basa en el fomento de la salud y consta de:[18,25]
1. Educación a la población con:
Información sobre el problema de la rabia.
Información sobre los beneficios de la vacunación antirrábica canina.
Información acerca del cuidado de los animales.
Información sobre el cuidado y manejo de las lesiones de manera inmediata y atención médica adecuada.
2. Protección específica con:
En el reservorio: vacunación antirrábica de perros y gatos, sacrificio o adopción de perros sin dueño, captura, monitoreo y eliminación del vampiro hematófago, observación y diagnóstico de animales sospechosos o agresores. Cuidado y control de la ambulación en la vía pública del perro.[25]
En el hombre: vacunación pre-exposición a población en riesgo (veterinarios). Tratamiento post-exposición, complementado mediante la observación del animal agresor.[25]
El lavado de la herida debe realizarse con jabón y aclararse con abundante agua. No se recomienda la utilización de cepillos, pues estos pueden inducir la diseminación a tejidos más profundos. En centros de salud, el lavado se realiza con solución salina o ringer lactato con una jeringa de 35 mL con aguja 18 que genera una presión aproximada de 500 g/cm2.[7,9,11,17, 20,25]
En caso de encontrase una herida penetrante por un colmillo se debe irrigar la lesión con una sonda Foley sin realizar demasiada presión pues la inyección de liquido a la herida puede también diseminar la infección.[13,25]
Una vez expuesto el paciente a mordedura por animal sospechoso se deben seguir las guías detalladas en el cuadro # 2.
La inmunización de rabia se la realiza según las guías detalladas en el cuadro # 3.
Las vacunas derivadas del sistema nervioso central de animales, como la VCRL y la vacuna de cerebro de cordero, no se utilizan en países desarrollados por su pobre antigenicidad, el requerimiento de varias dosis y la posibilidad de presentar serias complicaciones como encefalitis post-vacuna. Pese a los mencionados inconvenientes, la VCRL es ampliamente utilizada en nuestro país por ser una vacuna barata y preparada en laboratorios nacionales.[7,13,14,21]
La encefalitis post-vacuna se inicia típicamente a los 10-14 días después de la vacunación. El cuadro es muy similar a la rabia pero no se presentan espasmos fóbicos, síntomas prodrómicos locales ni fluctuación en el estado de conciencia.[2,6,7]
Un avance significativo en la elaboración de vacunas anti-rábicas fue el desarrollo de la tecnología en el cultivo celular, esta permitió la producción de vacunas altamente concentradas con alta potencia antigénica y bajo contenido de proteínas celulares. Con esta técnica se mejoró la inmunogenicidad, reduciendo así el número de dosis y las reacciones adversas. Existen tres vacunas cultivadas en células: VCDH, VRA, VPCEP.
En nuestro medio es posible adquirir la VCDH.[7]
La inmunización pasiva con inmunoglobulina especifica, extraída a partir de plasma humano produce un bloqueo inmediato de la adhesión del virus a las terminaciones nerviosas.[7,8,15]
Referencias
1. Rupprecht CE, Hanlon CA, Hemachudha T. Rabies re-examined. Lancet Infect Dis 2002; 2: 337- 53. [ Links ]
2. Bleck TP, Rupprecht CE. Rabies Virus. In Mandell GL, Bennett JE, Dolin R. Principles and Practice of Infectious Diseases. 5th ed. Churchill Livingstone; 2000: 1811 9. [ Links ]
3. Nath A, Berger JR. Rabies. In Goldman L, Bennet JC. Cecil Textbook of Medicine. 21st ed. W. B. Saunders Company; 2000: 2132 3. [ Links ]
4. Corey L. Virus de la rabia y otros rabdovirus. En Fauci AS, Braunwald E, Isaselbacher KJ, Wilson JD, Martin JB, Kasper DI, Hauser SI, Longo DL. Harrison, Principios de Medicina Interna. 14 ed. Madrid: Mc Grawn Hill; 1998: 1293 6. [ Links ]
5. Stanley AP. Rabies Virus. In Long SS, Pickering LK, Prober CG. Principles and Practice of Pediatric Infectious Diseases. 2nd ed. Elsevie; 2003: 1155 9.
6. Hemachudha T, Laothamatas J, Rupprecht C. Human rabies: a disease of complex neuropathogenetic mechanisms and diagnostic challenges. The Lancet Neurology. 2002: 1: 101 9. [ Links ]
7. Adams WG. Rabies. In Behrman RE, Kliegman RM, Arvib AM, Nelson WE. Nelson Text Book of pediatrics. 17ed. Pensilvania: Saunders Company 2004: 1101- 4. [ Links ]
8. Duncan L, Nisenn D. Mosby's Drug Consult. 13th ed. Mosby; 2003: 1236. [ Links ]
9. CDC. Human rabies preventionUnited States, 1999. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1999;48:(No. RR-1). [ Links ]
10. American Academy of Pediatrics. 2000 Red book: report of the Committee on Infectious Diseases, 25th ed. Elk Grove Village, Ill: The Academy; 2000: on line [ Links ]
11. Ebel B, Hirshfeld A. Inmunoprofilaxis. En Silberry GK, Iannone R. Manual de pediatria del Harriet Lane. 15ava ed. México: Mc Graw Hill; 2002. p. 327 55.
12. Hughes JM, LeDuc JW. Compendium of Animal Rabies Prevention and Control, National Association of State Public Health Veterinarians, Recommendations and Reports 2003; 52(RR05): 1-8. [ Links ]
13. Presutti RJ. Prevention and Treatment of Dog Bites. Am Fam Physician 2001;63:1567-72,1573-4. [ Links ]
14. Shelburne SA, Shandera WX. Infectious disease: Viral & rickettsial. In Tierney LM, Mc Phee SJ, Papadakis MA. Current medical diagnosis & treatment. 40th ed. NY: Mc Graw Hill. 2002: 1311 3.
15. National Center of Infectious Disease. Rabies. New standard DFA protocol for rabies; 2003. [ Links ]
16. Wunner WH, Calisher CH, Dietzgen RG, Jackson RG, Kitajima AO, Lafon MF et al. Rhabdoviridae. In classification and nomenclature of viruses. Sixth report of the International Committee on Taxonomy of Viruses, in press. Springer-Verlag, New York.
17. Krebs JW, Strine TW, Smith JS, Rupprecht CE, Childs JE. Rabies surveillance in the United States during 1994. J Am Vet Med 1995; 207: 1562 75. [ Links ]
18. Smith JS. New aspects of rabies with Emphasis on Epidemiology, Diagnosis, and Prevention of the Disease in The United States. Clin Microbiol Review 1996; 166 76. [ Links ]
19. Tsiang H, Ceccaldi PE, Lycke E. Rabies virus infection and transport in human sensory dorsal root ganglia neurons. J Gen Virol 1991;72: 1191 4. [ Links ]
20. Murphy FA, Bauer SP, Harrison AK, Winn WC. Comparative pathogenesis of rabies and rabies-like viruses. Viral infection and transit from inoculation site to the central nervous system. Lab Invest 1973; 28: 361 76. [ Links ]
21. Murphy FA, Harrison AK, Winn WC, Bauer SP. Comparative pathogenesis of rabies and rabies-like viruses: infection of the central nervous system and centrifugal spread of virus to peripheral tissues. Lab Invest 1973; 29: 1 16. [ Links ]
22. Sureau P, Ravisse P, Rollin PE. Rabies diagnosis by animal inoculation, identification of negri bodies, or ELISA. En GM Baer. The natural history of rabies. 2nd ed. CRC: Press. Boca Raton 1991; 202 17. [ Links ]
23. Rudd RJ, Trimarchi CV. Comparison of sensitivity of BHK-21 and murine neuroblastoma cells in the isolation of a street strain rabies virus. J Clin Microbiol 1987; 25:1456-8. [ Links ]
24. Eng TR, Fishbein DB. Epidemiologic factors, clinical findings, and vaccination status of rabies in cats and dogs in The United States in 1988. J Am Vet Med Assoc. 1990: 197: 201 9. [ Links ]
25. Centers for Disease Control and Prevention rabies website: http://www.cdc.gov/ncidod/dvrd/rabies/ [ Links ]
26. Strady A, Lang J, Lienard M, et al. Antibody persistence following preexposure regimens of cell-culture rabies vaccines: 10-year follow-up and proposal for a new booster policy. J Infect Dis 1998;177:12905. [ Links ]
27. Warrell MJ, Nicholson KG, Warrell DA, et al. Economical multiple-site intradermal immunisation with human diploid-cell strain vaccine is effective for post-exposure rabies prophylaxis. Lancet 1985;1:105962. [ Links ]
28. Plotkin SA. Rabies. Clin Infect Dis 2000; 30:412. [ Links ]