Servicios Personalizados
Revista
Articulo
Indicadores
-
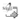 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
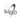 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Boliviana de Pediatría
versión On-line ISSN 1024-0675
Rev. bol. ped. v.41 n.3 La Paz ago. 2002
ARTICULOS DEL CONO SUR - BRASIL
Ventilação de alta freqüência por oscilação comparada a ventilação mecânica convencional associada a reposição de surfactante em coelhos(1)
High frequency oscillation ventilation compared to conventional mechanical ventilation plus exogenous surfactant replacement in rabbits
Jefferson Piva*, Phornlert Chatrkaw**, Karen Choong***, Helena Frndova****, Peter Cox*****
* Professor visitante.
** Pós-graduando em pesquisa.
*** Pós-graduando em clínica.
**** Engenheira biomédica.
***** Diretor clínico. Department of Critical Care Medicine (Pediatric Intensive Care), Hospital for Sick Children and School of Medicine of The University of Toronto.
Pesquisa patrocinada pelo Department of Critical Care Medicine, Hospital for Sick Children, Toronto, Canadá.
(1) Artículo original de Brasil, publicado en el Jornal de Pediatría el 2000; 76 (5): 349-356 y que fue seleccionado para su reproducción en el VI encuentro de Editores del Cono Sur, Bolivia, 2001
Resumo
Objetivos: a) avaliar o efeito na oxigenação e ventilação de coelhos artificialmente depletados de surfactante quando submetidos à ventilação mecânica convencional associada à reposição parcial de surfactante exógeno; b) comparar a evolução deste grupo com outro grupo submetido à ventilação de alta freqüência por oscilação (HFO) sem reposição associada de surfactante.
Métodos: Vinte coelhos brancos da raça New Zealand, peso de + 3 kg, foram anestesiados e artificialmente induzidos à depleção de surfactante endógeno através de sucessivas lavagens pulmonares com alíquotas (25 ml/kg) de solução fisiológica, até atingir uma PaO2 menor que 100 mmHg, quando ventilados via traqueostomia no modo de pressão controlada objetivando um volume corrente de 10ml/kg, com PEEP de 5cm H2O, FiO2 de 100%, freqüência respiratória de 30 mpm, e tempo inspiratório de 0,65 s. Posteriormente, os coelhos foram divididos em (a) grupo CMV+S, submetido à ventilação convencional associada com reposição parcial de surfactante exógeno; (b) grupo HFO submetido à ventilação de alta freqüência por oscilação. Gasometrias arteriais foram coletadas antes da lavagem pulmonar, após a lavagem pulmonar, 15, 60 e 120 minutos após iniciado o tratamento. Os grupos foram comparados utilizando-se o teste t de Student.
Resultados: Em ambos grupos a PaO2 (pós lavagem pulmonar) era inferior a 50mmHg (p=0,154), subindo aos15 minutos de tratamento para 254 mmHg (CMV+S) e 288 mmHg (HFO, p=0,626). Aos 60 e 120 minutos, a PaO2 foi maior (p=0,001) no grupo HFO (431 e 431 mmHg) quando comparado com o grupo CMV+S, que apresentou queda progressiva (148 e 126 mmHg). Aos 60 minutos a PaCO2 era significativamente menor no grupo do CMV+S (29 versus 41 mmHg).
Conclusões: Em modelo animal com SARA a estratégia de ventilação protetora como a HFO, isoladamente, promove uma rápida e persistente melhora na oxigenação, inclusive, com níveis superiores aos obtidos pelos animais submetidos à ventilação mecânica convencional associada à reposição de surfactante.
Palabras Claves:
J. pediatr. (Rio J.) 2000; 76 (5): 349-356: tensoativos, respiração artificial, anoxemia, insuficiência respiratória.
Abstract
Objectives: (a) to evaluate the effect on oxygenation and ventilation of rabbits with induced surfactant depletion when they are submitted to a conventional mechanical ventilation, plus a small dose of exogenous surfactant; (b) to compare this group with another group submitted to a High Frequency Oscillation (HFO) without exogenous surfactant administration.
Methods: Twenty New Zealand White rabbits weighing (+ 3 kg) were anaesthetized and artificially induced to a endogenous surfactant depletion by successively lung lavage with normal saline (aliquots of 25 ml/kg) until to reach a persistent PaO2 less than 100 mmHg when submitted to a mechanical ventilation in a pressure control mode with a target tidal volume of 10ml/kg, PEEP of 5cm H2O, FiO2 1.0, respiratory rate 30/min, and inspiratory time of 0.65 s. Then the rabbits were divided in (a) CMV+S group, submitted to a conventional mechanical ventilation plus exogenous surfactant replacement; (b) HFO group, submitted to a High Frequency Oscillation Ventilation. Arterial blood gases were measured at control period, post lung lavage, 15, 16 and 120 minutes after treatment started. The groups were compared using Student t test.
Results: The post lung lavage PaO2 in both groups was lower than 50mmHg (p=0.154), increasing after 15 min of treatment to 254 mmHg (CMV+S) and 288 mmHg (HFO, p=0.626). The PaO2 at 60 and 120 minutes were higher (p=0.001) in the HFO group (431 e 431 mmHg) when compared with the CMV+S group, which showed a progressive fall (148 e 126 mmHg). At 60 minutes of treatment, the PaCO2 was lower (p=0.008) in the CMV+S group (29 versus 41 mmHg).
Conclusions: In ARDS animal model a protect mechanical ventilation strategy as HFO by itself promotes a fast and persistent increase in the oxygenation, with superior levels than those observed in animals treated with conventional mechanical ventilation plus exogenous surfactant replacement.
Keywords:
J. pediatr. (Rio J.) 2000; 76 (5): 349-356: surface-active agents, artificial respiration, hypoxemia, respiratory insufficiency.
Introdução
Na Síndrome do Desconforto (Angústia) Respiratório Agudo (SDRA/ SARA) o comprometimento pulmonar não ocorre de forma homogênea, havendo áreas com complacência muito reduzida em oposição a outras com complacência próxima do normal(1,2). Como conseqüência há uma diminuição progressiva do volume pulmonar, sendo por este motivo que os pulmões na SARA têm sido preferentemente definidos como "pequenos" em substituição à denominação de "pulmões duros" (stiff lungs) usados no passado(3).
Embora a ventilação mecânica seja necessária para manter a vida de pacientes com SARA, o específico método ou padrão ideal de ventilação ainda permanece a ser definido.
Dependendo do padrão ventilatório adotado, pode-se induzir a lesões pulmonares progressivas. A técnica usada para ventilar áreas de "baixa complacência" pode não ser apropriada para ventilar áreas com "complacência normal", podendo, nestas regiões, induzir a dano pulmonar (VILI -Ventilator Induced Lung Injury)(2-6).
Lesão pulmonar induzida pelo ventilador na SARA tem sido associado com a) barotrauma, quando a pressão excessiva utilizada durante a ventilação mecânica causa escapes de ar (pneumotórax, enfisema intersticial, pneumomediastino,...); b) volutrauma, quando o volume corrente administrado distende preferentemente áreas com complacência normal ou aumentada, ocasionando estiramento e ruptura tecidual, seguida de extravasamento capilar, edema alveolar, anormalidades na produção e distribuição do surfactante; c) atelectrauma, é a lesão pulmonar relacionada com abertura e fechamento (colapso e distensão) de unidades alveolares. Neste caso, os pulmões são ventilados usando baixos volumes correntes, inferiores ao ponto de inflexão da curva pressão volume, e/ou a pressão no final da expiração não é capaz de manter as vias aéreas terminais e alvéolos abertos, levando a progressivo colapso pulmonar, sendo que, para reabrir estas unidades, uma pressão maior será necessária; d) biotrauma, quando a ventilação mecânica causa colapso, estiramento ou ruptura tecidual pulmonar levando a dano celular com aumento dos mediadores inflamatórios locais (citoquinas, radicais livres de oxigênio,...)(2,4-7).
Durante os últimos anos houve vários estudos demonstrando a importância da utilização de técnicas protetoras de ventilação mecânica em pacientes com SARA, reduzindo a incidência de lesão pulmonar induzida pelo ventilador e influindo na sobrevida(8,9).
Nos pacientes com SARA, ocorre também disfunção do surfactante, promovendo instabilidade das unidades, alveolares favorecendo ao seu colabamento(3,5,6,10). A ventilação protetora nesta situação baseia-se em aumentar o volume expiratório pulmonar (por exemplo, aumentando a pressão expiratória positiva final PEEP) para evitar o colapso alveolar, assim como usar baixos volumes correntes prevenindo a hiperinsuflação (distensão) alveolar. Estratégias envolvendo a manobra de recrutamento, mantendo volume pulmonar as custas de PEEP, uso associado de surfactante, ventilação líquida, ou ventilação por oscilação com uma pressão de vias aéreas superior a utilizada na ventilação convencional podem reduzir a lesão pulmonar induzida pela ventilação, promover uma insuflação alveolar mais fisiológica e reduzir a inflamação pulmonar(2,5,7-9,11-15).
A ventilação em alta freqüência por oscilação (High Frequency Oscillation - HFO) foi desenvolvida cerca de 50 anos atrás e baseia-se em utilizar diminutos volumes correntes mantendo constante a pressão média das vias aéreas, evitando desta forma volumes pulmonares extremos (baixos e elevados)(13,16-18). Vários autores puderam demonstrar em diferentes modelos animais que a HFO pode proteger os pulmões de lesão induzida quando comparada com ventilação convencional11,17,19,20. Apesar dos estudos clínicos em humanos serem ainda controversos, a HFO vem sendo reconhecida com uma alternativa eficaz para ser empregada em insuficiência respiratória da criança e do recém nascido. Estudos clínicos têm sugerido que a HFO estaria associada como uma menor incidência de lesão pulmonar induzida que a ventilação convencional(5,13,16,18,21).
Em modelos animais com SARA, a lesão pulmonar induzida pelo ventilador pôde ser evitada quando administrouse surfactante exógeno associado com PEEP de 4 cmH2O(11,14,15,22,23). Entretanto, o uso de surfactante exógeno em séries clínicas de pacientes com SARA tem apresentado resultados controversos18,24,25. Esses diferentes resultados podem ser atribuídos aos seguintes fatores: a) tipo e origem do surfactante utilizado; b) método de administração do surfactante; c) dose e fase da doença em que o surfactante foi administrado; d) presença de proteínas inibidoras na via aérea terminal; e d) estratégia ventilatória utilizada concomitante com a administração de surfactante(14,15,24,26).
O surfactante alveolar existe sob duas distintas formas estruturais: a) grandes agregados (ativa); e b) pequenos agregados (inativo)(14,15,24,27). O surfactante exógeno consiste basicamente da forma de grandes agregados. Uma vez depositado no pulmão o surfactante exógeno pode ser convertido na forma inativa. Tem-se demonstrado que a utilização de volumes correntes pequenos durante a ventilação mecânica é uma das melhores formas de preservar o surfactante endógeno(12,14,15,17). Por outro lado, a utilização de grandes volumes correntes foi associado com uma maior conversão da forma de grandes agregados (ativa) em pequenos agregados (inativa)(14,15,24,27).
Nossos objetivos neste estudo foram os seguintes: a) avaliar o efeito na oxigenação e ventilação de coelhos artificialmente depletados de surfactante quando submetidos à ventilação mecânica convencional, usando um volume corrente de 10 ml/kg e PEEP de 5cm H2O associado com uma reposição parcial de surfactante exógeno; b) comparar a evolução desse grupo com outro grupo submetido à ventilação de alta freqüência por oscilação (HFO) sem reposição associada de surfactante.
Métodos
O presente estudo foi realizado de acordo com as normas do National Institute of Health: guidelines for use of experimental animals (Canada) e com a aprovação do Institutional Animal Care and Use Committee (Canada).
Vinte coelhos brancos da raça New Zealand, pesando aproximadamente 3kg foram pré-medicados com acepromazine (0,5mg/kg intramuscular) e anestesiados com pentobarbital sódico (10-20mg/kg intravenoso). Um acesso venoso periférico foi estabelecido para infusão de fluidos e inserida uma linha arterial na artéria auricular para monitorização hemodinâmica contínua (Hewlett-Packard pressure transducer model 1280), assim como, permitir coletas seriadas de sangue para gasometria arterial (Radiometer ABL 3300). Um tubo endotraqueal com diâmetro 3,5 mm ou 4,0 mm foi inserido via traqueostomia. Anestesia e paralisia muscular foram obtidas através de uma infusão contínua de pentobarbital (6mg/kg/h) e pancurônio (0,2mg/kg/h). A manutenção hídrica foi de 7 ml/kg/hora de uma solução salina (NaCl a 0,9%) adicionada com glicose a 5%. A saturação da hemoglobina foi monitorizada continuamente (Nellcor) e a temperatura corporal foi monitorizada e mantida constante (entre 38 e 39 °C) com uso de uma fonte de calor irradiante e cobertor térmico. O volume corrente foi monitorizado através de um monitor (thermistor pneumotachograph - BEAR NVM-1, BEAR medical Systems, Riverside, CA) com reduzido espaço morto (1,3ml), inserido entre o tubo traqueal e o circuito do respirador.
Intervenção: Imediatamente após a realização da traqueostomia os animais foram ventilados no modo de pressão controlada objetivando um volume corrente de 10ml/ kg, com uma PEEP de 0cm H2O, uma FiO2 de 100%, uma freqüência respiratória de 30 ventilações por minuto, e um tempo inspiratório de 0,65 s. (Humming V, Senko Medical Instruments, Tokyo, Japan). Os animais foram mantidos com este regime por um período de 30 minutos (controle).
Posteriormente, os coelhos foram artificialmente induzidos à depleção de surfactante endógeno através de sucessivas lavagens pulmonares com alíquotas (25 ml/kg) de solução fisiológica aquecida, administradas através do tubo traqueal.
Concomitantemente o tórax dos animais era gentilmente massageado para melhor distribuição do fluido dentro dos pulmões. Tão logo se observasse uma queda acentuada na pressão arterial, na freqüência cardíaca ou na saturação da hemoglobina, o líquido infundido nos pulmões era succionado.
A monobra era repetida (usualmente entre 4 e 6 vezes) até atingir uma saturação da hemoglobina inferior a 90% e uma PaO2 menor que 100 mmHg com uma FiO2 de 100%, PEEP de 5 cmH2O; freqüência respiratória de 30 mpm, tempo inspiratório de 0,65 segundos e pico de pressão inspiratória (PIP) necessário para atingir um volume corrente de 10 ml/kg.
De acordo com a estratégia ventilatória a ser adotada, os animais eram divididos em dois grupos principais: a) ventilação convencional associada com reposição parcial de surfactante exógeno (CMV+S); b) ventilação de alta freqüência por oscilação (HFO). Dentro de cada grupo havia animais com discretas diferenças no tratamento utilizado, relacionados a outros experimentos associados. Conseqüentemente, quatro diferentes subgrupos puderam ser identificados:
a) ventilação convencional associada com reposição parcial de surfactante exógeno (CMV+S): oito coelhos foram submetidos à ventilação mecânica convencional com os seguintes parâmetros: FiO2de 1,0; PEEP de 5 cmH2O; freqüência respiratória de 30 mpm; tempo inspiratório de 0,65 segundos e PIP necessária para obter um volume corrente de 10 ml/kg. Esses parâmetros foram fixados antes da administração do surfactante exógeno e permaneceram fixos durante todo o período de estudo. De acordo com o regime de surfactante utilizado os coelhos poderiam pertencer a dois subgrupos:
a1) CMV+Sa: quando a ventilação convencional era associada apenas a uma reposição parcial de surfactante exógeno. Houve quatro coelhos (peso médio de 2,99 +0,10 kg) que receberam extrato de surfactante bovino (27 mg/ml) na dose de 1 ml/kg imediatamente após os parâmetros da ventilação terem sido atingidos e fixados.
a2) CMV+Sd: quando a ventilação convencional era associada a uma reposição parcial de surfactante exógeno associado com Dextran. Houve quatro coelhos (peso médio de 3,00 +0,14 kg) que receberam extrato de surfactante bovino (27 mg/ml) na dose de 1 ml/kg associados com 2 ml de Dextran (peso molécula de 70.000) na concentração de 50mg/ml. O Dextran foi associado para explorar a possibilidade de aumento da atividade do surfactante conforme demonstrado em alguns estudos in vitro28,29. O extrato de surfactante bovino e o Dextram somente foram administrados após os parâmetros da ventilação mecânica convencional terem sido atingidos e fixados.
b) ventilação de alta freqüência por oscilação (HFO) sem administração de surfactante exógeno. Dependendo da freqüência respiratória utilizada, os 12 coelhos deste grupo foram divididos em dois subgrupos:
b1) HFO15 ventilação por oscilação com 15 Hz de freqüência, utilizada em seis coelhos (peso médio de 3.03 +015 Kg), com uma pressão média de vias aéreas (MAP) de 15 cmH2O, tempo inspiratório de 33%, FiO2 100%. A amplitude e o power foram ajustados para manter uma pCO2 ao redor de 40 mmHg.
b2) HFO5 ventilação por oscilação com 5 Hz de freqüência, utilizada em seis coelhos (peso médio de 2.93+0.22 kg), com uma pressão média de vias aéreas (MAP) de 15 cmH2O, tempo inspiratório de 33%, FiO2 100%. A amplitude e o power foram ajustados para manter uma pCO2 ao redor de 40 mmHg.
Avaliações: gasometrias arteriais eram coletadas em cinco momentos distintos: antes da lavagem pulmonar (controle), após a lavagem pulmonar, 15 minutos, 60 minutos e 120 minutos após iniciado o tratamento. Os dois grupos principais (CMV+S versus HFO) e os quatro subgrupos (CMV+Sa, CMV+Sd, HFO15, HFO5) foram avaliados e comparados baseados em suas diferenças no paO2, pH, PCO2, índice de oxigenação [(FiO2 x MAP / PaO2)x 100] e pressão arterial média nestes cinco momentos de observação.
Os dados contínuos foram expressos através de médias e de seus desvios padrão (DP). As médias dos dois grupos principais (HFO versus CMV+S) foram comparadas utilizando o teste t de Student, enquanto que a Anova de uma via foi utilizada para comparar as médias de cada variável entre os quatro subgrupos (CMV+Sa, CMV+Sd, HFO15 e HFO5).
Um valor de "p" inferior a 0,05 foi considerado como diferença significativa.
Resultados
Durante o período "controle" (pré lavagem pulmonar), os quatro subgrupos não apresentaram nenhuma diferença no que se refere ao peso médio dos coelhos ou número de lavagens pulmonares, assim como as PaO2, PaCO2, e pH médios dos quatro subgrupos não diferiram (Anova de uma via) antes da lavagem pulmonar. Da mesma forma, durante os demais quatro momentos de avaliação do estudo (pós lavagem pulmonar, 15, 60 e 120 minutos pós tratamento) encontramos os mesmos e consistentes resultados quando comparamos os quatro subgrupos (CMV+Sa, CMV+Sd, HFO15 e HFO5, através da Anova de uma via) ou quando os dois grupos principais foram comparados (HFO e CMV+S, através do teste t de Student). Assim, por razões práticas, os resultados deste estudo serão apresentados (Tabela 1), agrupando os quatro subgrupos nos dois grupos principais: HFO (HFO15 mais HFO5) versus CMV+S (CMV+Sa mais CMV+Sd).
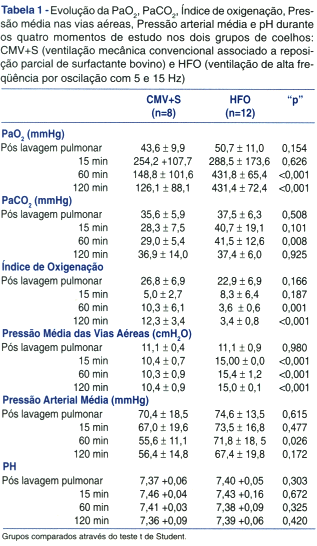
Após a lavagem pulmonar, a PaO2 média no grupo submetido à ventilação convencional associada à reposição de surfactante (CMV+S) foi de 43,6 ± 9,9 mmHg sem apresentar diferença (p=0,154) quando comparado com os coelhos submetidos à ventilação de alta freqüência por oscilação ou grupo HFO (50,7 ±10,9 mmHg). Após 15 minutos de tratamento, observouse um importante aumento na PaO2 média em ambos grupos. A PaO2 média aos 15 minutos nos coelhos alocados para CMV+S aumentou para 254,2 ± 107,7 mmHg, enquanto que no grupo HFO atingiu a 288,5 ± 173,6 mmHg, sem apresentar diferença (p=0,626). Entretanto, após 1 e 2 horas de tratamento (Figura 1, Tabela 1), o grupo HFO apresentou valores de PaO2 muito mais elevados (431,8 ± 65,4 mmHg e 431,4 ± 72,4 mmHg, respectivamente) quando comparado (p<0,001) com o grupo CMV+S (148,8 ± 101,6 mmHg e 126,1 ± 88,1 mmHg, respectivamente).
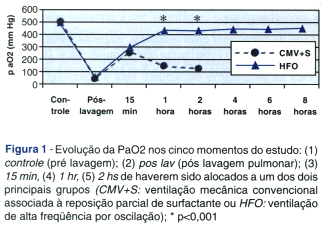
Não observamos nenhuma diferença nos índices de oxigenação entre os dois grupos após a lavagem pulmonar (p=0,166) e após 15 minutos de estudo (p=0,187). Entretanto, após 60 minutos e 120 minutos (Figura 2 e Tabela 1), o índice de oxigenação no grupo submetido à ventilação de alta freqüência por oscilação era menor (3,6 ± 0,6 e 3,4 ± 0,8; respectivamente) quando comparado (p<0,001) com aqueles coelhos que utilizaram CMV+S (10,3 ± 6,1; 12,3 ± 3,4; respectivamente).
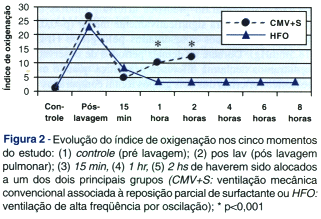
Em ambos os grupos, após a lavagem pulmonar, a pressão média nas vias aéreas (MAP) era a mesma (p=0,980). Entretanto, aos 15, 60 e 120 minutos após serem alocados para HFO ou CMV+S, observou-se que o grupo CMV+S apresentou uma MAP significativamente menor (p<0,001) que o grupo HFO (Tabela 1 e Figura 3).
No período pós lavagem pulmonar, não observamos nenhuma diferença entre os dois grupos nos níveis de PaCO2 (p=0,508). Porém, após uma hora de estudo (Tabela 1 e Figura 4) o grupo submetido a CMS+S apresentava uma PaCO2 média (29,0 +5.4 mmHg) significativamente menor (p=0,008) que os coelhos submetidos a HFO (41.5 +12.6 mmHg).
Após uma hora de tratamento os coelhos pertencentes ao grupo CMV+S apresentaram pressões arteriais médias de 55,6 +11,1mmHg, que era significativamente menor (p=0,026) que os níveis pressóricos apresentados pelo grupo HFO (71,8 +18,5mmHg). Durante os demais períodos de observação não encontramos nenhuma diferença estatística quando os níveis pressóricos arteriais dos dois grupos foram comparados (Tabela 1 e Figura 5).
Durante os cinco momentos de observação do presente estudo, não observamos nenhuma diferença quando os pH arteriais dos dois grupos foram comparados (Tabela 1).
Discussão
Neste estudo, envolvendo coelhos induzidos à depleção pulmonar de surfactante e posteriormente submetidos a duas estratégias diferentes de tratamento, foi possível demonstrar (a) que a utilização de uma estratégia ventilatória não protetora associada à reposição de surfactante, promoveu um imediato aumento (15 min) na oxigenação. Entretanto este efeito foi rápida e progressivamente dissipado durante os próximos 120 minutos; (b) que a utilização de uma estratégia alternativa de ventilação protetora (HFO Ventilação de alta freqüência por oscilação)) mesmo que não associada com a reposição de surfactante promoveu uma rápida (15min) e persistente (60 e 120 minutos) melhora na oxigenação, e com níveis superiores aos obtidos pelos animais submetidos à ventilação mecânica convencional (não protetora) associada com reposição de surfactante durante as duas horas de observação.
Antes de discutirmos esses resultados, julgamos pertinente que alguns detalhes do experimento sejam considerados: Definição da dose do surfactante utilizado: a dose estimada para repor todo o reservatório pulmonar de surfactante situa-se ao redor de 100 mg/kg(24,27). Estudos similares em animais têm utilizado uma dose entre 50 a 100 mg/ kg(14,15,24-26). Dentro de boas condições o surfactante exógeno tem uma meia vida estimada em torno de 5 horas(24,27).
Entretanto, dependendo da preparação utilizada, do método de administração, do curso da doença, da presença de inibidores e da estratégia ventilatória utilizada, a meia vida do surfactante exógeno administrado pode ser significativamente reduzida(3,10,12,14,15,23). Assim, optamos por utilizar aquela considerada como a menor dose efetiva de surfactante (27 mg/kg), obtida através de estudos prévios em nosso laboratório. Ao analisarmos os dados de nossa pesquisa, constatase que após 15 minutos da administração de surfactante ocorreu um grande aumento na PaO2 (de 43,6 para 254,2 mmHg), e melhora no índice de oxigenação (de 26,8 para 4,96), demonstrando que a dose administrada, apesar de reduzida, era realmente efetiva. Entretanto, a escolha de uma dose mínima efetiva nos permite demonstrar de forma mais evidente o efeito da ventilação convencional sobre a atividade do surfactante exógeno administrado.
No caso desta forma de ventilação ser protetora ou sinérgica com a ação do surfactante, o seu efeito sobre a oxigenação seria mantido por um longo período. Por outro lado, na eventualidade de atuar como um agente inibidor, o efeito sobre a oxigenação rapidamente seria perdido.
Por que um subgrupo recebeu Dextram associado ao surfactante? Existem alguns experimentos in vitro que demonstraram que o dextram além de apresentar um efeito protetor, potencializaria a ação do surfactante(28,29). Alguns dos animais de nosso experimento pertenciam também a este estudo em paralelo que pretendia avaliar esta possibilidade in vivo. Entretanto, como ambos subgrupos (surfactante isolado e surfactante associado ao dextram) no presente estudo apresentaram o mesmo comportamento, decidimos considerá-los como um único grupo.
Por que não utilizar PEEP mais elevado? Resultados de experimentos anteriores, utilizando este mesmo modelo animal, demonstraram que, aplicando-se um PEEP acima de 9 cmH2O, apresentavam uma mortalidade de 100%,1,5 hora após haver sido administrado o surfactante. Por outro lado, a utilização de um PEEP em torno de 5cm H2O demonstrou ser efetivo, seguro e com o efeito mais prolongado sobre a oxigenação. Sendo esta a razão de nossa escolha(10,12,23,30).
Em um primeiro momento (15 minutos), tanto o grupo de coelhos submetidos à ventilação convencional (não protetora) associada à administração de surfactante como aqueles coelhos submetidos à ventilação de alta freqüência por oscilação apresentam os mesmo efeitos na oxigenação.
Paralelo a este efeito, deve-se ressaltar a acentuada queda na PaCO2 (aumento do volume minuto) no grupo que recebeu surfactante. Como os parâmetros do respirador eram mantidos fixos (freqüência respiratória e pressão inspiratória), imagina-se que, após a administração de surfactante, áreas anteriormente colapsadas voltaram a ser ventiladas, contribuindo para o aumento verificado no volume minuto. Porém, aos 60 e 120 minutos, ainda sem modificar os parâmetros do respirador, observase neste grupo que recebeu surfactante, um aumento da PaCO2 associado a uma diminuição progressiva da PaO2. Seguindo esta linha de raciocínio, imaginase que neste momento, tenha havido uma progressiva diminuição da área de trocas pulmonares, provavelmente por colapso progressivo das unidades alveolares.
Na SARA, o colapso pulmonar progressivo durante a ventilação mecânica tem sido associado a a) uso de PEEP insuficiente, permitindo a redução do volume alveolar no final da expiração (atelectrauma); b) uso de altos volumes correntes levando à hiperdistensão alveolar (volutrauma), distensão do tecido alveolar com processo inflamatório local (biotrauma) e progressiva inativação do surfactante(2-6,10,23).
Desde que optamos por utilizar níveis de PEEP considerados adequados e protetores neste modelo animal(10,12,23,30), acreditamos que o colapso pulmonar progressivo seja prioritariamente conseqüência de volutrauma e biotrauma(2-4).
Nestes dois tipos de lesão induzida pela ventilação mecânica, o volume corrente elevado (neste caso 10 ml/kg), apresentase como o principal agente causador(2-4,10). O poder iatrogênico do volume corrente elevado como indutor de lesão pulmonar em nosso estudo foi tão pronunciado e extremamente rápido que neutralizou os benefícios obtidos com a reposição de surfactante em um período inferior a 60 minutos.
Por outro lado, a utilização de uma técnica ventilatória não convencional (HFO), baseada em baixíssimos volumes correntes administrados em altas freqüências respiratórias (5 e 15 Hz), permitiu uma elevação imediata na oxigenação e mantida no mesmo patamar durante as duas horas do experimento. Chama a atenção neste experimento utilizando coelhos deprivados de surfactante que já na 1 hora de uso da ventilação de alta freqüência por oscilação (HFO) mostrouse ser muito mais eficaz na melhora da oxigenação do que utilização surfactante associada à ventilação convencional.
Apesar de não constar dos objetivos do presente estudo, cabe ressaltar que a melhora na oxigenação permaneceu inalterada até completar seis horas de observação (Figura 1), quando foi interrompida a avaliação (dados referentes a outro experimento).
A ventilação de alta freqüência por oscilação, tem apresentado resultados consistentes em animais de laboratório induzidos a SARA(11,17,20,31). Os benefícios da HFO na SARA poderiam ser atribuídos a dois fatores: a manutenção de uma pressão constante nas vias aéreas e o uso de diminutos volumes correntes(11,17,20,31). Esses dois fatores têm como principais vantagens evitar o colapso pulmonar progressivo (mantêm a estabilidade alveolar), evitar grandes oscilações no volume alveolar (previnem a distensão e o colapso alveolar), poupar surfactante e diminuir o processo inflamatório local(2,5,6,11,13,18,20,21,31).
Ao contrário da Doença de Membrana Hialina do recémnascido, a SARA é uma doença multifatorial em que a deficiência de surfactante é apenas um dos múltiplos aspectos desta Síndrome(1,2,24,25). Por esta razão, o melhor planejamento terapêutico deve ser baseado em um conjunto de ações utilizando os potenciais benefícios de cada uma destas ações. Dentro deste conceito, tem sido extensivamente demonstrado que o uso de ventilação mecânica protetora em pacientes com SARA reduz a incidência de lesão pulmonar induzida pela ventilação mecânica, assim como aumenta a significativamente a sobrevida(8,9). Neste aspecto, a ventilação de alta freqüência por oscilação (HFO) parece preencher adequadamente os critérios de segurança e eficácia pretendidos com a ventilação pulmonar protetora, constituindose em uma excelente opção terapêutica.
Referências bibliográficas
1. Piva JP, Garcia PC, Carvalho PR, Luchese S. Síndrome do desconforto (angústia) respiratório agudo (SDRA/SARA). In: Piva J, Carvalho P, Garcia PC, eds. Terapia Intensiva em Pediatria. 4a edição. Rio de Janeiro: Medsi; 1997. p.176-96.
2. Slutzky AS. Lung injury caused by mechanical ventilation. Chest 1999; 116:9S-15S. [ Links ]
3. Hudson LD. Progress in understanding ventilator-induced lung injury. JAMA 1999;282:77-8. [ Links ]
4. Ranieri VM, Slutzky AS. Respiratory physiology and acute lung injury: the miracle of lazarus. Intesive Care Medicine 1999; 25: 1040-3. [ Links ]
5. Clark RH, Slutsky AS, Gerstmann DR. Lung protective strategies of ventilation in the neonate: what are they? Pediatrics 2000; 105:112-4. [ Links ]
6. Dreyfuss D, Saumon G. Ventilator-induced lung injury. Am J Respir Crit Care Med 1998; 157: 294-323. [ Links ]
7. Creamer KM, McCloud LL, Fisher LE, Ehrhart I. Closing pressure rather than opening pressure determines optimal positive end expiratory pressure and avoids overdistention. Chest 1999; 116:26s-27s. [ Links ]
8. Amato MB, Barbas CS, Medeiros DM. Effect of a protectiveventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med 1998; 338: 347-54. [ Links ]
9. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000;342:1301-8. [ Links ]
10. Taskar V, John J, Evander E, Robertson B, Jonson B. Surfactant dysfunction makes lungs vulnerable to repetitive collapse and reexpansion. Am J Respir Crit Care Med 1997; 155: 313-20. [ Links ]
11. Kolton M, Cattran CB, Kent G, Volgyesi G, Froese AB, Bryan AC. Oxygenation during high-frequency ventilation compared with conventional mechanical ventilation in two models of lung injury. Anesth Analg 1982; 61: 323-32. [ Links ]
12. Froese AB, McCulloch PR, Sugiura M, Vaclavik S, Possmayer F, Moller F. Optimizing alveolar expansion prolongs the effectiveness of exogenous surfactant therapy in the adult rabbit Am Rev Respir Dis 1993;148:569-77. [ Links ]
13. Doctor A, Arnold J. Mechanical support of acute lung injury: options for strategic ventilation. New Horizons 1999; 7: 359-73. [ Links ]
14. Ito Y, Manwell SEE, Kerr CL, Veldhuizen RAW, Yao LJ, Bjarneson D et al. Effects of ventilation strategies on efficacy of exogenous surfactante therapy in a rabbit model lung injury. Am J Respir Crit Care Med 1997; 157: 149-55. [ Links ]
15. Ito Y, Veldhuizen RAW, Yao LJ, McCaig A, Barttlett AJ, Lewis JF et al. Ventilation strategies affect surfactant aggregate conversion in acute lung injury. Am J Respir Crit Care Med 1997; 155: 493-9. [ Links ]
16. Hatcher D. Watanabe H, Ashbury T, Vincent S, Fisher J, Froese A. Mechanical performance of clinically available neonatal, high-frequency, oscilatory-type ventilators. Crit Care Med 1998; 26:1081-88. [ Links ]
17. McCulloch, PR, Forkert, PG, Froese, AB. Lung volume maintenance prevents lung injury during high frequency oscillation in surfactant deficient rabbits. Am Rev Respir Dis 1988; 137, 1185-92. [ Links ]
18. Thome U, Töpfer A, Achaller P, Pohlandt F. Effect of mean airway pressure on lung volume during high-frequency oscillatory ventilation of preterm infants. Am J Respir Crit Care Med 1998; 157:1213-18. [ Links ]
19. Meredith KS, de Lemos RA, Coalson JJ. Role of lung injury in pathogenesis of hyaline membrane disease in premature baboons. J Appl Physiol 1989; 66: 2150-8. [ Links ]
20. Hamilton, PP, Onayemi A, Smyth JA, Gillan JE, Cutz E, Froese AB et al. Comparison of conventional and high-frequency ventilation: oxygenation and lung pathology. J Appl Physiol 1983; 55: 131-8. [ Links ]
21. Takata M, Abe J, Tanaka H, Kitano Y, Doi Z, Koshaka T et al. Intra-alveolar expression of tumor necrosis factor gene during conventional and high frequency ventilation. Am J Respir Crit Care Med 1997; 156: 272-9. [ Links ]
22. Cochrane CG, Revak SD. Surfactant lavage treatment in a model of respiratory distress syndrome. Chest 1999; 116:85s-87s. 356 Jornal de Pediatria - Vol. 76, N5, 2000 [ Links ]
23. Kerr CL, Ito Y, Manwell SEE, Veldhuizen RAW, Yao LJ, McCaig LA, Lewis JF. Effects of surfactant distribution and ventilation strategies on efficacy of exogenous surfactant. J Appl Physiol 1998; 85: 676-84. [ Links ]
24. Bauman LA, Willson DF. Surfactant in pediatric respiratory failure. New Horizons 1999; 7: 399-413. [ Links ]
25. Gregory TJ, Steinberg KP, Spragg R. Bovine surfactant therapy for patients with acute respiratory distress syndrome. Am J Respir Crit Care Med 1997; 155: 1309-15. [ Links ]
26. Kruse MF, Schült-Mönting J, Hoehn T. Rate of surfactant administration influences lung function and gas exchange in a surfactant-deficient rabbit model. Pediatr Pulmonol 1998; 25: 196-204. [ Links ]
27. Hills BA. An alternative view of the role of surfactant and the alveolar model. J Appl Physiol 1999; 87:1567-83. [ Links ]
28. Kobayashi T, Ohta K, Tashiro K, Nishizuka K, Chen W, Ohmura S et al. Dextran restores albumin-inhibited surface activity of pulmonary surfactant extract. J Appl Physiol 1999; 86: 1778-84. [ Links ]
29. Tauesch HW, Lu KW, Goerke J, Clements JA. Nonionic polymers reverse inactivation of surfactant by meconium and other substances. Am J Respir Crit Care Med 1999; 159: 1391-5. [ Links ]
30. Sohma, A, Brampton, WJ, Dunnill, MS. Effect of ventilation with positive end-expiratory pressure on the development of lung damage in experimental acid aspiration pneumonia in the rabbit. Intensive Care Med 1992; 18,112-7. [ Links ]
31. Chang HK. Mechanisms of gas transport during ventilation by high frequency oscillation. J Appl Physiol 1984: 56: 553-63.Ventilação de alta freqüência por oscilação comparada... - Piva JP et al [ Links ]
Endereço para correspondência: Dr. Jefferson P. Piva Hospital São Lucas da PUCRS - UTI Av. Ipiranga 6690 - 5 andar CEP 91610-000 - Porto Alegre - RS - Brasil Fone/fax: (51) 315.2400 E-mail: jpiva@pucrs.br