La leishmaniasis en Bolivia es producida en un 85% por L. braziliensis1, clínicamente caracterizada por lesiones cutáneas y mucocutáneas2. La progresión de la enfermedad depende de la interacción de dos factores identificados como son, la especie de leishmania implicada y el estado inmunológico del paciente3. Una desregulación de la respuesta inmune posibilita la cronicidad de la enfermedad4.
Las drogas en base a antimoniales pentavalentes son consideradas como de primera elección, con una tasa de curación variable que en Latinoamérica oscila entre 70 a 94% en función de las especies de Leishmania involucradas en la infección5. Como droga de segunda elección está la Anfotericina B (desoxicolato o liposomal), con una tasa de curación de 90 a 95% en inmuno-competentes5, aunque también se ha utilizado como droga de segunda elección la miltefosina que tiene una tasa de curación superior al 90%, (dosis: 2,5 mg/kg peso/día por 28 días) en pacientes sin antecedentes previos de otros tratamientos en casos de leishmaniasis visceral6. Una experiencia previa sobre el empleo de miltefosina en leishmaniasis mucocutánea y en casos de falla terapéutica a los antimoniales y anfotericina B, evidenció una tasa de curación mayor al 75% con la dosis anteriormente descrita7. Finalmente, el empleo de cremas de uso dérmico con paromomicina al 15% en el tratamiento de la leishmaniasis cutáneas mostró resultados interesantes en estudios previos llevados a cabo en Panamá8, y Túnez9.
El empleo de tratamientos combinados de miltefosina con paramomicina10; miltefosina y antimoniales11, así como también de antimoniales con allopurinol12, demostraron la efectividad de estos tratamientos combinados con la disminución de la carga parasitaria al 100% en el sitio de las lesiones10-12. Los resultados descritos resultan de mucho interés más aún si se tiene en cuenta factores relacionados al parasito, huésped, droga e inmunidad, que pueden llevar a la resistencia al tratamiento13. No obstante, no se conoce de experiencias previas de tratamientos combinados con el empleo de tres drogas antileishmania. En este sentido, el interés en la presentación de un caso clínico de leishmaniasis cutánea con falla terapéutica a antimoniales, es mostrar la remisión del cuadro, después de usar un tratamiento combinado con tres drogas con actividad antileishmania comprobada: pentamidina, miltefosina y paromomicina.
Presentación del caso
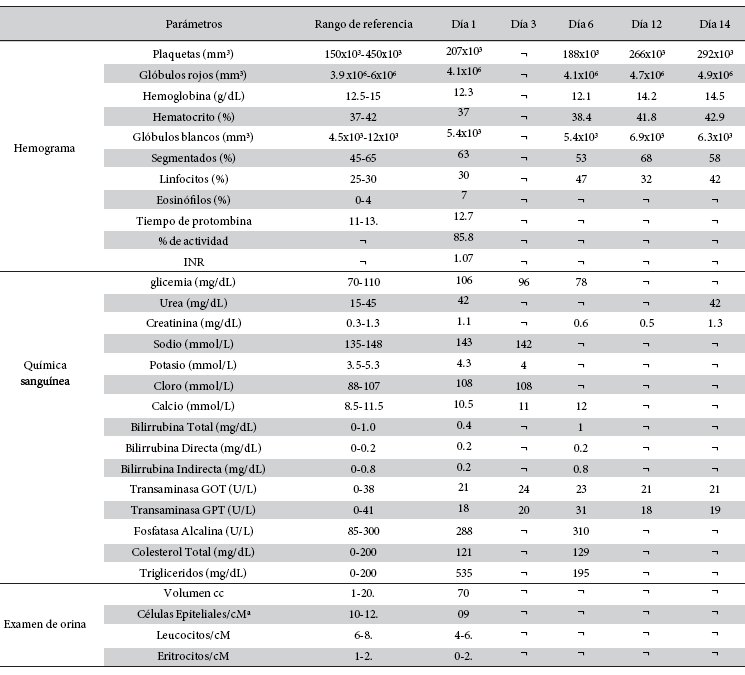
Paciente, varón de 55 años de edad, que reside en la localidad de Isinuta, Parque Isiboro Secure, Provincia Chapare, Cochabamba, Bolivia. Consultó en el Centro Universitario de Medicina Tropical (CUMETROP) el año 2019 por presentar múltiples lesiones ulcerativas en diferentes regiones anatómicas del cuerpo (Figura 1), compatibles con leishmaniasis cutánea. En esa oportunidad se solicitó un nuevo examen parasitológico directo. Muestras obtenidas de los bordes de las ulceras cutáneas, evidenciaron la presencia de Leishmania spp.
Antecedentes clínico-terapéuticos
Dos meses antes de haber recibido atención médica en CUMETROP, el paciente fue medicado con Glucantime® de acuerdo al esquema de tratamiento recomendado por el programa nacional de leishmaniasis, Bolivia (20 Kg/peso/día por 20 días, aplicación vía intramuscular), de los cuales llego únicamente a completar 18 días. Efectos adversos graves (astenia y adinamia), y falta de mejoría, obligaron interrumpir el tratamiento. A los pocos días de haber interrumpido el tratamiento, según refiere el paciente, se presentaron nuevas lesiones pequeñas en otras regiones anatómicas localizadas, una en antebrazo izquierdo, tres lesiones en cara, una en hombro izquierdo y otra en región dorsal (Figura 1).
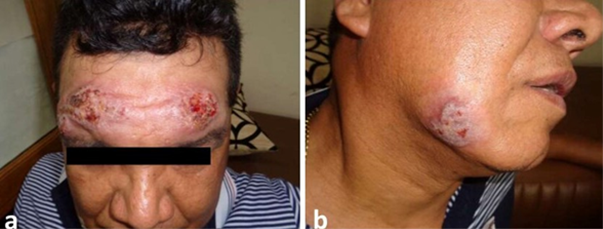
Figura 1 a y b Paciente con lesiones múltiples de Leishmaniasis después del tratamiento con Glucantime® en la consulta en CUMETROP antes del tratamiento combinado (Pentamidina, Miltefosina y Paromomicina) a=Lesiones activas en la frente; b=Lesion activa en region angular de la mandibula.
De todas ellas se aisló leishmania spp. Las nuevas lesiones aumentaron de tamaño, y se ulceraron en el lapso de un mes (tiempo de espera para la obtención del nuevo tratamiento para leishmaniasis), lo que generó angustia evidente en el paciente.
Intervención terapéutica con Pentamidina + Miltefosina + crema de Paromomicina
Se empleó como tratamiento triple combinado:
Pentamidina (4 mg Kg/peso/dosis) EV, inter-diaria, 7 aplicaciones.
Miltefosina (2,5 mg Kg/peso/dosis) tres veces al día, con las comidas por 28 días.
Crema de Paromomicina (al 15%) aplicación diaria, dos veces al día por 28 días sobre las lesiones.
El manejo fue hospitalario, en el municipio de Villa Tunari. El cuarto día de tratamiento, el paciente presentó fiebre, probablemente por la administración rápida de la infusión de pentamidina, esto fue solucionada con el monitoreo.
Hallazgos Clínicos pos tratamiento
Al finalizar el tratamiento (28 días) se observó epitelización de todas las lesiones, incluyendo las más extensas de la región de la frente (Figura 2), y el miembro superior derecho (Figura 3).
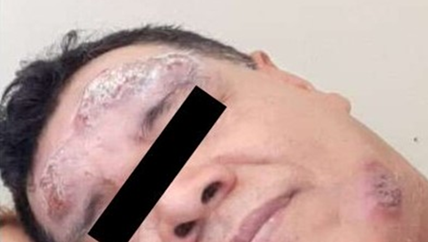
Figura 2 Paciente con lesiones múltiples de Leishmaniasis en proceso de epitelización a la finalización (28 días) del tratamiento combinado de tres drogas antileishmania.
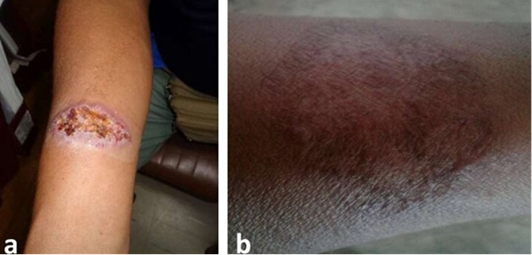
Figura 3 a y b Lesión en antebrazo derecho antes y después del tratamiento combinado con Pentamidina, Miltefosina y Paromomicina. a= Antes del tratamiento combinado; b=Lesión cicatrizada completamente al primer mes pos tratamiento combinado.
El control clínico en febrero de 2020 (sexto mes de evaluación post tratamiento), se evidencio cicatrización completa de todas las lesiones y ausencia de signos de actividad (Figura 4).
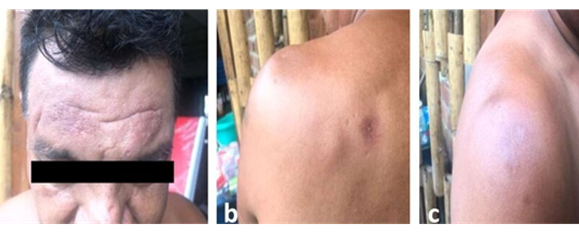
Figura 4 a, b, y c Lesión en antebrazo derecho antes y después del tratamiento combinado con Pentamidina, Miltefosina y Paromomicina. a= Antes del tratamiento combinado; b=Lesión cicatrizada completamente al primer mes pos tratamiento combinado.
Un último control clínico en julio de 2021(un año y nueve meses post tratamiento) evidenció la presencia de cicatrices de todas las lesiones y ningún signo de actividad sugerente de reactivación de la leishmaniasis.
Pruebas de control de laboratorio
Se realizó pruebas de función renal y hepática durante 14 días, correspondientes al tratamiento con pentamidina, para identificar posibles daños renal y/o hepático, además de un hemograma y examen general de orina como exámenes complementarios (Tabla 1).
Discusión
El tratamiento recomendado para la leishmaniasis tegumentaria americana, es la aplicación sistémica de antimoniales5, pero también se ha empleado miltefosina6,7 y paromomicina8,9, aunque todos con variable éxito terapéutico5-7. En el presente caso, con el antecedente de falla terapéutica a los antimoniales, se realizó un tratamiento combinado con Pentamidina, Miltefosina y Paromomicina, por un periodo de 28 días, con lo cual se alcanzó la remisión completa de la enfermedad. El uso de tratamientos combinados, ha sido descrito previamente14,15, con resultados expectables atribuibles por los propios autores al potenciamiento sinérgico del efecto tóxico de las drogas empleadas contra leishmania14.
El éxito terapéutico alcanzado en este paciente con el tratamiento empleado (Pentamidina, Miltefosina y Paromomicina), responde en opinión nuestra a la acción parasiticida de cada una las drogas usadas, mediante sus mecanismos de acción particulares, tales como interferencia del metabolismo tiol-redox16. fragmentación del DNA nuclear y la interferencia del metabolismo de lípidos8.
Conclusión
El paciente en el cual se utilizó una terapia combinada de tres drogas antileishmania, no mostró ninguna recidiva después de 6 meses de seguimiento clínico y estos hallazgos se volvieron a confirmar en un último control clínico 21 meses (1 año y 9 meses) después de concluido el tratamiento. Sobre la base de estos hallazgos, se considera que el paciente esta clínicamente curado.
En Bolivia, hay poca experiencia respecto al uso de terapias combinadas en leishmaniasis crónica resistente a mono drogas. Sin embargo, estas no están publicadas. Por tanto, la presentación de este caso clínico contribuye con evidencias documentadas en este sentido.