Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta Médica Boliviana
On-line version ISSN 1012-2966
Gac Med Bol vol.42 no.2 Cochabamba Dec. 2019
Artículo de Revisión
Blastocystis sp. puesta al día sobre su papel parasitario
Blastocystis sp. Update on your parasitic role
Gilberto Bastidas1, Carlos Malave2, Daniel Bastidas3
1Doctor en Parasitología, Departamento de Salud Pública y Centro de Investigaciones Médicas y Biotecnológicas, Facultad de Ciencias de la Salud, Universidad de Carabobo, Venezuela.
Recibido el 09 de julio de 2019.
Aceptado el 20 de agosto de 2019.
Resumen
Blatocystis sp. un parásito unicelular, anaerobio y de gran variabilidad genética del intestino de animal y del ser humano de distribución mundial y el de mayor prevalencia entre las zoonosis intestinales que ha estado inmerso en controversias y revisiones por su taxonomía, características morfológicas, ciclo de vida y papel patógeno. Por tanto, el objetivo del presente escrito es la consolidación de información sobre estos y otros aspectos de Blatocystis sp. producto de la revisión de la literatura científica. Se trata de un estudio documental. Los datos encontrados fueron agrupados en 8 capítulos a saber: tipificación, comportamiento epidemiológico, ciclo de vida y morfología parasitaria, patogenia, manifestaciones clínicas, diagnóstico, tratamiento y reflexiones finales. En esta revisión se actualizan aspectos relativos a Blatocystis sp. con el objeto de mostrar las tendencias del conocimiento sobre esta parasitosis como base esencial de las estrategias de promoción y prevención que adoptan los países contra Blatocystis sp.
Palabras claves: Blatocystis sp., enfermedad parasitaria, parásito, patogenia, zoonosis intestinales.
Blastocystis sp. a single-celled, anaerobic parasite of great genetic variability in the intestine of animals and humans of worldwide distribution and the one with the highest prevalence among intestinal zoonoses that has been immersed in controversies and reviews due to its taxonomy, morphological characteristics, life cycle and role pathogen. Therefore, the objective of this paper is the consolidation of information on these and other aspects of Blastocystis sp. product of the review of the scientific literature. It is a documentary study. The data found were grouped into 8 chapters: typification, epidemiological behavior, life cycle and parasitic morphology, pathogenesis, clinical manifestations, diagnosis, treatment and final reflections. In this review, aspects related to Blastocystis sp. in order to show the current trends of knowledge about this parasitism as an essential basis of the promotion and prevention strategies that countries adopt against Blastocystis sp.
Keywords: Blastocystis sp., parasitic disease, parasite, pathogenesis, intestinal zoonoses.
Blatocystis sp. un parásito unicelular y anaerobio del intestino de animal y del ser humano de distribución mundial y el de mayor prevalencia entre las zoonosis intestinales que ha estado inmerso en controversias y revisiones por su taxonomía, características morfológicas, ciclo de vida y papel patógeno, como consecuencia de su gran variabilidad genética, pues se han descrito varios genotipos de este organismo1. En este sentido, al Blatocystis sp. se le ha incluido en el grupo de las levaduras, en protozoos cercanos a los flagelados e incluso se le ha considerado como amiba, no obstante, hoy está claramente ubicado en el Reino Chromista (por análisis molecular de las subunidades pequeñas del ARN ribosomal [SSU-rRNA] y el factor de elongación 1α); Subreino Chromobiota; Infrarreino Stramenopiles; Phylum Sarcomastigophora; subphylum Opalinata; Clase Blastocystea, Orden Blastocystida y Género Blatocystis, como único parásito humano que pertenece a este reino2.
Son varios los aspectos que han generado polémica en el mundo científico en lo que respecta a Blatocystis sp. el primero su papel patógeno, mismo que se cree queda establecido con el reporte en 1987 de cuadros diarreicos en pacientes infectados con este parásito, el segundo la presencia de este parásito en el intestino que puede ser considerada como infección o colonización, este ultimo aún sin clara respuesta; también existen dudas sobre el mecanismo de transmisión, reproducción y patogenicidad de los subtipos, por tanto, la consolidación de información sobre distintos aspectos de Blatocystis sp. producto de la investigación facilita la discusión y contribuye con las estrategias de promoción y prevención de esta parasitosis3.
Metodología
La revisión documental caracterizó el presente trabajo de investigación con base en manuscritos de tipo electrónico, para ello se utilizaron las bases de datos: Pubmed, Medline, Scopus, Lilacs, Science Direct, SciELO y Ovid. En la búsqueda se emplearon, los descriptores: lifecycle, pathogenic mechanisms, morfology, epidemiology, diagnosis y treatment combinados con Blactocystis y/o blastocystosis, sin restricción por fecha pero con preferencia por los artículos de más reciente data sin descartar los trabajos referentes del tema independientemente de su fecha de publicación. Los datos fueron obtenidos y analizados por los autores y la información resultante fue agrupada en 8 capítulos: Tipificación, comportamiento epidemiológico, ciclo de vida y morfología parasitaria, patogenia, manifestaciones clínicas, diagnóstico, tratamiento y se culmina con algunas reflexiones sobre el tema desarrollado.
Tipificación de Blatocystis sp.
Este organismo fue descrito con criterios de nomenclatura por vez primera en 1911 por Alexieff (como Blatocystis enterocola), era considerado como la forma quística de un trichomonadideo o una levadura, y en 1912 Brumpt lo detalla y le llama Blatocystis hominis, pero no fue hasta 1967 cuando Zierdt por medio de estudios ultraestructurales le clasifico como un protozoo, no obstante, Silberman empleando secuencias del ARN ribosómico sugiere la ubicación de este parásito dentro del reino Chromista y es actualmente el único parásito intestinal humano perteneciente a este reino2,4-6.
Comportamiento epidemiológico de Blatocystis sp.
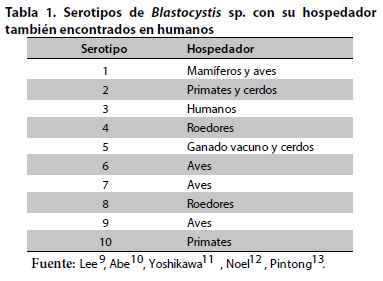
Desde inicios del siglo XX se reportan epidemias ocasionadas por Blatocystis sp., además esta parasitosis tiene distribución mundial (afecta aproximadamente a mil millones de personas en todo el mundo, con una distribución de aproximadamente 5% en los países desarrollados y de hasta 76% en los que están en vía de desarrollo), asociada su frecuencia en el ser humano con la edad, estado nutricional e inmunitario, e higiene y saneamiento ambiental, como ocurre con la mayoría de las parasitosis intestinales. La blastocistosis o enfermedad de Zierdt-Garavelli (descrita por vez primera por Phillips y Zierdt) debido a deficientes hábitos higiénicos e inmadurez del sistema inmunitario es más frecuente en niños que en adultos, en quienes practican relaciones sexuales bucoanales, y en los que padecen algún grado de inmunosupresión, por ejemplo, pacientes con HIV-SIDA, sin diferencias en la prevalencia según géneros14. Junto con Cryptosporidium sp., Giardia intestinalis y Enterocytozoon bieneusi, Blatocystis sp. es una de las zoonosis (con substancial transmisión entre animales y humanos) más importantes en la actualidad debido a su exitosa capacidad adaptativa, aunque la aparición de brotes es poco común15,16.
Se conoce que ST4 coloniza al ser humano desde hace muy poco tiempo y quizás solamente en Europa, sin embargo, se tienen reportes de su extensión al resto del mundo, ahora bien ST1 es frecuente en poblaciones rurales de Sudamérica y África en estrecho contacto con animales, debido a su marcado carácter zoonótico, y se constituye este subtipo en el segundo con mayor prevalencia en el mundo únicamente por debajo de ST3. El ST2, ST6 y el ST7 han sido descritos en Asia y el Medio Este (Egipto, Nepal, Malsia y Japón), aunque ST2 también es encontrado en Europa con mayor prevalencia en Irlanda16, 19. De ST11 a ST17 son exclusivamente observados en hospedadores animales distintos al hombre, de allí que se considere que los animales actúan como reservorio y que la transmisión zoonótica sea una forma de propagación hacia el ser humano20.
Ciclo de vida y morfología parasitaria de Blatocystis sp.
Blatocystis sp. no es un organismo de vida libre, sino se encuentra asociado al microbiota intestinal animal o humana (habita en el intestino grueso), con un tamaño que varía entre 5 y 200µ y con organelos celulares comunes a los eucariotas (por ejemplo, tiene aparato de Golgi, retículo endoplásmico liso y rugoso, y membrana celular con una capa superficial con variaciones estructurales entre diferentes aislados de Blatocystis sp.). Para el metabolismo energético posee estructuras tipo mitocondrias, con ADN circular que no codifica para enzimas que participan en el metabolismo aerobio, como la citocromo-oxidasa y ATP sintasa. Este organismo carece de pared celular21.
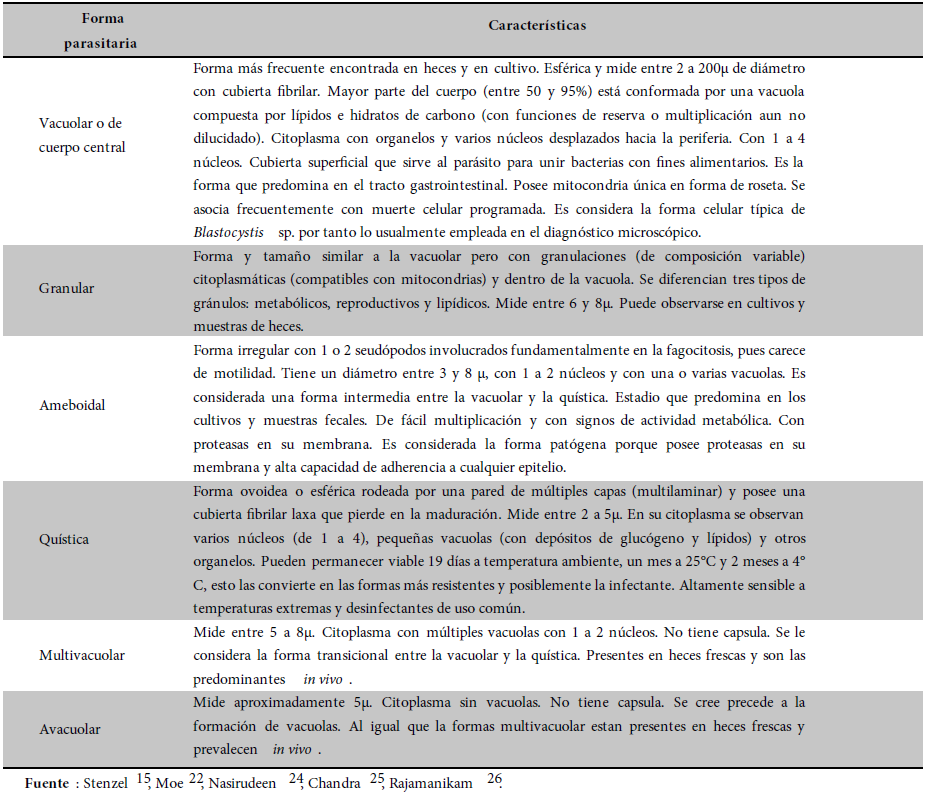
Tabla 2. Formas parasitarias de Blatocystis sp.
Patogenia en la blastocistosis
Las causas por las cuales Blatocystis sp. se comporta como patógeno o comensal son: la susceptibilidad del hospedador a la infección y la patogenicidad de los subtipos (ST1 y ST3 comúnmente relacionados con el papel patógeno de Blatocystis sp), no obstante, este parásito puede ser miembro de la microbiota intestinal (asociado fundamentalmente con Rumicoccus o Prevotella) de sujetos sanos, pues se han descrito portadores asintomáticos hasta con 10 años de evolución. En este orden de ideas la diversidad de la flora intestinal, con inclusión de Blatocystis sp. en ella influye en la baja incidencia de enfermedades inflamatorias y autoinmunes, ya que, en el caso específico de Blatocystis sp. este provoca la liberación de IL-22, una interleuquina estimuladora de la producción de mucus en el intestino implicado en el alivio de los síntomas de colitis; también este organismo está comprometido en la descomposición de la celulosa y por ello involucrado en procesos metabólicos claves del hospedador23, 27, 28.
Contrario a lo expuesto hasta aquí a Blatocystis sp. se le atribuye importante papel patógeno, se le señala como causante de enfermedad inflamatoria intestinal, de síndrome de intestino irritable, de bajo índice de masa corporal y de la llamada blastocistosis en referencia a un conjunto de síntomas gastrointestinales inespecíficos, para ello Blatocystis sp. podría cambiar la composición de la microbiota intestinal a favor de la infección (con afectación de especies como Ruminococcus que produce ácidos grasos de cadena corta necesarios para la respuesta inmunitaria innata y adaptativa del hospedador). También se involucran en la patogenia de este parásito su gran tamaño, la superficie irregular, el crecimiento lento y la alta carga parasitaria, en ausencia de factores de virulencia encontrados en otros como lecitinas y flagelos o roptrias25, 29,30.
Asimismo a nivel de la lámina propia del intestino grueso Blatocystis sp. produce inflamación al inducir en el hospedador la liberación de interleuquinas proinflamatorias (IL-8); a la vez que sustancias segregadas por este parásito provocan apoptosis de las células del epitelio entérico; y también produce un rearreglo de los filamentos de F-actina de las uniones intercelulares de las células epiteliales del colon, se genera entonces con estos mecanismos la disrupción de la barrera intestinal y por tanto la proliferación de los patógenos33,34.
Se atribuye a las proteasas secretadas (la cistein proteasas del tipo legumaina y captesina B) por Blatocystis sp. (principalmente estudiados en los subtipos ST4 y ST7) el papel patógeno toda vez que facilitan la invasión y proliferación celular, a través de la catálisis de reacciones metabólicas y de degradación del tejido conectivo en la mucosa intestinal, asimismo distintas proteínas de este parásito están involucradas en la evasión o modulación del sistema inmunitario del hospedador (la cistein proteasas estimulan la producción de IL- 8 con participación en la perdida de líquidos y generación de inflamación; también degradan la IgA del humano permitiéndole al parásito evadir la respuesta inmunitario del hospedador), entre ellos los inhibidores de proteasas con efectos sobre la homeostasis intestinal; péptidos no ribosómicos y polipéptidos con actividad antibacteriana e inmunomoduladora, por tanto, con participación en la disbiosis de la microbiota intestinal. Del mismo modo se han identificado genes para hidrolasas en el parásito que por adhesión alteran la mucosa intestinal e igualmente factores involucrados en la producción de anemia por deficiencia de hierro35-38.
También las hidrolasas y las cistein proteasas secretadas por Blatocystis sp. degradan las glicoproetinas del moco intestinal (producida por las células calificiformes estimulada por la IL-13 e IL-4 en la activación de la respuesta inmunitaria Th2 en defensa del hospedador) para emplearlas como nutrientes (a la vez que rompe con esa barrera protectora del intestino contra agentes infecciosos) (Poirier et al 2012). La activación de los mecanismos apoptóticos contra enterocitos infectados, como mecanismo de defensa del hospedador contra agentes infecciosos, igualmente han sido reportado con Blatocystis sp. particularmente con el subtipo ST7, pero también, la modulación de la rho quinasa por las cistein y glicosiltransferasas de Blatocystis sp. lleva a la activación de la caspasa involucrada en la apoptosis de enterocitos intestinales39,40.
Es importante resaltar que la infección por Blatocystis sp. rara vez es única, se asocia con mucha frecuencia con otros protozoo como Endolimax nana, Giardia intestinalis y Entamoeba histolytica/dispar, incrementándose en muchos casos la severidad de la sintomatología, pues se conoce que algunos parásitos (Giardia, Entamoba, Plasmodium y Cryptosporidium) se acompañan de rotavirus y adenovirus que estimulan la respuesta inflamatoria en pro de la infección y en la persistencia parasitaria en el hospedador30.
También se reporta in vitro alta proliferación de células cancerígenas inducida por algunos subtipos de Blatocystis sp., específicamente con el ST3, se cree por incremento TGF- β, citoquina del tipo Th2, y por la producción de Catepsina B, así como por la disminución de IFN-y y de la expresión de p53, también el estrés oxidativo causado por la presencia de este parásito en el intestino es determinante en la aparición de neoplasias, de allí que pueda atribuirse algún tipo de participación a Blatocystis sp. en la aparición de neoplasia gastrointestinal41.
Manifestaciones clínicas en la blastocistosis
Fue considerado como un organismo comensal o no patógeno (de presentación asintomática bajo la hipótesis de colonización por Blatocystis sp.) pero las indagaciones científicas le atribuyen una gran variedad de signos y síntomas, algunos de naturaleza inespecífica y común a otras parasitosis intestinales como: náuseas, vómitos, anorexia, fiebre, malestar general, dolor y distensión abdominal, flatulencias y diarrea de tipo aguda o crónica (la sintomatología en algunos casos resulta auto resolutiva o hacerse crónica y prevalecer por meses e incluso años); otras raras o poco frecuentes como el síndrome de colon irritable, anemia por deficiencia de hierro, erupciones cutáneas, urticaria, sinovitis, angioedema y prurito palmoplantar; así como eosinofilia periférica (por activación por moléculas del parásito de células Th2 que producen interleuquina o por activación de vías del complemento), y a pesar de aislarse de sujetos con HIV/SIDA, con enfermedades oncológicas, en trasplantados, en estresados y en quienes emplean inmunosupresores no es considerado como patógeno oportunista, aunque las infecciones sintomáticas son más frecuentes en este tipo de pacientes3, 42.
En las formas crónicas es evidente la gran carga parasitaria (aquellas con más de cinco formas parasitarias por campo de observación microscópica), resultando estas mayores en el síndrome de colon irritable y en la enfermedad de Crohn`s. Ahora bien para varios autores la diversidad de la sintomatología puede explicarse por las variaciones en la virulencia dependiente del subtipo de Blatocystis aislado3,42,43.
En el diagnóstico de blastocistosis se emplea el coproanálisis con muestras seriadas por lo irregular en la eliminación de las formas parasitarias (con examen directo, es decir, el estudio microscópico de heces frescas con solución salina fisiológica y con lugol), en este sentido se ha considerado que hay blastocistosis cuando se identifican más de cinco células parasitarias por campo de 40X, de formas de cuerpo central y ausencia de otros microorganismos44,45.
Dentro del análisis de materia fecal puede también recurrirse a métodos de enriquecimiento de sedimentación bifásico (ejemplo: Técnica de concentración por formol-Acetato de etilo, entre ellos el Ritchie modificado) y a la sedimentación espontanea en tubo; así como a cloraciones permanentes como la tricromica, hematoxilina férrica, tinta china modificada, safranina-azul de metileno y May-Grünwald-Giemsa, asimismo puede apelarse a cultivos axénicos en anaerobios. Todas estas son técnicas que permiten optimizar el protocolo de diagnóstico de la blastocistosis, toda vez que consienten sortear factores limitantes como la baja carga parasitaria e incluso la disrupción de las formas parasitarias (ser vivo muy frágil, es así que el agua destilada o corriente lisa las formas vacuolar, ameboide y multivacuolar) o favorecen la visualización de estructuras del parásito, con lo que se disminuyen significativamente los falsos negativos44,45.
También se emplea la detección de anticuerpos contra Blatocystis por métodos inmunológicos como ELISA e IFI y finalmente se usan técnicas de biología molecular para el diagnóstico, estas permiten identificar hasta subespecie46,47.
La infección por Blatocystis sp. es autolimida y generalmente se recomienda el tratamiento con imidazolicos (como medicamentos de primera elección) cuando se han descartado otros agentes etiológicos y la sintomatología clínica persiste. Se emplea como agente imidazolico de elección el metronizadol a dosis de 20-40mg/Kg de peso/día cada 8 horas en niños y 1,5 g día cada 8 horas en adultos, igualmente puede utilizarse el secnidazol a dosis de 30mg/Kg de peso/dosis el día 0 y 15 en niños, y 2g el día 0 y 15 en adultos3, 48.
Blatocystis sp. es cosmopolito con amplia variación en la frecuencia de la infección y único parásito intestinal humano incluido en el reino Chromista, con importante variabilidad genética a tal punto de recomendarse el empleo de la nomenclatura Blatocystis hominis por la de Blatocystis species, sin embargo, está inmerso en controversias, algunas intensamente abordadas por la ciencia mundial, en relación con su papel patógeno, ciclo de vida, mecanismos de transmisión y reproducción.
Asimismo se reconoce el carácter patogénico de Blatocystis sp: con base al reporte de numerosas epidemias ocasionadas por este parásito desde inicio del siglo XX; con el nombramiento de la enfermedad producida por este Chormista como blastocistosis en reconocimiento a su papel patógeno; por hallazgos fisiopatológicos descritos en esta parasitosis como: su capacidad de cambiar la composición de la microbiota intestinal a su favor, su gran tamaño, crecimiento lento, superficie irregular, alta carga parasitaria, su capacidad para ocasionar la perdida de la integridad de la mucosa intestinal y aumentar la permeabilidad de la misma (incluida su capacidad para producir apoptosis), y por catálisis de reacciones metabólicas. Con base en los resultados de investigaciones se entiende que la oferta de medicamentos contribuye con la disminución del daño en el hospedador y con la reducción del riesgo de diseminación en los grupos poblacionales.
El parásito Blatocystis sp. es polimórfico al que se le atribuyen múltiples formas de multiplicación e imputan ciclos de vidas discutibles, aunque se acepta la vía fecal-oral como la forma de transmisión aún se desconoce de forma precisa los pasajes o transiciones entre distintas formas del parásito, luego de las formas ameboides y granulares. Lo cierto, y aspecto altamente importante para la salud púbica, es que a este parásito se le atribuye gran variedad de signos y síntomas algunos inespecíficos y comunes a otras parasitosis intestinales y otras raras o poco frecuentes como el síndrome de colon irritable, la anemia y las manifestaciones alérgicas, que requieren en primer caso promoción de la salud y prevención de la enfermedad y en segunda instancia diagnóstico y tratamiento especifico una vez que se produce la sintomatología, con el fin de limitar los daños económicos que producen al individuo, familia y sociedad esta parasitosis.
Referencias bibliográficas
1. Kozubsky L, Archelli S. Algunas consideraciones acerca de Blastocystis sp., un parásitocontroversial. Acta Bioquím Clín Latinoam 2010; 44(3):371-376.
2. Silberman J, Sogin M, Leipe, Clark C. Human parasite finds taxonomic home. Nature 1996; 380(6573):398.
3. Chacón N, Durán C, De la Parte M. Blastocystis sp. en humanos: actualización y experiencia clínico-terapéutica. Bol Venez Infectol 2017; 28(1):5-14.
4. Brumpt E. Colite a Tetramitus mesnili (Wenyon 1910) et colite a Trichomonas intestinalis Leuchart 1879. Blastocystis hominis n sp et formes voisines Bull Socww Pathol Exot 1912; 5:725-730.
5. Alexeieff A. Sur la nature des formations dites “kystes de Trichomonas intestinalis.” C R Soc Biol 1911; 71:296-298.
6. Zierdt CH, Rude W, Bull B. Protozoan characteristics of Blastocystis hominis Amer. J. Clin Pathol 1967; 48(5):495-501.
7. Hoevers J, Holman P, Logan K, Hommel M, Ashford R, Snowden K. Restriction-fragment-length polymorphismanalysis of small-subunit rRNA genes of Blastocystis hominis isolates from geographically diverse human hosts. Parasitol Res 2000; 86(1):57-61.
8. Stensvold C, Suresh G, Tan K, Thompson R, Traub R, Viscogliosi E, et al. Terminology for Blastocystis subtypes-a consensus. Trends Parasitol 2007; 23(3):93-96.
9. Lee M, Stenzel D. A survey of Blastocystis in domestic chickens. Parasitol Res 1999; 85(2):109-117.
10. Abe N, Wu Z, Yoshikawa H. Zoonotic genotypes of Blastocystis hominis detected in cattle and pigs by PCR with diagnostic primers and restriction fragment length polymorphism analysis of the small subunit ribosomal RNA gene. Parasitol Res 2003; 90(2):124-128.
11. Yoshikawa H, Abe N, Wu Z. PCR-based identification of zoonotic isolates of Blastocystis from mammals and birds. Microbiology 2004; 150(5):1147-1151.
12. Noel C, Dufernez F, Gerbod D, Edgcomb V, Delgado-Viscogliosi P, Ho LC, et al. Molecular phylogenies of Blastocystis isolates from different hosts: implications for genetic diversity, identification of species, and zoonosis. J Clin Microbiol 2005; 43(1):348-355.
13. Pintong A, Sunyanusin S, Prasertbun R, Mahittikorn A, Mori H, Changbunjong T, et al. Blastocystis subtype 5: Predominant subtype on pig farms, Thailand. Parasitol Int 2018; 67:824–828.
14. Phillips B, Zierdt CH. Blastocystis hominis pathogenic potencial in human patients and in gnotobiotes. Exp Parasitol 1976; 39:358-364.
15. Stenzel D, Boreham P, Mc Dougall R. Blastocystis hominis revisited. Clin Microbiol Rev 1996; 9(4):563-584.
16. Alfellani M, Stensvold C, Vidal-Lapiedra A, Onuoha E, Fagbenro A, Clark C. Variable geographic distribution of Blastocystis subtypes and its potential implications. Acta Trop 2013; 126(1):11-18.
17. Souppart L, Moussa H, Cian A, Sanciu G, Poirier P, El Alaoui H, et al. Subtype analysis of Blastocystis isolates from symptomatic patients in Egypt. Parasitol Res 2010; 106:505-511.
18. Abu-Madi M, Aly M, Behnke J, Clark C, Balkhy H. The distribution of Blastocystis subtypes in isolates from Qatar. Parasit Vectors 2015; 8:465.
19. Nagel R, Cuttell L, Stensvold C, Mills P, Bielefeldt-Ohmann H, Traub R. Blastocystis subtypes in symptomatic and asymptomatic family members and pets and response to therapy. Intern Med J 2012; 42(11):1187-1195.
20. Zhu W, Tao W, Gong B, Yang H, Li Y, Song M, et al. First report of Blastocystis infections in cattle in China. Vet Parasitol 2017; 246(2017):38-42.
21. Yason J, Shyong K. Membrane Surface Features of Blastocystis Subtypes. Genes 2018; 9(8):417.
22. Moe K, Singh M, Howe J, Ho L, Tan S, Chen X, et al. Development of Blastocystis hominis cysts into vacuolar forms in vitro. Parasitol Res 1999; 85(2):103-108.
23. Lepczyńska M, Białkowska J, Dzika E, Piskorz-Ogórek K, Korycińska J. Blastocystis: how do specific diets and human gut microbiota affect its development and Pathogenicity? Eur J Clin Microbiol Infect Dis 2017; 31:1689-1696.
24. Nasirudeen A, Tan K, Singh M, Yap E. Programmed cell death in a human intestinal parasite, Blastocystis hominis. Parasitology 2001; 123(3):235-246.
25. Chandra S, Jeremiah S. Blastocystis: Taxonomy, biology and virulence. Tropical Parasitology 2013; 3(1):17-25.
26. Rajamanikam A, Govind S. Amoebic forms of Blastocystis spp. evidence for a pathogenic role. Parasit Vectors 2013; 6(1): 295.
27. Moosavi A, Haghighi A, Mojarad E, Zayeri F, Alebouyeh M, Khazan H, et al. Genetic variability of Blastocystis sp. isolated from symptomatic and asymptomatic individuals in Iran. Parasitol Res 2012; 111(6):2311-2315.
28. Andersen L, Stensvold C. Blastocystis in Health and Disease. Are we moving from a clinical to a public health perspective? J Clin Microbiol 2016; 54(3):524-528.
29. Nourrisson C, Scanzi J, Pereira B, NkoudMongo C, Wawrzyniak I, Cian A, et al. Blastocystis is associated with decreased of fecal microbiota protective bacteria: comparative analysis between patients with irritable bowel syndrome and control subjects. PLoS One 2014; 9(11):e111868.
30. Scanlan P, Stensvold C, Rajilić-Stojanović M, Heilig H, De Vos W, O’Toole P, et al. The microbial eukaryote Blastocystisis a prevalent and diverse member of the healthy human gut microbiota. FEMS Microbiol Ecol 2014; 90(1):326-330.
31. Chandramathi S, Govind Suresh K. Mahmood A, Kuppusamy. Urinary hyaluronidase activity in rats infected with Blastocystis hominis-evidence for invasion? Parasitol Res 2010; 106(6):1459-1463.
32. Wawrzyniak I, Texier C, Poirier P, Viscogliosi E, Tan K, Delbac F, et al. Characterization of two cysteine proteases secreted by Blastocystis ST7, a human intestinal parasite. Parasitol Int 2012; 61(3):437-442.
33. Long H, Handschack A, Konig W, Ambrosch A. Blastocystis hominis modulates immune responses and cytokine release in colonic epithelial cells. Parasitol Res 2001; 87(12):1029-1030.
34. Puthia M, Sio S, Lu J, Tan K. Blastocystis ratti induces contact-independent apoptosis, F-actin rearrangement and barrier function disruption in IEC-6 cells. Infect Immun 2006; 74(7):4114-4123.
35. Puthia M, Lu J, Tan K. Blastocystis ratti contains cysteine proteases that mediate interleukin-8 response from human intestinal epithelial cells in an NF-kappaBdependent manner. Eukaryot Cell 2008; 7(3):435-443.
36. Mirza H, Tan K. Blastocystis exhibits inter- and intrasubtype variation in cysteine protease activity. Parasitol Res 2009; 104(2):355-361.
37. Nagel R, Traub R, Kwan M, Bielefeldt-Ohmann H. Blastocystis specific serum immunoglobulin in patients with irritable bowel syndrome (IBS) versus healthy controls. Parasites Vectors 2015; 8:453.
38. Nourrisson C, Wawrzyniak I, Cian A, Livrelli V, Viscogliosi E, Delbac F, et al. On Blastocystis secreted cysteine proteases: a legumain-activated cathepsin B increases paracellular permeability of intestinal Caco-2 cell monolayers. Parasitology 2016; 143(13):1713-1722.
39. Mirza H, Wu Z, Teo J, Tan K. Statin pleiotropy prevents rho kinase-mediated intestinal epithelial barrier compromise induced by Blastocystis cysteine proteases. Cell Microbiol 2012; 14(9):1474-1484.
40. Yakoob J, Abbas Z, Usman M, Sultana A, Islam M, Awan S, et al. Cytokine changes in colonic mucosa associated with Blastocystis spp. subtypes 1 and 3 in diarrhoea-predominant irritable bowel syndrome. Parasitology. 2014; 141(7):957-969. Doi: 10.1017/S003118201300173X.
41. Kumarasamy V, Rani U, Jayaloakshmi P, Samudi C, Devi N, Kumar S. Exacerbation of colon carcinogenesis by Blastocystis sp. PLoS ONE 2017; 12(8):e0183097.
42. Yamamoto-Furusho J, Torijano-Carrera E. Intestinal protozoa infections among patients with ulcerative colitis: Prevalence and impact on clinical disease course. Digestion 2010; 82(1):18-23.
43. Boorom K, Smith H, Nimri L, Viscogliosi E, Spanakos G, Parkar U, et al. Oh my aching gut: irritable bowel syndrome, Blastocystis, and asymptomatic infection. Parasit Vectors 2008; 1:40.
44. Devera R, Blanco Y, Requena I, Velásquez V. Diagnóstico de Blastocystis hominis: bajo rendimiento de los métodos de concentración de formol-éter y sedimentación espontánea. Rev Biomed 2006; 17(3):231-233.
45. Figueroa M, Mora L, Silva H. Comparación de seis métodos coproscópicos para el diagnóstico del cromista Blastocystis spp. Saber 2017; 29:66-75.
46. Menounos P, Spanakos G, Tegos N, Vassalos C, Papadopoulou C, Vakalis N. Direct detection of Blastocystis sp. in human faecal samples and subtype assignment using single strand conformational polymorphism and sequencing. Mol Cell Probes 2008; 22(1):24-29.
47. Eymael D, Schuh G, Giacomelli Tavares R. Standarization of Blastocystis hominis diagnosis using different staining techniques. Rev Soc Bras Med Trop 2010; 43(3): 309-312.
48. Wettstein A, Borody T, Wee T, Torres M. Novel Intra-colonic Infusion of Three Antiparasite Agents for Resistant Blastocystis hominis Infections. Available in: http://www.e-learning.ueg.eu/documents-view.html? eprs%5Br%5D=9083 19/12/2012. Cited: 15 apr 2017.
49. Rodríguez C, Alcudia J, Martinez-Gonzalez J, Guadall A, Raposo B, Sanchez-Gomez S, et al. Statins normalize vascular lysyl oxidase down regulation induced by proatherogenic risk factors. Cardiovasc Res 2009; 83(3): 595-603.
50. Basyoni M, Fouad S, Amer M, Amer A, Ismail D. Atorvastatin: In-Vivo Synergy with Metronidazole as Anti-Blastocystis Therapy. Korean J Parasitol 2018; 56(2):105-112.














