Services on Demand
Journal
Article
Indicators
Related links
Share
Gaceta Médica Boliviana
On-line version ISSN 1012-2966
Gac Med Bol vol.41 no.2 Cochabamba Dec. 2018
Artículo Original
Sensibilidad y especificidad de pruebas inmunocromatográficas utilizadas en el nuevo algoritmo de diagnóstico de VIH en Bolivia
Sensitivity and specificity of inmunocromatographic tests used in the new algorithm of HIV diagnosis in Bolivia
Brenda Gisela Martínez-Oliva1,a, Karen Jimena Montaño-Valenzuela1,b, Patricia Rodriguez-Herbas1,c, Amilcar Alejandro Flores-León1,d, Ricardo Enrique Grados-Torrez2,e
1Laboratorio de Virología – LABIMED, Facultad de Medicina, Universidad Mayor de San Simón. Avenida Aniceto Arce, 379 .Cochabamba, Bolivia. 2Laboratorio de Farmacología, Instituto de Investigaciones Fármaco Bioquímicas (I.I.F.B.) ”Luis Enrique Terrazas Siles”. Universidad Mayor de San Andrés, Av. Saavedra 2224. La Paz, Bolivia.aMagister en Bioquímica Clínica, bLicenciada en Bioquímica y Farmacia, cMagister en Bioquímica y Biología Celular y Molecular, mención en Inmunología, dMagister en Biología Celular y Molecular, mención en Inmunología, ePhD en Biotecnología.
*Correspondencia a: Brenda Gisela Martínez Oliva
Correo electrónico: gisela_b-2010@hotmail.com
Recibido el 27 de abril de 2018.
Aceptado el 2 de julio de 2018
Resumen
Objetivo: evaluar la sensibilidad y especificidad de dos pruebas rápidas utilizadas en el nuevo algoritmo de diagnóstico de VIH en Bolivia, Alere DetermineTM HIV 1/2 como prueba de tamizaje y Uni-GoldTM HIV como prueba confirmatoria.
Métodos: estudio descriptivo, no experimental. Se utilizaron 60 muestras de suero provenientes de diferentes establecimientos de salud de Cochabamba con resultados reactivos para VIH, enviadas a LABIMED desde enero a junio de 2016 para confirmación. Las 60 muestras (27 positivas y 33 negativas para VIH) fueron procesadas con Alere DetermineTM HIV 1/2 y Uni-GoldTM HIV.
Resultados: alere DetermineTM HIV 1/2 presentó una sensibilidad del 100% y una especificidad del 54,5%. Uni-GoldTM HIV reportó una especificad del 97% y una sensibilidad del 92,6%.
Conclusiones: la sensibilidad de Alere Determine TM HIV 1/2 cumplió con el criterio del Ministerio de Salud y Deportes de Bolivia (Prueba rápida de tamizaje debe tener una sensibilidad ≥ 99,8%). La especificidad de Uni-GoldTM HIV en este estudio no alcanzó el criterio de especificidad del Ministerio (Prueba rápida de confirmación debe tener una especificidad ≥ 99,9%).
Palabras claves: anticuerpos contra VIH, diagnóstico temprano, serodiagnóstico del SIDA, pruebas inmunológicas, sensibilidad y especificidad, algoritmo.
Abstract
Objective: to evaluate the sensitivity and specificity of the two rapid tests used in the new algorithm of HIV diagnosis in Bolivia, Alere DetermineTM HIV 1/2 as a screening test and Uni-Gold TM HIV as a confirmatory test.
Methods: this is a descriptive and non-experimental study. Sixty serum samples were used with reactive results for HIV from different health establishments in Cochabamba sent to LABIMED from January to June 2016 for HIV confirmation. The 60 samples (27 positive and 33 negative for HIV) were tested with Alere DetermineTM HIV 1/2 and Uni-GoldTM HIV.
Results: Alere DetermineTM HIV 1/2 presented a sensitivity of 100 % and a specificity of 54,5%. Uni-GoldTM HIV reported a sensitivity of 92,6% and a specificity of 97%.
Conclusions: the sensitivity of Alere Determine TM HIV 1/2 fulfilled the criteria of the Ministry of Health and Sports of Bolivia (rapid screening test must have a sensitivity ≥ 99.8%). The specificity of Uni-GoldTM HIV in this study did not fulfill the Ministry’s specificity criterion (rapid confirmation test must have a specificity ≥99.9%).
Keywords: HIV antibodies, early diagnosis, AIDS serodiagnosis, inmunologic tests, sensitivity and specificity, algorithm
Las pruebas rápidas (PRs) para diagnóstico de VIH en general son inmunoensayos que detectan cualitativamente anticuerpos producidos contra el virus en líquidos biológicos. La membrana de una PR está cubierta de antígenos recombinantes de VIH en la región de prueba1. La normativa del Ministerio de Salud en Bolivia establece que la PR para tamizaje debe tener una sensibilidad ≥ 99,8% y la PR para confirmación debe tener una especificidad ≥ 99,9%2.
Las pruebas rápidas han ganado importancia en el diagnóstico de VIH debido a que los resultados son inmediatos, económicos, fáciles de utilizar, distribuir y cada nueva generación acorta más el periodo de ventana (tiempo de detección en fase aguda cuando el nivel de anticuerpos es muy bajo)3, permitiendo mejorar la oportunidad de diagnóstico en la población de riesgo y en aquellos con los que se tiene solo una oportunidad de asesoramiento4,5.
Estas pruebas rápidas están siendo utilizadas en algoritmos internacionales como en Brasil4, África, EEUU6,7, República Democrática del Congo8, Bolivia2 y otros países.Una investigación realizada en Perú determinó que la sensibilidad diagnóstica de Alere DetermineTM HIV 1/2 para anticuerpos contra antígenos del VIH es de 100 % e indican que esta PR es la mejor candidata para ser utilizada en el tamizaje de pacientes con riesgo de infección por VIH 9. Estudios en Brasil también señalan que Uni-Gold HIV en conjunción con otra prueba rápida de alta sensibilidad es ideal para ser parte de un algoritmo de diagnóstico basado solo en pruebas rápidas realizadas en paralelo4,5.
Por lo cual, el objetivo de esta investigación fue determinar la sensibilidad y especificidad de Alere DetermineTM HIV 1/2 y Uni-GoldTM HIV, pruebas comerciales utilizadas en el nuevo algoritmo de diagnóstico de VIH en Bolivia a partir de muestras de suero de pacientes residentes en el departamento de Cochabamba.
Material y métodos
El presente estudio es una investigación descriptiva, no experimental realizada en el laboratorio de Virología – Laboratorio de Investigación Médica (LABIMED), Facultad de Medicina de la Universidad Mayor de San Simón durante el periodo de enero a junio de 2016.
Se seleccionaron un total de 60 muestras de suero procedentes de pacientes residentes en el departamento de Cochabamba. 27 muestras de suero sanguíneo con resultado reactivo confirmado por Western blot y/o carga viral (grupo verdaderos enfermos) y 33 con resultado no reactivo confirmado por Western blot y/o carga viral (grupo verdaderos sanos). No se incluyeron muestras visiblemente hemolizadas, ictéricas y lipémicas, que no fueron transportadas en cadena de frio o sin formulario A4 y de pacientes menores de 18 meses de edad.
Las 60 muestras de suero fueron procesadas con la Prueba rápida 1 (PR1) (Alere DetermineTM HIV 1/2 – Alere Medical Co., Ltda, Japón) como prueba de tamizaje y laPrueba rápida 2 (PR2) (Uni-GoldTM HIV – Trinity Biotech, Irlanda) como prueba confirmatoria. La determinación de sensibilidad y especificidad de las dos pruebas rápidas se realizó en base al número de verdaderos enfermos y sanos utilizando una tabla de 2x2 que compara verdaderos positivos y negativos con falsos positivos y negativos de ambas pruebas rápidas (Tabla 1 y 2).
El presente estudio cuenta con aprobación del comité ético de la Facultad de Medicina. Todos los pacientes firmaron el consentimiento informado antes de la realización de las pruebas para VIH.
Resultados
De las 60 muestras de suero utilizadas 27 tenían resultados reactivos y 33 no reactivos. Todas fueron procesadas por las pruebas rápidas 1 y 2. Los resultados de ambas pruebas rápidas se presentan en la Tabla 1 y 2.
La PR1 detectó 27/27 muestras reactivas que corresponden al 100% de resultados reactivos en el grupo de verdaderos enfermos. Sensibilidad de 100% para las 60 muestras (Tabla 1).
Tabla 1. Contingencia 2x2 para PR1.
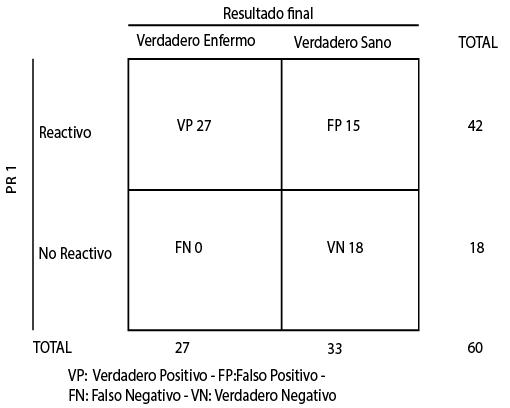
Fuente. Elaboración propia
La PR2 HIV detectó 25/27 muestras reactivas que corresponden al 92,6% de resultados reactivos en el grupo de verdaderos enfermos. Sensibilidad de 92,6% para las 60 muestras (Tabla 2).
Tabla 2. Contingencia 2x2 para PR2.
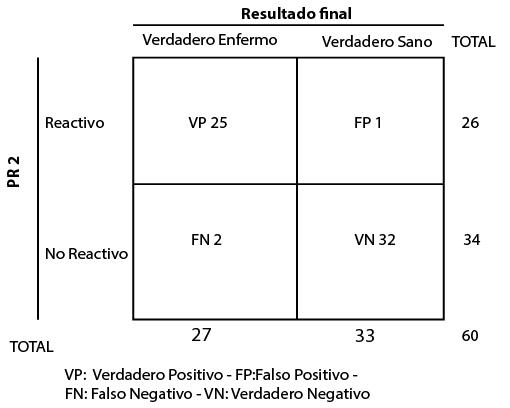
Fuente. Elaboración propia
La PR1 reportó 18/33 muestras no reactivas que corresponden al 54,5 % de resultados no reactivos en el grupo de verdaderos sanos. Especificidad de 54,5% para las 60 muestras (Tabla 1).
La PR2 reportó 32/33 muestras no reactivas que corresponden al 97% de resultados no reactivos en el grupo de verdaderos sanos. Especificidad de 97% para las 60 muestras (Tabla 2).
Los resultados de sensibilidad y especificidad de las pruebas rápidas se contrastan en la Tabla 3.
Tabla 3. Comparación de sensibilidad y especificidad de PR1 Y PR2
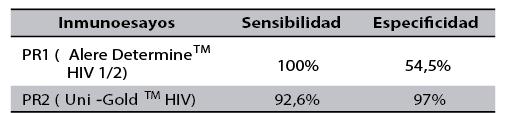
Fuente. Elaboración propia
Discusión
Si bien en la actualidad las PR son ampliamente utilizadas por su menor costo y facilidad de utilización3, otros estudios indican que algunas pruebas rápidas tienen una sensibilidad reducida y durante la etapa aguda de infección por VIH se producen más resultados falsos negativos, detectando solo el 91% de los casos positivos10, cuando la normativa en Bolivia exige una sensibilidad ≥ 99,8% para pruebas rápidas de tamizaje2.
El Ministerio de Salud en Bolivia indica que la primera prueba rápida debe tener una sensibilidad ≥ 99,8%2. En este estudio la primera prueba rápida (Alere DetermineTM HIV 1/2) presentó una sensibilidad del 100% para las 60 muestras utilizadas, cumpliendo con el criterio del Ministerio de Salud.
Una evaluación de Alere DetermineTM HIV 1/2 realizada por la OMS encontró que para 250 muestras esta prueba tenía 100% de sensibilidad y una especificidad del 99,4%11. Sin embargo, un estudio realizado en Uganda señaló problemas con la especificidad de esta prueba rápida reportando un elevado número de falsos reactivos en 1 000 casos negativos, 96 fueron falsos reactivos)12. En este estudio la especificidad de Alere DetermineTM HIV 1/2 fue de 54,5% (de 33 casos negativos, 15 fueron falsos reactivos).Un estudio realizado en la República Democrática del Congo atribuyó un elevado número de falsos reactivos en esta PR por reactividad cruzada e inespecificidad o defectos del sistema inmune7.
Uni-GoldTM HIV reportó una sensibilidad de 92,6% y especificidad de 97% para las 60 muestras procesadas. Estudios realizados en Brasil, donde evaluaron la marca Uni-GoldTM HIV indican que con esta prueba se obtuvieron resultados casi idénticos a los obtenidos con ELISA Ag/Ac4.
A causa de la baja sensibilidad de Uni-GoldTM HIV reportada en este estudio (92,6%), no se recomienda como prueba de tamizaje, por tanto, aquellos establecimientos de salud que utilizan esta prueba deberían utilizar otra prueba rápida con mayor sensibilidad para el tamizaje de pacientes.
Estudios en Brasil también señalan que Uni-GoldTM HIV en conjunción con otra prueba rápida de alta sensibilidad es ideal para ser parte de un algoritmo de diagnóstico basado solo en pruebas rápidas realizadas en paralelo, permitiendo mejorar la oportunidad de diagnóstico en la población de riesgo y en aquellos con los que se tiene solo una oportunidad de asesoramiento4,5. Otros estudios en África y E.E.U.U. utilizan Uni-GoldTM HIV como prueba confirmatoria y/o desempate en algoritmos basados en pruebas rápidas6,7. Según el protocolo del nuevo algoritmo en Bolivia, la prueba de confirmación utilizada es Uni-GoldTM HIV debido a su elevada especificidad, estudios realizados en México indican que esta marca tiene una especificidad de 99,7 a 99,8%13. Para el Ministerio de Salud en Bolivia, la segunda prueba rápida de confirmación debe tener una especificidad ≥ 99,9%2. En este estudio Uni-GoldTM HIV alcanzó una especificidad del 97% para las 60 muestras procesadas.
La conjunción de estas dos PR en el diagnóstico de VIH en Bolivia ha tenido éxito en el reconocimiento de pacientes seropositivos y seronegativos. Se recomienda utilizar un mayor número de muestras de pacientes en distintos estadios de infección por VIH y evaluar otras pruebas rápidas que se utilizan en Bolivia para mejorar el diagnóstico de VIH.
Conflictos de interés: los autores declaramos que no existe conflicto de intereses.
Referencias bibliográficas
1. Lamotte, J. A. Infection due to VIH/AIDS in the current world. Medisan 2014; 18 (7): 993.
2. Ministerio de Salud y Deportes. (2015). Informe final nuevo algoritmo diagnóstico para VIH en Bolivia.
3. Santiesteban, Y. A., Sanabria, J. G. Evaluación de los test rápidos en el Hospital regional de Bata, Guinea ecuatorial. Rev Ciencias Médicas Pinar del Río 2015; 19(6): 1201 – 9.
4. Ferreira, J. O., Ferreira, C., Riedel, M., Visinoni, W. M., Barbosa-Junior, A. Evaluation of rapid test for anti-HIV detection in Brazil. AIDS 2005; 4(19 Suppl): S70 - S5.
5. Masciotra, S., McDougal, S.J., Feldam, J., Sprinkle, P., Wesolowski L. Owen, M. Evaluation of an alternative HIV diagnostic algorithm using specimens from seroconversion panels and persons with established HIV infections. Journal of Clinical Virology 2011; 52 (1 Suppl): S17 – S22.
6. Crucitti, T., Taylor, D., Beelaert, B., Fransen, K., Damme, L. Performance of a Rapid and Simple HIV Testing Algorithm in a Multicenter Phase III Microbicide Clinical Trial. Clinical and vaccine immunology 2011; 18 (9): 1480 – 5
7. Boeras, D., Luisi, N., Karita, E., McKinney, S., Sharkey, T., Keeling, M., Chomba, E., Kraft, C., Wall, K., Bizimana, J., Kilembe, W., Tichacek, A., Caliendo, A., Hunter, E. Allen, S. Indeterminate and discrepant rapid HIV test results in couples’ HIV testing and counselling centres in Africa. Journal of the International AIDS Society 2011; 14 -18.
8. Klarkowski, D., Wazome, J., Lokuge, K., Shanks L., Mills, C., O’Brien, D. The evaluation of rapid In Situ HIV confirmation test in a programme with a High failure rate of the WHO HIV Two-Test diagnosis algorithm. PLoS ONE 2009; 4 (2) : e4351.
9. Miranda, E. U., Romero, R. S., Briceño, E. R., Santos, A. S. Evaluation of three commercial brands of HIV rapid tests. Rev Perú Med Exp Salud Pública 2015; 32(2): 404 – 5.
10. Bernard, M., Branson, M. D. The future of HIV Testing. Acquir Immune Defic Syndr 2010; 55 (2): S102 – 5.
11. WHO. (2011). Report of Expert consultation and review of the latest evidence to update guidelines for the management of sexually transmitted infections. [Consultado 5 de Noviembre 2017]. Disponible en: http://www.who.int/reproductivehealth/publications/rtis/rhr_11_37/en/
12. Gray, R. H. Limitations of rapid HIV-1 tests during screening for trials in Uganda: diagnostic test accuracy study. BMJ 335 2007; 7612: 188.
13. Vásquez- Rosales G. Uso de la prueba rápida para la detección de infección por VIH en pediatría. Bol. Med. Hosp. Infant. Mex.2009; 66(4): 382 – 8.














