Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta Médica Boliviana
Print version ISSN 1012-2966On-line version ISSN 2227-3662
Gac Med Bol vol.35 no.2 Cochabamba Dec. 2012
Artículo Especial
Cambiando la Identidad celular para crear una verdadera medicina personalizada
Changlng cell identity to create true personalized medicine
Mohammed A. Mostajo-Radji1,a,b, Leonardo M.R. Ferreira1,b,c
1Department of Molecular and Cellular Biology; Department of Stem Cell and Regene-rative Biology, Harvard University. Cambridge, Massachusetts, United States of America.aBiotecnólogo; investigador de Celulas Madre y Biologia Regenerativa; cBioquímico.*Correspodencia a: Mohammed A. Mostajo-Radji,Dirección: 7 Divinity Avenue, Cambridge, MA, 02138, United States of America.Correo electrónico: mmostajoradji@fas.harvard.edu
Recibido el 6 de noviembre 2012.
Aceptado el 19 de noviembre de 2012
Resumen
El Premio Nobel 2012 en Fisiología o Medicina fue concedido a Sir John Gurdon y Shinya Yamanaka por sus avances en la reprogramación celular. Estos descubrimientos no sólo cambiaron nuestra visión del proceso de diferenciación celular, pero también tienen el potencial de revolucionar la medicina. Proporcionando una breve contextualización histórica y un resumen sucinto de las metodologías actuales, presentamos los principales avances en la investigación básica, así como sus posibles aplicaciones en la clínica. Esta revisión tiene como objetivo proporcionar un panorama general del estado actual sobre el campo de reprogramacióncelular y sus implicaciones terapéuticas.
Palabras claves: reprogramación celular; células madre; pluripotencia; medicina personalizada.
Abstract
The 2012 Nobel Prize in Physiology or Medicine was awarded to Sir John Gurdon and Shinya Yamanaka for their breakthroughs in cellular reprogramming. These discoveries not only changed our view of the process of cell fate determination, but also hold the potential to revolutionize medicine. By providing a brief historical context and a succinct summary of the current methodologies, we present the major advances in basic research, as well as their potential applications to the clinic. This review aims to provide a concise overview of the current state of the field and its implications for therapy.
Keywords: cellular reprogramming; stem cells; pluripotency; personalized medicine.
Experimentos en reprogramación nuclear, han desafiado la idea de que cambios genéticos son responsables de la sub-diferenciación de linajes celulares. En 1962, Sir John Gurdon demostró que el núcleo de células diferenciadas de intestinos de Xenopus laevis, podían generar animales sanos al ser transferidos a huevos enucleados. Es muy interesante que, al tomar células de embriones clonados, parcialmente desarrollados y transferirlos a nuevos huevos enucleados, el éxito era significativamente mayor1. Complementados con la generación de la oveja Dolly, el primer mamífero clonado de células diferenciadas2, estos experimentos demostraron que cambios epigenéti-cos reversibles son los responsables de la diversidad de tejidos en un organismo.
Las células madres embrionarias son naturalmente pluri-potentes, ya que tienen dos características específicas: la capacidad de auto-renovarse y la posibilidad de ser diferenciadas en cualquier tipo de célula en el cuerpo3. Una pregunta fundamental que quedó por ser explorada en los experimentos en clonación, plantea lo siguiente: ¿cuáles son los factores necesarios para revertir estos cambios epigenéticos, y llevar a las células a un estado embrionario? Experimentos en fusión celular dejaron en claro que factores de transcripción son necesarios y suficientes para alterar el paisaje epigenético de las diferentes células4. Sin embargo, no fue hasta que el japonés Shinya Yamanaka generó células pluripotenciales inducidas (iPS, por sus siglas en inglés) mediante la introducción de factores exógenos a células epiteliales de ratones y humanos, que estos factores fueron identificados5,6.
Si bien la reversión a estado embrionario fue elegantemente demostrada, la conversión directa de un linaje celular a otro, sin pasar por un estado embrionario, es de mayor interés, ya que permitiría la rápida producción de células necesarias para pacientes afectados por diferentes enfermedades7.
En esta revisión bibliográfica se discutirán los diferentes procesos de reprogramación, tanto directa como a través de la formación de células iPS, seguida por diferenciación in vitro (figura 1). Además, se debatirán las ventajas de la reprogramación en la medicina personalizada y la investigación científica.
Pluripotencia inducida: La prueba máxima de conservación genética y plasticidad celular
Las primeras pruebas de que pluripotencia puede ser inducida a los diferentes tipos de células provenientes de los experimentos en clonación. Si bien la oveja Dolly fue el primer mamífero formalmente clonado2, esta fue derivada de células mitóticas mamarias. Es por esto que, la clonación de Dolly no dejó en claro si todas las células terminalmente diferenciadas adultas pueden ser inducidas a pluripotencia. De hecho, los autores no estaban seguros si la célula donante era terminalmente diferenciada o si era una célula progenitora en las glándulas mamarias. La clonación de ratones a partir de linfocitos maduros B y T, en la cual el genoma había sido recombinado8, y la clonación a partir de neuronas postmitóticas del bulbo olfatorio9, demostraron inequívocamente que células terminalmente diferenciadas pueden dar origen a animales sanos. Aunque la clonación exitosa ha sido obtenida de múltiples células donantes, esta no ha sido definida en todos los tipos de células. Por ejemplo, Yagi y colegas fallaron en clonar animales sanos a partir de neuronas corticales postnatales10.
Las células madres embrionarias son pluripotentes y son el estándar de oro en el campo de la pluripotencia inducida. Las primeras células madres embrionarias mamíferas fueron derivadas en 198111. Sus contrapartes humanas fueron obtenidas en los años 9012,13. Sin embargo, su uso es extremadamente controversial, ya que son obtenidas a partir de la masa celular interna de blastocitos, y por tanto, este proceso destruye necesariamente al embrión en desarrollo14. Una manera de esquivar los problemas éticos y técnicos de generar células madres, ya sea por derivación directa a partir de un embrión o por clonación, es la inducción a pluripotencia en células diferen-ciadas7. la investigación revolucionaria de Yamanaka y otros colegas, ha demostrado que la expresión forzada de solamente cuatro factores de transcripción, es suficiente para reprogra-mar células adultas a un estado equivalente al embrionario5,6. Aunque el trabajo original fue desarrollado en fibroblastos, estos principios han sido mantenidos en múltiples sistemas7,15, incluyendo neuronas postmitóticas postnatales16.
originalmente, las células pluripotenciales inducidas (iPS) fueron obtenidas a través de infección viral5,15. lamentablemente, estos métodos integraban el genoma viral dentro del receptor, disminuyendo las aplicaciones médicas, ya que la integración viral ha sido anteriormente asociada con el desarrollo de tumores, y con la expresión residual de los factores exógenos17. Desde entonces, métodos alternativos han sido desarrollados. Es de gran relevancia mencionar a los métodos basados en expresión de ARN18,19 y administración directa de proteínas recombinantes20.
Problemas adicionales en la generación de células iPS para usos médicos incluyen el difícil mantenimiento de las mismas en cultivos in vitro; y las diferencias entre las células iPS y células embrionarias naturales. Recientes avances desarrollados por Chad Cowan y colegas, han optimizado el cultivo, retención y modificación genética de células pluripotentes; usando medios de cultivos sin productos animales21. Finalmente, las diferencias y similitudes entre células iPS y células madres embrionarias han sido sujetas a extenso análisis por distintos grupos. Hasta el momento no se han encontrado diferencias consistentes entre células iPS y células embrionarias bona fide2223.
Reprogramación directa: Forzando células a cambiar su identidad
Aunque la producción de células iPS es muy atractiva para el campo de la medicina, esta también tiene algunas desventajas, como ser la baja eficiencia de reprogramación y los largos tiempos requeridos para la derivación, validación y diferenciación en el tipo de células deseadas7. Sorprendentemente, varios grupos han logrado reprogramar directamente un tipo de células terminalmente diferenciadas en otro subtipo, sin necesitar ir por el estado embrionario. Inicialmente, investigadores de la Universidad de Pennsylvania, demostraron la conversión directa de fibroblastos, condroblastos y células epiteliales a mioblastos; gracias a la sobreexpresión de factores de transcripción necesarios para el desarrollo musculo-esquelético24. Estos resultados inspiraron la búsqueda de combinaciones necesarias para generar otros tipos de células directamente. Uno
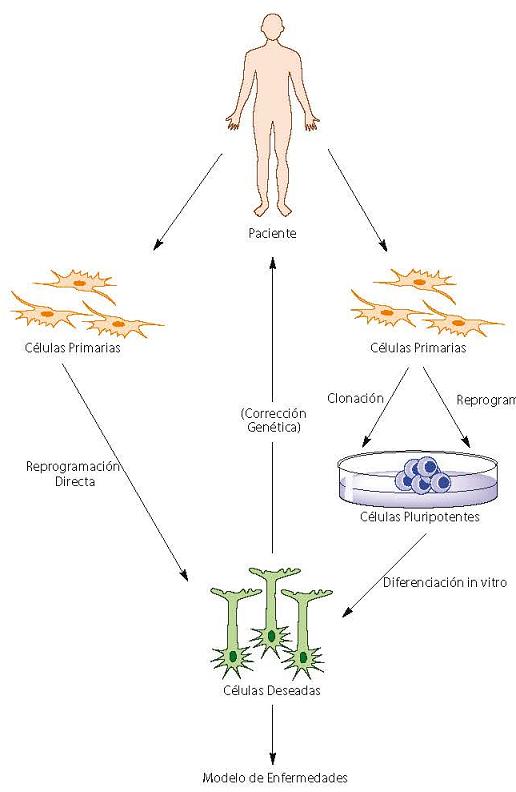
Figura 1. Aplicaciones de la reprogramación celular en la medicina.
Existen dos maneras de generar células especificas para pacientes. La manera mas rápida es por la reprogramación directa de células donantes a células deseadas. Sin embargo, la manera mas utilizada es la inducción de pluripotencia en células donantes, ya sea a través de clonación o de reprogramación. Estas células pluritpotentes pueden posteriormente ser diferencias en células deseadas. Las células deseadas son después utilizadas para modelar enfermedades in vitro o para ser transplantadas nuevamente al paciente.
de los primeros ejemplos proviene del sistema inmunológico, donde se logró la conversión de linfocitos B a macrófagos25. Ejemplos adicionales incluyen la reciente conversión directa de fibroblastos en cardiomiocitos26 y células Sertoli27.
la producción directa de células del sistema nervioso ha sido una prioridad para el campo de la reprogramación. Recientemente, Huang y colegas han generado células madres neuronales a partir de fibroblastos28. Sorprendentemente, estas células pueden generar neuronas y células glía in vitro. Adicionalmente, neuronas maduras y funcionales, como ser neuronas dopaminérgicas y motoras, pueden también ser obtenidas a partir de fibroblastos29,30.
Idealmente y para uso en terapia médica, la reprogramación directa se debería lograr in vivo, es decir, dentro del organismo del paciente. lamentablemente, este proceso es extremadamente difícil y muy pocos avances se han realizado en el área. Sin lugar a duda, el pionero en este tema es el grupo dirigido por Douglas Melton en Harvard. A través de elegantes experimentos, este grupo logró convertir directamente células exocrinas de páncreas en células ^, que exitosamente producen insulina31. Notoriamente, dos grupos independientes reportaron la conversión in vivo de fibroblastos a cardio-miocitos32,33. Estos avances han abierto las puertas a nuevos enfoques para revolucionar la medicina moderna.
La Medicina Personalizada: ¿Una Realidad?
La posibilidad de utilizar células paciente-especificas, para generar células pluripotentes que pueden renovarse infinitamente y diferenciarse in vitro en cualquier célula del cuerpo, ofrece grandes esperanzas en el ámbito de la medicina per-sonaliza34. Varios protocolos han sido establecidos para obtener diferentes células diferenciadas de gran interés, para tratamiento médico de enfermedades degenerativas35. Por ejemplo, un reciente reporte demostró la diferenciación de células pluripotentes en adipocitos blancos y marrones36. Similarmente, la obtención de células ^ productoras de insulina ha sido lograda, aunque con menor éxito37,38. En el campo de la neurociencia, diferentes neuronas motoras han sido obtenidas al tratar células pluripotentes con combinaciones de factores de transcripción y drogas39,40. De gran importancia para terapias en salud reproductiva, fascinantes experimentos han producido oocitos y espermatozoides a partir de células iPS41,42. Finalmente, no podemos olvidar la creación in vitro de células progenitoras sanguíneas43, que pueden convertirse en una fuente ilimitada de sangre altamente pura y segura para transfusión.
Indiscutiblemente, la aplicación más grande de la reprogramación celular y el desarrollo de células iPS es el tratamiento y corrección de mutaciones genéticas que dan origen a enfermedades actualmente incurables. Como prueba de principio, el grupo de Rudolf Jaenisch demostró por primera vez que es posible curar la anemia de células falciformes, usando una combinación de reprogramación celular e ingeniería genética. Brevemente, este grupo tomó fibroblastos de ratones que llevaban la mutación genética que causa la anemia. Estos fibroblastos fueron reprogramadas a células iPS, y las mutaciones fueron corregidas por recombinación homologa, para luego ser diferenciadas a progenitores sanguíneos. Después de un trasplante autólogo en animales enfermos, esta anemia fue curada permanentemente44.
En humanos, células iPS son principalmente utilizadas para modelar enfermedades genéticas in vitro, y visualizar síntomas tempranos en el desarrollo de estas. Con este enfoque, actualmente se han obtenidos importantes pistas que pueden acelerar la detección y tratamiento de desordenes degenerativos, como ser la enfermedad de Alzheimer45 y de Parkison46. Además, estos métodos también han sido aplicados a la enfermedad de Huntington; en la cual se han podido corregir las expansiones CAG, que dan origen a fenotipo particular de este desorden47. Finalmente, uno de los experimentos más impresionantes de este año es la eliminación del cromosoma extra causante del Síndrome de Down en células iPS, derivadas de fibroblastos de pacientes afectados por esta enfermedad48. Aunque esta técnica no puede ser utilizada para reemplazar todos los tejidos de los afectados, es de particular interés para la generación de células progenitoras sanguíneas. Utilizando un enfoque similar al demostrado por Rudolf Jaenisch en anemia de células falciformes44, trasplantes autólogos podrían ser realizados en pacientes con Síndrome de Down, para eliminar la alta susceptibilidad a leucemia y otros desordenes sanguíneos característicos de la enfermedad.
El ámbito de reprogramación se ha desarrollado a un paso tan acelerado que es muy difícil predecir los avances que podremos conseguir para el final de esta década. Sin embargo, todas las historias discutidas en esta revisión indican claramente que la reprogramación tendrá un papel fundamental en la medicina moderna. Es razonable pensar que en el futuro cercano, científicos y especialistas médicos trabajaran mano a mano para ofrecer terapias altamente innovadoras para enfermedades actualmente consideradas incurables. Claro está, que esfuerzos son necesarios para apoyar la creación de bancos internacionales de células iPS, como es sugerido por el Premio Nobel Shinya Yamanaka y otros49. Estas instituciones facilitarían en gran magnitud los accesos a estas tecnologías, y por tanto acelerarían la realización de todas las promesas de las células madres pluripotentes a la medicina personalizada.
Agradecimientos: agradecemos a Sasha Mostajo y Kristian Herrera, por su valioso aporte al desarrollo de este manuscrito. Adicionalmente, deseamos felicitar de manera formal a Sir John Gurdon y Shinya Yamanaka, por haber ganado el Premio Nobel en Fisiología o Medicina 2012, por sus investigaciones en reprogramación nuclear.
Conflictos de interés: los autores declaran que no existe ningun conflicto de interés.
Referencias bibliográficas
1. Gurdon JB. The developmental capacity of nu-clei taken from intestinal epithelium cells of fee-ding tadpoles. J Embryol Exp Morphol 1962; 10: 622-40.. [ Links ]
2. Campbell KHS, McWhir J, Ritchie WA, Wilmut I. Sheep cloned by nuclear transfer of a cultured cell line. Nature 1996; 380: 64-66 [ Links ]
3. Hanna JH, Saha K, Jaenisch R. Pluripotency and cellular reprograming: facts, hypotheses, unresol-ved issues. Cell 2010; 143(4): 508-525. [ Links ]
4. Silva J, Chambers I, Pollard S, Smith A. Nanog promotes transfer of pluripotency after cell fusion. Nature 2006; 441(7096): 997-1001. [ Links ]
5. Takahashi K, Yamanaka S. Induction of Pluri-potent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell 2006; 126 (4): 663-676. [ Links ]
6. Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, et al. Induction of pluri-potent stem cells from adult human fibroblasts by defined factors. Cell 2007; 131(5): 861-72. [ Links ]
7. Masip M, Veiga A, Izpisua Belmonte JC, Simon C. Reprogramming with defined factors: from induced pluripotency to induced transdifferentia-tion. Mol Hum Reprod 2010; 16(11): 856-68. [ Links ]
8. Hochedlinger K, Jaenisch R. Monoclonal mice generated by nuclear transfer from mature B and T donor cells. Nature 2002; 415 (6875): 10351038. [ Links ]
9. Eggan K, Baldwin K, Tackett M, osborne J, Go-gos J, Chess A, et al. Mice cloned from olfactory sensory neurons. Nature 2004; 428(6978): 44-9. [ Links ]
10. Makino H, Yamazaki Y, Hirabayashi T, Kaneko R, Hamada S, Kawamura Y, et al. Mouse embryos and chimera cloned from neural cells in the postnatal cerebral cortex. Cloning Stem Cells 2005; 7(1): 45-61. [ Links ]
11. Evans MJ, Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos. Nature 1981; 292: 154-156. [ Links ]
12. Bongso A, Fong CY, Ng SC, Ratnam S. Isola-tion and culture of inner cell mass cells from human blastocysts. Hum Reprod 1994; 9(11): 2110-7. [ Links ]
13. Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, et al. Em-bryonic stem cell lines derived from human blas-tocysts. Science 1998; 282(5391): 1145-7. [ Links ]
14. Ramalho-Santos J. Human procreation in un-chartered territory: new twists in ethical discus-sions. Hum Reprod 2011; 26(6): 1284-7. [ Links ]
15. Stadtfeld M, Hochedlinger K. Induced pluri-potency: history, mechanisms, and applications. Genes Dev 2010; 24(20): 2239-63. [ Links ]
16. Kim J, Lengner CJ, Kirak O, Hanna J, Cassady JP, Lodato MA, et al. Reprogramming of postnatal neurons into induced pluripotent stem cells by defined factors. Stem Cells 2011; 29(6): 992-1000. [ Links ]
17. Yu J, Hu K, Smuga-otto K, Tian S, Stewart R, Slukvin, II, et al. Human induced pluripotent stem cells free of vector and transgene sequences. Scien-ce 2009; 324(5928): 797-801. [ Links ]
18. Warren L, Manos PD, Ahfeldt T, Loh YH, Li H, Lau F, et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell 2010; 7(5): 618-30. [ Links ]
19. Anokye-Danso F, Trivedi CM, Juhr D, Gupta M, Cui Z, Tian Y, Zhang Y, Yang W, Gruber PJ, Epstein JA, Morrisey EE. Highly Efficient miRNA-Mediated Reprogramming of Mouse and Human Somatic Cells to Pluripotency. Cell Stem Cell 2011, 8: 376-388.
20. Zhou H, Wu S, Joo JY, Zhu S, Han DW, Lin T, et al. Generation of induced pluripotent stem cells using recombinant proteins. Cell Stem Cell 2009; 4(5): 381-4. [ Links ]
21. Schinzel RT, Ahfeldt T, Lau FH, Lee YK, Cowley A, Shen T, et al. Efficient culturing and genetic manipulation of human pluripotent stem cells. PLoS One 2011; 6(12): e27495. [ Links ]
22. Guenther MG, Frampton GM, Soldner F, Hoc-kemeyer D, Mitalipova M, Jaenisch R, et al. Chro-matin structure and gene expression programs of human embryonic and induced pluripotent stem cells. Cell Stem Cell 2010; 7(2): 249-57. [ Links ]
23. Bock C, Kiskinis E, Verstappen G, Gu H, Boul-ting G, Smith ZD, et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell 2011; 144(3): 439-52. [ Links ]
24. Choi J, Costa ML, Mermelstein CS, Chagas
C, Holtzer S, Holtzer H. MyoD converts primary dermal fibroblasts, chondroblasts, smooth muscle, and retinal pigmented epithelial cells into striated mononucleated myoblasts and multinucleated myotubes. Proc Natl Acad Sci USA 1990; 87(20): 7988-92.
25. Xie H, Ye M, Feng R, Graf T. Stepwise Repro-gramming of B Cells into Macrophages. Cell 2004; 117: 663-676. [ Links ]
26. Efe JA, Hilcove S, Kim J, Zhou H, Ouyang K, Wang G, et al. Conversion of mouse fibroblasts into cardiomyocytes using a direct reprogram-ming strategy. Nat Cell Biol 2011; 13(3): 215-22. [ Links ]
27. Buganim Y, Itskovich E, Hu YC, Cheng AW, Ganz K, Sarkar S, et al. Direct reprogramming of fibroblasts into embryonic Sertoli-like cells by de-fined factors. Cell Stem Cell 2012; 11(3): 373-86. [ Links ]
28. Ring KL, Tong LM, Balestra ME, Javier R, Andrews-Zwilling Y, Li G, et al. Direct repro-gramming of mouse and human fibroblasts into multipotent neural stem cells with a single factor. Cell Stem Cell. 2012; 11(1): 100-9. [ Links ]
29. Caiazzo M, Dell’Anno MT, Dvoretskova E, Lazarevic D, Taverna S, Leo D, et al. Direct ge-neration of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 2011; 476(7359): 224-7.
30. Son EY, Ichida JK, Wainger BJ, Toma JS, Rafu-se VF, Woolf CJ, et al. Conversion of mouse and human fibroblasts into functional spinal motor neurons. Cell Stem Cell 2011; 9(3): 205-18. [ Links ]
31. Zhou Q, Brown J, Kanarek A, Rajagopal J, Melton DA. In vivo reprogramming of adult pancreatic exocrine cells to (3-cells. Nature 2008; 455(7213): 627-632. [ Links ]
32. Qian L, Huang Y, Spencer CI, Foley A, Ve-dantham V, Liu L, et al. In vivo reprogramming of murine cardiac fibroblasts into induced cardiom-yocytes. Nature 2012; 485(7400): 593-8. [ Links ]
33. Song K, Nam YJ, Luo X, Qi X, Tan W, Huang GN, et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Na-ture 2012; 485(7400): 599-604. [ Links ]
34. Cohen DE, Melton D. Turning straw into gold: directing cell fate for regenerative medicine. Nat Rev Genet 2011; 12(4): 243-52. [ Links ]
35. Ferreira LM, Floriddia EM, Quadrato G, Di Giovanni S. Neural Regeneration: Lessons from Regenerating and Non-regenerating Systems. Mol Neurobiol 2012; 46(2): 227-41. [ Links ]
36. Ahfeldt T, Schinzel RT, Lee YK, Hendrickson
D, Kaplan A, Lum DH, et al. Programming human pluripotent stem cells into white and brown adi-pocytes. Nat Cell Biol 2012; 14(2): 209-19.
37. Lumelsky N, Blondel O, Laeng P, Velasco I, Ravin R, McKay R. Differentiation of Embryonic Stem Cells to Insulin-Secreting Structures Similar to Pancreatic Islets. Science 2001; 292: 1389-1393. [ Links ]
38. Zhang D, Jiang W, Liu M, Sui X, Yin X, Chen S, et al. Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulin-producing cells. Cell Res 2009; 19(4): 429-38. [ Links ]
39. Miles GB, Yohn DC, Wichterle H, Jessell TM, Rafuse VF, Brownstone RM. Functional proper-ties of motoneurons derived from mouse embryo-nic stem cells. J Neurosci 2004; 24(36): 7848-58. [ Links ]
40. Takazawa T, Croft GF, Amoroso MW, Studer L, Wichterle H, Macdermott AB. Maturation of spinal motor neurons derived from human em-bryonic stem cells. PLoS One. 2012; 7(7): e40154.
41. Easley CAt, Phillips BT, McGuire MM, Barrin-ger JM, Valli H, Hermann BP, et al. Direct diffe-rentiation of human pluripotent stem cells into haploid spermatogenic cells. Cell Rep. 2012; 2(3): 440-6. [ Links ]
42. Hayashi K, Ogushi S, Kurimoto K, Shimamo-to S, Ohta H, Saitou M. Offspring from Oocytes Derived from in Vitro Primordial Germ Cell-Like Cells in Mice. Science. En prensa 2012.
43. Xu Y, Liu L, Zhang L, Fu S, Hu Y, Wang Y, et al. Efficient commitment to functional CD34+ progenitor cells from human bone marrow mes-enchymal stem-cell-derived induced pluripotent stem cells. PLoS One 2012; 7(4): e34321. [ Links ]
44. Hanna J, Wernig M, Markoulaki S, Sun CW, Meissner A, Cassady JP, et al. Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin. Science 2007; 318(5858): 1920-3. [ Links ]
45. Israel MA, Yuan SH, Bardy C, Reyna SM, Mu Y, Herrera C, et al. Probing sporadic and familial Alzheimer’s disease using induced pluripotent stem cells. Nature 2012; 482(7384): 216-20.
46. Devine MJ, Ryten M, Vodicka P, Thomson AJ, Burdon T, Houlden H, et al. Parkinsons disease induced pluripotent stem cells with triplication of the alpha-synuclein locus. Nat Commun 2011; 2: 440. [ Links ]
47. An MC, Zhang N, Scott G, Montoro D, Wittkop T, Mooney S, et al. Genetic correction of Huntingtons disease phenotypes in induced pluripotent stem cells. Cell Stem Cell 2012; 11(2): 253-63. [ Links ]
48. Li LB, Chang KH, Wang PR, Hirata RK, Papa-yannopoulou T, Russell DW. Trisomy Correction in Down Syndrome Induced Pluripotent Stem Cells. Cell Stem Cell 2012; 11(5): 615-619. [ Links ]
49. Yamanaka S. Induced Pluripotent Stem Cells: Past, Present, and Future. Cell Stem Cell 2012; 10(6): 678-684. [ Links ]














