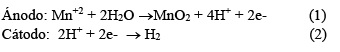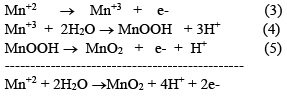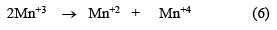INTRODUCCIÓN
El Dióxido de Manganeso Electrolítico (DME) se utiliza como material catódico en pilas alcalinas Zn/MnO2. Estas pilas al cumplir con su ciclo de vida son desechadas. De esta manera, las pilas usadas constituyen una parte muy importante de los desechos domésticos, los cuales aportan metales pesados en los botaderos urbanos [1]. En este trabajo, se describe la obtención de MnO2 por electro-oxidación de lixiviados ácidos de pilas alcalinas agotadas. Las baterías alcalinas conocidas como pilas secas son una fuente de energía portátil empleada en diferentes dispositivos electrónicos [2,3]. Una batería alcalina consta de una o más células electroquímicas conectadas en serie o en paralelo. Cada celda tiene un ánodo, un cátodo y electrolito. Los ánodos están constituidos por zinc mientras que los cátodos son de dióxido de manganeso, y el electrolito contiene hidróxido de potasio [4,5]. La energía es producida por reacciones químicas que resultan de la trasferencia de electrones desde el ánodo al cátodo. La cantidad de energía disponible en una batería está limitada propiamente a los cambios en las especies químicas durante las reacciones, las baterías alcalinas son consideradas agotadas cuando sus químicos son consumidos en su totalidad y son descartadas [5].
Las baterías alcalinas se emplean en la mayoría de dispositivos electrónicos portátiles tales como linternas, juguetes, herramientas, dispositivos inalámbricos, etc., su uso y disposición final ha crecido enormemente en todo el mundo [2,3]. En nuestra región y en los países en vías de desarrollo como Perú, existen reglamentos referentes a la disposición final de baterías alcalinas agotadas para evitar la contaminación de suelo, aire y recursos acuíferos con metales pesados como el zinc, manganeso, plomo, cadmio y mercurio, provenientes de las mencionadas baterías [6,7]. Las baterías alcalinas agotadas representan una importante fuente de recursos de metales tales como el zinc, manganeso y plomo [2,6], los cuales pueden encontrarse con niveles de alta concentración y en algunos casos con una concentración más grande que los recursos minerales [8]. Es conocido que las reservas de zinc estarán agotadas dentro de 20-40 años [2], por lo tanto, la recuperación de metales a partir de baterías agotadas resulta ser económicamente conveniente debido a que grandes cantidades de residuos sólidos pueden ser una fuente de materia prima secundaria, como por ejemplo para el manganeso [4,6,9-11].
La disposición más adecuada de las baterías agotadas comenzaría en los depósitos municipales de residuos sólidos con la estabilización, incineración y los respectivos procesos de reciclado. La disposición segura en los depósitos municipales y la estabilización de residuos de baterías alcalinas sería muy costosa debido al incremento de residuos sólidos producidos y la limitada capacidad de los depósitos municipales. La incineración de baterías agotadas también es costosa y puede causar emisiones de mercurio, cadmio y dioxinas hacia el ambiente [8]. Por lo tanto, el reciclado de baterías alcalinas agotadas sería el destino más apropiado para este tipo de residuos sólidos [8]. El reciclado es importante porque contribuye con el beneficio para futuras generaciones con la preservación de materias primas, principalmente en el caso de las baterías. Es necesario desarrollar un eficiente sistema de recolección para reciclar las baterías consumidas en todo el mundo [8].
Los pasos o procesos para el reciclado de baterías alcalinas son principalmente dos, el primer paso consiste en la preparación y el segundo paso en la aplicación de un proceso metalúrgico. Durante el primer paso de preparación, las baterías son enviadas a etapas de separación física de sus constituyentes empleando métodos de procesamiento de minerales tales como, chancado, conminución, separación magnética, y separación electrostática.
En la etapa de chancado, se fragmentan las baterías con el objetivo de separar los materiales de la envoltura de las baterías (Carcasa, polímero y metales) del material interno de las baterías (material anódico y catódico). Por otro lado, el objetivo de la conminución es el de disminuir el tamaño de partícula con la finalidad de liberar los diferentes tipos de materiales a ser recuperados. En el segundo paso del procesamiento metalúrgico básicamente se tiene tres diferentes vías: hidrometalúrgica, pirometalúrgica o un proceso híbrido, es decir se emplean procesos hidrometalúrgicos y/o pirometalúrgicos para obtener metales o compuestos metálicos [6,8,11].
Los procesos pirometalúrgicos se caracterizan por el uso de altas temperaturas para recuperar los principales metales. Durante el tratamiento térmico de una batería agotada, varias reacciones tienen lugar tales como la descomposición de compuestos, reducción y evaporación de metales. Todos los procesos pirometalúrgicos para el reciclado de baterías comparten un paso en común, el de la evaporación de un metal y su segregación de otros materiales que tienen un alto punto de evaporación, por lo tanto, el objetivo de este proceso es evaporar el Hg, Zn, y Cd. Existen diferentes procesos pirometalúrgicos para el reciclado de baterías, siendo los más conocidos: el Proceso SUMITOMO, el cual trata baterías alcalinas, baterías de ZnC, baterías de NiMH, baterías Zn-aire y mercurio; el proceso RECYTEC trata diversos tipos de baterías; el proceso SNAM-SAVAM trata baterías de NiCd, NiMH y Li- ion; el proceso INMETCO trata diversos tipos de baterias NiCd, NiMH, NiFe, Li-ion y Zn-Mn; el proceso ACCUREC trata baterías de NiCd, NiMH, y baterías con contenidos de Zn [6,8].
En el proceso hidrometalúrgico, primeramente, las baterías son clasificadas por su tipo debido a que la composición de metales varia significativamente. Luego, se desmantelan para remover el hierro, plásticos y papel presentes en la cubierta de la batería, mientras que el material interno constituido por el ánodo y cátodo es enviado a un proceso de lixiviación con el objetivo de transferir los metales de interés desde la fase solida hacia una solución acuosa. Soluciones acidas o alcalinas son normalmente utilizadas en este proceso, así como también agentes oxidantes o reductores. Después de la lixiviación, la solución acuosa es enviada a una etapa de purificación la cual puede incluir a su vez varias etapas de separación tales como la cementación, precipitación, extracción por solventes, adsorción, intercambio iónico y otros. Finalmente, las especies metálicas son recuperadas a partir de soluciones puras de metales u óxidos metálicos, hidróxidos o sales. Los proseos hidrometalúrgicos más empleados en el reciclado de baterías son: el Proceso TNI trata baterías de NiCd; el proceso BATENUS trata diversos tipos de baterías; el proceso ZINCEX trata baterías con contenido de Zn; el proceso RECUPYL trata diversos tipos de baterías [6,11].
De los procesos mencionados en el reciclado de baterías, los procesos hidrometalúrgicos (lixiviación) son procesos económicos, bien establecidos, con una eficiente selectividad del metal. También son procesos amigables con el medio ambiente [3,8,11] empleando tiempos de lixiviación que pueden variar de 10 minutos hasta 24 horas, con concentraciones de ácido sulfúrico de 0.25 a 6 M. Con esto, se obtienen extracciones de 5% al 82% para el Mn y de del 30% al 100% para el Zn, empleando temperaturas que varían desde 25° a 80°C, con diferentes proporciones de solido/liquidó de 1/3 hasta 1/60 [6,11].
Como proceso hidrometalúrgico, el proceso de electrodeposición para recuperar Zn de alta pureza es ampliamente conocido. Se emplean diversos materiales como cátodo (Al, Cu, Pt y acero) aplicando temperaturas desde 30°C a 50°C, con potenciales de - 2.5 a -3.5 V, para una densidad de corriente del cátodo de 0.5 a 10.7 A/dm2. El tiempo de deposición es de 60 minutos, obteniéndose depósitos de Zn de 97%-100% de pureza, empleando ánodos de plomo [3].
El dióxido de manganeso electrolítico MnO2, se deposita en el ánodo. Los materiales empleados como ánodo son el grafito, plomo, titanio, mientras que los cátodos pueden ser de grafito, cobre o plomo, con una densidad de corriente de 0.5 a 1 A/dm2. Bajas densidades de corriente son necesarias para producir altas calidades de dióxido de manganeso electrolito, con altas rareas anódicas. El potencial del área anódica debe ser 3 veces más grande que el área catódica. Se alcanzan espesores de depósitos en el ánodo de 5 a 30 mm después de 29 días, dependiendo de la densidad de corriente anódica. El voltaje de celda es cercano a 2.5V para una temperatura de 90°C, y el dióxido de manganeso electrolítico alcanza una pureza del 90-99%.
Las telas de fibra de carbono presentan diferentes texturas que en combinación con las propiedades del grafito forman una estructura tridimensional flexible dando como resultado un material de gran área superficial, económico, químicamente resistente y versátil; lo cual resulta de gran interés en los procesos electroquímicos.
En la electrodeposición del dióxido de manganeso electrolítico, una de las ventajas de emplear telas de fibra de carbono es la de contar con un material con una enorme superficie de contacto. Además, la de presentar menores sobrepotenciales y una alta eficiencia de corriente. Esto, es una de las grandes ventajas en los procesos electrolíticos, para obtener depósitos de MnO2 electrolítico con 99.99 % de pureza.
La técnica de voltametría cíclica permite diagnosticar mecanismos de reacciones electroquímicas, e identificar especies presentes en la solución a partir de resultados experimentales, también, mediante esta técnica es posible identificar los picos de oxidación y reducción con sus respectivos voltajes alcanzados.
Actualmente, las investigaciones sobre el reciclado de baterías alcalinas agotadas se enfocan principalmente en la recuperación de Zn y Mn a través de diferentes métodos que incluyen procesos hidrometalúrgicos, precipitación, lixiviación, electrodeposición y tratamientos pirometalúrgicos [11]. Existen diferentes estudios referentes a la recuperación de Zn y Mn a partir de baterías agotadas: Marta de Souza y otros (Brasil) estudiaron la recuperación de Zn y Mn a partir de baterías alcalinas alcanzando recuperaciones del 100% y 30% respectivamente [12]. Quintanilla y otros (Brasil) investigaron una ruta para procesar los componentes electroactivos de baterías secas mediante fusión con KHSO4, alcanzando recuperaciones mayores al 92% para el Zn y Mn [2]. Buzatu y otros (Rumania) obtuvieron dióxido de manganeso electrolítico de alta pureza mediante procesos electrolíticos [13]. Sadeghi y otros (Portugal) evaluaron la posibilidad del uso de microondas o ultrasonido para asistir la lixiviación de Zn y Mn [14]. Rácz y Ilea (Rumania) recuperaron Zn y Mn a partir de baterías agotadas de Zn-C, alcanzando recuperaciones mayores al 99% para el Zn y Mn durante la electrodeposición [15].
Existen diversos procesos de recuperación de Mn y Zn por vía hidrometalúrgica. Sin embargo, la introducción de materiales a base de carbono tales como telas, fieltros y carbono vítreo como electrodos en la recuperación de Zn y Mn esta aun por estudiarse. Más aún, es necesario evaluar el comportamiento de estos materiales en los procesos electroquímicos en la recuperación de metales, tema aún no explorado.
EXPERIMENTAL
Materiales y reactivos
Se empleó como material de partida un conjunto de pilas alcalinas agotadas tipo D de diferentes marcas provenientes de residuos sólidos domésticos. Se empleó ácido sulfúrico de grado analítico con una pureza del 98% distribuido por Quiminet, y sulfato de manganeso de grado analítico.
Se emplearon como ánodos telas y fieltros de grafito de la marca Mitsubishi. Éstos fueron seleccionados debido a la relativamente alta densidad de corriente (1.5 a 3.0 A/dm2) que puede aplicarse sin pasivar o elevar el sobrepotencial del electrodo.
Desarmado de las Pilas
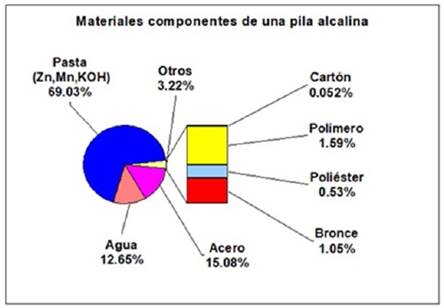
Se recolectaron 17 pilas alcalinas tamaño D de diversas marcas. Se desmantelaron las pilas alcalinas tamaño D, por procedimientos mecánicos, separándose el blindaje, los contactos y el separador. Esto se realizó con la finalidad de obtener una pasta activa con los materiales que forman el cátodo y ánodo de la pila (polvo de color oscuro). Esta pasta activa fue secada en horno a temperaturas menores y próximas a 100°C para evaporar el contenido de agua. De la diferencia de peso se dedujo que el conjunto de pilas tiene una humedad del 12.65% (304.15 g de agua). Posteriormente, la pasta seca se pulverizó y se pasó por un tamiz No. 80 (escala normalizada de tamices Tyler) obteniéndose de esta manera 1659.15 g (69.02%) de pasta con un tamaño de partícula inferior a 175µ (0.175mm=80 mallas). Esta pasta pulverizada fue el material base para elaborar el trabajo de investigación posterior.
Los materiales remanentes tales como: el recubrimiento protector ó blindaje (acero = 15.08%), el anillo aislante separador de polos (polímero =1.59%), el diafragma separador (poliéster = 0.53%), la barra colectora (bronce = 1.05% Cu-Zn) y las envolturas (cartón =0.052%), no fueron de interés para este estudio. Por lo tanto, fueron descartados. La figura 1 muestra la proporción de materiales presentes en una pila alcalina tamaño D, obtenida durante la investigación realizada.
Para la caracterización de la pasta activa (polvo oscuro) se empleó un difractómetro de rayos-X, marca Philips PW 1710, operado con ánodo de cobre (CuK-α,), monocromador curvo de grafito operado a 45 KV y 30 mA. Se tomó una muestra representativa de la pasta activa la cual fue homogenizada, secada y tamizada por malla N° 200 de la serie Tyler. Se emplearon 50 g de muestra para la respectiva caracterización.
La pasta activa se refiere al material obtenido de la etapa de desarmado de las pilas y está principalmente constituida por el material anódico y catódico de una pila alcalina.
Lixiviación de la pasta
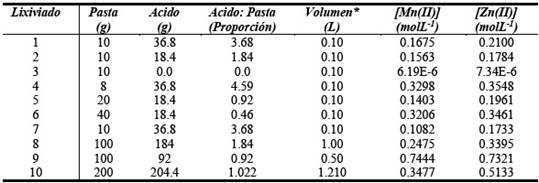
El objetivo del proceso de lixiviación es el de pasar los elementos metálicos de interés presentes en la pasta al estado de iones solubles, por medio de un solvente químico acuoso (0.5 M de H2SO4). El método empleado fue lixiviación en un tanque cerrado con agitación a temperatura constante. Se realizaron 10 lixiviaciones variando la cantidad de pasta de las pilas y la cantidad de ácido sulfúrico añadido. Las proporciones utilizadas para la lixiviación se presentan en la Tabla 1. Primero, se preparó la solución de ácido sulfúrico. Esta solución fue añadida a la pasta extraída de las pilas que fue introducida en un vaso de pp de 1000 mL. Luego, se realizó la lixiviación en el vaso de pp cerrado con agitación a temperatura constante. Se emplearon diferentes proporciones de pasta/ácido con la finalidad de determinar las eficiencias elevadas en las extracciones de Mn y Zn. El procedimiento de lixiviación más óptimo fue alcanzado en la lixiviación N° 9 con una relación 1:1 (Peso de pasta: Peso de ácido). La pasta activa fue lixiviada con ácido sulfúrico en un reactor tipo Bach entre 70 y 90 °C.
Las distintas soluciones de lixiviación se muestran en la Tabla N° 1, en donde se observa que se realizaron 10 pruebas con diferentes proporciones de pasta activa y ácido sulfúrico.
Se determinaron las condiciones óptimas de extracción de zinc y manganeso con ácido sulfúrico, analizándose las soluciones resultantes por Espectrometría de Masas con Plasma Acoplado Inductivamente (ICP-MS) (SHIMADSZU ICP-OES/MS 1000 III). La espectrometría de masas con plasma acoplado inductivamente ICP-MS es altamente sensible y capaz de determinar de forma cuantitativa casi todos los elementos presentes en la tabla periódica que tengan un potencial de ionización menor que el potencial de ionización del argón a concentraciones muy bajas (nanogramo/litro o parte por trillón, ppt). Se basa en el acoplamiento de un método para generar iones (plasma acoplado inductivamente) y un método para separar y detectar iones (espectrómetro de masas).
La muestra de 10 mL, en forma líquida, es transportada por medio de una bomba peristáltica hasta el sistema nebulizador donde es transformada en aerosol gracias a la acción del gas argón. Dicho aerosol es conducido a la zona de ionización que consiste en un plasma generado al someter un flujo de gas argón a la acción de un campo magnético oscilante inducido por una corriente de alta frecuencia. En el interior del plasma se pueden alcanzar temperaturas de hasta 8000°K, en estas condiciones los átomos presentes en la muestra son ionizados. Los iones pasan al interior del filtro cuadripolar a través de una interface de vacío creciente, allí son separados según su relación carga/masa. Cada una de las masas sintonizadas llegan al detector donde se evalúa su abundancia de la muestra.
Electrodeposición de dióxido de manganeso electrolítico
La electrodeposición de dióxido de manganeso electrolítico se efectuó sobre materiales de carbono tales como telas de fibra de carbono. Se empleó como electrodo de trabajo ánodos de tela de fibra de carbono en los distintos lixiviados. Las condiciones de operación durante la electrodeposición fueron: tiempo de acondicionamiento de 15 segundos a 2V, para facilitar la impregnación del electrodo de tela de fibra de carbono con el lixiviado, y tiempo de deposición 5 horas, potencial de 1.4 V (para ECS). Los ensayos se realizaron en un potenciostato PAR modelo 273A, comandado por una computadora personal con un software de investigación electroquímica M/270.
La electrodeposición de manganeso en el lixiviado N° 10, se realizó en un reactor electrolítico de 250 mL. En 200 mL de lixiviado N° 10 se introdujo el ánodo de tela de fibra de carbono GC-16 como electrodo de trabajo, y como contra-electrodo se empleó un electrodo de plomo. Se empleó un electrodo de calomel saturado (ECS) como electrodo de referencia. Se conectaron los electrodos al potenciostato, y se ingresaron los datos de tiempo de deposición de 5 horas, el voltaje de celda de 1.4 V, y la densidad de corriente de 0.0025 A/cm2.
Para la electrodeposición sobre telas de grafito, se cortaron telas de fibra de grafito en forma rectangular con un área de 0.90 cm2. La deposición de compuestos de manganeso sobre telas de fibra de carbono, se realizó bajo condiciones normales.
Caracterización electroquímica de lixiviados por voltametría cíclica
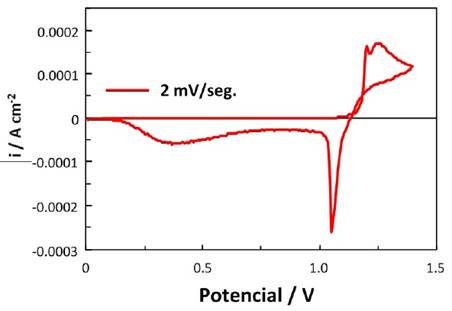
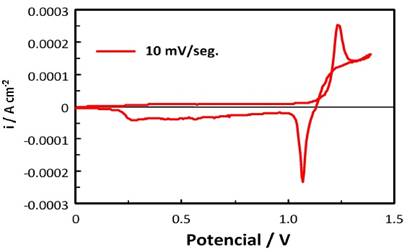
Se estudió el comportamiento de un electrodo de carbono vítreo [16] en los lixiviados N°5 y N° 7, por voltametría cíclica [17-24] en un rango de potenciales 0 a 1.4 V (ECS). Los lixiviados fueron diluidos al 50% cuidando de que el pH no sea mayor a 0.5.
Las voltametría cíclica se realizó en un reactor electrolítico de 250 mL. Se introdujo 200 mL de lixiviado N°5. Luego, se introdujo el ánodo de carbono vítreo como electrodo de trabajo. Como contra-electrodo, se empleó un electrodo de platino. Se empleó como electrodo de referencia un electrodo de calomel saturado (ECS). Se conectaron los electrodos al potenciostato, se ingresaron los datos de voltaje de celda de 1.4 V para una velocidad de barrido de 2mV/seg, y densidad de corriente de 0.0025 A/cm2. Se realizó un tiempo de acondicionamiento de 15 segundos a 2V para facilitar la impregnación del electrodo de carbono vítreo con el lixiviado. Los ensayos se realizaron en un potenciostato PAR modelo 273A, comandado por una computadora personal con un software de investigación electroquímica M/270. Los ensayos de voltametría cíclica se efectuaron en un intervalo de potencial entre 0 y 1.4V (SCE).
Caracterización de los depósitos obtenidos
La morfología superficial de los óxidos de manganeso formados sobre telas de grafito fue revelada por microscopía electrónica de barrido (SEM). El microscopio electrónico de barrido utilizado fue un JEOL -100 modelo JSM-35CF con una intensidad del haz de electrones de 15 kV, equipado con un espectrómetro, EDAX 9600, que permite realizar medidas de energía dispersiva. La identificación de las especies de óxidos de manganeso formado, se realizó mediante difracción de rayos-X. Se empleó un difractómetro de rayos-X Philips PW 1710 con ánodo de cobre, monocromador curvo de grafito, operado a 45Kv y 30 mA.
RESULTADOS Y DISCUSIONES
Presencia de metales en la pasta activa
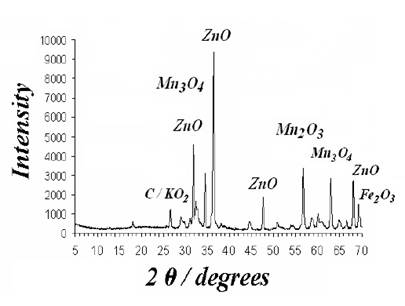
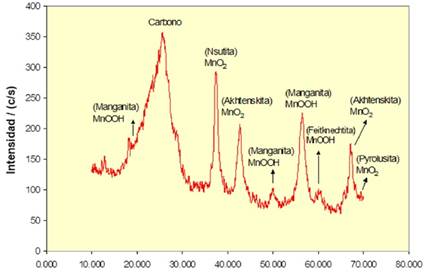
La caracterización de la pasta inicial (polvo oscuro) por difracción de rayos-X determinó la presencia de ZnO, Mn3O4, KFeO2, Fe2O3, carbón y K2O. El espectro de difracción se puede observar en la Figura 2. Los componentes mayoritarios son los óxidos de manganeso y de zinc. Los óxidos de hierro probablemente provienen de las partículas que se desprendieron del blindaje durante la ruptura de las pilas. La presencia de K2O (óxido de potasio) se atribuye a la reacción de KOH con el oxígeno y puede ocurrir durante los pasos de desmantelamiento pulverizado y secado de la pasta de las pilas [12].
Lixiviación de la pasta activa
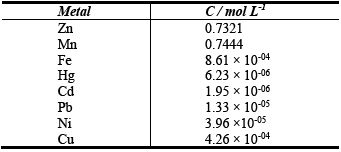
En las soluciones de lixiviado de la pasta activa se detectó Zn y Mn como principales componentes, bajas concentraciones de Fe y Cu, y trazas de Hg, Cd, Pb y Ni en todas las muestras analizadas.
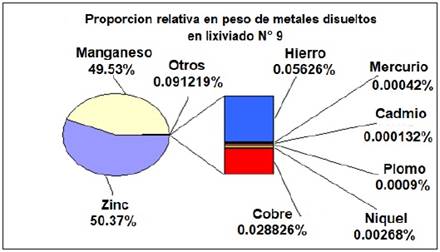
La Tabla 1 muestra las proporciones de pasta/ácido utilizadas para cada lixiviación y los resultados de las concentraciones de Zn y Mn obtenidas. La máxima extracción de zinc y manganeso se obtuvo en el lixiviado N° 9 alcanzando una concentración de 0.7321 moles L-1 para el Zn(II) y de 0.7444 moles L-1 para el Mn(II), manteniendo un volumen constante de la fase liquida de 500ml, con una relación [H2SO4]/[pasta] de 1:1 en peso. También se puede observar que la concentración de ácido utilizado influye directamente sobre la solubilidad del manganeso. La figura N° 3 muestra los porcentajes relativos de los metales disueltos en el lixiviado N° 9.
La tabla 2 muestra las concentraciones de los metales extraídos utilizando las condiciones óptimas de lixiviación para la pasta activa. Estas concentraciones fueron medidas por medio del análisis por espectroscopia de plasma inducido (ICP-MS). Las concentraciones del lixiviado N° 9 son parecidas a valores reportados en literatura para los metales más comunes presentes en una solución de lixiviación con ácido sulfúrico [12,25]. Se puede apreciar tanto en la tabla No. 2 como en la Figura 3, que son llamativas las altas concentraciones de manganeso que se solubilizan probablemente como MnSO4. No puede descartarse la reducción de los óxidos con zinc residual o con el hidrógeno resultante de la corrosión del mismo [12].
El comportamiento electroquímico de las distintas soluciones se realizó por voltametría cíclica, en el rango de potenciales de 0 y 1.4 V (ECS). En el barrido anódico se observó una pequeña onda correspondiente a la oxidación de Fe2+ a Fe3+, y un pico pronunciado a 1.2 V, que corresponde a la oxidación de Mn2+ a MnO2. En el barrido catódico se observaron varios picos de reducción del óxido de manganeso, y una pequeña onda debida a la reducción de Fe3+. Los voltamogramas de las Fig. 4 y 5 muestran el comportamiento electroquímico de un electrodo de carbono vítreo en los lixiviados N° 5 y lixiviado N° 7 . Se observa que en los procesos de deposición del manganeso en que el rango de potencial considerado no se modifica en forma apreciable, el cambio más notable se produce en la reducción de los óxidos de manganeso depositados ( γ-MnO2 y γ-MnOOH).
Caracterización electroquímica del lixiviado por voltametría cíclica
La deposición del dióxido de manganeso electrolítico (DME) se lleva a cabo en una solución fuertemente ácida, y en ausencia de otros metales, las principales reacciones de deposición son las siguientes [12,25]:
Paúl y Cartwright [20-22,26-28] han propuesto un modelo para reacciones electroquímicas en presencia de iones Mn (II):
En este mecanismo se distinguen 3 pasos: el primer paso (ecuación 3) y el tercer paso (ecuación 5) son reacciones electroquímicas, mientras que el segundo paso (ecuación 4) es una reacción química. Por lo tanto, estas reacciones corresponden a un modelo [29] de reacción Electroquímica - Química - Electroquímica (EQE). En general, la reacción es controlada por difusión de los iones Mn+2 a través del MnOOH, que forma una capa pobremente conductora que se comporta como un semiconductor. El ion Mn+3 obtenido en la ecuación (3) puede descomponerse en Mn+2 y Mn+4 tal como se puede observar en la ecuación (6) para bajas concentraciones de ácido [1,30].
Caracterización de los depósitos de DME obtenidos en electrodos de grafito.
Se obtuvo MnO2 electrolítico [31] bajo condiciones potenciostáticas utilizando como ánodos telas de fibra de carbono [32,33]. El material resultante se caracterizó por microscopía electrónica de barrido y difracción de rayos X. Se encontró que estaba compuesto por MnO2 y MnOOH. No se detectó la presencia de impurezas provenientes del lixiviado.
Los resultados de microscopia electrónica de barrido (SEM) muestran que el MnO2 obtenido sobre telas de grafito (Fibra de carbono), tienen depósitos muy uniformes y aparecen encapsulando las fibras de carbón. La Figura 6 muestra un crecimiento cilíndrico del MnO2 causado posiblemente por la distribución uniforme de la corriente. La fractura de los depósitos muestra una estructura fibrosa (ver Fig. 6).
Los puntos nodulares que se observan en la figura de la derecha corresponden a los puntos de nucleación y crecimiento de los depósitos de óxido de manganeso, para un tiempo de 5 horas. La velocidad de deposición es razonable, sin embargo, el tiempo de deposición dependerá de la concentración del manganeso en el lixiviado.
Figura 5. Voltamograma obtenido empleando electrodo de carbono vítreo en lixiviado N° 7 con una concentración de 0.108M [Mn+2], para una velocidad de barrido de 10mV/seg.
Caracterización de los depósitos de DME obtenidos en electrodos de grafito.
Se obtuvo MnO2 electrolítico [31] bajo condiciones potenciostáticas utilizando como ánodos telas de fibra de carbono [32,33]. El material resultante se caracterizó por microscopía electrónica de barrido y difracción de rayos X. Se encontró que estaba compuesto por MnO2 y MnOOH. No se detectó la presencia de impurezas provenientes del lixiviado.
Los resultados de microscopia electrónica de barrido (SEM) nos muestran que el MnO2 obtenido sobre telas de grafito (Fibra de carbono), tienen depósitos muy uniformes y aparecen encapsulando las fibras de carbón. La Figura 6 muestra un crecimiento cilíndrico del MnO2 causado posiblemente por la distribución uniforme de la corriente. La fractura de los depósitos muestra una estructura fibrosa (ver Fig. 6).
Los puntos nodulares que se observan en la figura de la derecha corresponden a los puntos de nucleación y crecimiento de los depósitos de óxido de manganeso, para un tiempo de 5 horas. La velocidad de deposición es razonable, sin embargo, el tiempo de deposición dependerá de la concentración del manganeso en el lixiviado. Los espectros de difracción de rayos-X (DRX) confirman la presencia de dióxido de manganeso electrolítico, γ-MnO2, y manganita, γ-MnOOH, como las especies de óxidos de manganeso [27] presentes en los depósitos obtenidos sobre las telas de fibra de carbono (ver Figura. 7). Los óxidos de manganeso presentes en el sustrato podrían ser empleados como material anódico de una pila alcalina debido a que no se observan impurezas presentes en los respectivos sustratos de carbono.
CONCLUSIÓN
Es factible recuperar manganeso a partir de lixiviados ácidos de pilas agotadas aún a temperatura ambiente. Las condiciones óptimas de lixiviación de los metales de Zn y Mn a partir de pilas en desuso son para una relación 1:1 (w/w) de pasta activa(g) a Ácido sulfúrico(g), a 70 °C, y durante 2 horas. Se encontró un máximo rendimiento de extracción para Zn y Mn de 50.69 % y 49.80 %, respectivamente. Las condiciones de electrodeposición fueron 1.4 V, y tiempo de 5 horas a temperatura ambiente, alcanzando eficiencias de deposición mayores al 100%. Esto confirma que él óxido obtenido es una mezcla de óxidos de manganeso. Los ensayos de voltametría cíclica muestran que a mayor concentración de Mn la velocidad de barrido disminuye.

Figura 6 Micrografía del MnO2 obtenido por deposición potenciostática sobre ánodo de tela de grafito GC-16 en lixiviado N°10 (0.347M Mn+2), luego de 5 horas a 1.4V (ECS). La figura de la izquierda con una magnificación de 2600X, y la de la derecha con una magnificación de 400X.











 uBio
uBio