Revista Boliviana de Química
versión On-line ISSN 0250-5460
Rev. Bol. Quim vol.36 no.2 La Paz jun. 2019
ARTÍCULOS ORIGINALES COMPLETOS
Síntesis directa de eter dimetílico de syngas. Parte I: preparación de los catalizadores
bifuncionales de CuO-ZnO / HZSM-5 por síntesis sucesiva y mezcla física
Direct synthesis of dimethyl ether from syngas. Part I: preparation of bifunctional
Cuo-ZnO/HZSM-5 catalysts by successive sinthesis and physical mixture
Dayana M. Capcha Vargas 1,*, Ronald M. Lara Prado 1, Yamil Acho Sarzuri 2, Saul Cabrera 1,2, Luis López 1,2.
1 Department of Chemical Sciences, Instituto de Investigaciones Químicas IIQ, Laboratorio de Ciencia de Materiales, School of Pure and
Natural Sciences FCPN, Universidad Mayor de San Andrés UMSA, P.O. Box 303, Calle Andrés Bello s/n-Edificio IIQ,
Ciudad Universitaria Cota Cota, Phone +59122795878, La Paz, Bolivia, http://cienciasquimicas.umsa.bo/
*Corresponding author: dmcapcha@gmail.com
2 Department of Chemical Sciences, Instituto del Gas Natural IGN, School of Pure and Natural Sciences FCPN, Universidad
Mayor de San Andrés UMSA, P.O. Box 303, Calle Andrés Bello s/n-Edificio IIQ, Ciudad Universitaria
Cota Cota, Phone +59122795878, La Paz, Bolivia, http://cienciasquimicas.umsa.bo/
Received: 06/04/2019 Accepted: 06/22/2019 Published: 06/30/2019
Abstract
The direct synthesis of dimethylether (DME) from synthesis gas (CO + H2) requires bifunctional catalysts type CuO-ZnO/HZSM-5, where the CuO-ZnO performs the synthesis of methanol by its hydrogenation activity and the HZSM-5 zeolite performs the dehydration of methanol by its acid activity. In this work, two methods of preparation of the bifunctional catalyst are compared: by successive synthesis (catalyst name CuO-ZnO/S-HZSM-5) and by physical mixture (catalyst name CuO-ZnO/HZSM-5). For this purpose, CuO-ZnO, HZSM-5 and silicalite were first prepared and characterized. In the preparation of the bifunctional catalyst CuO-ZnO/S-HZSM-5, silicalite (S) was incorporated to favor the growth of crystals with MFI-like structure (Zeolite Socony Mobil - FIVE).. All catalysts were characterized by the technique of X-ray diffraction, reduction at programmed temperature and desorption of NH3 at programmed temperature. The crystallinity of CuO in the CuO-ZnO, CuO-ZnO / S-HZSM-5 and CuO-ZnO-HZSM-5 catalysts was 67%, 49% and 64%, respectively. The maximum reduction temperature found for the CuO-ZnO / S-HZSM-5 was 306 °C, which differs from the bifunctional catalyst by physical mixing CuO-ZnO-HZSM-5 which was 282 °C, this change is related to the crystallinity of CuO, at a lower crystallinity of CuO; higher its reduction temperature. The CuO-ZnO / S-HZSM-5 catalyst has a Brönsted acidity equal to 0.37mol NH3/kg comparable to the acidity of pure zeolite HZSM-5 (0.41mol NH3/kg), while the CuO-ZnO- catalyst HZSM-5 has a lower Brönsted acidity, equal to 0.25mol NH3/kg.
Keywords. Bifunctional catalyst, CuO-ZnO, HZSM-5, successive synthesis, physical mixture.
Resumen
La síntesis directa de dimetiléter a partir de gas de síntesis (CO + H2) requiere de catalizadores bifuncionales tipo CuO-ZnO/HZSM-5, donde el CuO-ZnO realiza la síntesis de metanol dada su función de hidrogenación y la zeolita HZSM-5 realiza la deshidratación de metanol dada su función ácida. En este trabajo se comparan dos métodos de preparación del catalizador bifuncional; por síntesis sucesiva (catalizador con el nombre CuO-ZnO/S-HZSM-5) y por mezcla física (catalizador con el nombre CuO-ZnO/HZSM-5). Para ello, primero se preparó y se caracterizó CuO-ZnO, HZSM-5 y silicalita. En la preparación del catalizador bifuncional CuO-ZnO/S-HZSM-5 se incorporó silicalita (S) para favorecer el crecimiento de cristales con estructura tipo MFI ((Zeolite Socony Mobil - FIVE). Todos los catalizadores fueron caracterizados mediante las técnicas de difracción de rayos X, reducción a temperatura programada y desorción de NH3 a temperatura programada. La cristalinidad de CuO en los catalizadores CuO-ZnO, CuO-ZnO/S-HZSM-5 y CuO-ZnO-HZSM-5 fue de 67%, 49% y 64%, respectivamente. La temperatura máxima de reducción encontrada para el CuO-ZnO/S-HZSM-5 fue de 306°C, que difiere del catalizador bifuncional por mezcla física CuO-ZnO-HZSM-5 que fue de 282°C, este cambio tiene relación con la cristalinidad de CuO, a menor cristalinidad de CuO; mayor su temperatura de reducción. El catalizador CuO-ZnO/S-HZSM-5 presenta una acidez de Brönsted igual a 0,37mol NH3/kg comparable con la acidez de zeolita pura HZSM-5 (0,41mol NH3/kg), mientras el catalizador CuO-ZnO-HZSM-5 tiene una acidez de Brönsted menor, igual a 0,25mol NH3/kg.
Palabras clave. Catalizador bifuncional, CuO-ZnO, HZSM-5, síntesis sucesiva, mezcla física.
INTRODUCCIÓN
El proceso de síntesis directa de dimetiléter a partir de gas de síntesis requiere de catalizadores bifuncionales con función de hidrogenación para la síntesis de metanol, típicamente CuO-ZnO, y función ácida para la deshidrogenación de metanol, típicamente zeolita protonada HZSM-5. Para la preparación de los catalizadores bifuncionales se suelen emplear mezclas físicas de CuO-ZnO y HZSM-5 previamente sintetizadas, ya que se trata de un método simple que le permite ser aplicado a mayor escala con facilidad [1,2]. No obstante, existen trabajos que proponen el empleo de otros métodos de preparación como por ejemplo la coprecipitación de las sales precursoras de CuO-ZnO sobre la zeolita ZSM-5, seguidos de su calcinación para dar lugar al catalizador bifuncional CuO-ZnO/HZSM-5 [3,4]. En todo caso, mediante la preparación de los catalizadores bifuncionales se debería lograr un balance adecuado entre los centros activos de ambos componentes, así como una adecuada proximidad entre los mismos [5].
En el presente trabajo reportamos la preparación del catalizador bifuncional CuO-ZnO/S-HZSM-5, en el cual se incorpora silicalita (S) para favorecer el crecimiento de cristales con estructura MFI [6], por coprecipitación y síntesis sucesiva. También se reporta el catalizador bifuncional de mezcla física CuO-ZnO-HZSM-5 obtenido por mezcla de CuO-ZnO y HZSM-5, molienda en mortero y posterior prensado. Las propiedades de ambos catalizadores bifuncionales, así como las de los catalizadores CuO-ZnO y HZSM-5, son analizadas por difracción de rayos X, reducción a temperatura programada y desorción de NH3 a temperatura programada. Los resultados son comparados y discutidos.
RESULTADOS Y DISCUSIÓN
Difracción de Rayos X
a) Síntesis de CuO-ZnO
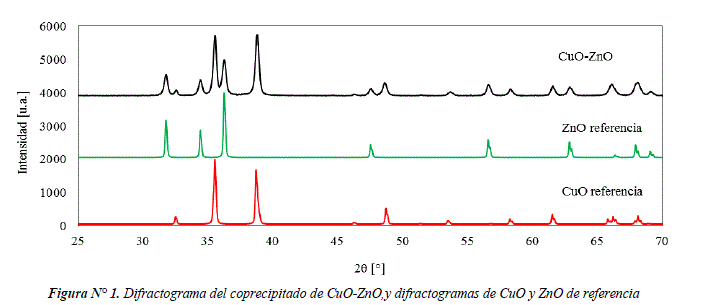
En la figura Nº 1 se presenta el difractograma de CuO-ZnO sintetizada por el método de coprecipitación, las señales encontradas corresponden a las señales de referencia de CuO (PDF 00-048-1548) evidenciado por las reflexiones en 2θ =38,68°; 58,30° y a las señales de ZnO (PDF 01-079-2205) con 2θ=47,57°; 56,62°. Se observa señales en los rangos de 2θ=31-33° y 2θ=34-37° que indican el solapamiento de señales de CuO y ZnO. Por último, el coprecipìtado de CuO-ZnO tiene una cristalinidad de 67% en comparación con la cristalinidad de CuO (Fluka, purum; >98%).
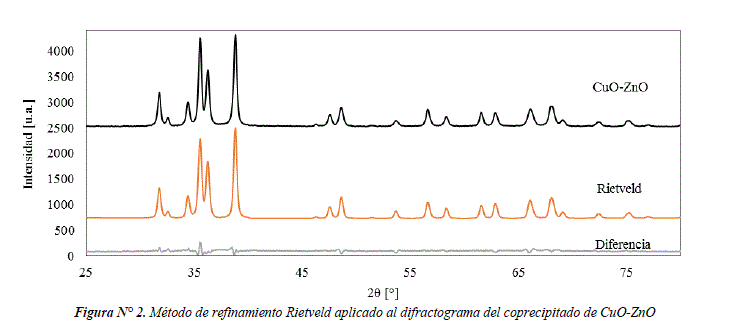
En la figura Nº 2 se compara el difractograma experimental del coprecipitado de CuO-ZnO con el difractograma obtenido por el método de refinamiento Rietveld. La diferencia de las señales entre ambos difractogramas es del 3%. A partir del método de refinamiento Rietveld se obtiene la siguiente composición: 66±2% de CuO y 34±1% de ZnO. Estos resultados están de acuerdo a la composición nominal utilizada para el coprecipitado de CuO-ZnO i.e. 66,7% CuO y 33,3% ZnO en peso.
b) Síntesis de Silicalita y HZSM-5
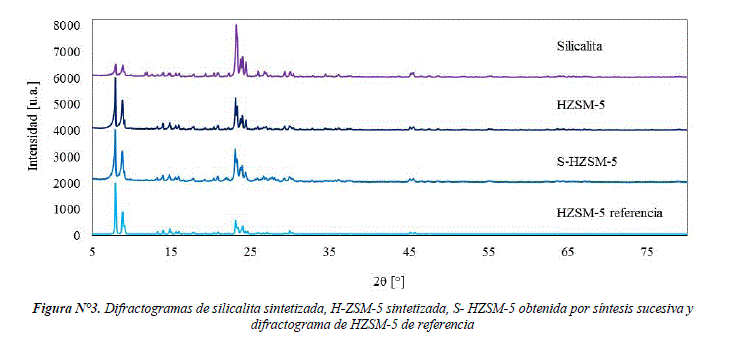
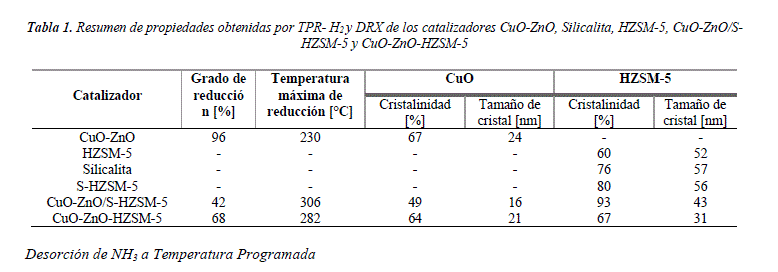
Los difractogramas de: silicalita sintetizada, HZSM-5 sintetizada y Silicalita-HZSM-5 (S-HZSM-5) obtenido por síntesis sucesiva, son presentados en la figura Nº 3. Las señales de las 3 zeolitas corresponden con el difractograma de HZSM-5 referencial (PDF 00-042-0024) en las señales principales de 2θ = 7,92°; 8,94°; 23,18°; 24,42°, los cuales corresponden a la estructura MFI. En comparación con la cristalinidad de la zeolita ZSM-5 comercial se obtienen los siguientes valores de cristalinidad para las 3 zeolitas sintetizadas: 60% para la silicalita, 76% para HZSM-5 y 80% para S-HZSM-5.
c) Catalizador bifuncional de síntesis sucesiva: CuO-ZnO/S-HZSM-5
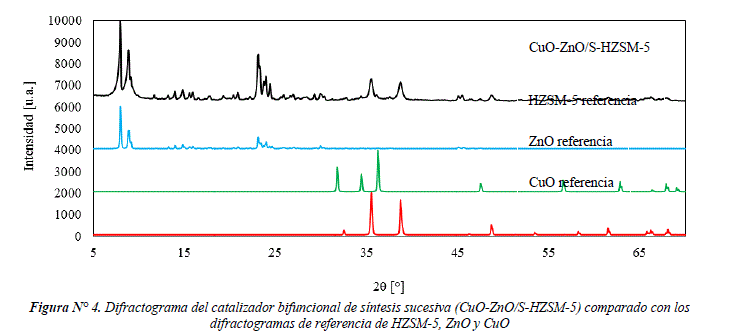
En la figura Nº 4 se presenta el difractograma del catalizador CuO-ZnO/S-HZSM-5, comparado con los difractogramas de referencia de HZSM-5, ZnO y CuO. Las principales señales encontradas corresponden a las señales de HZSM-5 (PDF 00-042-0024) evidenciado por las señales en 2θ = 7,92°; 8,94°; 23,18°; 24,42° que corresponden a la estructura MFI. Por otro lado, se encuentran las señales claramente definidas de CuO (2θ = 35,58°; 38,70°; 49,05°). También se observan señales de ZnO (2θ = 31,90°; 34,75°), la baja intensidad de estas señales podría ser debido por la dispersión en silicalita y/o en HZSM-5. La cristalinidad de CuO en el catalizador CuO-ZnO/S-HZSM-5 es de 49% comparado con la cristalinidad de CuO (Fluka). Finalmente, la cristalinidad de HZSM-5 en el catalizador CuO-ZnO/S-HZSM-5 es de 93% comparado con la cristalinidad de la zeolita ZSM-5 comercial.
d) Catalizador bifuncional de mezcla f ísica: CuO-ZnO-HZSM-5
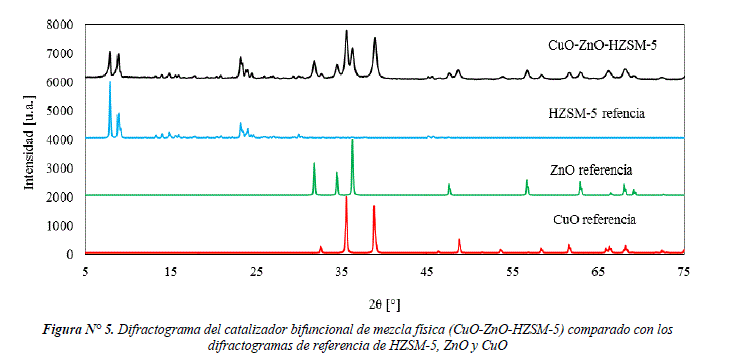
En la Figura Nº 5 se presenta el difractograma del catalizador CuO-ZnO-HZSM-5, comparado con los difractogramas de referencia de HZSM-5, ZnO y CuO. Las principales señales encontradas corresponden a las señales de CuO (evidenciado por las señales en 2θ = 35,58°; 38,70°; 49,05°) y ZnO (2θ = 31,90°; 34,50°; 36,39°; 47,84°; 56,56°). Por otro lado, se encuentran las señales en menor intensidad de HZSM-5 (PDF 00-042-0024) evidenciado por las señales en 2θ = 7,92°; 8,94°; 23,18°; 24,42° que corresponden a la estructura MFI. La cristalinidad de CuO en el catalizador CuO-ZnO-HZSM-5 es de 64% comparado con la cristalinidad de CuO (Fluka). Finalmente, la cristalinidad de HZSM-5 en el catalizador CuO-ZnO-HZSM-5 es de 67% comparado con la cristalinidad de la zeolita ZSM-5 comercial.
El catalizador CuO-ZnO/S-HZSM-5 presenta mayor intensidad en las señales (2θ = 7,92°; 8,94°; 23,18° y 24,42°) que corresponden a la estructura MFI, comparado con el catalizador CuO-ZnO-HZSM-5. Esto podría estar relacionado con la presencia de silicalita en el catalizador CuO-ZnO/S-HZSM-5, de tal manera que las señales de silicalita y HZSM-5 se adicionan intensificando las señales. Por otro lado, la cristalinidad (64%) de CuO en el catalizador CuO-ZnO-HZSM-5 es mayor comparado con la cristalinidad (49%) en el catalizador CuO-ZnO/S-HZSM-5, esta diferencia podría estar relacionada con el método de preparación. En el método de síntesis sucesiva, se provoca una dispersión de CuO-ZnO en la silicalita y en la zeolita HZSM-5, disminuyendo las señales de reflexión de CuO.
Reducción a Temperatura Programada
a) Coprecipitado CuO-ZnO
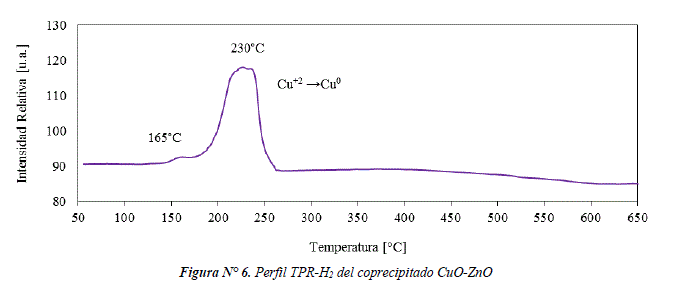
Se analizó el comportamiento de la reducción del coprecipitado de CuO-ZnO a partir de los perfiles TPR-H2, figura Nº 6. La señal de reducción en el rango de temperaturas 150–260 °C se atribuye a la reducción de CuO en un paso (Ec.1) esto de acuerdo con la temperatura de reducción del CuO igual a 230°C [7]. El grado de reducción de CuO es del 97%. También se observa un pequeño hombro en el rango de 150-170°C, que se podría atribuir a una fracción de CuO disperso en la superficie de partículas de ZnO [8]. Finalmente, no se observa señales de la reducción de ZnO, las cuales normalmente ocurren en el rango 600-800°C [9].
CuO + H2 → Cu + H2O (Ec.1)
b) Catalizador CuO-ZnO/S-HZSM-5
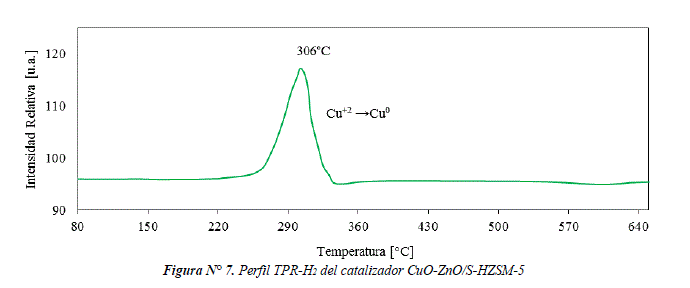
El perfil de reducción del catalizador CuO-ZnO/S-HZSM-5 se presenta en la figura Nº 7. La señal de reducción en el rango de temperaturas 255-338°C corresponde a la reducción de CuO, la temperatura máxima de reducción igual a 306°C, es más alta que la encontrada en el coprecipitado CuO-ZnO (ver figura Nº 6). Esto podría estar relacionado con la menor cristalinidad (49%) que presenta el CuO en el catalizador CuO-ZnO/S-HZSM-5 en comparación con la cristalinidad (67%) del coprecipitado de CuO-ZnO, en conformidad con el reporte en bibliografía acerca la relación entre cristalinidad y temperatura máxima de reducción [3].
c) Catalizador CuO-ZnO-HZSM-5
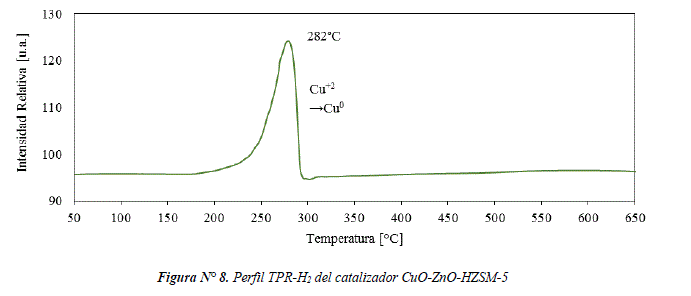
El perfil de reducción del catalizador CuO-ZnO-HZSM-5 se presenta en la figura Nº 8. La señal de reducción en el rango de temperaturas 192-300°C corresponde a la reducción de CuO, la temperatura máxima de reducción, igual a 282°C es más alta que la encontrada en el coprecipitado de CuO-ZnO (ver figura Nº 6). Este efecto podría estar relacionado del mismo modo que en el catalizador CuO-ZnO/S-HZSM-5, respecto a la relación de cristalinidad y temperatura de reducción.
En la Tabla 1, se puede observar que el catalizador CuO-ZnO-HZSM-5 tiene un mayor grado de reducción que el catalizador CuO-ZnO/S-HZSM-5, lo cual tiene un efecto positivo ya que requiere menor cantidad de energía para reducir el CuO.
a) Silicalita
La figura Nº 9 muestra el perfil de TPD-NH3 de Silicalita, que presenta señales en el rango de temperatura de 100°C-470°C. Este rango de temperaturas indica interacciones débiles entre NH3 con grupos silanoles de la silicalita[10].
b) Zeolita HZSM-5
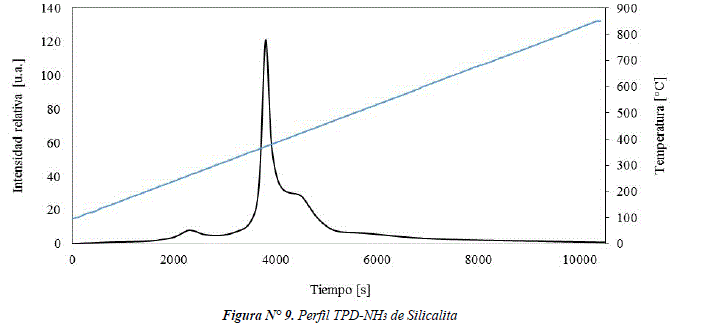
La figura Nº 10 muestra el perfil de TPD-NH3 de la zeolita HZSM-5, que presenta señales en el rango de temperaturas de 100°C-850°C. Después de realizar un análisis de deconvolución se asignan cuatro señales denominadas I, II, III y IV. Las señales I y II podrían ser interacciones débiles, debido a la desorción física de NH3 de especies NH4+nNH3 y/o desorción de NH3 de grupos silanoles [10-11]. La señal III puede corresponder a la desorción de NH3 desde sitios ácidos tipo Brönsted, donde protones ácidos compensan la deficiencia de carga de los átomos de Al en la estructura marco (Si-OH-Al) [12]. Finalmente, la señal IV podría atribuirse a la desorción de NH3 desde sitios ácidos tipo Lewis, provocados por los átomos de Al fuera de la estructura marco denominados Al extra-framework [13].
En la Tabla 2 se observa que la mayor cantidad de desorción de NH3 de la zeolita HZSM-5 corresponde a sitios ácidos tipo Brönsted, lo cual indica que la mayoría de los átomos de Al se encuentran dentro la estructura marco de la zeolita y en menor proporción como Al extra-framework. Normalmente los sitios ácidos tipo Brönsted son buenos sitios activos para aplicaciones catalíticas, por ejemplo, para la deshidratación de metanol [14,15].
c) Catalizador bifuncional de síntesis sucesiva: CuO-ZnO/S-HZSM-5.
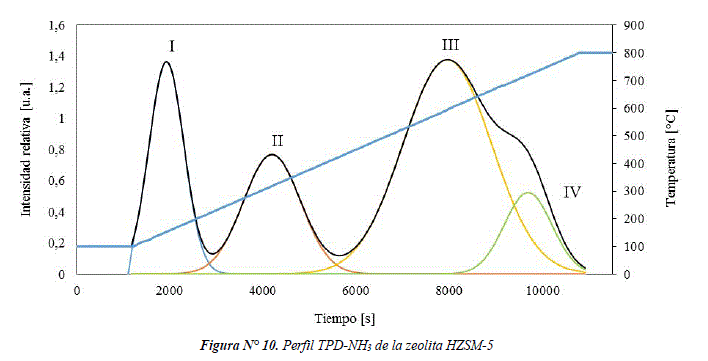
La Figura Nº 11 muestra el perfil de TPD-NH3 del catalizador CuO-ZnO/S-HZSM-5, que presenta señales en el rango de temperatura de 100-380°C, que pueden ser asignadas a la desorción física de NH3 de especies NH4+nNH3 y/o desorción de NH3 de grupos silanoles [11] de la zeolita y la silicalita, también podría ser causada por la adsorción de NH3 sobre el coprecipitado CuO-ZnO. Después del análisis de deconvolución, la señal asignada como III (450-630°C) puede corresponder a la desorción de NH3 desde sitios ácidos tipo Brönsted y la señal IV (630-792°C) puede atribuirse a sitios ácidos tipo Lewis, provenientes de la HZSM-5.
La mayor cantidad desorbida de NH3 en el catalizador CuO-ZnO/S-HZSM-5 corresponde a interacciones débiles (ver Tabla 2), esto se puede justificar por la presencia de silicalita, que contribuye con la adsorción de NH3. Por otro lado, el catalizador CuO-ZnO/S-HZSM-5 tiene similar cantidad de sitios ácidos Brönsted que la zeolita HZSM-5, lo cual indica que el método de síntesis sucesiva preserva las propiedades ácidas en el catalizador final. Del mismo modo que en la zeolita HZSM-5, se obtiene mayor cantidad de sitios ácidos tipo Brönsted, comparado a sitios ácidos tipo Lewis.
d) Catalizador bifuncional de mezcla física: CuO-ZnO-HZSM-5.
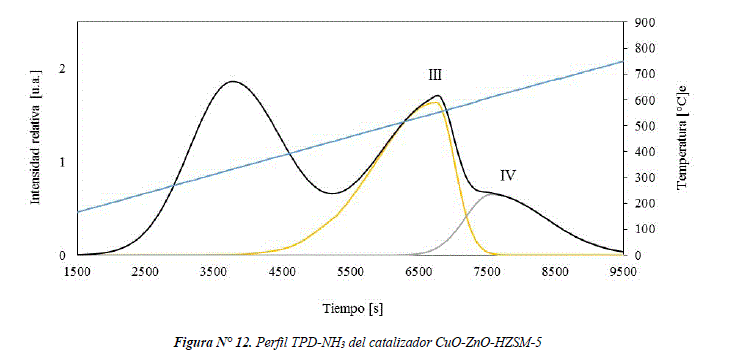
La Figura Nº 12 muestra el perfil de TPD-NH3 del catalizador CuO-ZnO-HZSM-5, que presenta una señal en el rango de temperatura de 230-425°C relacionada con interacciones débiles, que podrían ser asignados a la desorción física de NH3. La señal asignada como III (460-590°C) podría ser asignado como sitio ácido tipo Brönsted y la señal IV (590-725°C) correspondería a la desorción de NH3 desde sitios ácidos tipo Lewis.
El catalizador CuO-ZnO/S-HZSM-5 presenta mayores interacciones débiles con NH3 comparado a las interacciones fuertes con sitios ácidos (Brönsted y Lewis), como se muestra en la Tabla 2. Esto podría estar relacionado con la presencia de silicalita, que aporta en las interacciones débiles con NH3 como se vio en la figura Nº 9. Mientras que en el catalizador CuO-ZnO-HZSM-5 las interacciones débiles con NH3 son similares a las interacciones fuertes con sitios ácidos (Brönsted y Lewis).
El catalizador CuO-ZnO/S-HZSM-5 tiene mayor cantidad de sitios ácidos Brönsted y Lewis (equivalente a 0,49 moles NH3/kg muestra) comparado al catalizador bifuncional de mezcla física (equivalente a 0,35 moles NH3/kg muestra), como se muestra en la Tabla 2. Esto podría tener relación con el método de preparación de los catalizadores. Así, en el método de mezcla física al mezclar el coprecipitado CuO-ZnO y HZSM-5 en polvo, molienda en mortero y luego prensarlo, existe la posibilidad de colapso de poros de la zeolita HZSM-5 por la presión mecánica ejercida y con ello disminuir el acceso a sitios ácidos.
CONCLUSIÓN
En el presente artículo, se describieron las propiedades de los catalizadores CuO-ZnO, HZSM-5 y catalizadores bifuncionales de síntesis sucesiva CuO-ZnO/S-HZSM-5 y mezcla física CuO-ZnO-HZSM-5. Para el CuO-ZnO, el método de coprecipitación mantiene la relación inicial de 66% CuO y 34% ZnO en el producto final. El método de síntesis sucesiva da como resultado silicalita, HZSM-5 y S-HZSM-5 con una cristalinidad de 60%, 76% y 80%, respectivamente. El catalizador CuO-ZnO/S-HZSM-5 presenta una disminución en la cristalinidad de CuO, comparado al coprecipitado de CuO-ZnO lo cual aumenta la temperatura máxima de reducción. Por otro lado, en el catalizador bifuncional CuO-ZnO/S-HZSM-5 se mantienen los sitios ácidos tipo Brönsted, comparado a la zeolita pura HZSM-5. Por último, el catalizador bifuncional CuO-ZnO-HZSM-5 obtenido por mezcla en polvo y prensado presenta principalmente cambios en la cristalinidad de CuO y HZSM-5 los cuales influyen en la temperatura máxima de reducción y disminuyen levemente los sitios ácidos tipo Brönsted y Lewis. Las propiedades de grado de reducción y acidez de Brönsted encontrados en los catalizadores bifuncionales podrían ser adecuados para aplicaciones catalíticas. Así el catalizador coprecipitado de CuO-ZnO será evaluado, en una segunda parte de este estudio de próxima publicación, en la reacción de síntesis de metanol a partir de gas de síntesis; el catalizador zeolítico HZSM-5 será evaluado en la reacción de deshidratación de metanol y los catalizadores bifuncionales CuO-ZnO/S-HZSM-5 y CuO-ZnO-HZSM-5 serán evaluados en la síntesis directa de dimetiléter a partir de gas de síntesis.
EXPERIMENTAL
Síntesis de catalizadores
Coprecipitación de CuO-ZnO
Se utilizaron soluciones acuosas de los correspondientes nitratos metálicos: 0.6 M de Cu(NO3)2·3H2O y 0.3 M de Zn(NO3)2·6H2O, estas soluciones se mezclaron simultáneamente en un vaso de precipitados, posteriormente se añadió una solución acuosa de 1 M de Na2CO3 como agente precipitante. La coprecipitación se llevó a cabo a 70 oC hasta llegar a pH final de 7, se dejó en envejecimiento durante 1 hora a la misma temperatura. Seguidamente, el precipitado se filtró y lavó con un exceso de agua desionizada, para llevarlo a secar a 100 oC durante 1 hora. Finalmente, fue calcinado a 450 oC durante 5 horas (rampa térmica de 5 oC /min), dando lugar al catalizador de síntesis de metanol.
Síntesis de silicalita
Se siguió el método propuesto por Guohui Yang et al [16]. La composición molar de la mezcla reactiva fue: 0,48TPAOH:2TEOS:8EtOH:120H2O:0,24HNO3, y se dejó en agitación por 6 horas a temperatura ambiente, luego se traspasó la mezcla a una bomba hidrotermal para realizar la síntesis a 180°C por 24h. Después se la filtró y lavó con un exceso de agua desionizada, para llevarla a sequedad a 100 oC durante 1 hora. Finalmente fue calcinada a 500 oC durante 5 horas (rampa térmica de 5 oC /min).
Síntesis de HZSM-5
Se siguió el método propuesto por Guohui Yang et al [16]. La composición molar de la mezcla reactiva fue: 0,48TPAOH:2TEOS:8EtOH:120H2O:0,025Al2O3, y se dejó en agitación por 6 horas a temperatura ambiente, luego se traspasó la mezcla a una bomba hidrotermal para realizar la síntesis a 180°C por 24h. Después se la filtró y lavó con un exceso de agua desionizada, para llevarla a sequedad a 100 oC durante 1 hora. Finalmente fue calcinada a 500 oC durante 5 horas (rampa térmica de 5 oC /min).
Catalizador Bifuncional CuO-ZnO/S-HZSM-5 por síntesis sucesiva
Se preparó una mezcla reactiva con la misma composición molar descrita en la síntesis de silicalita, a la cual se añadió el coprecipitado de CuO-ZnO y se dejó en agitación por 6 horas a temperatura ambiente. La relación másica nominal de silicalita:CuO-ZnO fue de 2:1. Se traspasó la mezcla a una bomba hidrotermal a 180°C por 24h, para después filtrarla y lavarla con un exceso de agua desionizada. Paralelamente, se preparó una mezcla reactiva de los precursores de HZSM-5, en la misma relación molar descrita en la síntesis de HZSM-5, a la cual se añadió el producto obtenido de silicalita y CuO-ZnO. La nueva mezcla se traspasó a una bomba hidrotermal a 180°C por 72h y fue filtrada y lavada con un exceso de agua desionizada, para llevarla luego a sequedad a 100 oC durante 1 hora. Finalmente, se la calcinó a 500 oC durante 5 horas (rampa térmica de 5 oC /min).
Catalizador Bifuncional CuO-ZnO-HZSM-5 por mezcla física
Se mezcló físicamente el coprecipitado de CuO-ZnO y la zeolita HZSM-5 en una relación másica de 2:1, respectivamente. Se homogenizó con un mortero y luego se prensa a 0,2 toneladas/cm2.
Caracterización
Difracción de rayos X
Los catalizadores preparados se caracterizaron por difracción de rayos X (DRX) mediante un difractómetro Panalitycal con radiación Cu y detector XCelerator. El tubo de rayos X fue operado en 40 mA y 40 kV. El rango de 2θ fue de 5-80° con un tamaño de paso de 0.026 °. El grado de cristalinidad de la zeolita ZSM-5 se calculó utilizando el área de las señales en 2θ=22-25° [17] y para el CuO la señal de 2θ=38° [18]. El tamaño promedio de los cristalitos se estimó utilizando la ecuación de Scherrer, con la señal más intensa. Se realizó el refinamiento de los datos por el método Rietveld usando el programa Xpert High Score.
Reducción a Temperatura Programada -TPR-H2
Se utilizó el equipo ChemBET Quantachrome para la técnica TPR-H2. Se colocó un peso conocido de la muestra en la celda de análisis, luego se desgasificó a 200 °C. Posteriormente, se realizó el cambio de He gaseoso por 5% H2/N2 (25 ml/min) y finalmente se calentó a 850 °C en una rampa térmica de 5 °C/min. Las señales se registraron con un detector tipo TCD.
Desorción de NH3 a temperatura programada -TPD-NH3
Se utilizó el equipo ChemBET Quantachrome para la técnica TPD-NH3. El procedimiento común que se utilizó es el siguiente: en la celda de análisis se colocó un peso conocido de la muestra y luego se desgasificó a 200 °C con flujo de He (15 ml/min). Posteriormente, se realizó el cambio del gas de He por 5% de NH3/He, para la adsorción de NH3 durante 1 hora a 100 °C. Finalmente, el flujo de gas se cambió a He (15 ml/min) programado a 100 °C por 1h para eliminar NH3 fisisorbidos. Finalmente se calentó a 850 °C a una rampa térmica de 5 °C/min. Las señales se registraron con un detector tipo TCD. Este procedimiento se siguió para la zeolita HZSM-5 y silicalita. Para los catalizadores bifuncionales, después de la desgasificación se redujo los catalizadores con 5% H2/N2 y rampa térmica de 5°C/min hasta llegar a la temperatura máxima de reducción y se mantuvo por 30 min, luego se cambió el flujo de gas por He y se dejó por 1 hora para activar la zeolita. Posteriormente, se retomó el procedimiento desde la adsorción de NH3 y se continuó con el análisis TPD-NH3.
AGRADECIMIENTOS
Los investigadores expresan su agradecimiento a The World Academy of Sciences TWAS por el financiamiento dell proyecto Renewable energy and fuels for the transportation sector y a Swedish International Development Cooperation Agency SIDA por el financiamiento del proyecto Energía e Hidrocarburos para el Desarrollo Sostenible, en los cuales se halla inmersa la presente investigación. Al Ing. Mario Blanco, Instituto de Investigaciones Geológicas y del Medio Ambiente IGEMA-UMSA, por la realización de los análisis de difracción de rayos X.
REFERENCIAS
1. Mao, D., Yang, W., Xia, J., Zhang, B., Song, Q., 2005, Highly effective hybrid catalyst for the direct synthesis of dimethyl ether from syngas with magnesium oxide-modified HZSM-5 as a dehydration component, Q. Chen. J. Catal. 230, 140-149. [ Links ]
2. Moradi, G.R., Ahmadpour, J., Nazari, M., Yaripour, F., 2008, Effects of Feed Composition and Space Velocity on Direct Synthesis of Dimethyl Ether from Syngas, Ind. Eng. Chem., 47(20), 7672-7679. [ Links ]
3. Khoshbin, R., Haghighi, M., 2014, Direct Conversion of Syngas to Dimethyl Ether as a Green Fuel over Ultrasound- Assisted Synthesized CuO-ZnO-Al2O3/HZSM-5 Nanocatalyst: Effect of Active Phase Ratio on Physicochemical and Catalytic Properties at Different Process Conditions, Catalysis Science and technologies, 6. [ Links ]
4. Nie, R., Lei. H., Pan, S., Wang, L., Fei, J., Hou, Z., 2012, Core–shell structured CuO–ZnO@H-ZSM-5 catalysts for CO hydrogenation to dimethyl ether, Fuel, 96, 419-425. [ Links ]
5. Bonura G., Cordaro M., Cannilla C., Mezzapica A., Spadaro L., Arena F., Frusteri F., 2013, Catalytic behaviour of a bifunctional system for the one step synthesisof DME by CO2 hydrogenation, Catalysis Today, 228, 51-57. [ Links ]
6. Yang, G., Montree, T., Vitidsant, T., Yoneyama, Y., Tan, Y., Tsubaki, N., 2011, A double-shell capsule catalyst with core–shell-like structure for one-step exactly controlled synthesis of dimethyl ether from CO2 containing syngas, Catalysis Today, 171, 229– 235. [ Links ]
7. Fierro, G., Lo Jacono, M. , Inversi, M., Porta, P., Cioci, F. Lavecchia, R., 1996, Study of the reducibility of copper in CuO-ZnO catalysts by temperature-programmed reduction, Applied Catalysis A: General, 137, 327-348. [ Links ]
8. Fierro, G., Lo Jacono, M., Inversi, M., Porta, P., Cioci, F. Lavecchia, R., 1994, A study of anomalous Temperature-Programmed Reduction profiles of Cu2O, CuO, and CuO-ZnO Catalyst, Journal of Catalysis, 148, 709-721. [ Links ]
9. Liang, M., Kang, W., Xie, K., 2009, Comparison of reduction behavior of Fe2O3, ZnO and ZnFe2O4 by TPR technique, Journal of Natural Gas Chemistry, 18, 10–113. [ Links ]
10. Hidalgo, C.V., Itoh, H., Hattori, T., Miki, N., Murakami, Y., 1984, Measurement of the Acidity of Various Zeolites by Temperature- Programmed Desorption of Ammonia, Journal of Catalysis, 85, 362-369. [ Links ]
11. Takeuchi, M., Tsukamoto, T., Kondo, A., Matsuoka, M., 2015, Investigation of NH3 and NH4+ adsorbed on ZSM-5 zeolites by near and middle infrared spectroscopy, Catalysis Science and technologies, DOI: 10.1039/c5cy00753d. [ Links ]
12. Lonyi, F., Valyon, J., 2001, On the interpretation of the NH3-TPD patterns of H-ZSM-5 and H-mordenite, Microporous and Mesoporous, 47, 293-301. [ Links ]
13. Karge, H.G., Ohlmann, G., Pfeifer, H., Fricke ,R.,1991, Studies in Surface science and catalysis, Catalysis and adsortion by zeolites, Elservier, 65, 133. [ Links ]
14. Fu, Y., Hong, T.O, Chen, J., Auroux, A., Shen, J., 2005, Surface acidity and the dehydration of methanol to dimethyl ether, Thermochimica Acta, Elservier, 434, 22-26. [ Links ]
15. Bandiera, J., Naccache, C., 1991, Kinetics of methanol dehydration on dealuminated H-mordenite: Model with acid and basic active centres, Applied Catalysis, Elservier, 69, 139-148. [ Links ]
16. Yang, G., Tsubaki, N., Shamoto, J, Yoneyama, Y., Zhang, Y., 2010, Confinement Effect and Synergistic Function of H-ZSM-5/ Cu-ZnO-Al2O3 Capsule Catalyst for One-Step Controlled Synthesis, J. Am. Chem. Soc., 132,23. [ Links ]
17. Aguilar-Mamani, W., García, G., Hedlund, J., Mouzon, J., 2014, Comparison between leached metakaolin and leached diatomaceous earth as raw materials for the synthesis of ZSM-5, SpringerPlus, 3, 292. [ Links ]
18. Saedya, S., Haghighia, M., Amirkhosrow, A., 2012, Hydrothermal synthesis and physicochemical characterization of CuO/ZnO/Al2O3 nanopowder. Part I: Effect of crystallization time, Particuology, 10, 729– 736. [ Links ]












 uBio
uBio