Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Boliviana de Química
On-line version ISSN 0250-5460
Rev. Bol. Quim vol.35 no.5 La Paz 2018
FULL ORIGINAL ARTICLES
Determination of the total antioxidant capacity, total phenols, and the enzymatic activity in a non-diary beverage based on grains of chenopodium quinoa
Determinación de la capacidad antioxidante total, fenoles totales, y la actividad enzimática en una bebida no láctea en base a granos de chenopodium quinoa
Alejandra P. Rioja Antezana1,*, Beatriz E. Vizaluque1, Enzo Aliaga-Rossel2, Leslie Tejeda1,2, Olof Book2, Patricia Mollinedo1,2, J. Mauricio Peñarrieta1,2
1Laboratorio de Química de Alimentos. Carrera de Ciencias Químicas, Facultad de Ciencias Puras y Naturales FCPN, Universidad Mayor de San Andrés UMSA, P.O. Box 303, Calle Andrés Bello s/n, Ciudad Universitaria Cota Cota, Tel. +59122795878, La Paz, Bolivia, www.umsa.bo
2SWEBOL Biotech AB, Scheelevägen 22 22363 Lund, Sweden, www.swebol.com
*Corresponding author: a.rioja87@gmail.com
Received 12 18 2018 Accepted 12 25 2018
Abstract
Due to its numerous nutritional properties, the quinoa grain, constitutes an excellent altemative for its use as raw material in the elaboration of a non-dairy beverage. These grains are rich in phenolic compounds and dietary fiber, minerals such as calcium, iron and zinc, fundamental in physiological and biochemical functions of the human body.
Antioxidants are molecules capable of preventing or slowing down the oxidation of biological molecules such as proteins, lipids and nucleic acids. They are of vital importance for the prevention of the action of free radicals on the organism; decreasing oxidative processes, slowing the aging process and preventing the development of various diseases.
The antioxidant compounds present in food can be classified as vitamins, carotenoids, phenolic compounds and others. Along with vitamins, phenolic compounds are considered important antioxidant components in foods such as fruits, vegetables, tubers and cereals.
The objective of the present study was to measure the beneficial antioxidant components and the enzymatic activity in the non-dairy drink based on quinoa.
For the determination of antioxidant molecules in general, the ABTS and FRAP standardized methods that measure Total Antioxidant Capacity (TAC) were used. For the determination of phenolic compounds, the Folin Ciocalteu method was used.
The Miller (DNS) method was used to measure the activity of the added a-amylase and the amylases present in the non-dairy beverage by means of the determination of reducing sugars (maltose) produced by the hydrolysis of the starch present in the grains of quinoa.
All the methods used in the present work were adjusted and adapted to the nature of the sample to obtain reliable results.
Keywords: Quinua, Bebida no láctea de origen vegetal, Antioxidantes, a-amilasa.
Resumen
El grano de quinua, debido a sus numerosas propiedades nutricionales, constituye una excelente alternativa para su uso como materia prima en la elaboración de una bebida no láctea. Estos granos son ricos en compuestos fenólicos y fibra dietaria, minerales como calcio, hierro y zinc, fundamentales en funciones fisiológicas y bioquímicas del cuerpo humano.
Los antioxidantes son moléculas capaces de prevenir o retardar la oxidación de moléculas biológicas como proteínas, lípidos y ácidos nucleicos. Son de vital importancia para la prevención de la actuación de los radicales libres sobre el organismo; disminuyendo los procesos oxidativos, retardando el proceso de envejecimiento y previniendo el desarrollo de diversas enfermedades.
Los compuestos antioxidantes presentes en alimentos pueden ser clasificados como vitaminas, carotenoides, compuestos fenólicos y otros. Junto a las vitaminas, los compuestos fenólicos son considerados importantes componentes antioxidantes, en alimentos como frutas, vegetales, tubérculos y cereales.
El objetivo del presente estudio fue realizar la medición de componentes antioxidantes beneficiosos presentes y la actividad enzimática en la bebida no láctea a base de quinua.
Para la determinación de moléculas antioxidantes en general, se utilizaron los métodos estandarizados ABTS y FRAP que miden la Capacidad Antioxidante Total (TAC). Para la determinación de compuestos fenólicos se utilizó el método de Folin Ciocalteu.
El método de Miller o DNS fue utilizado para la medición de la actividad de la a-amilasa añadida y las amilasas presentes en la bebida no láctea por medio de la determinación de azucares reductores (maltosa) producidos por la hidrólisis del almidón presente en los granos de quinua.
Todos los métodos utilizados en el presente trabajo fueron ajustados y adaptados a la naturaleza de la muestra para la obtención de resultados fiables.
INTRODUCCIÓN
Debido a los problemas de salud derivados del consumo de leche vacuna como, la intolerancia a la lactosa, reacciones alérgicas a algunas proteínas de la leche, hinchazón, indigestión y celiaquía, existe una tendencia mundial hacia el consumo de productos sustitutivos. Dichos problemas también han desalentado el incremento de ganado vacuno y la consecuente deforestación para terrenos de pastoreo. Por ello, surgen nuevas alternativas de alimentación más saludable como el vegetarianismo y el veganismo, incrementándose la producción y el consumo de las llamadas "leches vegetales", producidas a partir de cereales como, por ejemplo, arroz (Oryza sativa), soja (Glycine max), avena (Avena sativa) y frutos como las almendras (Prunus dulcís, Bertholletia excelsa) y el coco (Cocos nucífera) entre otros [1].
El creciente interés por adoptar una dieta saludable y la prevención de enfermedades a través de la alimentación, abre paso al estudio de los componentes nutricionales y su actividad en los procesos bioquímicos en el organismo humano. Esta tendencia brinda una gran oportunidad para el desarrollo de nuevos productos a partir de alimentos que crecen en nuestro territorio, tales como la quinua [2].
Los antioxidantes son compuestos químicos naturales en muchas variedades de plantas y alimentos, pero también pueden ser sintéticos. Tienen la propiedad de retrasar la oxidación de un sustrato oxidable por medio de varios mecanismos como la quelación de radicales libres y la intercepción de oxígeno libre. Los antioxidantes sintéticos han sido usados como aditivos alimentarios por décadas con el fin de mantener la calidad de los productos, previniendo la degradación de lípidos [2].
La peroxidación de lípidos comienza cuando un ácido graso poliinsaturado libera radicales libres debido a la influencia de luz UV, calentamiento o catálisis metálica, por ejemplo. Los radicales libres luego forman radicales peroxi, junto a otros compuestos radicales y peróxidos. La hipótesis concerniente a los compuestos antioxidantes es que previenen la oxidación debido a su capacidad de atrapar radicales libres y retardar la peroxidación lipídica, reduciendo de esta forma el daño celular por inhibición de la oxidación de lipoproteína de baja densidad y protegiendo el ADN. Las vitaminas E y C, junto a compuestos fenólicos, son los principales antioxidantes que encontramos en alimentos de origen vegetal. La capacidad antioxidante de compuestos fenólicos está basada en su habilidad de acomplejar radicales libres [2].
La quinua (Chenopodium quinoa), pseudocereal originario de los Andes, es una planta resistente a condiciones extremas de clima y radiación, gozando de una extraordinaria adaptabilidad la cual ha favorecido la expansión de su cultivo a cerca de 70 países incluyendo Francia, Inglaterra, Suecia, Dinamarca, Holanda e Italia que la cultivan debido a su alto valor nutricional con potenciales beneficios para la salud [3]. La quinua no pertenece a la familia de las Gramíneas como los cereales más consumidos a nivel mundial; trigo, cebada y centeno, y a diferencia de éstos, se constituye en un alimento muy accesible y adecuado para la gente que sufre intolerancia al gluten y celiaquía, ya que contiene mínimas cantidades de prolamina [4].
La quinua es una buena fuente de vitamina E y vitaminas de complejo B (riboflavina folato y tiamina), y de minerales como el sodio, calcio, magnesio, potasio, fósforo, hierro y zinc. Tiene un alto contenido de fibra dietética. En cuanto a su perfil lipídico, contiene principalmente ácidos grasos poliinsaturados (ácido linoleico) seguido de ácidos grasos monoinsaturados (ácido oleico) [5-9].
El mayor componente en los granos de quinua son los carbohidratos, que varían en un rango de 67-74% del peso seco. El almidón está presente en un rango de 52-60% del total de carbohidratos. El almidón se localiza en el perisperma de los granos y puede estar presente en unidades simples o en agregados esféricos. La cantidad de anulosa va alrededor del 11%, que, en comparación a otros cereales, es una fracción más baja; por ejemplo, el arroz contiene un 17%, la cebada contiene 22% y el trigo va alrededor del 26% [4]. Los diámetros de los gránulos de almidón son menores a los granulos de maíz reportados (l-23 µm) o aquellos del trigo (2-40 µm) [4].
Los granulos de almidón de menor tamaño requieren una mayor temperatura de gelatinización, en la quinua 57 a 64° C. Otros carbohidratos encontrados en los granos de quinua en pequeñas cantidades son monosacáridos (2%), disacáridos (2,3%), fibra cruda (2,5-3,9%) y pentosas (2,9-3,6%) [4].
La quinua es una buena fuente de proteínas y contiene un buen balance proteico; su contenido en lisina es excepcionalmente alto. El aminoácido lisina no es abundante en vegetales. El contenido proteico de los granos es de 14-20%, particularmente ricos en aminoácidos esenciales como lisina y metionina, y que es en promedio, un superior al de cereales como el arroz, trigo y la cebada. En los granos andinos como la quinua, las globulinas y las albúminas constituyen la mayor fracción proteica (44-77% de la proteína total), que es mayor a la fracción de prolaminas (0,5-7%) [4]. Además de la riqueza proteica, los granos de quinua tienen altos contenidos de fitosteroles y escualeno, que son compuestos que ayudan a reducir niveles de colesterol [5-9]. Tienen un alto grado de digestibilidad con efecto prebiótico. Tienen un índice glucémico bajo, lo que le otorga propiedades glucorregulatorias. Aporta beneficios hipocolesterolémicos ejerciendo un efecto de protección contra enfermedades cardiovasculares. Adicionalmente, la quinua tiene efectos anti-tumorales, por lo que puede jugar un rol importante contra algunos tipos de cáncer, como el cáncer de colon. Tiene también propiedades antiinflamatorias y antianémicas [5-9].
En los últimos años la quinua ha ido ganando mercado y por lo tanto se ha incrementado la producción nacional, debido a la calidad de sus propiedades nutricionales. Sin embargo, a partir del año 2015, la sobreoferta de quinua en el mercado internacional ha hecho que los precios de la quinua sufran una apreciable baja. (Informe FAO con datos FAOSTAT, 2011), ocasionando una disminución en la exportación nacional. Esta delicada situación, nos obliga a investigar el desarrollo de productos elaborados con valor agregado, y mantener al país como el segundo productor originario de quinua.
Los alimentos funcionales se definen como aquellos que tiene componentes fisiológicamente activos y que proveen beneficios, tanto en lo nutricional, como en lo terapéutico. Cada día es mayor la investigación interdisciplinaria para determinar los componentes químicos que tienen efectos positivos en la salud, así como las fuentes alimentarias disponibles [10]. Tal es el caso de las bebidas vegetales, conocidas como "leches vegetales".
En general, las bebidas vegetales elaboradas a partir de nueces, almendras y otros frutos secos son emulsiones en las que las grasas contenidas en estos frutos son dispersadas en una fase acuosa. El resto de los componentes juegan distintos papeles en la estabilidad del producto. En el caso de la quinua, que tiene un bajo porcentaje de grasas, ésta debe ser emulsionada con pequeñas proporciones de aceite vegetal. Las diferentes etapas del proceso de elaboración de la bebida no láctea a base de quinua, como la homogenización, los tratamientos térmicos y especialmente la actividad enzimática usualmente producen cambios estructurales en los componentes, por lo que se modifica el color y el tamaño de la partícula de quinua, la viscosidad y la estabilidad de la bebida [11].
Con todos los antecedentes mencionados, es necesario proponer productos alimenticios con valor agregado desde el campo de la ciencia y la investigación que puedan impactar en el mercado local e internacional con posibilidades de patentes nacionales e internacionales y realizar estudios en el producto final. En ese sentido ha sido desarrollada una bebida de quinua no láctea con patente de invención SP-0025-2016/P147180002BO; PCT/EP2018/052512 y que se encuentra en fase de desarrollo de mercado (www.drinkquiny.com). Existe la posibilidad en el mercado nacional de introducir este nuevo producto nutritivo a niños en edad preescolar y escolar como un suplemento y refuerzo alimenticio para su desarrollo y crecimiento. Puede ser una buena alternativa para niños sanos, y también a los intolerantes a la lactosa, intolerantes al gluten entre otros.
En el presente trabajo se realizó la medición de componentes antioxidantes beneficiosos presentes y la actividad enzimática en la bebida no láctea a base de quinua por métodos estandarizados ABTS y FRAP los cuales miden la Capacidad Antioxidante Total (TAC). Para la determinación de compuestos fenólicos se utilizó el método de Folin Ciocalteu.
Se utilizó el método de Miller (DNS) para la medición de la actividad de la a-amilasa añadida y las amilasas presentes en la bebida no láctea por medio de la determinación de azucares reductores (maltosa) producidos por la hidrólisis del almidón presente en los granos de quinua.
EXPERIMENTAL
Reactivos
El reactivo Folin-Ciocalteu, ácido gálico, carbonato de sodio, ABTS [2,2'-azino-bis(3-etilbenzotiazolina-6-ácido sulfónico)], persulfato de potasio, Trolox (6-hidroxi-2,5,7,8-tetrametilchroman-2-ácido carboxilico, 97%), TPTZ (2,4,6-tripiridil-s-triazina), cloruro férrico, fosfato monobásico de sodio, cloruro de sodio, almidón de papa, hidróxido de sodio, tartrato de sodio y potasio tetrahidratado, ácido 3,5-Dinitrosalicílico, D(+) maltosa monohidrato fueron obtenidos de Sigma-Aldrich (St. Louis, USA), etanol absoluto de J.T. Baker (México DF, México)
Bebida no láctea
La bebida no láctea de origen vegetal es un producto autorizado, obtenido bajo el procedimiento protegido legalmente bajo la patente pendiente de invención SP-0025-2018/P147180002BO; PCT/EP2018/052512.
Preparación de las muestras
Una vez preparada la bebida no láctea, se procede a dejarla reposar o en su defecto, centrifugarla para obtener el sobrenadante. El sobrenadante es separado del sedimento y refrigerado para la realización de los análisis. En caso de que el sobrenadante presentara turbidez, se procede a filtrarlo. Se realizan todos los análisis en la fase hidrofílica de la bebida.
Para los ensayos de actividad enzimática, se preparan dos muestras de bebida no láctea a base de quinua (BQ1 y BQ2) y a una de ellas se le adiciona a-amilasa en una concentración de 1 U/ml (BQ 1). Para ello, es necesario gelatinizar la bebida no láctea, calentándola a temperaturas de 60-65° C e incubando por un lapso de 30 minutos. Para la desactivación de la enzima, se calienta hasta ebullición. Luego de enfriar, se deja reposar o centrifugar para la obtención del sobrenadante.
MÉTODOS DE CAPACIDAD ANTIOXIDANTE TOTAL (TAC)
Las pruebas de actividad antioxidante se realizan con los sobrenadantes por los métodos estandarizados colorimétricos ABTS, FRAP. Ambos métodos se emplean por tener una cinética de determinación más rápida que permite ahorrar tiempo en comparación con otros métodos de determinación de la Capacidad Antioxidante Total.
ABTS
Este método se fundamenta en la cuantificación de la decoloración del radical ABTS+, debido a su reducción a ABTS por la acción de antioxidantes. El radical catiónico ABTS+ es un cromóforo verde azulado que absorbe a una longitud de onda de 734 nm y se genera por una reacción de oxidación del ABTS (2,2'-azino-bis- (3-etil benzotiazolin-6-sulfonato de amonio) con persulfato de potasio. De esta manera el grado de decoloración como porcentaje de inhibición del radical ABTS+está determinado en función a la concentración.
En el análisis se utilizaron 100 µL de la muestra y 1 mL de la solución del radical ABTS+. La solución del radical ABTS+ se preparó mezclando 5 ml de solución ABTS 7 [mM] con 88 µL de solución de persulfato de potasio 140 [mM], posteriormente se diluyó en buffer ácido acético-acetato de sodio (pH 5) hasta obtener una absorbancia de 0,7 nm aproximadamente. Las mediciones se realizaron a una longitud de onda de 734 nm a los 3 min de reacción y a temperatura ambiente. Se utilizó un lector multi-modal Cytation 3, marca BioTek (Vermont, USA). Los resultados se expresaron mediante la construcción de una curva patrón usando como antioxidante trolox (0-200 µmol/L) [12].
FRAP
El método FRAP se fundamenta en la reducción del hierro férrico (Fe+3) presente en el reactivo de FRAP hasta la forma ferrosa (Fe+2) por presencia de antioxidantes.
Reactivo FRAP: buffer ácido acético-acetato de sodio (pH 3,6), TPTZ (2,4,6-tri(2-piridil)-s-triazina) y FeCl3 Se genera una coloración azul, de intensa proporcionalidad a la capacidad reductora de la muestra (se genera un complejo ferroso-TPTZ) que puede cuantificarse por colorimetría (593nm) en base a un patrón de sulfato ferroso.
Para la lectura de las muestras se utilizaron 900 µL de solución FRAP, 30µL de muestra y 120µL de agua destilada. La solución FRAP está compuesta por 25 mi de solución buffer ácido acético-acetato de sodio (pH 3,6), 2,5 ml de solución 10 [mM] TPTZ diluida con HCl 40 [mM] y solución 20 [mM] FeCl3. Se determinó la absorbancia a una longitud de onda de 593 nm en un lector multi-modal Cytation 3, marca BioTek (Vermont, USA). Para cada lectura se tuvo en cuenta la lectura de la absorbancia de la muestra testigo. La absorbancia final de las muestras se comparó con la curva estándar de Trolox (100-1000 µmol/L) disuelto con etanol al 96% [12].
FENOLES TOTALES
El análisis se realizó por el método de Folin-Ciocalteu. Los compuestos fenólicos reaccionan con el reactivo de Folin-Ciocalteu en medio básico dando lugar a una coloración azul susceptible de ser determinada espectrofotométricamente a 765 nm. Este reactivo contiene una mezcla de wolframato sódico y molibdato sódico en ácido fosfórico, el ácido fosfomolibdotúngstico formado, de color amarillo, al ser reducido por los grupos fenólicos da lugar a un complejo de color azul intenso, cuya intensidad es la que medimos para evaluar el contenido en polifenoles.
Para la determinación de Fenoles Totales se mezclaron 50 µL de muestra, 1000 µL solución Folin-Ciocalteu (1:10 V/V) y 500 uL de carbonato de sodio (7,5 %). La mezcla se homogenizó y calentó a 45 °C por 30 minutos, se midió la absorbancia a 765 nm en un lector multi-modal Cytation 3, marca BioTek (Vermont, USA). La absorbancia final de cada muestra se comparó con una curva estándar de calibración de ácido gálico (40-200 mg/l) como se muestra en la tabla 6 [2].
ACTIVIDAD DE LA ALFA AMILASA
El DNS o Método de Miller es una técnica colorimétrica que emplea ácido 3,5 dinitrosalicílico para la hidrólisis de polisacáridos en una muestra.
Esta técnica sirve para cuantificar los azúcares reductores producidos durante una fermentación o para cuantificar los productos de una reacción enzimática.
El DNS reacciona únicamente con los azúcares reductores generando un producto coloreado. La intensidad del color, que se puede medir por espectrofotometría a 540 nm es proporcional a la concentración de azúcares reductores.
La enzima a-amilasa es utilizada para hidrolizar enlaces a de polisacáridos, como almidones y glicógeno. La enzima cataliza la amilólisis de almidón gelatinizado para la producción de azúcares reductores. Este procedimiento puede ser usado para la determinación de actividad de α-amilasa [13].
La determinación de reacción espectrofotométrica está basada en:
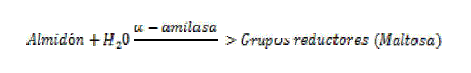
Definición de Unidad: Una Unidad liberará 1,0 mg de maltosa a partir del almidón en 3 minutos a pH 6,9 a 20° C. El método consiste en determinar el ΔA540 para cada prueba estándar vs. Blanco. ΔA540 (Standard) = A540 (Standard) - A540 (blanco) . Se preparó una curva estándar graficando el ΔA540 de los estándares vs. los mg de maltosa utilizando regresión lineal. De la misma manera, se preparó una curva estándar para determinar el ΔA540 de las muestras de almidón de quinua vs. el blanco de muestras. ΔA540 (Muestra) = A540 (Muestra) - A540 (Blanco muestra)
Análisis estadístico
Estándar de los valores obtenidos en el ensayo de actividad enzimática. Se realizaron siete ensayos. Los resultados fueron expresados como valores promedio con sus respectivos cálculos de desviación estándar (SD) de dos lecturas por triplicado en un lapso de siete días para los ensayos de Fenoles Totales, FRAP y ABTS. Todos los cálculos fueron hechos usando hojas de datos dentro del programa Excel. De la misma manera, se calcularon los promedios, desviaciones consecutivas modificando la concentración de enzima a adicionar.
RESULTADOS
Se determinó la capacidad Antioxidante Total de la bebida no láctea a base de quinua por medio de los métodos colorimétricos estandarizados FRAP y ABTS. La capacidad antioxidante total final de la bebida no láctea a base de quinua es 232.8 µmol TE/L según el método FRAP y 176.1 µmol TE/L por el método ABTS. Los valores más altos reportados son 244.4 µmol TE/L (FRAP) y 182.7 µmol TE/L (ABTS).
Se determinó también el contenido de Fenoles Totales en la bebida no láctea por el método Folin Ciocalteu. El promedio del contenido de Fenoles Totales en muestras de la bebida no láctea a base de quinuas trabajadas es de 393,4 mg GAE/g de muestra seca.
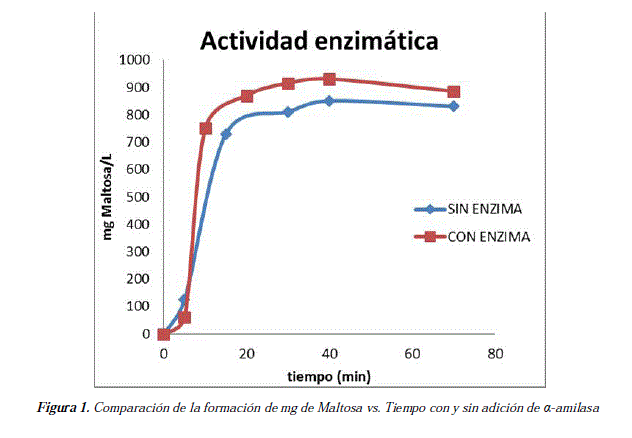
Se determinó la actividad enzimática de la a-amilasa por el método colorimétrico DNS en el que se pudo observar y cuantificar los mg de azúcares reductores formados, en este caso, los mg de maltosa. A partir de los mg de maltosa que se forman, se pudo calcular las Unidades de α-amilasa que son necesarias para hidrolizar el almidón en maltosa. Esta maltosa liberada mediante la catálisis de la α-amilasa, puede tener un potencial poder edulcorante en la bebida, lo que significa que se pueden encontrar azúcares originados a partir del almidón contenido en la quinua sin necesidad de añadirle ningún tipo de azúcar.
La bebida no láctea a base de quinua formulada tiene un alto contenido en antioxidantes y azúcares no adicionados, siendo una buena opción como complemento alimenticio para personas que no consumen la leche de vaca por enfermedad o por propia elección. Los valores obtenidos de actividad enzimática son graficados en la Figura 1.
DISCUSIÓN
Existen pocos trabajos reportados en literatura acerca del estudio de la capacidad antioxidante en productos no -lácteos, lácteos y similares, por lo tanto, el presente trabajo se constituye en una contribución importante en ese campo.
Los valores determinados de la Capacidad Antioxidante y contenido de Fenoles Totales a lo largo de este estudio sirven como parámetros a ser comparados con valores analizados en otro tipo de productos lácteos o similares, tanto de origen vegetal como animal. Lo que se quiere demostrar en este caso, son los beneficios nutricionales que aporta la quinua como materia prima óptima para el aporte a la dieta de compuestos tales como los antioxidantes, aparte de los ya conocidos.
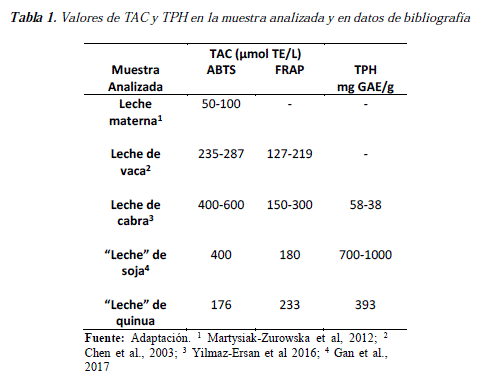
La Tabla 1 presenta un resumen de los valores obtenidos en literatura y los resultados obtenidos por los métodos ABTS y FRAP para la determinación de antioxidantes y los valores de Fenoles Totales obtenidos en el presente trabajo.
Si comparamos los valores de ABTS entre la leche materna [14] y los de la bebida no láctea a base de quinua, podemos llegar a la conclusión de que la quinua presenta un valor superior. Los valores de ABTS de la leche de vaca [15] son ligeramente más altos que los de la quinua, mientras que los de FRAP son superiores a la leche de vaca.
En la leche de cabra [16] se aprecia que los valores de ABTS son significativamente más altos, el valor de FRAP de la bebida no láctea a base de quinua se halla dentro del rango de los de la leche de cabra y por último los Fenoles Totales presentes en la bebida no láctea a base de quinua son significativamente mayores a los de la leche de cabra.
Finalmente, al comparar la bebida no láctea a base de quinua con otra bebida no láctea o leche de soja [17], podemos deducir que los valores de la quinua son menores por el método ABTS, mayores por el método FRAP y dentro del rango de fenoles totales, lo cual podría explicarse a que la quinua presenta otro tipo de compuestos antioxidantes en comparación con la soya.
De todas estas comparaciones, se puede observar que la bebida no láctea a base de quinua analizada constituye una buena fuente de compuestos antioxidantes. Además, [18] se demostró que el contenido de antioxidantes en leches vegetales puede ser extendido cuando éstas son sometidas a procesos de pasteurización y UHT.
En la determinación de la actividad enzimática de la α-amilasa por medio del método colorimétrico DNS se obtuvieron valores muy cercanos entre la muestra sin α-amilasa y la que contenía α-amilasa. Los resultados sugieren que al incluir α-amilasa en la preparación, la actividad del producto es más homogénea en la producción de maltosa, sugiriendo un producto más estable. Sin embargo, se puede comprobar la presencia de enzimas nativas en el grano de quinua, por la formación de azucares en la muestra que no contenía a-amilasa añadida. La naturaleza de las enzimas nativas presentes no fue determinada ni estudiada en este trabajo, pero se podría realizar un trabajo para identificarlas y estudiarlas. No se encontraron trabajos similares con quinua en bibliografía científica publicada, resaltando el crácter primicial del presente estudio.
CONCLUSIONES
En base a los resultados de las pruebas realizadas en la bebida no láctea a base de quinua, se confirma la presencia de antioxidantes además de azúcares no adicionados, originados por la actividad enzimática de la a-amilasa en ésta. La a-amilasa adicionada coadyuva a la obtención de una suspensión más homogénea y estable, por lo que su adición es de gran importancia en la elaboración de la bebida no láctea.
La bebida no láctea a base de quinua desarrollada es una excelente opción como complemento alimenticio, debido a las propiedades nutricionales inherentes a la quinua (revalorización), particularmente en el contenido proteico y como fuente importante de antioxidantes (polifenoles) reportado en el presente trabajo.
RECONOCIMIENTOS
Los autores agradecen a la Agencia Sueca de cooperación para el Desarrollo Internacional (SIDA) por el respaldo financiero.
REFERENCIAS
1. Gallego Villa, D.Y., Russo, L, Kerbab, K., Landi, M., Rastrelli, L, 2014, Chemical and nutritional characterization of Chenopodium pallidicaule (cañihua) and Chenopodium quinoa (quinoa) seeds, Spec. Issue med. Edihle plants their Appl, 26, 609-615. [ Links ]
2. Peñarrieta, J. M., Alvarado, J. A., Bergenstáhl. B., Ákesson, B. 2009, Total antioxidant capacity and content of phenolic compounds in wild Strawberries (Fragaria vesca) collected in Bolivia, International Journal of Fruít Science, 9, 344-359. [ Links ]
3. Repo-Carrasco-Valencia, R.A., Encina, C.R., Binaghi, M.J., Greco, C.B., Ronayne de Ferrer, P.A. 2010, Effects of roasting and boiling quinoa, kiwicha, and kañiwa on composition and availability of minerals in vitro, J. Sci. Food Agrie, 90, 2068-2073. [ Links ]
4. Valencia-Chamorro, S.A. Quinoa, In: Encyclopedia of Food Science and Nutrition.Vol. 8., ed by Caballero, B., Trago, L., Fingías, P.M 2003, Academic Press, Amsterdam, 4895-4902. [ Links ]
5. Abugoch-James, L.E. 2009, Quinoa (Chenopodium quinoa Willd.): Composition, chemistry, nutritional and functíonal propertíes, In: Advances ín Food and Nutrítíon Research, edby Taylor, S.L., Elsevier Inc., Amsterdam, 58, 1-31. [ Links ]
6. Alvarez-Jubete, L, Arendt E.K., Galagher, E. 2010, Nutritive value of pseudocereals and their increasing use as functional gluten-free ingredients, Trends in Food Science and Technology, 21(2), 106-113. [ Links ]
7. Brady, K., Ho, C.T., Robert, T.R., Shengmin, S., Karwe, M,V. 2007, Effects of processing on the nutraceutical profile of quinoa, Food Chemistry, 100(3), 1209-1216. [ Links ]
8. Chauhan, G.S., Eskin, N.A.M., Mills, P.A. 1999, Effect of saponin extraction on the nutritional quality of quinoa (Chenopodium quinoa Willd) proteins, Journal of Food Science and Technology, 36(2), 123-126. [ Links ]
9. Zhu, N., Sheng, S., Sang, S., Jhoo, J.W., Bai, N., Karwe, M.V., Rosen, R.T., Ho, C.T. 2002, Triterpene saponins from Debittered Quinoa (Chenopodium quinoa) seeds. Journal of Agricultura! Food Chemistry, 50(4), 865-867. [ Links ]
10. Sedó P. 2001, Alimentos funcionales: análisis general acerca de las características químicas - nutricionales, desarrollo industrial y legislación alimentaria, Revista Costarricense de Salud Públíca,10, 34-39. [ Links ]
11. Bernat, N. Tesis de doctorado, Desarrollo, caracterización y optimización de productos fermentados a base de licuados vegetales como alternativa a yogures convencionales, Universidad Politécnica de Valencia, 2013, España. [ Links ]
12. Peñarrieta, J. M., Alvarado, J. A., Akesson, B. Bergenstáhl, B. 2008, Total antioxidant capacity and content of flavonoids and other phenolic compounds in canihua (Chenopodíum pallídícaule): An Andean pseudocereal, Molecular Nutrition and Food Research, 52, 708-717. [ Links ]
13. Bernfeld, P. 1955, Amylases: alpha and betamethods, Enzymology, 1, 149-158. [ Links ]
14. Martysiak-Zurowska, D., Wenta, W. 2012, A comparison of ABTS and DPPH methods for assessing the Total Antioxidant Capacity of human milk. Department of Food Chemistry, Technology and Biotechnology, Acta Sci. Pol, Technol. Aliment., 11(1), 83-89. [ Links ]
15. Chen, J., Lindmark-Mansson, L., Gorton, L., Akesson, B. 2003, Antioxidant capacity of bovine milk as assayed by spectrophotometric and amperometric methods, International Diary Journal, 13, 927-935. [ Links ]
16. Yilmaz-Erzan, L, Ozcan, T., Akpinar-Bayizit, A., Sahin, S. 2016, The antioxidative capacity of Kefir produced from goat milk, International Journal of Chemical Engineering and Applications, 1(1), 22-26. [ Links ]
17. Gan, R., Shah, N., Wang, M, Liu, W., Corke, H. 2017, Lactobacíllus plantarum WCFS1 fermentation differentially affects antioxidant capacity and polyphenol content in mung bean (Vígna radíala) and soya bean (Glycine max) milks, Journal oí Food Processing and Preservation, 41(1), https://doi.org/10.1111/jfpp.12944. [ Links ]
18. Baghbadorani, S.T., Ehsani, M.R., Mirlohi, M., Ezzatpanah, H, Azadbakht, L, Babashahi, M. 2017 Antioxidant Capability of Ultra-high Temperature Milk and Ultra-high Temperature Soy Milk and their Fermented Products Determined by Four Distinct Spectrophotometric Methods, AdvBiomedRes, 2017, 6, 62. DOI: 10.4103/2277-9175.207150. [ Links ]
19. Aliaga, E., Book, O., Mollinedo, P., Tejeda, L. 2016, Patente N° SP-0025-2016/P147180002BO; PCT/EP2018/052512. La Paz, Bolivia. Servicio Nacional de Propiedad Intelectual. [ Links ]
20. Bazile, D. 2014, Estado del arte de la quinua en el mundo 2013: FAO (Santiago de Chile) y CIRAD (Montpellier, Francia), 724. [ Links ]
21. Bojanic, A. 2011, La Quinua: Cultivo milenario para contribuir a la seguridad alimentaria mundial, Journal of Food Engineering, 65(4), 489-495. [ Links ]
22. Bravo, L. 1998, Polyphenols: chemistry, dietary sources, metabolism, and nutritional significance, Nutrition Reviews, 56, 317 333. [ Links ]
23. Codex Alimentarás, FAO, Food and Agriculture Organisation of the United Nations. Rome, Italy. Retrieved September 2009 http://www.codexalimentarius.net/web/more_info.jsp?id_sta=7, access date 09/21/2018. [ Links ]
24. Koziol M.J. 1992, Chemical composition and nutritional evaluation of quinoa (Chenopodíum quínoa Willd.), Journal oí Food Composition Analysis, 5, 35-68. [ Links ]
25. Marnett, L.J. 1999, Lipid peroxidation-DNA damage by malondialdehyde, Mutation Research, 424 (1-2), 83-95. [ Links ]
26. Pradere, M. 2017, Optimization of a quinoa drink with and without chocolate and the development of a drink based on Canihua. Internship report. Montpellier. Polytech Montpellier, GBA Department. [ Links ]
27. Ruales J., Nair, B. 1994, Properties of starch and dietary fibre in raw and processed quinoa (Chenopodíum quínoa Willd), Plant Foods Hum Nutr, 45, 223-246. [ Links ]
28. Versan, A., Parpinello, G. P., Tornielli, G B., Ferrarini, R Giulivo, C. 2001, Stilbene compounds and stilbene synthase expression during ripening, wilting, and UV treatment in Grape cv. Corvina, Journal of Agrícultural of Food Chemistry 49, 5531-5536. [ Links ]
29. Wang, S., Zhu, F. 2016, Formulation and Quality Attributes of Quinoa Food Products, Food Bioprocess Technol, 9, 49-68. [ Links ]
30. Zheng, L.T, Ryu, GM, Kwon, B.M, Lee, W.H. Suk, K. 2008, Anti-inflammatory effects of catechols in lipopolysaccharide-stimulated microglia cells: inhibition of microglial neurotoxicity, European Journal of Pharmacology, 588, 106-113. [ Links ]
31. Zulueta, A., Esteve, M.J., Frigola, A. 2009, ORAC and TEAC assays comparison to measure the antioxidant capacity of food products, Food Chemistry, 114, 310-316. [ Links ]