Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Boliviana de Química
On-line version ISSN 0250-5460
Rev. Bol. Quim vol.35 no.5 La Paz 2018
FULL ORIGINAL ARTICLES
Comparative study of the proteolytic complex of species of the genus Ficus spp.
Estudio comparativo del complejo proteolítico de especies del género Ficus spp.
Gabriela Quiroga Seláez, Carla D. Parra Lizarazu, Alberto Giménez Turba, Esther Flores Quisbert
College of Pharmaceutical and Biochemical Sciences, Biochemical Drug Research Institute IIFB, Universidad Mayor de San Andrés UMSA, P.O. Box 3239, Av. Saavedra 2224, Phone 5912229021, La Paz, Bolivia, farbio@farbio.edu. bo
*Corresponding author: mgqs88.mgqs@gmail.com
Received 10 31 2018 Accepted 12 20 2018 Published 12 30 2018
ABSTRACT
The studies carried out in recent years on the pharmacological and biotechnological activity of cysteine proteases have impelled us in exploring new natural sources of plant proteases. In the present work we have studied the cysteine proteases contained in the latex of Ficus spp. This is a plant species widely used in Bolivia and Peru for its látex, collected for the present purposes in Iquitos, Peru (P-IQ), Sud Yungas Province, Charcas II (B-SY), Los Olivos (B-SY), Hernández (B-SY) and in the Province Abel Iturralde (B-AI), Buena Vista, el Tigre, (B-AI) in northern La Paz, Bolivia. In the present paper we established the proteolytic activity of the samples with a correlation to the place of origin, the influence of the pH on the proteolytic activity as well as the proteic contents of the samples.
Keywords: Ficus spp., Proteolytic activity, Cysteine proteases.
RESUMEN
Los estudios realizados en los últimos años sobre la actividad farmacológica y biotecnológica de las proteasas de cisterna nos han impulsado a explorar nuevas fuentes naturales de proteasas vegetales. En el presente trabajo hemos estudiado las cisteína-proteasas contenidas en el látex de Ficus spp. Esta es una especie de planta ampliamente utilizada en Bolivia y Perú por su látex, recolectada para los fines actuales en Iquitos, Perú (P-IQ), provincia de Sud Yungas (B-SY), Charcas II (B-SY), Los Olivos (B-SY), Hernández (B-SY) y en la Provincia. Abel Iturralde (B-AI), Buena Vista (B-AI), el Tigre (B-AI) en el norte de La Paz, Bolivia. En el presente trabajo establecimos la actividad proteolítica de las muestras con una correlación con el lugar de origen, la influencia del pH en la actividad proteolítica y el contenido proteico de las muestras.
INTRODUCCIÓN
Ficus (Moraceae) es considerado un taxón monofilético, cuya antigüedad se ha calculado entre 80 y 90 millones de años [1]. Se estima que existen 750 especies nombradas, las mismas están ampliamente difundidas en las regiones tropicales y sub-tropicales del mundo [2]. Pertenecen a este género diversas formas tales como el higo comestible común (F. carica), la higuera sicómora (F. sycotmorus), la higuera de Bengala (F. indica y F. benghalensis), varias higueras estrangulantes, el árbol de caucho (F. elástica) y la higuera trepadora (F. repens) [3]. Quizás las únicas características que unifican a este género (que incluye a vides, arbustos, y árboles), es la producción de frutos y de látex lechoso.
Dentro de los componentes del látex de algunas especies de Ficus se han encontrado: esteróles; terpenos (lavandulol, lupeol, fillantol y eloxantina); alcaloides (dolairina) y enzimas lisosómicas como la hexosaminidasa [4-6], como parte de los principios activos presente en la planta. Sin embargo, el componente principal es el complejo proteolítico enzimático, llamado ficina o ficaina [7]. La ficina es una cisteín-proteasa con un único grupo -SH activo por molécula, aunque la misma contiene al menos otro grupo tiol y una unión disulfuro no esenciales para la actividad proteolítica [8], y es ampliamente utilizada en las industrias alimentaria, textil y farmacéutica [9,10].
En Bolivia y Perú se tiene documentada la actividad proteolítica de especies de Ficus reconocidas como Ficus insípida Willd spp. insípida (Moraceae) y Ficus máxima Miller (Moraceae), las cuales son conocidas genéricamente como Ojé [11,12]. Esta investigación se realizó con el objetivo de evaluar las principales diferencias de componentes proteínicos y la actividad proteolítica de los látex de especies Ficus obtenidos en diferentes regiones.
RESULTADOS
Un total de ocho muestras de látex de Ficus spp. fueron colectadas en diferentes zonas y tiempos que se agruparon de acuerdo al lugar de procedencia.

Caracterización del látex
Cuantificación de la concentración total de proteínas
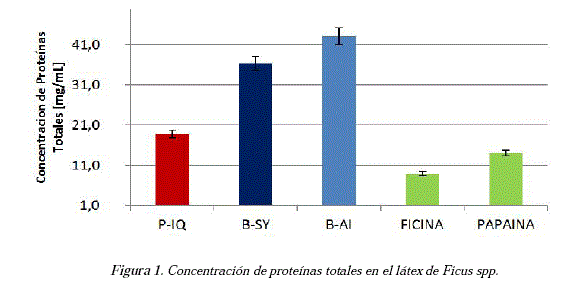
Empleando el método de Biuret, se determinó el contenido de proteínas totales, previa separación de los residuos orgánicos presentes en los látex (fase acuosa). La concentración de proteínas totales en las muestras se aprecia en la figura 1. La concentración de las sustancias patrón ficina y papaína se definió en 9,06 y 14,09 mg/mL respectivamente. Las muestras procedentes de Perú (P-IQ) presentaron menor concentración de proteínas totales (18,91 mg/mL) respecto a las de Bolivia con 36,39 mg/mL (B-SY) y 43,15 mg/mL (B-AI).
Determinación de la actividadproteolítica del complejo proteolítico de Ficus spp.
Los valores de la actividad proteolítica se evaluaron mediante el método de la azocaseína, empleando a la ficina como estándar.
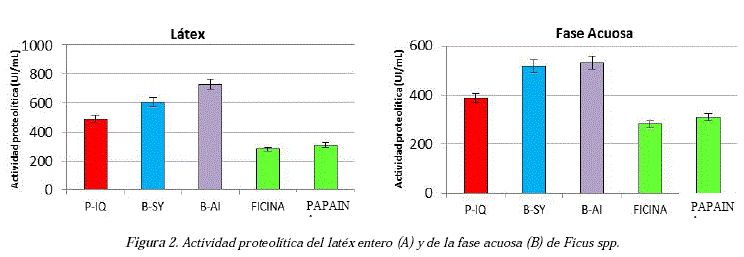
Como se puede apreciar en la Figura 2 A, la actividad proteolítica fue mayor cuando se trabajó con el látex entero, muy superior a las enzimas de referencia (ficina y papaína) con valores máximos de actividad en UI/mL superiores a las 600 UI/mL en las muestras bolivianas y superiores a 450 UI/mL en muestras peruanas (Fig. 2 A). La fase acuosa que contiene los residuos orgánicos presentes en los latex (Fig. 2 B) enseña una actividad proteolítica inferior a la de las muestras de latex entero para todas las colectas.
Las muestras colectadas en Perú presentaron actividad proteolítica menor (490 UI/mL) respecto de las muestras de Bolivia (~600 UI/mL, provincia Sud Yungas) y ~750 UI/mL (provincia Abel Iturralde). Estos datos sugieren que la actividad proteolítica se ve influenciada por factores como las condiciones ecológicas, la edad del árbol, la hora de recolección del látex, incluso el número de incisiones que se realizan sobre el árbol.
Caracterización electroforética del látex de Ficus spp.
Se trabajó con muestras de látex ya que no se obtuvieron corridas electroforéticas claras de la fase acuosa. La electroforesis se desarrolló empleando una intensidad constante de 80V durante el apilado y de 100V hasta la finalización de la corrida.
Se observó la separación de una amplia variedad de componentes proteínicos de baja, media y alta movilidad electroforética; una banda mayoritaria con similar movilidad a la del patrón, cercana a los 25 KDa, confirmando la presencia de ficina en las muestras de látex.
Según el lugar de colecta, se observan diferencias marcadas ya que las muestras de P-IQ presentan 2 bandas de muy bajo peso molecular; las de B-AI una banda proteínica de aproximadamente 30 KDa y las de B-SY entre 2 y 3 bandas cercanas a los 20 y 30 KDa (Figura 3).
Influencia del pH
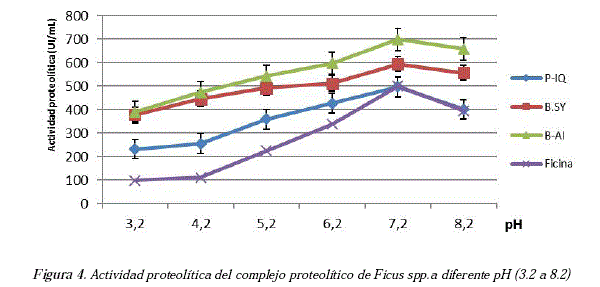
Se determinó la actividad proteolítica del látex de Ficus spp. en un amplio rango de pH (de 3.2 hasta 8.2) mostrando ser bastante estable, difícilmente afectado por las variaciones en la acidez. Además, la máxima actividad para el complejo proteolítico de Ficus spp. se sitúa en la zona neutra de 7 a 8, pudiendo ser clasificada como una proteasa neutra o alcalina, ver Figura 4.
Se observa que, sin utilizar procedimientos de purificación como la precipitación, se incrementan los valores de actividad respecto a la enzima ya purificada. También las muestras bolivianas muestran resultados de actividad enzimática elevada incluso a pH ácido, que podría llegar a ser una ventaja en nuevos estudios farmacológicos y/o biotecnológicos.
DISCUSIÓN
Los estudios comparativos realizados indicaron que el contenido de cisteína-proteasa en el látex de Ficus, nativas de Bolivia y Perú, crecida en condiciones silvestres es bastante alto respecto a la enzima purificada. También se observan diferencias marcadas entre las muestras boliviana y peruana, siendo estas últimas las que presentan una menor cantidad de proteínas totales, actividad proteolítica y componentes proteínicos. Llegando a concluir que existe una relación directamente proporcional entre el contenido de proteínas y la actividad proteolítica y que además éstas se ven influenciadas por las condiciones ecológicas en que se desarrolló el árbol, a saber: altitud sobre el nivel del mar, condiciones climáticas, etc.
La cuantificación de proteínas en la fase acuosa evidencia una mayor cantidad de proteínas en las muestras bolivianas por la presencia de otras proteínas y/o péptidos. Por otra parte, la actividad proteolítica es mayor en el látex entero o crudo, y es menor cuando se separa la fase acuosa de los materiales sólidos orgánicos, lo que podría deberse a que en la centrifugación posiblemente se arrastran algunas proteínas o componentes que afectan de alguna manera a la actividad proteolítica, haciendo que esta disminuya. Además, las muestras procedentes de Iquitos-Perú (P-IQ) muestran menor actividad (~490 UI/mL) frente a las procedentes del norte de La Paz-Bolivia, de B-AI ~750 UI/mL y B-SY ~600 UI/mL.
La caracterización de las muestras por electroforesis, muestra una banda mayoritaria con similar movilidad a la del patrón comercial (25 KDa) que evidencia la presencia de ficina. Además, se observa la presencia de componentes de baja, media y alta movilidad electroforética, según el lugar de procedencia. Comparativamente, el número de componentes y su actividad proteolítica pueden ser el resultado de las diferencias de las condiciones geográfico-climáticas en las que se desarrollan los árboles. También se evidenció que el complejo enzimático presente en el látex es bastante estable frente a las variaciones de pH, pudiendo llegar a ser una ventaja a tomarse en cuenta en futuros estudios con vistas a aplicaciones especiales.
EXPERIMENTAL
Colecta del material vegetal
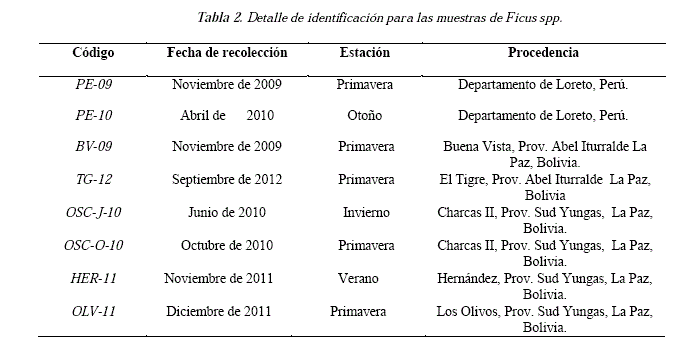
La colecta del látex de Ficus spp. (Ojé) se realizó en diferentes épocas y regiones, que se detallan en la Tabla 2.
Las gotas de látex fueron recolectadas en recipientes de polietileno, una vez en el laboratorio, el látex fue almacenado en un equipo refrigerador Whirlpool®, a 4°C hasta su utilización en la realización de los análisis pertinentes.
Procesamiento del látex
Una parte del látex fue depositada en tubos Falcon, para separar la goma de la fase acuosa por centrifugación a 10000 r.p.m. durante 30 minutos a 4°C en una centrífuga refrigerada multirotor modelo 2-16PK, de marca Sigma®. Una vez obtenidas las fases, éstas fueron divididas, congeladas y almacenadas a -20°C hasta su utilización.
Caracterización del látex
Cuantificación de la concentración total de proteínas
En todos los casos se mezclaron: 20 µL de la solución de proteína (fase acuosa del látex) y 200 µL del reactivo de Biuret (1,5 g de CuSO4·5H2O y 6 g de tartrato de sodio-potasio en 500 mL de H2O(d); añadir 300 mL de NaOH 2,5 N; agregar 1 g de KI y H2O(d) c.s.p. 1000 mL) la mezcla fue equilibrada a temperatura ambiente por 20 minutos, y se determinó su absorbancia a 540nm en un lector un ELISA Epoch, modelo ELx800, Blotek®, con el programa de análisis Gen 5, contra los blancos apropiados.
La curva de calibración se realizó con albúmina sérica bovina (BSA, Sigma) manejando un rango de concentración de proteínas entre 0,5-10 mg/mL. Como proteínas de referencia también se utilizó a las proteasas comerciales ficina (Sigma), papaína (Sigma).
Determinación de la actividad proteolítica sobre un sustrato cromogénico hidrosoluble: Azocaseina
El método es una modificación del ensayo descrito por Christen y Marshall (Bendicho et al, 2002). Se agregaron 500 µl de la solución de azocaseina (Sigma) (solución al 1% en tampón fosfato a pH 7.2 (0,78g de Na2HPO4 y 1,05g de NaH2PO4 y H2O(d) c.s.p. 1000 mL) a 50 µl de la muestra que contiene la enzima proteolítica (látex y fase acuosa). Se mezcló y se incubó a 37°C durante 15 minutos. La reacción se detuvo agregando 500 µl de ácido tricloroacético (ATA al 5%). Los tubos fueron equilibrados a 4°C por 30 minutos, y centrifugados a 8000 r.p.m. por 20 minutos a la misma temperatura. Finalmente, se dispusieron 200 µL de cada sobrenadante y se determinó su absorbancia a 415 nm en un lector un ELISA Epoch ELx800, Biotek®, con el programa de análisis Gen5, contra los blancos apropiados (tampón fosfato y azocaseina con ATA 5% sin enzima).
La actividad de la enzima se expresa en UI/mL después de verificar la correlación lineal que existe entre los valores dados para el producto de la actividad proteolítica de la ficina (Sigma) y papaína (Sigma) estándar preparada a diferentes diluciones de dicha enzima, con la absorbancia del sobrenadante en cada dilución.
Electroforesis desnaturalizante en geles de poliacrilamida (SDS-PAGE)
Esta técnica es la clásica electroforesis discontinua, desnaturalizante y reductora de Laemmli (1970), conocida como SDS-PAGE (Sodium Dodecyl Sulphate-PolyAcrylamide Gel Electrophoresis). Se usaron geles de poliacrilamida al 12 % m/v.
Preparación de los geles
Los geles se moldearon empleando el soporte provisto a tal efecto con el equipo Mini-Protean III, Bio-Rad. La composición de los sistemas buffer y de los geles se indica a continuación.
Buffer de apilamiento 0.5M (Tris 36,3g, agua destilada c.s.p. lOOmL, pH final 6,8)
Gel de apilamiento 5% (Acril-Bis (30:0,8) l,16mL; Buffer de stacking 0,87 mL; SDS 10% 70 µL; Agua destilada 4,79 mL; Persulfato de amonio PSA 5% 105 µL; TEMED 5 µL) volumen final 7mL
Buffer de resolución 1.5 M (Tris 36,3g, agua destilada c.s.p. 1OOmL, pH final 8,8)
Gel de resolución 12,5% (Acril-Bis (30:0,8) 4,15 mL; Buffer de resolución 1,25 mL; SDS 10% 100 µL; Agua destilada 4,39 mL; Persulfato de amonio PSA 5% 5 µL) volumen final 1OmL
Se colocaron 5 ml de la mezcla del gel de resolución en cada placa y se dejaron polimerizar. Sobre la mezcla del gel de resolución se colocó agua destilada para alinear la interfase en contacto con el aire y facilitar la visualización de la polimerización. Luego de la polimerización se retiró el agua, se lavó la superficie y se eliminó el exceso de agua con papel filtro. A continuación, se colocó la mezcla del gel de apilamiento y de inmediato los peines formadores de pozos.
Preparación de las muestras
Las muestras de látex se redisolvieron en 20µLde buffer de muestra.
Buffer de muestra (Tris 1,57 g; SDS 2 g; Mercaptoetanol 5 mL; Glicerol 8 mL; Azul de bromofenol 2 mg; Agua destilada c.s.p. 10OOmL; pH final 6,8)
Aplicación de las muestras y condiciones de corrida
Los volúmenes de siembra fueron de 20 µl por pozo. El patrón de Peso Molecular (Sigma) utilizado contenía como marcadores: Atropina, (6,500 Da), a-Lacto albumina (14,200 Da) Inhibidor de tripsina (20,000 Da), tripsinogeno, (24,000 Da), anhidrasa carbónica, (29,000 Da), glyceraldehido-3-fosfato deshidrogenasa (36,000 Da), ovoalbúmina (45,000 Da), albumina sérica (66,000 Da).Los reservorios anódico y catódico, se llenaron con buffer de electroforesis.
Buffer de electroforesis lx (Tris 3 g; Glicina 14,4 g; SDS 1 g; Agua destilada c.s.p. 1OOOmL La electroforesis se desarrolló empleando una intensidad constante de 80V durante el apilado y de 100V hasta la finalización de la corrida (llegada del colorante al borde inferior del gel). Dichas condiciones se obtuvieron tras una estandarización del método.
Influencia del pH
Para esta determinación se siguió la metodología de la actividad enzimática, sólo que en este caso se varió el pH en el cual estaba disuelta la azocaseína al 1%. Se utilizó buffer fosfato 50mM en un rango desde 3,2 hasta 8,2 y HC1 (0.1N). (Pandey et al, 2003). Todas las determinaciones se realizaron por triplicado.
RECONOCIMIENTOS
Los autores agradecen el apoyo financiero dado por el Proyecto IDH "Desparasitación en escuelas rurales II para el desarrollo de esta investigación".
REFERENCIAS
1. Datwyler, S.L., Weiblen, G.D., 2004, On the origin of the fig: phylogenetic relationships of Moraceae from ndhF sequences, American Journal ofBotany, 91,161-111. [ Links ]
2. Berg, C.C., 1989. Classification and distribution of Ficus, Experientia, 45, 605-611. [ Links ]
3. Lansky, E.P., Paavilainen, H.M, Pawlus, A.D., Newman, R.A. 2008, Ficus spp.: Ethnobotany and potential as anticancer and anti-inflammatory agents, JEthnopharmacol, 119, 195-213. [ Links ]
4. Lansky, E.P., Paavilainen, H.M., Figs: The Genus Ficus, In: TraditionalHerbal Medicines for Modern Times, v. 9, ed Hardman, R., 2011, CRC Press, Taylor & Francis Group, Boca Ratón, FL, U.S.A. [ Links ]
5. López, M.I., Natalucci, C.L., Priolo, N.S., Arribare, M.C., Caffini, N.O. 1994 Proteasas de Plantas Superiores.II. Ficina (EC 3.4.22.32). ActaFarm. Bonaerense. 13(2), 123-31. [ Links ]
6. Orlacchio, A., Maffei, C, Emiliani, C, Reinosa, J.A. 1985, On the active site of P-hexosaminidase from látex of Ficus glabrata, Phytochemistry, 24 (4), 659-662. [ Links ]
7. Gaughran, E.R.L. 1976, Ficin: history and present status, Q. J. Crude DrugRes, 14, 1-21. [ Links ]
8. Liener, LE., 1961, A study of the number and reactivity of the sulfhydryl groups of ficin, Biochim Biophys Acta, 28(53), 332-342. [ Links ]
9. Caffini, N.O., Natalucci, C.L., Priolo, N.S. Buttazzoni, M.S. 1988, Proteasas de Bromilaceae. IV. Aislamiento de una fitoproteasa sulfhídrica presente en frutos de Bromeliasea Griseb, Actafarmaceutica Bonaerense, 7, 9 -14. [ Links ]
10. Azarkan, M., Wintjens, R., Looze, Y., Baeyens-Volant, D. 2004, Detection of three wound-induced proteins in papaya látex, Phytochemistry, 65, 525-534. [ Links ]
11. Barrett, A., Rawlings, N., Woessner, J., Introduction, In: Handhook of Proteolytic Enzymes, ed by Barrett, A., Rawlings, N., Woessner, J., 2004, Academic Press, London. [ Links ]
12. Bourdy, G., De Walt, S.J., Chávez de Michel, L.R. , Roca, A. , Deharo, E., Muñoz, V., Balderrama, L., Quenevo, C, Giménez, A. 2000, Medicinal plants uses of the Tacana, an Amazonian Bolivian ethnic group, Journal of Ethnopharmacology 70(2), 87-109. [ Links ]
13. Reynel, C, Pennington, R.T., Pennington, T.D., Flores C, Daza, A, Arboles útiles de la Amazonia Peruana y sus usos, Tarea Asociación Gráfica Educativa, 2003, Lima, Perú. [ Links ]