Revista Boliviana de Química
versión On-line ISSN 0250-5460
Rev. Bol. Quim vol.33 no.3 La Paz jul. 2016
ARTÍCULOS ORIGINALES
Chemical content of the wood of tabebuia impetiginosa (mart. ex dc)
standley from rural community ocho hermanos, municipality el Carmen Rivero Torrez, department of Santa Cruz
David Fernando Urrelo1,*, Laura Leal2, Carmen Bozo3
* Corresponding author: david_urrelo@hotmail.com
Abstract
The chemical composition of Tabebuia impetiginosa (Mart. ex DC) Standley, was characterized by applying standard analytical methodologies (TAPPI). The species also known as Tajibo Morado was collected in the rural community "Ocho Hermanos" from the "El Carmen Rivero Torrez" county of the Santa Cruz Department in Bolivia. Three samples of 30 cm long were extracted for each tree affording a total of nine wood slices. The obtained results show an average of 45.22% of cellulose, 32.07% of lignine and 22.69% of hemicellulose, in the etanol-benzene extracts with 2.27%. The evaluation of the moisture contents gave an average of 15.44%; the pH was 5.22. The ashes afforded an average of 1.31% and the minerals were estimated as: phosphor 0.011%, calcium 0.22%, magnesium 0.12%, potasium 0.013%, sodium 0.060%. The nitrogen determination afforded the average valué of 0.47%. Finally, the proteins were in an average of 2.96%. As a conclusión we can infer that the species Tabebuia impetiginosa (Mart. ex DC) Standley has an important potential as a source for the exploitation of wood waste, as well as for the obtaining of: pellets, briquettes, bioethanol, cattle food, carbón, adhesive and other derivatives.
Keywords: Cellulose, Lignin, Hemicellulose, Soluble extracts, Macro minerals, Hydrogen potential
Resumen
Spanish tule: Composición química de la madera de Tabebuia impetiginosa (Mart. Ex DC) Standley proveniente de la comunidad rural Ocho Hermanos, Municipalidad El Carmen Rivero Torrez, Departamento de Santa Cruz. Se caracterizó la composición química en la especie Tajibo Morado, (Tabebuia impetiginosa "Mart. ex DC) Standley, procedente de la Comunidad Campesina Ocho Hermanos, del Municipio Carmen Rivero Torrez, del Departamento de Santa Cruz de la Sierra, aplicando metodologías y protocolos normalizados (TAPPI). Se extrajeron 3 trozas de 30 cm de alto por cada árbol de muestreo, obteniéndose un total de 9 rodajas. Los resultados muestran una media de 45,22% de Celulosa, lignina 32,07% y hemicelulosa 22,69%, en los extractos con etanol-benceno fue de 2,27%. La valoración del contenido de humedad dio una media de 15,44% y un pH de 5,22. En ceniza se obtuvo un valor medio de 1,31%, los porcentajes de minerales fueron: fósforo 0,011%, calcio 0,22%, magnesio 0,12%, potasio 0,013%, sodio 0,060%. La determinación de nitrógeno tuvo una media de 0,47% y de proteínas 2,96%. A partir de los resultados obtenidos se puede inferir que la especie Tabebuia impetiginosa (Mart. ex DC) Standley presenta un potencial importante desde el punto de vista químico, para el aprovechamiento de residuos, pudiendo ser utilizada en la obtención de; pellets, briquetas, bioetanol, alimento para ganado, carbón, adhesivos entre otros derivados.
INTRODUCCIÓN
Desde la aparición del hombre sobre el planeta, las plantas han jugado un papel muy valioso en lo económico, social y ambiental. El conocimiento y manejo adecuado de la flora ha permitido mejorar sus condiciones de vida. Destacando el aprovechamiento de estos recursos en la alimentación, construcción, fabricación de papel, en la industria textil, farmacéutica, química, ganadera, fertilizantes entre otras.
Bolivia se encuentra en el centro de Sudamérica, colindante con Argentina, Brasil, Chile y Perú. Cuenta con 1,1 millones de Km2 de superficie y una población de 8 millones de habitantes, es considerado uno de los países con mayor índice de biodiversidad de plantas en Latinoamérica, con 40 millones de hectáreas aproximadamente de bosque relativamente intacto (WWF 2014).
En los últimos años, el potencial forestal se incrementó por la fuerte demanda de especies de valor comercial del bosque. Sin embargo, pese a la importancia de este recurso en nuestro país, existen muchas especies con potencial maderero que todavía no han sido investigadas respecto a sus propiedades tecnológicas, particularmente respecto a sus propiedades químicas. Propiedades cuyo estudio son de interés para la industria papelera, curtiembre, preservación, agricultura, ganadería, y otros derivados de la madera. Estas ejercen una gran influencia sobre otras propiedades de la madera, como por ejemplo, sobre las propiedades físicas (contenido de humedad, poder calorífico, peso y durabilidad), en las propiedades organolépticas (brillo, color y olor) y en las propiedades mecánicas (resistencia a la aplicación de fuerzas). Por lo cual, su conocimiento permitirá establecer un uso adecuado de los residuos de aserraderos (Rollizos, Astillas, Recortes del aserrío, Corteza, Ramas y Hojas) y proporcionar valor agregado al recurso forestal boliviano.
México, Chile, Brasil, Argentina y Uruguay poseen un avance direccionado en la determinación química de su recurso forestal. Estos países utilizan la norma TAPPI, como marco de referencia en el estudio químico de la madera, norma que ha sido tomada de estudios realizados en países desarrollados como; Estados Unidos, España y Alemania.
En este contexto se desarrolla esta investigación, la cual tiene como objetivo proporcionar información en cuanto al; Contenido de humedad, pH, celulosa, lignina, hemicelulosa, ceniza, proteínas y minerales (calcio, magnesio, fosforo, potasio y magnesio) de la especie Tajibo morado, especie con gran potencial para su utilización en la industria maderera.
Los resultados obtenidos en este trabajo serán de utilidad para la determinación de su aptitud tecnológica, para brindar usos alternativos e integrados de los residuos, y para comparar estos resultados con los resultados obtenidos en otras especies y con estudios realizados de las mismas en otros lugares o sitios. Como así también serán de interés en diversas industrias en las cuales la madera es un insumo fundamental como por ejemplo Agroindustria, Curtiembre, Carbonera y Papelera.
RESULTADOS
Componente físico
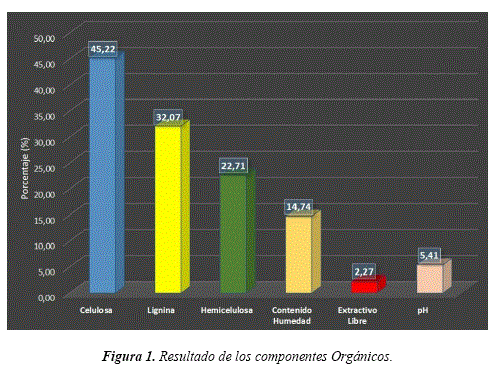
Se obtuvo una media de 14.74% de contenido de humedad, y se dieron diferencia en su contenido en cada árbol. Por lo que esto difiere debido a que los arboles fueron extraídos en diferentes tipos de suelos como se puede ver en la (Figura 1).
Componentes orgánicos
Se determinó una media de 45.22% para celulosa, 32.07% de lignina, 22.71% de hemicelulosa, 2,27% de extractos y se promedió una lectura de 5,41 pH (Ver Figura 1). Por lo tanto, estos resultados están dentro del rango mencionado por Sxmetal. (2002) [25], Nuñez (2008) [16,17] y Saccarello (2010) [21].
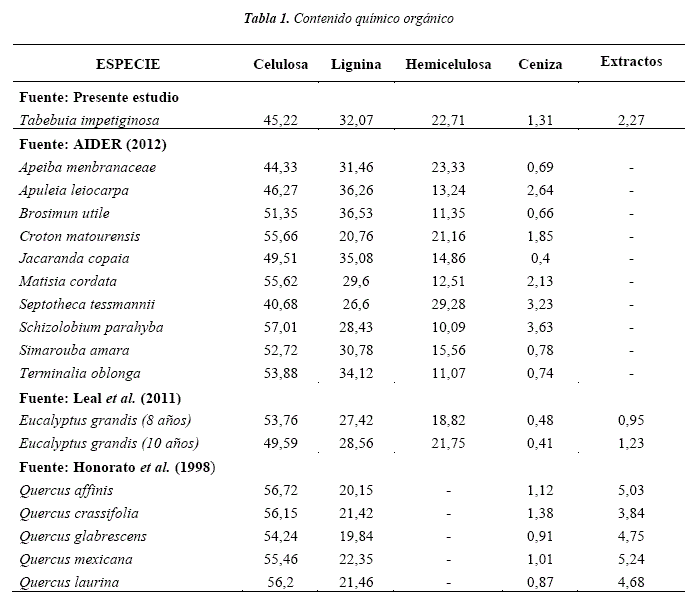
Donde la especie Tajibo Morado al comparar con otras especies en diferentes estudios demostró mayor contenido de lignina y hemicelulosa sin embargo la celulosa mostró menor contenido con excepción de la especie Apeiba menbranaceae y Septotheca tessmannii, luego en los extractos la especie Tajibo Morado tiene mayor contenido de extractos que la especie Eucalyptus granáis en edad de 8 y 10 años y es más ligeramente acida que las demás especies comparadas (Ver Tabla 1 y Tabla 2).
Componentes inorgánicos
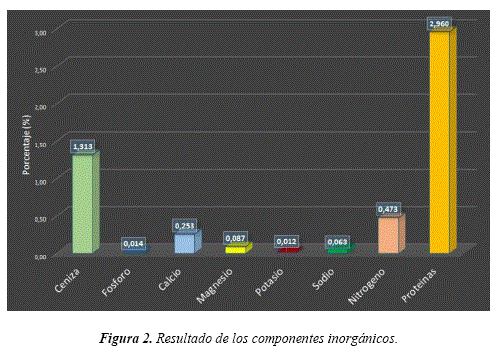
Se calculó una media de 1.31% de ceniza, 0.014% de fosforo, 0.253% de calcio, 0.087% de magnesio, 0.012% de potasio, 0.063% de sodio, 0.473% de nitrógeno y 2.96% de proteínas (Ver Figura 2). Por lo tanto estos resultados están por debajo del rango como menciona McKean (1993) [13] con la excepción de las proteínas (su contenido varía según la especie y el sitio).
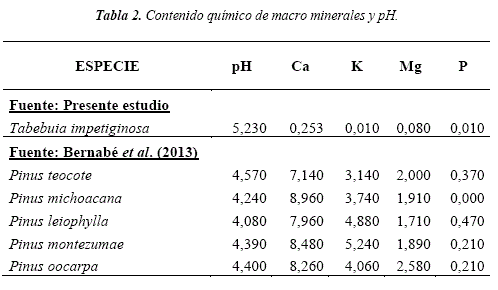
Al comprar la especie Tajibo morado con 5 especies de Pinus, la especie del presente estudio muestra déficit en contenido de macro minerales, pero presentando mayor contenido de fosforo en la especie Pinus michoacana (Ver Tabla 2).
DISCUSIÓN
Estas comparaciones pueden diferir por el diferente tipo de diseño de estudio utilizado y el protocolo en la determinación de cada componente, como así también por tratarse de distintas especies. Es importante destacar que la composición química de la madera esta varía según la localización geográfica, condiciones de crecimiento, de clima y de sitio de crecimiento de cada especie (Salazar et al. 1998) [23].
Los altos valores de lignina encontrados y bajos de celulosa pueden ser positivos para la fabricación de briquetas y pellets que usan los residuos de los aserraderos transformándolos por presión y temperatura, por las propiedades adhesivas de la lignina (se ablanda entre los 70 - 120 °C), sin requerir compuestos químicos.
En cuanto al bajo contenido de los componentes inorgánicos, esto puede deberse al hecho de que las sustancias minerales, varían en el árbol en dependencia de la parte que se estudie: Altos contenidos pueden encontrarse en las hojas, ramas, corteza, raíces, por lo que es común encontrar diferencias entre las maderas de latifolias y las de coniferas; diferencias existen entre la madera joven y la tardía. Las condiciones del suelo y la edad influyen en los contenidos de sustancias minerales, según plantea Carballo (1990) [8]. Este déficit de minerales es negativo para el uso de esta madera como fertilizante natural, pero es positivo en la industria maderera ya que produce un menor desgaste de las maquinarias ya que estos le confieren resistencia.
CONCLUSIONES
La composición química de la especie Tajibo morado procedente de la Comunidad Ocho Hermanos, del Municipio El Carmen Rivera Torrez, Departamento de Santa Cruz de la Sierra, se determinó satisfactoriamente los contenidos químicos, obteniendo valores que están dentro del rango mencionado.
Estos resultados permiten inferir diferentes usos para esta especie de la región Brasileño-Paranense; el alto contenido de lignina (30% a 33% de contenido) y extractivos encontrados (1.8% a 2.6% de contenido), favorecen su utilización en: el armado de los pellets y briquetas debido a sus propiedades adhesivas y alto poder calorífico (19,57 kj/g) como indica Lima (2013) [12] y Álvarez (2013) [2]; en la fabricación de postes dado a que este mayor contenido de lignina, le confiere resistencia mecánica y durabilidad natural Barcenas et al. (1999) [5], así también para la obtención de Glucosa (Jarabe glucosado para producción de Bioetanol), debido que la especie Tajibo morado presenta un 45.22% de contenido de celulosa superando lo reportado de Tejeda et al. (2011) [26] y como suplemento de alimento para animales ya que tiende a presentar pH ligeramente ácido, proteínas, cenizas y contenido de minerales significativamente similar al indicado por Álvarez et al. (2001) [3], sin embargo al bajo contenido de minerales (Ca, K, Mg y P) no puede ser usado para la elaboración de compost.
EXPERIMENTAL
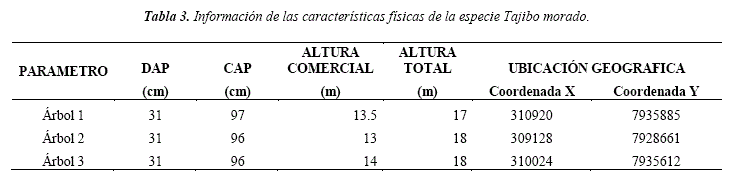
Del área de estudio se seleccionó tres árboles con separación entre 1 km y 7 km de distancia, pertenecientes a la especie Tajibo morado, los árboles que se seleccionaron fueron árboles maduros que presentaban características morfológicas semejantes (similitud en diámetro y altura) como se puede observar en la (Figura 3). Para cada árbol se registraron datos de localización geográfica, altura total, comercial y de fuste, el diámetro en la base, a la altura de pecho y del punto de copa como se puede ver en la (Tabla 3). De cada individuo se cortó una troza de 30 cm a 1,20 m del suelo, las cuales fueron identificadas y trasladadas al laboratorio para su preparación y posterior análisis.
Preparación de las muestras
Se inició con el corte de una troza de 30 cm la cual fue tomada del árbol a 1.2 metros sobre el nivel del suelo, siguiendo la norma TAPPI T 257-os76 como indica Rutiaga et al. (2000) [20] y Bernabé et al. (2013) [6], dicha troza se cortó en tres rodajas de 4 cm de espesor, sobre las cuales se dibujó dos líneas diametralmente opuestas, obteniéndose cuatro cuadrantes; se seleccionaron dos al azar los cuales posteriormente fueron descortezados y molidos. El polvo obtenido se tamizó para obtener partículas entre 0.4 mm a 0.6 mm en un tamiz número 40, de esa manera se logró 100 gr de polvo homogéneo (igual cantidad de peso para albura y duramen), como se puede ver en la (Figura 4).
Determinación del contenido de humedad
Se utilizó la norma TAPPI 12 os-75 como menciona Leal et al. (2011) [11] y Cea (2003) [9], que consistió en pesar 2 gramos de muestras molidas en un crisol de peso conocido y se la introdujo en una estufa a 105°C durante 2 horas, transcurrido este tiempo se la dejó enfriar dentro de un desecador y se pesó la muestra. Repitiendo este proceso hasta obtener un peso constante. Finalmente, obtenido el peso de las muestras se aplicó la siguiente fórmula para obtener el porcentaje de contenido de humedad:
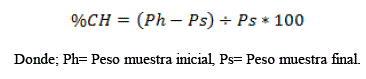
Lectura del pH
Se realizó según la metodología empleada por Rutiaga et al. (2000) [20] y Bernabé et al. (2013) [6]la cual consiste en añadir 2 gr de muestra molida y 20 mi de agua destilada en un vaso precipitado conteniendo la muestra hasta empaparla completamente para luego tomar lecturas con un peachimetro (potenciómetro) a los 5 min, 4 h, 24 h y 48 h consecutivamente. El valor del pH se calculó como el promedio de todas las lecturas registradas.
Preparación de las muestras libres extractos (etanol-benceno)
Se usó la norma TAPPI T 12os-75, según Salazar et al. (1998) [23], Rutiaga et al. (2010) [19] y Nuñez (2008) [16,17], que consistió en colocar 4 gr de muestra a una extracción en un equipo Soxhlet durante 4 h con una mezcla de solución etanol-benceno (1:2 v/v), seguido de otra extracción con etanol durante 4 horas o hasta que la solución quede incolora. Finalmente se lavó 4 veces con agua caliente por periodos de 1 hora, el residuo obtenido se colocó en un horno a 105°C hasta obtener un peso constante y se calculó el contenido de extractivos en porcentaje mediante la siguiente formula:

Determinación de Lignina
De acuerdo con Leal et al. (2011) [11] y Flores et al. (2009) [10] se aplicó la norma TAPPI 222 os-74, consiste en tomar 1 gr de muestra libre extractivo y se le agregó 15 mi de ácido sulfúrico al 72% a una temperatura constante de 20°C, luego se aumentó agua destilada para reducir el ácido a 3%, seguidamente se calentó a reflujo por 4 horas para mantener el volumen del agua como se puede ver en la (Figura 6). Después se filtró y se lavó con agua caliente para introducirlo a un horno a 105°C de temperatura. Finalmente se pesó y se calculó su contenido en porcentaje mediante la siguiente formula:
![]()
Donde; P inicial= Peso libre de extractos, P fínal= Peso seco de la muestra después del lavado con agua caliente.
Determinación de Celulosa:
Se utilizó el método Kurshner-hoffer como indica Barcenas et al. (2008) [4], Carballo et al. (2004) [7] y Leal et al. (2011) [11], consisten en tomar 2 gramos de muestra libre de extractos y se le agregó 25 mi de ácido nítrico-etanol (1:4 v/v). Luego se colocó a reflujo en baño maría durante 1 hora, se decantó y se agregó nuevamente la solución ácido nítrico-etanol (Repitiendo 3 veces este proceso). Después se aumentó 25 mi de hidróxido de potasio al 1% durante 30 minutos y se filtró, como se puede ver en la (Figura 7). Finalmente, se lo introdujo a un horno a 105°C de temperatura y se pesó la muestra, hasta obtener peso constante y se calculó mediante la siguiente formula:
![]()
Donde; P inicial= Peso libre de extractos, P frnal= Peso seco de la muestra después de la filtración.
Determinación de Hemicelulosa
Se determinó mediante la diferencia del 100% y la sumatoria del contenido de celulosa-lignina (Nuñez 2008) [16,17] como se observa en la siguiente formula y en la (Figura 8):
![]()
Donde; % celulosa= resultado en porcentaje de celulosa, % Lignina= resultado en porcentaje de lignina.
Determinación de Ceniza
Según AIDER (2012) [1] y Vargas (2008) [27], se determinó usando la norma TAPPI os-58, consistió en colocar 2 gr de muestra en un crisol de peso conocido. Luego se lo introdujo en una mufla a 200°C hasta carbonizar la muestra y se lo volvió a introducir a 525 °C durante 2 h más, hasta calcinar todas las partículas de la muestra cómo se puede observar en la (Figura 9). Finalmente se colocaron en un desecador y se pesó solo la partícula blanquecina de la muestra carbonizada mediante la siguiente formula:
![]()
Donde; P inicial= peso inicial "4 gramos", P final= Peso de la muestra blanquecina.
Preparación de la muestra madre para el Análisis de minerales
Se realizó como menciona la Guía de Análisis de Tejido Vegetal, tomando 5 gr de cada troza y se colocó en una estufa a 70 °C, luego se calcinó a 500 °C y se dejó enfriar. Las cenizas obtenidas se disolvieron en 10 mi de Ácido clorhídrico diluido, posteriormente se filtró en un balón volumétrico de 100 mi de capacidad enrasando y lavando con agua destilada (Sadzawka et al. 2007) [22].
Determinación de Sodio
Se utilizó el método Flamométrico, consistió en tomar 5 mi de la muestra madre totalmente filtrada y 5 mi de muestra blanca (Contenido de sodio conocido), luego se calibró el fotómetro de llama para Sodio. El análisis consistió en introducir cada muestra en el fotómetro de llama para que se produzca la absorción y calcinación de la muestra (McKean 1993) [13], se calculó el porcentaje de sodio mediante la siguiente formula:
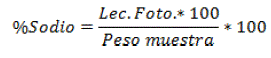
Donde; Lee. Foto.= Lectura del fotómetro de llama y Peso Muestra= Peso ceniza de la muestra madre.
Determinación de Potasio
De la misma manera que el sodio, se usó el método Flamométrico, tomando 5 mi de la muestra madre totalmente filtrada y Muestra blanca (Contenido de Potasio conocido), luego se calibró el fotómetro de llama para la posterior lectura de potasio. El análisis consistió en introducir cada muestra en el fotómetro de llama para que se produzca la absorción y calcinación de la muestra McKean (1993) [13], se calculó el porcentaje de potasio mediante la siguiente formula:
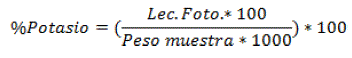
Donde; Lee. Foto.= Lectura del fotómetro de llama y Peso Muestra= Peso ceniza de la muestra madre.
Determinación de Calcio
Se usó el método Titulométrico, consistió en añadir 10 mi de la muestra madre y 20 mi de agua destilada en un matraz Erlenmeyer de 250 mi, luego se introdujo 10 mi de Tampón pH 12 y una pizca de ácido carbón carboxílico. Finalmente, se agregó la solución EDTA (ácido etilendiaminotetracético) en una bureta y se dejó caer gota a gota hasta que la solución con la muestra madre produzca un cambio de color Sadzawka et al. (2007) [22], se calculó el contenido de calcio mediante la siguiente formula:
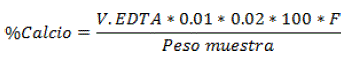
Donde; V EDTA= Volumen de EDTA, F= Volumen Alícuota, Volumen del Tampón pH 10 y Peso Muestra= Peso inicial.
Determinación de Magnesio
Al igual que la determinación de magnesio se utilizó el método Titulométrico, consistió en añadir 10 mi de la muestra madre y 20 mi de agua destilada a un matraz Erlenmeyer de 250 mi, luego se le aumentó de la solución 5 mi de tampón (Hidróxido Amónico y Cloruro Amónico) a un pH 10 y una pizca de Eriocromo Negro de T. Finalmente, se agregó la solución EDTA en una bureta y se dejó caer gota a gota hasta que la solución con la muestra madre produzca un cambio de color Sadzawka et al. (2007) [22], se calculó el contenido de magnesio mediante la siguiente formula:
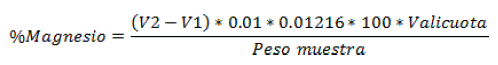
Donde; V2= Volumen de EDTA, Vl= Volumen EDTA de Calcio, V alícuota= Volumen del Tampón pH 10 y Peso Muestra= Peso inicial.
Determinación de Fósforo
Se utilizó el método Espectrofotométrico, consistió en tomar 5 mi de la muestra madre y se lo introdujo en un matraz aforado de 100 mi de capacidad, luego se agregó 4 mi se Sulfato de hidracina y 10 mi de Molibdato al 25%, después se lo enrazó hasta 100 mi de Agua destilada y se colocó en Baño maría. Finalmente, se deja enfriar y se tomó la cantidad necesaria de la muestra que llene el tubo, el equipo fue calibrado para la lectura con el Espectrofotómetro Rodríguez (1955) [18], se calculó el contenido de Fosforo mediante la siguiente formula:
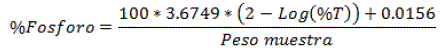
Fórmula para la determinación de fosforo donde; % T= Lectura del Espectrofotómetro y Peso mg (ceniza)= Peso de ceniza de la muestra madre.
Determinación de Nitrógeno
Se usó la guía del Análisis del Tejido Vegetal, el cual consistió en pesar la muestra aproximadamente 0,3 gr totalmente secado a 60 C° y se lo introdujo en un tubo de digestión, luego se agregó 10 mi de Ácido Sulfúrico, un catalizador y se calentó progresivamente a 400 °C. Después de esto se lo colocó en un destilador semiautomático el cual estará destilando durante 3 minutos. En un matraz Erlenmeyer se añadió 8 gotas de indicador y 5 mi de ácido bórico para que se mezcle con la solución del destilado. Finalmente, la solución resultante del matraz Erlenmeyer se lo tituló con ácido clorhídrico al 1% hasta que cambie de color McKean (1993) [13], se calculó el contenido de nitrógeno mediante la siguiente formula:

Fórmula para la determinación de nitrógeno donde; V-B= Volumen gastado del Ácido Clorhídrico, N HCL= la normalidad del Ácido Clorhídrico y Peso Muestra= Peso inicial.
Cálculo de Proteínas
Se realizó como menciona McKean (1993) [13], calculando el contenido de porcentaje de proteínas en base al contenido de Nitrógeno mediante la siguiente formula:
![]()
Donde; %N= Contenido de nitrógeno.
NOTA
1 Ingeniería Forestal, Facultad Ciencias Agrícolas, Universidad Autónoma Gabriel Rene Moreno, Av. Juan Pablo II, Calle 2, Teléfono 3-3448075, Santa Cruz, Bolivia. david_urrelo@hotmail.com
2 Ingenieria en Recursos Naturales y Medio Ambiente, Facultad de Ciencias Naturales. Universidad Nacional de Salta. Las capuchinas, N° 17, Código Postal 4400, Salta, Argentina, leallauraevelyn@yahoo.com.ar
3 Biologia, Facultad Ciencias Agrícolas, Universidad Autónoma Gabriel Rene Moreno, Av Beni, 4to Anillo, Santa Cruz, Bolivia. cbozo@gmail.com
REFERENCIAS
1. AIDER. 2012. Estudio de la composición química de la madera de diez especies maderables potenciales de bosques secundarios y primarios residuales. Perú. Consultado el 22 Abril 2015. Disponible en http://www.aider.com.pe. [ Links ]
2. Álvarez, A. 2013. Caracterización química de biomasa y su relación con el poder calorífico. Tesis de Maestría. Universidad de Oviedo, Oviedo, España. [ Links ]
3. Álvarez, E., Díaz, S., Alessadrini, M. 2001. Investigación sobre los métodos para transformar el follaje y los residuos de la industria maderera en productos como piensos animales, fertilizantes, productos cosméticos y farmacéuticos. Consultado el 20 de Marzo 2015. Disponible en http://www.fao.org. [ Links ]
4. Barcenas, G., Ríos, R., Aguirre, R., Juárez, B., Honorato, J. 2008. Composición química y densidad básica relativa de la madera de dos especies arbustivas de encino blanco de la Sierra de Álvarez, SLP, México. Revista Madera y Bosques 14 (3), 81-94. [ Links ]
5. Barcenas, G., Dávalos, R. 1999. Importancia de la lignina en las contracciones de la madera; Revisión bibliográfica. Revista Madera y Bosque 5(1), 13-26. [ Links ]
6. Bernabé, R., Ávila, L., Rutiaga, J. 2013. Componentes químicos de la madera de cinco especies de pino del municipio de Morelia, Michoacán. Revista Madera y Bosques 19(2), 21-35. [ Links ]
7. Carballo, L., Orea, U., Cordero, E. 2004. Composición química de tres maderas en la provincia de pinar del río, Cuba a tres alturas del fuste comercial parte N° 1: Corymba citriodora. Revista Chapingo Serie Ciencias Forestales y del Ambiente 10(1), 57-62. [ Links ]
8. Carballo, L.R., 1990 "The influence of chemical composition and age of caribea pine wood (Pinus caribea) on the physical and mechanical properties as well as on the yield of sulfite pulp". Faculty of wood Technology, University College of Foresty and wood Technology. Dissertation Thesis of the degree of CSc Zvolen. Rep. Eslovaca. [ Links ]
9. Cea, H. 2003. Caracterización de astillas y aserrín para una planta de tableros de partículas en Valdivia. Tesis de Licenciatura, Universidad Austral de Chile, Valdivia, Chile. [ Links ]
10. Flores, O., Velásquez, J., Toro, M. 2009. Composición química del xilema de Ficus insípida Willd (Moraceae). Revista Forestal Venezolana 53 (2), 155-163. [ Links ]
11. Leal, L., Juárez, V., Terán, M. 2011. Composición química de la madera de Eucalyptus granáis Hill ex Maiden procedente de finca las Maravillas, Departamento de Oran, Salta. Revista de Ciencias Forestales 19 (1,2), 75-83. [ Links ]
12. Lima, L. 2013. Evaluación de la composición química y propiedades físicas de madera y corteza de cuatro coniferas para la producción de bioenergía. Tesis de Maestría. Universidad Autónoma de Nuevo León, Nuevo León, México. [ Links ]
13. McKean, S. 1993. Manual de análisis de suelos y tejido vegetal. Documento técnico Nro. 129, International Center for Tropical Agriculture "CIAT". Estados Unidos. [ Links ]
14. Montes, I. 2005. Enciclopedia geográfica de Bolivia. Consultado el 25 de Marzo 2015. Disponible en http://www.bolivia.com. [ Links ]
15. Navarro, G., Ferreira, W. 2007. Mapa de vegetación de Bolivia. Consultado el 25 de Marzo 2015. Disponible en http://www.rumbol.com. [ Links ]
16. Nuñez, C. 2008. Extracciones con equipo Soxhlet. Argentina. Consultado el 18 febrero 2015. Disponible en http://www.cnunez.com.ar [ Links ]
17. Nuñez, C. 2008. Pulpa y papel I; Sexta parte, 7.- Química de la madera, Introducción y Análisis. Consultado el 18 febrero 2015. Disponible en http://www.cnunez.com.ar. [ Links ]
18. Rodríguez, L., García, C. 1955. Determinación colorimétrica del Fosforo en el carbón. Boletín informativo del Instituto Nacional del Carbón 4 (20), 84-101. [ Links ]
19. Rutiaga, J., Pedraza, F., López, P. 2010. Componentes químicos principales de la madera de Dalbergia granadillo Pittier y de Platymiscium lasiocarpum Sandw. Revista Chapingo Serie Ciencias Forestales y del Ambiente 16(2), 179-186. [ Links ]
20. Rutiaga, J., Windeisen, E., Strobel, C. 2000. Composición química del duramen de la madera de Quercus candicans Neé. Revista Madera y Bosques 6 (2), 73-80. [ Links ]
21. Saccarello, M. 2010. La madera de su conocimiento a su conservación. Editorial Gente Común. La Paz, Bolivia. [ Links ]
22. Sadzawka, A., Carrasco, M., Demanet, R., Flores, H., Grez, R., Mora, M., Neaman, A., 2007. Método de análisis de tejidos vegetales. Segunda edición. Instituto de Investigaciones Agropecuarias, Santiago, Chile. [ Links ]
23. Salazar, A. H. y Pérez., J. H. 1998. "Determinación de componentes químicos de la madera de cinco especies de encino del estado de Puebla". Rev. Madera y Bosque. 4 (2), 79-93. [ Links ]
24. Serezo, R. 2015. Evaluación del desarrollo de las plantaciones de clones Eucaliptus, En los predios Las Lajitas, San Crispin y El Recreo dentro del municipio de Carmen Rivero Torrez, Santa cruz, Bolivia. Tesis de Licenciatura, Universidad Autónoma Gabriel Rene Moreno -UAGRM, Santa cruz, Bolivia. [ Links ]
25. Sun, Y., Cheng, J. 2002. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bio resource Technology 83, 1-11. [ Links ]
26. Tejeda, L., Quintana, J., Pérez, J., Young, H. 2011. Obtención de etanol a partir de residuos de poda, mediante hidrólisis acida e hidrólisis enzimática. Revista U.AD.C.A. Actualidad e Divulgación Científica 14 (1), 111-116. [ Links ]
27. Vargas, J. 2008. Comportamiento de algunos extractos de la corteza de Pino caribe (Pinuscaribeae Morelet var. Hondurensis Barret & Golfari) sobre el crecimiento de hongos xilófagos y su acción antioxidante. Documento técnico 4, Proyecto FOMABO/ESFOR-UMSS. Cochabamba, Bolivia. [ Links ]
28. WWF. 2014. Sobre Bolivia. Bolivia. Consultado el 20 de Octubre 2014. Disponible en http://bolivia.panda.org. [ Links ]












 uBio
uBio