Revista Boliviana de Química
versión On-line ISSN 0250-5460
Rev. Bol. Quim v.29 n.1 La Paz 2012
ARTÍCULO ORIGINAL
EVALUACIÓN DEL EFECTO INMUNOMODULADOR DEL ÁCIDO ÚSNICO SOBRE LA CAPACIDAD FAGOCÍTICA, ADHERENCIA, QUIMIOTAXIS CELULAR Y CITOTOXICIDAD SOBRE MONOCITOS Y POLIMORFONUCLEARES
Claudia L. Riveros González, Fernando Sosa Tordoyaa, Grace Ruiz Pinelli, Juan Antonio Avila Illanesb, Patricia Mollinedo Portugalc, José Luis Vila Castro.c
a Instituto de Servicios de Laboratorio de Diagnóstico e Investigaciones en Salud (SELADIS), Facultad de Ciencias Farmacéuticas y Bioquímicas, Av. Saavedra N° 2224, Miraflores, La Paz, Bolivia, b Instituto de Investigaciones Fármaco Bioquímicas (IIFB), Facultad de Ciencias, Farmacéuticas y Bioquímicas, Universidad Mayor de San Andrés, Av. Saavedra N° 2224, Miraflores, La Paz, Bolivia, c Instituto de Investigaciones en Productos Naturales (IIPN), Facultad de Ciencias Puras, Universidad Mayor de San Andrés, Campus Cota Cota, La Paz, Bolivia
Keywords: immunomodulating effect ¡phagocytic capacity |Adhesion |Chemotaxis| Cytotoxicity| CC50 | Usnea spp acid úsnico
ABSTRACT
This study describes the evaluation of activities cytotoxic and immunomodulating effect of the acid úsnico, secondary metabolite obtained from a lichen, Usnea sp., with a high potential leishmanicidal in vitro (IC50 10.3 ug/mL) according to research of the I. I. F. B. collected in the locality of: Pazña (Oruro, Bolivia), which is attributed to him a variety of uses in traditional medicine as be antibacterial and antifungal. The cytotoxic activity was evaluated against human cells from peripheral blood (monocytes and polymorphonuclear leukocytes), at concentrations less than or equal to 250 µg/mL, taking that the CC50 of monocytes exposed to acid úsnico per 24 hours was 63.5 µg/mL and at 48 hours was 58.9 µg/ml in relation to the Glucantime that at the same incubation time was 45.3 µg/ml and 38.6 µg/ml for polymorphonuclear cells at 6 hours of exposure showed a CC50 of 58.9 µg/ml and 12 hours a CC50 of 54.3 µg/ml, the Glucantime in the same incubation period showed a CC50 of 43.5 µg/ml and 36.5 µg/ml. On the other hand, the effect inmunomodulador of the sour úsnico specifically on the quimiotaxis, adherence, fagocitosis and the activity total hemolítica of the complement, having that the sour úsnico favors the quimiotaxis from the monocitos to the concentrations of 31,2 and 15,6 µg / mL, it increases the capacity of cellular adherence of the monocitos and polymorphonuclear cells at concentrations greater than 125 µg/ml in general reduces the percentage of cells with capacity to phagocytose at concentrations greater than 15.6 µg/ml and has an effect on the hemolytic activity of the complement system in the range of concentrations ranging between 125 and 15.6 µg/ml was a decrease of 50 % of the hemolytic activity of the complement system. These results provide a basis to suggest that the Acid Úsnico has potential for the development of drugs against Leishmania, which must be validated in future studies in vivo in animal models.
RESUMEN
Este estudio describe la evaluación de las actividades citotóxica y el efecto inmunomodulador del ácido úsnico (AU), metabolito secundario obtenido de un liquen, Usnea sp., con un alto potencial leishmanicida in vitro (CI50 10,3 µg/mL) según investigaciones del I.I.F.B., especie colectada en la localidad de Pazña (Oruro, Bolivia), a la que se le atribuye una variedad de usos en la medicina tradicional como ser antibacteriano y antifúngico. La actividad citotóxica se evaluó contra células humanas de sangre periférica (monocitos y polimorfonucleares), a concentraciones menores o iguales que 250 µg/ml, teniendo que la CC50 de los monocitos a las 24 horas fue de 63,5 |ig/l y a las 48 horas fue de 58,9 µg/ml, con relación al Glucantime fue de 45,3 µg/ml a las 24 horas y 38,6 µg/ml a las 48 horas, para las células polimorfonucleares a las 6 horas de exposición mostró una CC50 de 58,9 µg/ml y a las 12 horas un CC50 de 54,3 µg/ml, el Glucantime en el mismo periodo de incubación mostró una CC50 de 43,5 y 36,5 µg/ml. Por otra parte, el efecto inmunomodulador del AU específicamente sobre la quimiotaxis, adherencia, fagocitosis y la actividad hemolítica total del complemento favorece la quimiotaxis de los monocitos a las concentraciones de 31,2 y 15,6 µg/ml, incrementa la capacidad de adherencia celular de los monocitos y células polimorfonucleares a concentraciones mayores a 125 µg/ml, en general disminuye el porcentaje de células con capacidad de fagocitar a concentraciones mayores a 15,6 µg/ml y tiene efecto sobre la actividad hemolítica total del sistema del complemento ya que en el rango de concentraciones comprendidas entre 125 y 15,6 µg/ml produjo una disminución del 50% de la actividad hemolítica total del sistema del complemento. Estos resultados aportan bases para sugerir que el AU tiene potencial para el desarrollo de medicamentos contra Leishmania, el cual debe ser validado en estudios futuros en modelos animales.
INTRODUCCIÓN
Durante la evolución de los seres vivos se han desarrollado mecanismos para identificar agentes patógenos y eliminarlos, mediante la diferenciación de los componentes propios del organismo frente a los que muestran tolerancia. Esta labor de defensa de las agresiones externas está a cargo del sistema inmune, compuesto por un conjunto de órganos, tejidos, células y moléculas, que actúan de manera coordinada. Las primeras defensas del organismo o inmunidad innata con las que se enfrentan los agentes externos al intentar penetrar en el organismo son totalmente inespecíficas y están constituidas por barreras físicas, químicas y biológicas, características de cada localización. A finales del siglo XIX Metchnikoff se propuso convencer a la comunidad científica sobre la importancia de células inespecíficas, "los fagocitos"1,2, ya que su función es un mecanismo clave de la respuesta inmune natural, eliminando elementos nocivos y actuando como enlace entre la respuesta innata y la adquirida, además comparó la fagocitosis de bacilos del ántrax por células sanguíneas en animales sensibles y resistentes a la enfermedad y observó que era más activa en los vacunados3. Otro componente de la inmunidad innata es el sistema del complemento, un grupo de proteínas plasmáticas y de membrana celular que desempeñan un rol clave en el proceso de defensa del huésped. Actualmente se conocen más de 30 proteínas que actúan al menos bajo cuatro formas diferentes; el primero y mejor conocido es desencadenar lisis celular, bacteriano y cubierta de virus, el segundo mediar la opsonización, el tercero es la generación de fragmentos peptídicos que regulan procesos inmunológicos e inflamatorios, y el cuarto regular la actividad biológica de las células4. Las infecciones generalmente inducen una respuesta inmune como es el caso de la infección producida por Leishmania, la cual es muy compleja y varía dependiendo de diferentes factores: según la forma clínica de la enfermedad, la especie de Leishmania implicada en el proceso infeccioso y la cronicidad de la enfermedad, se genera un espectro de respuestas inmunes que incluyen desde mecanismos de inmunidad inespecífica (por ejemplo: reacciones inflamatorias) hasta mecanismos de inmunidad específica mediados por células o por anticuerpos5. En el periodo 1983-2006, fueron registrados en Bolivia, 35 714 casos autóctonos de Leishmaniasis Tegumentaria Americana y menos de 10 casos de Leishmaniasis visceral6. Recientemente el incremento de reportes de casos de resistencia al tratamiento de primera línea contra leishmaniasis (Pentostam y Glucantime), el elevado costo y efectos adversos de los medicamentos de segunda línea contra leishmaniasis (Anfotericina B y Miltefosina) ha motivado a los investigadores a seguir buscando nuevos productos terapéuticos de origen natural. Entre estos un metabolito está tomando interés por su actividad antiparasitaria y es el ácido úsnico (AU) derivado de la Usnea spp, con un alto potencial leishmanicida in vitro (CI50 10,3 µg/ml)7 también se le atribuye una variedad de usos medicinales como antibacteriano y antifúngico utilizado por la medicina natural,8 a la fecha no se han realizado ensayos para determinar su actividad inmunomoduladora in vitro, ni la citotoxicidad en células sanguíneas como: polimorfonucleares y monocitos de sangre periférica humana. Por lo tanto en el presente estudio para mejorar el entendimiento de la actividad antiparasitaria del AU, se evaluó el rol inmunomodulador del metabolito mayoritario de la Usnea spp "ácido úsnico", dando continuidad a los trabajos ya realizados sobre este producto.
RESULTADOS
Efecto citotóxico del AU, sobre monocitos y polimorfonucleares.
Densidad óptima para el aislamiento de polimorfonucleares por el método de Ficoll-Hipaque
En el aislamiento de polimorfonucleares, se obtuvo un mayor rendimiento utilizando Ficoll-Hipaque a una densidad de 1,090 g/dl, siendo el promedio de polimorfonucleares obtenidos de 89,1%, mientras que a la densidad de 1,080 g/dl se obtuvo un menor rendimiento de 41,4%. (Gráfico No. 1).
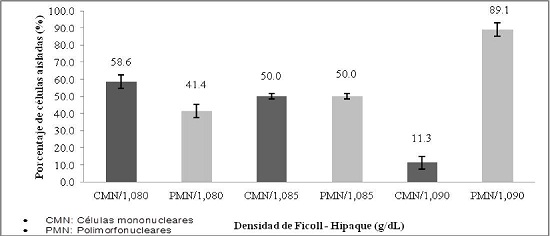
Gráfico No. 1: Evaluación in vitro del aislamiento de polimorfonucleares. Los valores representan el promedio del porcentaje ± la desviación estándar de polimorfonucleares frente a densidades de Ficoll - Hipaque. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
Viabilidad celular de polimorfonucleares
Los resultados de la evaluación de la viabilidad de células polimorfonucleares, mostraron que a las 24 horas el porcentaje de viabilidad fue 87,6 % y a las 48 horas de cultivo fue de 51,3 %. (Gráfico No. 2).
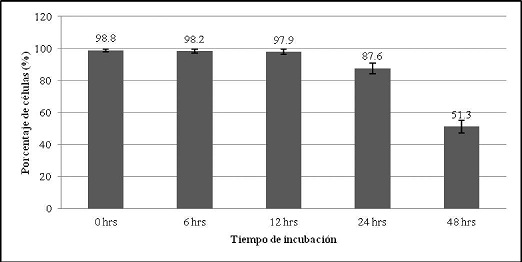
Gráfico No. 2: Evaluación de la viabilidad celular de los polimorfonucleares. Los valores representan el promedio del porcentaje ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
Efecto citotóxico del AU, sobre monocitos
La evaluación de la citotoxicidad en monocitos, mostró una concentración citotóxica del 50 % (CC50) de 63,5 µg/ml a las 24 horas de exposición con AU y con el Glucantime al mismo tiempo de incubación fue de 45,3 µg/ml. A las 48 horas de exposición el AU mostró un CC50 de 58,3 µg/ml y el Glucantime 38,6 µg/ml. (Gráfico No. 3)
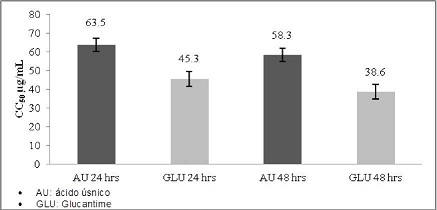
Gráfico No. 3: Citotóxicidad in vitro del ácido úsnico en comparación con el Glucantime sobre monocitos humanos. Los valores representan el promedio ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
Efecto citotóxico del AU, sobre polimorfonucleares.
La evaluación de la citotoxicidad del ácido úsnico sobre polimorfonucleares, mostró una CC50 de 58,9 µg/ml a las 6 horas de exposición y el Glucantime en el mismo periodo de incubación mostró una CC50 de 43,5 µg/ml. A las 12 horas de exposición el ácido úsnico mostró un CC50 de 54,3 µg/ml y el Glucantime 36,5 µg/ml. (Gráfico No. 4)
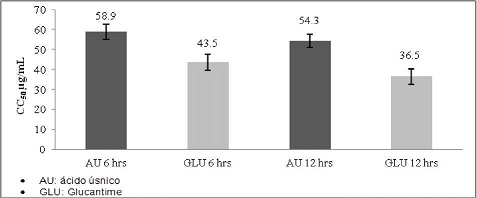
Gráfico No. 4: Citotóxicidad in vitro del AU frente a Glucantime sobre polimorfonucleares humanos. Los valores representan el promedio ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
Quimiotaxis de los monocitos y polimorfonucleares
La evaluación de la quimiotaxis de monocitos, mostró que a la concentración de 250 µg/ml de ácido úsnico los monocitos migraron 50,82 µm, mientras que a la concentración de 15,6 ng/ml migraron 66,44 µm. Por otra parte el Glucantime, a 250 µg/ml indujo una migración en un 46,12 µm, mientras que a la concentración de 15,6 µg/ml los monocitos migraron 61,51 µm. El control positivo de quimiotaxis (lipopolisacarido) utilizado a 1 µg/ml, indujo una migración de 81,57 µm y el control negativo (colchicina) utilizado a 1 µg/ml, indujo una migración de 15,33 µm. La muestra sin tratar indujo una migración de 50,3 µm. (Gráfico No. 5)
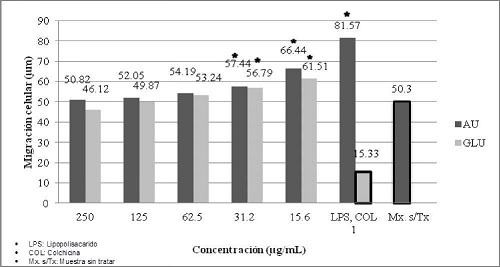
Gráfico No. 5: Evaluación in vitro de la migración de monocitos hacia los metabolitos utilizados. Los valores representan el promedio ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
La evaluación de la quimiotaxis de polimorfonucleares, mostró que a la concentración de 250 µg/ml del AU los polimorfonucleares migraron 60,21 µm, mientras que a la concentración de 15,6 µg/ml migraron 70,78 µm. Por otra parte, el Glucantime a 250 µg/ml indujo una migración de 48,89 µm, mientras que a la concentración de 15,6 µg/ml los polimorfonucleares migraron 65,35 µm. El lipopolisacárido utilizado como control positivo de quimiotaxis a 1 µg/ml, indujo una migración de 87,05 µm y el control negativo (colchicina) utilizado a 1 µg/ml, indujo una migración de 18,35 µm. La muestra sin tratar estimuló una migración de 55,5 µm. (Gráfico No. 6)
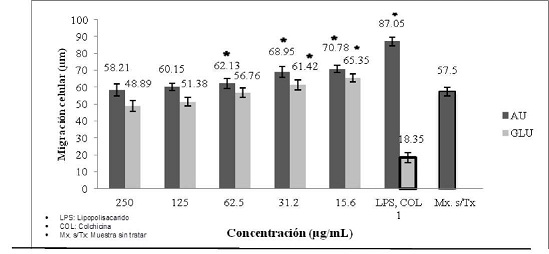
Gráfico No. 6: Evaluación in vitro de la migración de polimorfonucleares hacia los metabolitos utilizados. Los valores representan el promedio ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
Adherencia de los monocitos y polimorfonucleares
La evaluación de la adherencia celular de monocitos, a la fibra de nailon mostró que a la concentración de 250 µg/ml de AU el porcentaje de células adheridas fue del 36,3 % y a 15,6 µg/ml de 26,2 % de monocitos. Por otra parte el Glucantime, a 250 µg/ml estimuló adherencia del 28,6 %, mientras que a la concentración de 15,6 µg/ml un 20,3 %. El lipopolisacárido control positivo de adherencia utilizado a 1 µg/ml, indujo una adherencia del 39,7 % de los monocitos y las células sin tratar (control negativo) mostraron una adherencia del 27,1 % de monocitos. (Gráfico No. 7)
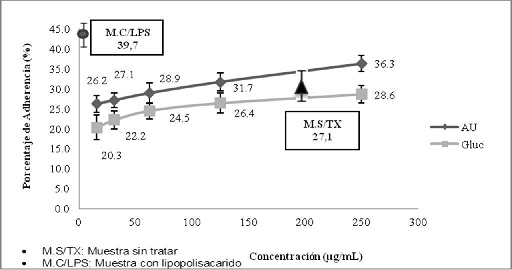
Gráfico No. 7: Evaluación in vitro de la adherencia de monocitos hacia los metabolitos utilizados. Los valores representan el promedio de porcentaje ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
La evaluación de la adherencia de polimorfonucleares, expuestos a 250 µg/ml de ácido úsnico, mostró un porcentaje de células adherentes del 23,5 % y a 15,6 µg/ml un porcentaje del 14,7 %. Por otra parte el Glucantime, a 250 µg/ml indujo adherencia del 15,9 %, mientras que a la concentración de 15,6 µg/ml un 7,9 %. El lipopolisacárido control positivo de adherencia utilizado a 1 µg/ml, indujo una adherencia del 28,0 % de células polimorfonucleares y las células sin tratar (control negativo) mostraron una adherencia del 14,8 % de células polimorfonucleares. (Gráfico No. 8).
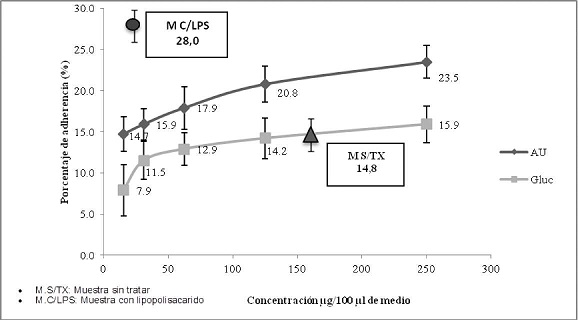
Gráfico No. 8: Evaluación in vitro de la adherencia de polimorfonucleares hacia los metabolitos utilizados. Los valores representan el promedio de porcentaje ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
Capacidad fagocítica de monocitos y polimorfonucleares
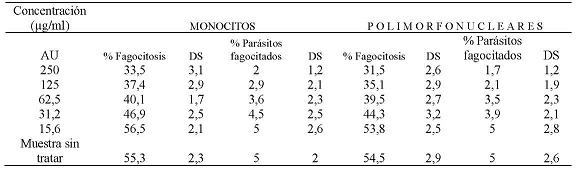
La evaluación de la capacidad fagocítica de monocitos y polimorfonucleares expuestos al AU, enfrentados con promastigotes de Leishmania braziliensis, sin opsonizar, mostró que a una concentración de 250 µg/ml el 33,5 % y el 31,5 % de monocitos y polimorfonucleares respectivamente fagocitaron promastigotes de Leishmania braziliensis. También, se encontró que a esta concentración el promedio de promastigotes fagocitados era de 2 y 1,7 parásitos por célula respectivamente. A la CC50 que fue de 63,5 µg/ml para monocitos el porcentaje de células fagocíticas fue del 40,1 % con un promedio de 3,6 parásitos por célula, a la CC50 que fue de 58,9 µg/ml para células polimorfonucleares, donde el porcentaje de células fagocíticas fue del 39,5 % con un promedio de 3,5 parásitos por célula. A la concentración de 15,6 µg/ml el porcentaje de monocitos que fagocitaron fue del 56,5 % y de células polimorfonucleares que fagocitaron fue del 53,8 %, ambos tipos celulares a esta concentración mostraron fagocitar un promedio de 5 parásitos. (Tabla N° 1)
Tabla No. 1: Evaluación in vitro de la capacidad fagocítica de los monocitos y polimorfonucleares frente a las diferentes concentraciones utilizadas del AU. Los valores representan el promedio de porcentaje de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
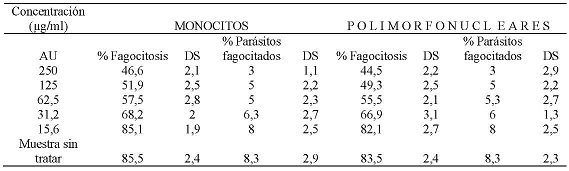
La evaluación de la capacidad fagocítica de monocitos y polimorfonucleares expuestos al AU, enfrentados con promastigotes de Leishmania braziliensis opsonizados, mostró que a una concentración de 250 µg/ml el 46,6 % y el 44,5 % de monocitos y polimorfonucleares respectivamente fagocitaron promastigotes de Leishmania braziliensis. También, se encontró que a esta concentración el promedio de promastigotes opsonizados fagocitados era de 3 parásitos por célula respectivamente. A la CC50 que fue de 63,5 µg/ml para monocitos el porcentaje de células fagocíticas fue del 57,5 % con un promedio de 5 parásitos por célula, a la CC50 que fue de 58,9 µg/ml para células polimorfonucleares, donde el porcentaje células fagocíticas fue del 55,5 % con un promedio de 5,3 parásitos por célula. A la concentración de 15,6 µg/ml el porcentaje de monocitos que fagocitaron fue del 85,1 % y de células polimorfonucleares que fagocitaron fue del 82,1 %, ambos tipos celulares a esta concentración mostraron fagocitar un promedio de 8 parásitos. (Tabla No. 2)
Tabla No. 2: Evaluación in vitro de la capacidad fagocítica de los monocitos y polimorfonucleares frente a las diferentes concentraciones utilizadas del AU. Donde los parásitos fueron previamente opsonizados con suero de pacientes positivos por frotis y serología para leishmaniasis. Los valores representan el promedio de porcentaje de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
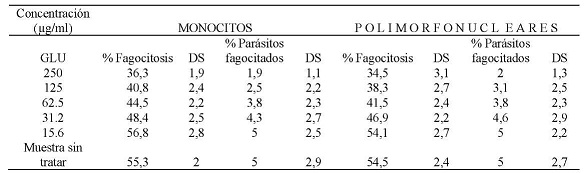
La evaluación de la capacidad fagocítica de monocitos y polimorfonucleares expuestos al Glucantime, enfrentados con promastigotes de Leishmania braziliensis, sin opsonizar, mostró que a una concentración de 250 µg/ml el 36,3 % y el 34,5 % de monocitos y polimorfonucleares respectivamente fagocitaron promastigotes de Leishmania braziliensis. También, se encontró que a esta concentración el promedio de promastigotes fagocitados era de 2 parásitos por célula respectivamente. A la CC50 que fue de 45,3 µg/ml para monocitos el porcentaje células fagocíticas fue del 44,5 % con un promedio de 3,8 parásitos por célula, a la CC50 de 43,5 µg/ml para células polimorfonucleares el porcentaje células fagocíticas fue del 41,5 % con un promedio de 3,8 parásitos por célula. A la concentración de 15,6 µg/ml el porcentaje de monocitos que fagocitaron fue del 56,8 % y de células polimorfonucleares que fagocitaron fue del 54,1 %, ambos tipos celulares a esta concentración mostraron fagocitar un promedio de 5 parásitos. (Tabla N° 3)
Tabla N° 3: Evaluación in vitro de la capacidad fagocítica de monocitos y polimorfonucleares frente a. las diferentes concentraciones utilizadas de Glucantime. Los valores representan el promedio de porcentaje de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
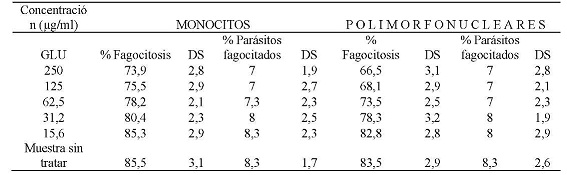
La evaluación de la capacidad fagocítica de monocitos y polimorfonucleares expuestos al Glucantime, enfrentados con promastigotes de Leishmania braziliensis, opsonizados, mostró que a una concentración de 250 µg/ml el 73,9 % y el 66,5 % de monocitos y polimorfonucleares respectivamente fagocitaron promastigotes de Leishmania braziliensis opsonizados. También, se encontró que a esta concentración el promedio de promastigotes fagocitados era de 7 parásitos por célula respectivamente. A la CC50 que fue de 45,3 µg/ml para monocitos el porcentaje células fagocíticas fue del 78,2 % con un promedio de 7,3 parásitos por célula, a la CC50 de 43,5 µg/ml para células polimorfonucleares el porcentaje células fagocíticas fue del 73,5 % con un promedio de 7 parásitos por célula. A la concentración de 15,6 µg/ml el porcentaje de monocitos que fagocitaron fue de 85,3 % con un promedio de 8,3 parásitos por célula, las células polimorfonucleares a esta concentración fagocitaron el 82,8 %, con un promedio de 8 parásitos por célula. (Tabla N° 4).
Tabla N° 4: Evaluación in vitro de la capacidad fagocítica de monocitos y polimorfonucleares frente a las diferentes concentraciones utilizadas de Glucantime.Los parásitos fueron previamente opsonizados con suero de pacientes positivos por frotis y serología para leishmaniasis. Los valores representan el promedio de porcentaje de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
Efecto inmunomodulador del AU sobre la actividad hemolítica total del complemento.
La evaluación del efecto inmunomodulador del ácido úsnico sobre la actividad hemolítica total del sistema del complemento, mostró que las muestras tratadas con una concentración de 125 µg/ml de AU dieron un valor de 96,5 U/ml y a 15,6 µg/ml un valor de 108,2 U/ml. Por otra parte el Glucantime, a 125 µg/ml, mostró un 89 U/ml, mientras que a la concentración de 15,6 µg/ml un 93,5 U/ml. Las muestras sin tratar tenían 200 U/ml de actividad hemolítica y las muestras tratadas con dimetilsulfóxido (DMSO), utilizado como diluyente para preparar AU a la concentración de 125 µg/ml produjo un resultado de 175 U/ml de actividad hemolítica. (Gráfico N° 9).
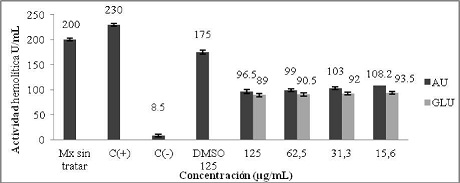
Gráfico N° 9: Evaluación in vitro del efecto inmunomodulador del AU sobre la actividad hemolítica total del complemento. Los valores representan el promedio de porcentaje ± la desviación estándar de los ensayos realizados. Para la evaluación se realizaron tres ensayos cada uno por triplicado.
DISCUSIÓN
Densidad óptima para el aislamiento de células polimorfonucleares por el método de Ficoll-Hipaque
En la literatura científica se han utilizado diferentes densidades para el aislamiento de células polimorfonucleares por el método de gradiente de densidades. Nuestro estudio se basó en los trabajos realizados por Kuo et al. y Sedgwick et al. 9 10, en ambos protocolos se emplea como agente de separación el Percoll, agente similar al Ficoll-Hipaque que trabaja bajo el mismo fundamento de separación de células por gradiente de densidad. Kuo et al. y Sedgwick et al., emplearon Percoll a diferentes densidades, 1,080, 1,085 y 1,090 g/dl; hallando la densidad de 1,085 g/dl para el aislamiento de células polimorfonucleares, obteniendo un rendimiento del 78 % de células polimorfonucleares aisladas. En nuestro estudio en lugar de emplear Percoll se utilizó Ficoll-Hipaque, con el cual determinamos que la densidad óptima para el aislamiento de polimorfonucleares por el método de Ficoll-Hipaque es a la densidad de 1,090 g/dl, obteniéndose un rendimiento del 89,1% (Gráfico N° 2).
Para el aislamiento de células polimorfonucleares, se siguió el protocolo planteado por Sedgwick et al., que aisló células mononucleares con Ficoll-Hipaque, a una densidad de 1,077 g/dl, proceso realizado con la finalidad de evitar el entremezclado de células mononucleares y polimorfonucleares. Una vez obtenidas las células mononucleares, se trasvasó a un tubo Falcon para realizar los ensayos planificados con esas células. Posteriormente, se volvió a resuspender el remanente celular, donde se encontraban las células polimorfonucleares, el cual fue trasvasado a un tubo Falcon que contenía Ficoll-Hipaque a 1,090 g/dl, obteniendo un mayor rendimiento en el aislamiento de polimorfonucleares. No obstante, en nuestro estudio, también se empleo Ficoll-Hipaque a diferentes densidades tales como: 1,080 y 1,085 g/dl, en las que el porcentaje de aislamiento de células polimorfonucleares fue menor, pudiéndose observar también células mononucleares e inclusive se llegó a observar la presencia de glóbulos rojos, fenómeno que puede ser atribuido a la densidad de estos agentes celulares.
Viabilidad celular de polimorfonucleares
Una vez realizado el aislamiento de células polimorfonucleares por el método de Ficoll-Hipaque a la densidad de 1,090 g/dl, se determinó la viabilidad de las células polimorfonucleares en relación al tiempo de incubación con medio RPMI 1640. Este aspecto fue importante determinar debido a que las células polimorfonucleares son de vida corta y la bibliografía difiere en este aspecto ya que menciona que la vida media es de 6 a 8 horas11. El tener en cuenta el tiempo de vida celular es importante y más aun cuando se realizan estudios de citotoxicidad, en este trabajo uno de los objetivos fue realizar el ensayo citotóxico del AU sobre las células polimorfonucleares. para lo cual se necesitó conocer la vida media in vitro de estas células. evitando así la posibilidad de resultados falsos positivos en el ensayo de citotoxicidad. En el estudio se pudo observar que a las 6 horas de incubación hubo un 98.2 % de viabilidad celular. a las 12 horas un 97.9 %. mientras que a las 24 y 48 horas fue del 87.6 y 51.3 % respectivamente. (Gráfico N° 2). conociendo estos resultados se realizó el ensayo citotóxico del AU sobre las células polimorfonucleares a las 6 y 12 horas de incubación. donde el porcentaje de mortalidad no supera el 4 %. Otros investigadores como Schinella G. et al}2. en sus ensayos de citotoxicidad de ácido polómico. sobre las células polimorfonucleares. realizaron su evaluación a las 3 y 6 horas de exposición. ya que a tiempos mayores todas las células polimorfonucleares realizaban apoptosis. porque este ácido polómico es un inhibidor de la viabilidad de los polimorfonucleares.
Efecto citotóxico del AU, sobre monocitos y polimorfonucleares.
La CC50 del Au sobre los monocitos a las 24 horas de exposición fue de 63.5 µg/ml. concentración a la cual hubo un 50 % de mortalidad celular. En el caso de las células polimorfonucleares se obtuvo a las 6 horas de incubación una CC50 de 58.9 µg/ml. Según los criterios definidos por el Programa de Estudios de Enfermedades Tropicales PECET 65. el AU mostró ser un producto tóxico debido a que valores mayores a 10 y menores a 100 µg/m son considerados como productos tóxicos. Aunque los mecanismos específicos de citotóxicidad se desconocen. recientemente. se ha sugerido que el AU pertenecería a la clase de productos denominados "agentes desacopladores". estos productos actuarían sobre la respiración mitocondrial evitando la síntesis de ATP y la fosforilación oxidativa; o bien. pudiera involucrar cambios en la permeabilidad de las membranas. lo que puede ocasionar lisis de los monocitos y polimorfonucleares o alteraciones en la actividad de enzimas mitocondriales que conducirían a la muerte celular13.
Quimiotaxis de monocitos y polimorfonucleares
Basados en los estudios realizados por Chenoweth et al.14. se realizó el ensayo de quimiotaxis. En el caso de la sustancia quimioatractante (control positivo) Chenoweth et al.. plantean usar el componente C5a del sistema del complemento. ya que aumenta la migración direccional (quimiotaxis) de las células polimorfonucleares. en su estudio encontraron que inducía una migración celular de 65 µm de distancia. El lipopolisacarido (componente característico de la pared celular de la bacteria gram negativa E. coli serotipo 026:B6). también es un indicador de quimiotaxis15. aspecto que fue verificado en este estudio. induciendo una migración celular de 81.57 µm y 87.05 µm de distancia para monocitos y polimorfonucleares respectivamente. Los resultados determinaron que el AU. induce una mayor migración celular de los monocitos y células polimorfonucleares. a las concentraciones de 31.2 y 15.6 µg/ml. con respecto a la muestra sin tratar; la droga control (Glucantime) solo mostró inducción de migración en ambos tipos celulares a la concentración de 15.6 µg/ml. (Gráfico N° 5).
A concentraciones mayores a 31.2 µg/ml. no se encontró diferencia en la inducción de quimiotaxis entre el AU y el Glucantime con respecto a la muestra sin tratar. este aspecto puede ser debido a la citotoxicidad de ambos productos. ya que a concentraciones mayores a 58.9 µg/ml y 43.5 µg/ml respectivamente hay un 50% de mortalidad celular. (Gráfico N° 3 y 4). La extravasación o la migración de células monocíticas y polimorfonucleares (neutrófilos) desde el sistema vascular a los sitios de exposición de patógenos es un evento clave en la defensa inmune. por lo cual los leucocitos tienen la característica de llegar al lugar preciso en el momento requerido. Lo logran gracias al efecto coordinador de cuatro sistemas de moléculas: 1) citoquinas como TNF e IL-1; 2) mediadores de inflamación como histamina. trombina. prostaglandina y leucotrienos; 3) factores del complemento como C5a; y 4) quimioquinas como la IL-8 que atraen al lugar requerido diferentes tipos de células 16. Según los resultados el AU indujo mayor capacidad de migración celular. sin el efecto coordinador de los cuatro sistemas ya mencionados. por lo que la respuesta inmune se beneficia con una mayor cantidad y velocidad de migración celular de parte de los polimorfonucleares y monocitos enfrentados con AU.
Adherencia de monocitos y polimorfonucleares
Este ensayo se baso según estudios realizados por Christou et al}1. que utilizó una modificación a la técnica propuesta por McGreggor et al.. se trata de una técnica que utiliza la propiedad de adherencia de las células a la fibra de nailon. donde McGreggor et al.. realizó el ensayo de adherencia de polimorfonucleares a partir de sangre entera y
Christou et al., a partir de polimorfonucleares purificados. En la técnica de McGreggor, no era posible medir exactamente el porcentaje de polimorfonucleares adheridos a la fibra de nailon, por contaminación con células mononucleares adherentes, por lo cual Christou et al., realizó comparaciones entre la adherencia de polimoronucleares purificados y polimorfonucleares a partir de sangre entera de los mismos pacientes, observándose que existía la contaminación ya mencionada.
Los resultados obtenidos demuestran que el AU a concentraciones mayores a 200 µg/ml en el caso de los monocitos y mayores a 125 µg/ml en caso de las células polimorfonucleares, incrementa la capacidad de adherencia celular, lo cual sugeriría que el AU a concentraciones elevadas estimula la expresión de moléculas de adherencia celular como ser las integrinas (LFA-1, VLA-4, Mac-1, etc.), que juegan un papel muy importante en la respuesta inmunológica, especialmente en lo que se refiere al proceso de la inflamación. Para ambos tipos celulares se determinó que el Glucantime no incrementa la capacidad de adherencia celular y que a concentraciones menores a 62,5 µg/ml disminuye significativamente la capacidad de adherencia celular.
Capacidad fagocítica de monocitos y polimorfonucleares
Para determinar la capacidad fagocítica de células mononucleares y células polimorfonucleares, se trabajó con promastigotes de Leishmania braziliensis en fase estacionaria de crecimiento, esto fue realizado en base a los resultados de los estudios realizados en 1984 por Sacks y Perkins18, que empleando macrófagos peritoneales murinos, informaron que la infectividad de promastigotes de Leishmania major obtenidos en fase estacionaria era mayor que la de promastigotes obtenidos en fase logarítmica de crecimiento. En este ensayo se utilizó tanto promastigotes opsonizados con un pool de sueros de pacientes con leishmaniasis y promastigotes sin opsonizar. En ambos ensayos se observó que, ni el AU, ni el Glucantime incrementan las capacidades fagocíticas de las células evaluadas con respecto al control negativo utilizado (células cultivadas en medio de cultivo sin estímulo de AU o Glucantime respectivamente).
Se observó que tanto el ácido úsnico como el Glucantime a concentraciones mayores a 62,5 µg/ml disminuyen significativamente el porcentaje de células con capacidad fagocítica y el número de parásitos fagocitados con respecto al control de fagocitosis. En el caso de los monocitos frente a los parásitos opsonizados se evidenció que el Glucantime no disminuye significativamente el porcentaje de parásitos fagocitados a partir de la concentración de 62,5 µg/ml, aunque hasta la concentración de 250 µg/ml no afecta el porcentaje de parásitos fagocitados por célula. En el caso de los polimorfonucleares frente a los parásitos opsonizados se evidenció que el Glucantime no disminuye significativamente el porcentaje de parásitos fagocitados a partir de la concentración de 31,2 µg/ml, aunque hasta la concentración de 250 µg/ml no afecta el porcentaje de parásitos fagocitados por célula. El AU mostró una disminución del porcentaje de parásitos fagocitados por monocitos y polimorfonucleares desde la concentración de 31,2 µg/ml y mostró una diferencia en el promedio de parásitos fagocitados a la concentración de 250 µg/ml. No se sabe cuál es el mecanismo específico, considerando que es un posible agente desacoplador, estos productos actuarían sobre la respiración mitocondrial (evitando la síntesis de ATP y la fosforilación oxidativa) 13, por lo cual a mayor concentración de este producto menor síntesis de ATP y las células no tendrían suficiente capacidad energética para realizar el proceso de fagocitosis, bajando de esta manera la cantidad de parásitos fagocitados por célula, o que produzca menor cantidad de receptores celulares en la célula fagocítica. La fagocitosis sólo se desencadena cuando los receptores de la superficie celular se unen a la partícula que va a ser fagocitada. Por lo que se propone que el AU se una a los receptores de superficie celular y bloquee los sitios de unión de los antígenos del parasito y es por esto que a concentraciones mayores del AU menor capacidad de fagocitosis, o que este porcentaje de fagocitosis se vea afectada por la citotoxicidad del AU y Glucantime sobre las células evaluadas, para confirmar o descartar estas hipótesis se deben realizar más estudios al respecto.
Efecto inmunomodulador del ácido úsnico sobre la actividad hemolítica total del complemento (AHTC).
El efecto inmunomodulador del AU sobre la actividad hemolítica total del complemento se determinó mediante la técnica de ELISA (IMTEC-Complement Activity). Los resultados muestran que tanto el AU como el Glucantime, presentaron actividad inhibitoria de la AHTC (Gráfico No. 9). Lemus et al.19, quien trabajó con seis plantas medicinales de Guatemala, encontró que los extractos de las plantas evaluadas presentan una actividad inhibitoria del complemento, e indicó que este efecto podía deberse a la interferencia con los componentes Ci, C2, C3 y C4, ó a la presencia de agentes quelantes de los cationes divalentes Ca+2y Mg+2. Se considera de importancia el hallazgo del efecto inhibidor observado en el AU porque este metabolito no había sido reportado como poseedor de dicha actividad u otra similar en la literatura previa revisada. Estos resultados dan la pauta para estudios más profundos y especializados para determinar los principios activos presente y proveen vistas prometedoras a su aplicación en el campo de la inmunofarmacología. Estas aplicaciones incluyen el uso como inmunosupresores sobre el sistema de complemento y todo lo que este conlleva. proveer acción anti-inflamatoria y disminuir los efectos de amplificación de la respuesta inmune. Todo esto beneficiaría específicamente a pacientes que padecen enfermedades autoinmunes o de tipo inflamatorio20.
CONCLUSIONES
Se determinó que el AU es un componente con actividad citotóxica sobre monocitos y células polimorfonucleares determinándose para monocitos una CC50 de 63.5 µg/mL a las 24 horas y de 58.3 µg/ml a las 48 horas. En el caso de las células polimorfonucleares se determinó una CC50 de 58.9 µg/ml a las 6 horas y de 54.3 µg/ml a las 12 horas. también se determinó que el AU tiene menor efecto citotóxico frente a las células evaluadas con la droga de uso convencional Glucantime.
El AU favorece la quimiotaxis de los monocitos. a las concentraciones de 31.2 y 15.6 µg/ml y en las células polimorfonucleares el rango de concentraciones es de 62.5 a 15.6 µg/ml. el Glucantime para ambos tipos celulares favorece la quimiotaxis en el rango de concentraciones de 31.2 y 15.6 µg/ml. Incrementa la capacidad de adherencia celular de los monocitos como de las células polimorfonucleares a concentraciones mayores a 125 µg/ml y el Glucantime no incrementa la capacidad de adherencia de las células evaluadas.
La evaluación del rol del AU sobre la capacidad fagocítica de monocitos y polimorfonucleares. mostró que a concentraciones mayores de 15.6 µg/ml disminuye el porcentaje de células con capacidad de fagocitar y que a concentraciones mayores a 125 µg/ml afecta el promedio de parásitos fagocitados por célula. Tiene efecto sobre la actividad hemolítica total del sistema del complemento ya que en el rango de concentraciones comprendidas entre 125 y 15.6 µg/ml produjo una disminución del 50 % de la actividad hemolítica total del sistema del complemento. similar hallazgo se encontró para el Glucantime.
SECCION EXPERIMENTAL PROCEDIMIENTOS
Efecto citotóxico del AU, sobre monocitos y polimorfonucleares Aislamiento de monocitos
Las células mononucleares de sangre periférica se aislaron a partir de sangre anticoagulada con heparina. por el método de centrifugación con Ficoll-Hipaque (MP Biomedicals) a una densidad de 1.077. Una vez obtenida la muestra. se centrifugó a 1100 rpm por 10 min. posteriormente el sedimento globular se resuspendió con buffer fosfato salino (PBS) celular estéril al 1*. para luego cargar sobre 3 ml del Ficoll-Hipaque. se centrifugó a 1 550 rpm durante 25 min. obteniéndose una interface. la cual fue recuperada con la ayuda de una pipeta Pasteur y se lavó tres veces con PBS. por centrifugación a 1 100 rpm por 10 min El pellet o botón celular obtenido se resuspendió en medio RPMI 1640 (SIGMA-Aldrich) suplementado con antibióticos (penicilina y estreptomicina). para realizar el recuento de células mononucleares en una cámara de Neubauer. Una vez ajustada a la concentración requerida de 5*105 células/pozo. se procedió a sembrar en placas de cultivo de 96 pozos. se incubó a 37 °C. 5% de CO2 y 99% de humedad relativa. por tres horas. Al final de la incubación. a fin de eliminar todas las células no adherentes (linfocitos). se desecho el sobrenadante y se lavaron las células adheridas dos veces con medio de cultivo. Posteriormente los monocitos fueron resuspendidos con 100 µl de medio RPMI 1640.
Densidad óptima para el aislamiento de células polimorfonucleares por el método de Ficoll-Hipaque
En base a trabajos realizados por Kuo y Sedgwick910. se preparó Ficoll-Hipaque a diferentes densidades 1.080. 1.085 y 1.090. Se obtuvieron muestras de sangre periférica humana anticoagulada con heparina. un volumen aproximado de 8 ml. del cual se aisló células mononucleares y posteriormente células polimorfonucleares del sedimento globular restante. el cual fue resuspendido en PBS. para luego cargar sobre 3 ml del Ficoll-Hipaque a densidades de 1.080. 1.085 y 1.090. con mucho cuidado para evitar que ambas soluciones se mezclen. se centrifugó a 1 550 rpm durante 20 min, obteniéndose una interface, el cual se recuperó con la ayuda de una pipeta Pasteur y se lavó tres veces con PBS celular al 1*, por centrifugación a 1 100 rpm por 10 min cada vez. El pellet obtenido se resuspendió con PBS celular estéril al 1*, se realizaron extensiones celulares (frotis) y posterior tinción con el colorante panóptico, se realizó el recuento de células polimorfonucleares, 200 células por cada frotis, obteniendo así los porcentajes de pureza del aislamiento de células polimorfonucleares.
Viabilidad celular de polimorfonucleares
Una vez aislados y resuspendidos los polimorfonucleares en medio RPMI 1640, se realizó el recuento celular, para ajustar a la concentración requerida de 5*105 células/pozo, se procedió a sembrar en placas de cultivo de 96 pozos, incubándose a 37 °C en 5% de CO2 y 99% de humedad relativa, por un periodo de 6, 12, 24 y 48 horas. Al final de cada periodo de se realizó el correspondiente recuento de 100 células polimorfonucleares, por el método de coloración supravital con azul tripán, obteniendo así los porcentajes de viabilidad y mortalidad celular.
Efecto citotóxico del AU, sobre monocitos
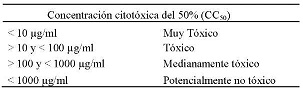
Para la evaluación de la citotoxicidad, se realizó el cultivo de monocitos en medio RPMI 1640 suplementado con 10% (v/v) de suero fetal bovino (SBF), en placas de cultivo de 96 pozos a una concentración de 5*105 células/pozo, posteriormente se añadió 100 µL de AU a concentraciones de (250; 125; 62,5; 31,2 y 15,6 µg/ml). Como control negativo se tomó células sin tratar y como control de citotoxicidad se tomó células tratadas con el fármaco de uso convencional Glucantime a concentraciones de (250; 125; 62,5; 31,2 y 15,6 µg/ml). Se realizó tres ensayos cada uno por triplicado, las placas se incubaron a 24 y 48 horas, tiempo necesario para que las células puedan incorporar las sustancias de los extractos. Pasado estos períodos de incubación se removieron los monocitos con medio RPMI 1640 a 4 °C, para proceder al recuento de células en cámara de Neubauer. Se determinó la citotoxicidad del AU sobre los monocitos mediante el método de coloración supravital con azul tripán, obteniéndose así la concentración citotóxica del 50% (CC50). Para determinar la toxicidad del producto se siguieron los criterios según PECET. (Tabla N° 5).
Tabla N° 5. Clasificación del grado de citotoxicidad para extractos y fracciones derivados de plantas y productos naturales. Criterios definidos por el Programa de Estudio y Control de Enfermedades Tropicales, PECET, con base en las investigaciones realizadas desde 1992 65.
Efecto citotóxico del AU, sobre polimorfonucleares.
Para determinar la citotoxicidad del AU sobre células polimorfonucleares se utilizaron 5*105 células polimorfonucleares por pozo contenidas en un volumen de 100 µl de medio RPMI 1640, se añadió 100 µl de AU a concentraciones de (250; 125; 62,5; 31,2 y 15,6 µg/ml). Como control negativo se tomaron células polimorfonucleares sin tratar y como control de citotoxicidad se tomaron células tratadas con Glucantime a concentraciones de (250; 125; 62,5; 31,2 y 15,6 µg/ml), incubándose a 37 °C en atmósfera húmeda, 5% de CO2, durante 6 y 12 horas. El ensayo se realizó por triplicado. La citotoxicidad se evaluó mediante el método de coloración supravital con azul tripán a través del conteo de células polimorfonucleares en cámara de Neubauer, con el objetivo de encontrar la CC50 del ácido AU sobre las células polimorfonucleares.
Quimiotaxis de monocitos y polimorfonucleares
Después del aislamiento de monocitos y células polimorfonucleares, se realizó la prueba de quimiotaxis, se preparó gel agarosa-gelatina, posteriormente se procedió a vaciar el gel en placas de portaobjetos, una vez gelificadas se fabricó los pozos alineados en tres filas, donde se sembraron 10µl de monocitos o polimorfonucleares a una concentración de 2,5*106 células/pozo, en los pozos centrales, posteriormente se sembró 10µ1 de lipopolisacárido como control positivo de quimiotaxis a una concentración de 1 µg/ml, 10µl de colchicina como control negativo de quimiotaxis a una concentración de 1 µg/ml, 10µl de AU y Glucantime a concentraciones de 250; 125; 62,5; 31,2 y 15,6 µg/ml, y 10µl de medio RPMI 1640 en los pozos periféricos se incubó a 37 °C, 5% de CO2 y 99% de humedad relativa, por 2 horas. Pasado este tiempo se fijaron las células con metanol p.a. durante media hora, posteriormente se cambio por otro fresco dejando en incubación durante 18 horas. Cumplido el tiempo se realizó la tinción panóptica (MG - 6) de las placas, luego se observó en el microscopio óptico con aumento 10* y se realizó medidas de las distancias de migración de monocitos y polimorfonucleares ver, (Figura N° 1).
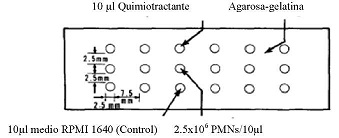
Figura N° 1: Esquema de la localización de los pozos en gel de agarosa-gelatina.
Adherencia de los monocitos y polimorfonucleares
La determinación del efecto del AU sobre la capacidad de adherencia de monocitos y polimorfonucleares fue determinada por el método propuesto por Christou N. y cols., que se basa en la capacidad de adherencia de células a la fibra de nailon17. Después del aislamiento de monocitos y polimorfonucleares, se procedió a sembrar en placas de cultivo de 24 pozos con AU a concentraciones de (250; 125; 62,5; 31,2 y 15,6 µg/ml), se utilizó como control positivo de adherencia al lipopolisacarido (1µg/ml)13, como control negativo células sin tratar, cultivadas en medio RPMI 1640 solamente y células tratadas con Glucantime (250; 125; 62,5; 31,2 y 15,6 µg/ml), dejando incubar en medio RPMI 1640 a 37 °C y 5 % de CO2 por 2 horas, para la realización de esta prueba se utilizó jeringas de tuberculina con aguja 25G colocada sobre un tubo de ensayo de 10 cm de longitud y 2 cm de ancho. La jeringa fue previamente empaquetada con 5 mg de fibrade nailon pre-humedecida con 1 ml de medio RPMI 1640 (Figura N° 8). El sistema fue calentado a 37 °C en estufa por 30 min. Posteriormente, se depositó 1 ml de células en medio RPMI 1640, aisladas anteriormente y tratadas en placas de cultivo de 24 pozos con AU y Glucantime, a la parte superior de la fibra de nailon, con una jeringa de tuberculina aguja 16G, dejando atravesar el espesor de la fibra, a 37 °C. Cada ensayo se procesó por triplicado, las lecturas fueron hechas mediante el conteo de células que pasaron a través de la fibra en cámara de Neubauer. Para obtener el resultado del porcentaje de células adheridas se uso la siguiente fórmula:

Capacidad fagocítica de monocitos y polimorfonucleares:
La función más relevante en los monocitos y neutrófilos (polimorfonucleares) es sin duda el proceso de la fagocitosis y destrucción intracelular de microorganismos. proceso que se ve facilitado por la acción de las opsoninas. Mediante el co-cultivo en el sistema quadriperm (SIGMA aldrich) de células fagocíticas y promastigotes de Leishmania (V) braziliensis. sin opsonizar y opsonizados con suero de pacientes con leishmaniasis. sometidos a diferentes concentraciones de AU. se evaluó si tiene un efecto modulador en la capacidad fagocítica. de estas células. Primeramente se cultivaron promastigotes de Leishmania (V) braziliensis (MH0M/BR/75/M2903). a 26 °C en medio Schneider's Insects Médium (SIGMA) suplementado con 10 % (v/v) de suero fetal bobino (SFB) y antibióticos (estreptomicina y penicilina). Por separado. se incubaron en experimentos independientes monocitos y polimorfonucleares a una concentración de 5*105 cel/ml. a estos se añadió por una parte promastigotes de Leishmania braziliensis sin opsonizar. cosechados en la fase estacionaria de crecimiento a una concentración de 1,5*107 parásitos/ml (relación 1:30), al mismo tiempo se añadió AU y Glucantime a concentraciones de 250; 125; 62,5; 31,2 y 15,6 µg/ml. Por otra parte para evaluar la acción del AU sobre la capacidad fagocítica de las células evaluadas sobre promastigotes de Leishmania braziliensis opsonizados, se incubó los promastigotes por una hora a 26 °C, con un pool de sueros de pacientes positivos para Leishmaniasis, al cabo de este tiempo se añadieron al sistema experimental, en relación (1:30), con las correspondientes concentraciones de AU y Glucantime. El sistema experimental fue incubado a 37 °C en 5% CO2 y 99% de humedad relativa, durante 2 horas para permitir el proceso de fagocitosis, pasado este tiempo se efectuó el recuento de 200 células y se determinó el porcentaje de células que fagocitaron y no fagocitaron parásitos, así como también el promedio de parásitos fagocitados por célula.
Efecto inmunomodulador del AU sobre la actividad hemolítica total del complemento.
Para el desarrollo de este experimento, se utilizó suero de pacientes con valores mayores a 200 U/ml de actividad hemolítica total del complemento. Esta prueba fue realizada mediante la técnica de ELISA (IMTEC-Complement Activity). Las muestras procesadas fueron diluidas según recomendación del Kit, (dil 1/51 con buffer diluyente de muestras). La muestra diluida a 1/51, contenían AU a 125; 62,5; 31,2 y 15,6 µg/ml, de la misma manera se diluyó el Glucantime a las mismas concentraciones incubándose por 30 min a 4 °C, posteriormente se procedió a sembrar 100 µl de los sueros tratados, control positivo y control negativo del Kit y la muestra sin tratar, se incubó a 37 °C por una hora. Pasado este tiempo se procedió al lavado correspondiente con el buffer de lavados al 1* y se sembró 100 µl de anti-C9 (anticuerpo monoclonal contra el neoepítopo de C9) incubándose a 37 °C por una hora, nuevamente se realizó el proceso de lavado, y se sembró 100 µl del conjugado (anticuerpo anti-ratón IgG conjugado con peroxidasa) incubándose una hora a temperatura ambiente, se realizó el último proceso de lavado y se sembró 100 µl del sustrato (peróxido de hidrógeno, 3,3, 5,5-tetrametilbenzidina), incubando 10 min a temperatura ambiente, finalmente se paró la reacción con 100 µl de la solución stop (ácido sulfúrico). La lectura se realizó en el lector de placas de ELISA a una longitud de onda de 450 y 630 nm.
Interpretación de resultados
Se graficaron las absorbancias medidas contra las concentraciones de los calibradores S1-S4 (25(S1), 50(S2), 100(S3), 200(S4) U/ml) en papel milimetrado lineal. Se interpolaron los puntos mesurados graficados, para obtener una curva de calibración por medio de la cual se determino la concentración de C9 activado en la muestra del paciente. El rango normal de la actividad del complemento establecido por el Kit comercial es de 40-200 U/ml.
RECONOCIMIENTOS
Se agradece al Instituto de Investigaciones en Productos Naturales (IIPN), Facultad de Ciencias Puras, Universidad Mayor de San Andrés por haber proporcionado el material vegetal y al Instituto de Servicios de Laboratorio de Diagnóstico e Investigaciones en Salud (SELADIS), Facultad de Ciencias, Farmacéuticas y Bioquímicas donde se desarrollo los ensayos biológicos in vitro.
Notas
*CorrespondÍng author: lore claudi@hotmail.com
REFERENCIAS
1. FRESQUET Febrer J. Elie Metchnikoff (1845-1916). Instituto de Historia de la Medicina y de la Ciencia (Universidad de Valencia - CSIC). Julio, 2009. Disponible en: http://www.historiadelamedicina.org/metchnikoff.html. [ Links ]
2. ROJAS William M, Anaya J. Factores constitutivos y barreras naturales. Inmunología. 14a edición. Corporación para investigaciones biológicas. Medellín, Colombia. p 18 - 33. 2007 [ Links ]
3. VELOSO B. Medicina sin fronteras Metchnikoff y la Medicina. Diciembre 2010. Disponible en: http://mediccine.wordpress.com/metchnikoff-y-la-medicina [ Links ]
4. LEZAMAASENCIO P. Importancia del Sistema de Complemento. Escuela de Medicina Universidad César Vallejo. Trujillo, Perú Rev. Med. Vallejiana. Vol. 4 N° 1. p 55-65. 2006 [ Links ]
5. AGUDELO S, Robledo S. Respuesta inmune en infecciones humanas por Leishmania spp. Colombia. Vol 13. N° 3. p 115-135. 2000 [ Links ]
6. MOLLINEDO S, Monasterio H. Leishmaniasis guía operativa para el control en Bolivia. Documentos técnico-normativos. Ministerio de salud y deportes. 1° edición. La Paz-Bolivia 2007 [ Links ]
7. NAVARRO E. Determinación de la actividad leishmanicida, tripanocida in vitro y valoración de la toxicidad aguda del ácido úsnico in vivo. Universidad Mayor de San Andrés, Facultad de Ciencias Farmacéuticas y Bioquímicas carrera de bioquímica. 2010 [ Links ]
8. ROSALES L, Naranjo N. Los líquenes como fuente de sustancias bactericidas. Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional, UPN, Unidad Durango, México Durango, CP. 2002 [ Links ]
9. KUO H, Yu T. Hypodense eosinophil number relates to clinical severity, airway hyperresponsiveness and response to inhaled corticosteroids in asthmatic subjects. Yu Eur Respir J. Vol 7. p 1452-1459. 1994 [ Links ]
10. SEDGWICK J. Shikama Y. Brener K. William B. Effect of isolation protocol on eosinophil function: Percoll gradients versus immunomagnetic beads Allergy and Immunology Unit. Department of Medicine. 1996 [ Links ]
11. ROJAS William M. Anaya J. Fagocitosis. Inmunología. 15a edición. Corporación para investigaciones biológicas. Medellín. Colombia. p 18 - 33. 2010 [ Links ]
12. SCHINELLA G. Aquila S. Ríos J. Anti-Inflammatory and Apoptotic Activities of Pomolic Acid Isolated from Cecropia pachystachya. Planta Med. Vol. 74 p 215-220. 2008 [ Links ]
13. MITCHELL J. Allergic contact dermatitis from usnic acid produced by lichenized fungi. Arch Dermatol. Vol 92. N° 2. p 142 -146. 1995 [ Links ]
14. CHENOWETH D. Rowe J. A modified method for chemotaxis under agarose. Journal of Immunological Methods. Elsevier/North-Holland Biomedical Press. Vol 25. p 337â353. 1979 [ Links ]
15. CASSATELLA M. Molecular basis of interferon-gamma and lipopolysaccharide enhancement of phagocyte respiratory burst capability. Studies on the gene expression of several NADPH oxidase components. J. Biol. Chem. Vol 265. N° 33. p 20241-20246. 1990 [ Links ]
16. ROJAS William M. Anaya J. Fagocitosis. Inmunología. 14a edición. Corporación para investigaciones biológicas. Medellín. Colombia. p 18 - 33. 2007 [ Links ]
17. CHRISTOU N. Neutrophil Function in Anergic Surgical Patients: Neutrophil Adherence and Chemotaxis. Annals of Surgery. Vol. 190 N° 5. p 557-564. 1979 [ Links ]
18. SACK P. Perkins P. Identification of an infective stage of Leishmania promastigotes. Science: Vol. 223 N° 4643. p 1417-1419. 1984 [ Links ]
19. LEMUS L. Inmunomodulación de las vías clásica y alterna del Sistema de Complemento por seis plantas medicinales de Guatemala. Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia. Química Biológica Guatemala. Mayo de 2007. [ Links ]
20. CALDERÓN A. Gupta M. Forest plot as a tool to demostrate the pharmaceutical potential of plants in a tropical forest of Panama. Economic Botany. Vol 54. N° 3. p 278-294. 2000 [ Links ]












 uBio
uBio 

