Revista Boliviana de Química
versión On-line ISSN 0250-5460
Rev. Bol. Quim v.29 n.1 La Paz 2012
ARTÍCULO ORIGINAL
PERSPECTIVAS EN EL PROCESAMIENTO DE MATERIALES-ELECTRODOS PARA BATERÍAS DE ION LITIO EN BOLIVIA
Saúl Cabreraa, Fabián Benaventea, Max,Vargasa, José Luis Floresa, Manuel Ortegaa, Jaime Villcaa, Rafael Mamania, Naviana Leivaa, Martin Lunaa, Waldo Yapua, Mario Blanco Eduardo R. Palenquec, Rodny Balanzad
a Laboratorio de Energías Alternativas, Instituto de Investigaciones Químicas, UMSA. b Laboratorio de Caracterización Estructural de Minerales, Instituto de Investigaciones Geológicas y del Medio Ambiente, UMSA c Laboratorio de Materia Condensada, Instituto de Investigaciones Físicas, UMSA d Instituto de Investigaciones en Metalurgia y Materiales, UMSA
Keywords: Síntesis, Ánodo, Cátodo, Batería de ion litio, Electrodos.
ABSTRACT
The existing aspects about synthesis, characterization and electrochemical properties of different electrodes for lithium ion batteries are analyzed. Identification and synthesis of precursors are included and also the processes of these materials obtaining in Bolivia. The commercial properties for these materials offered by different companies are mentioned. Finally local synthesis of two cathode electrodes (LiMn2O4) and (LiFePO4) from potential precursors present in Bolivia are reported.
RESUMEN
Se analiza la síntesis, caracterización y las propiedades electroquímicas de diferentes electrodos para baterías de ion litio, identificándose los precursores y los métodos de síntesis, resaltando los procesos de los materiales obtenidos en Bolivia, y las propiedades comerciales ofertadas para estos materiales por diferentes empresas. Finalmente se hace la identificación de los procesos de obtención para dos electrodos catódicos (LiMn2O4) y del (LiFePO4), a partir de potenciales precursores existentes en Bolivia.
INTRODUCCIÓN
La puesta al mercado de baterías de ion litio (LIB) a principios de 1990 por la empresa japonesa Sony (1) ha constituido el inicio de una revolución comercial en el campo de sistemas de almacenamiento de energía, provocando un crecimiento en el mercado de dispositivos electrónicos, tales como teléfonos móviles, computadoras portátiles, MP3 y otros. De hecho, las baterías de ion litio son actualmente producidas por miles de millones de unidades al año (2), su demanda en los últimos años está en aumento, fundamentalmente por la utilización de baterías de litio de potencia para diferentes aplicaciones, y su introducción poco a poco al mercado de la industria de automóviles Híbridos (HEV), Eléctricos (EV), y Eléctricos Enchufables (PHEV) (3). Su aplicación en estos sistemas, más su potencial aplicación en sistemas de energías renovables (Eólicos y Solares), donde las mismas son una opción atractiva para obtener sistemas eficientes de almacenamiento, hace que las LIB se vayan constituyendo en un elemento clave para el campo energético amigable al medio ambiente, consolidándose poco a poco un mercado altamente atractivo para los próximos años (4). No obstante en ambos casos las baterías todavía son costosas y para consolidarse en el mercado internacional deben volverse accesibles para la mayoría de los consumidores. (5).
Hoy en día, si bien estos costos han bajado, los materiales para su construcción de baterías de ion litio siguen resultando del orden del 40 a 50% del costo total de baterías de potencia, (Figura N° 1) (6).
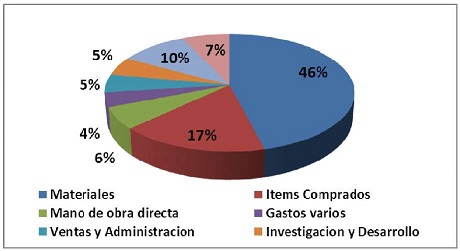
Figure N° 1 Distribución de costos de producción de baterías de ion litio para HEV y PHEV (criterios de evaluación: planta de producción de 100000 baterías por año, configuración de celda comercial tipo NCA - G, poder 50 - kW, capacidad 30-Ah, 8 módulos, 12 celdas por módulo, y 96 celdas por batería) (6).
Entre los materiales que constituyen las baterías de ion litio, los de mayor precio son los electrodos (materiales anódicos, catódicos y electrolitos líquidos o sólidos). Los electrodos catódicos y anódicos comerciales para baterías de ion litio de potencia son un aglomerado de un compuesto de intercalación activo (material catódico o anódico), aglutinante y aditivos conductores. En la actualidad los compuestos catódicos y anódicos más utilizados para la producción de baterías de ion litio comerciales o que están en fase de introducción al mercado, permite proponer siete configuraciones básicas (Tabla N°1).
Tabla N°1. Configuraciones básicas de baterías de ion litio en función de los compuestos catódicos y anódicos existentes en el mercado.
| Electrodo | LC-G | LNCA-G | LFP - G | LFP - LTO | LM - G | LNM - G | LMS- LTO |
| Cátodo (Positivo) | LiCoO2 | LiNi0.8Co0.15Al0.05O2 | LiFePO4 | LiFePO4 | LiMn2O4 | LiNi05Mn15O4 | LiMn2O4 |
| Ánodo (Negativo) | Grafito | Grafito | Grafito | LÍ4TÍ50I2 | Grafito | Grafito | LÍ4TÍ50I2 |
La mayoría de estos compuestos activos son sintetizados a través de reacciones en estado sólido [7,8], síntesis hidrotermal [9] y procesos sol-gel [10], estando actualmente disponibles en algunas empresas (como ser: Merck [11], Nippon Química Industria [12], Mitsui Ingeniería [13], Seimi Químicos [14], Südchemie [15], Phostech Litio Inc.[16], y otros). Los precios de esto compuestos son muy altos, fundamentalmente por ser productos de alta calidad (con muy buena cristalinidad, tamaño de partícula pequeño, estructura estable a los proceso de intercalación de iones de litio), y, una alta pureza (mayores al 99,7%). estos factores son muy importantes para que sus propiedades electroquímicas (alta capacidad de energía y buena densidad de carga) sean aceptables y que las mismas se mantengan en los ciclos de carga / descarga (17 - 20). Bolivia, en este marco, al disponer de grandes fuentes de recursos minerales (entre ellos el litio), tiene el interés de impulsar el desarrollo de la producción de productos con valor agregado (como son las baterías de ion litio) y consolidar un proceso de industrialización en este sector. Para ello es necesario identificar los elementos precisos para el desarrollo de una industria de electrodos (cátodos, ánodos y electrolitos), por lo que en la presente revisión se hace un análisis de los procesos de obtención de estos compuestos (catódicos y anódicos) y se identifica dos caso de estudio específicos de alto interés comercial en la actual industria de baterías de ion litio (Oxido de Manganeso Litio - LiMn2O4, y Fosfato de Hierro Litio -LiFePO4).
RESULTADOS Y DISCUSIÓN
SÍNTESIS Y CARACTERIZACIÓN DE MATERIALES CATÓDICOS Oxido de Cobalto y Litio (LC)
El material laminar de LiCoO2 (Figura N° 2) es uno de los materiales catódicos más ampliamente utilizado a nivel industrial en baterías secundarias de ion litio, debido a su fácil preparación (habitualmente sintetizado en reacciones en estado sólido con prolongados tiempos de reacción y altas temperaturas), alta conductibilidad electrónica y excelente comportamiento en la ciclización. Su capacidad teórica es de 2 73.8 Ah/Kg, lastimosamente el material sufre una degradación estructural cuando más del 50% del litio es extraído de su red laminar, perdiendo su capacidad para el procesos de carga/descarga, siendo su capacidad práctica solo de 140 Ah/Kg[21],
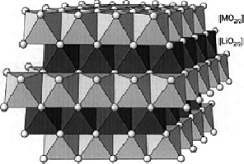
Figura N° 2. Estructura bidimensional de LiMO2 (M = Co, Ni, V, etc.) tipo a-NaFeO2 (22)
Se ha sintetizado materiales en la serie Lii_xCoO2 con x = 0,0; 0,25 y 0,50 (Parte experimental) donde se evalúa el comportamiento estructural en el proceso de litiación, de hecho los espectro de difracción de rayos X (Figura N° 3), muestran que el incremento de litio favorece el proceso de formación de la fase laminar de LiCoO2 pura (Ficha 00075 - 0532), haciendo desaparecer la fase del oxido mixto de Cobalto Co3O4 (Ficha 00 - 009 - 0418). En la fase pura x = 0,0 se identifica claramente las señales del pico (003) a 20 = 18.5° demostrando la estructura laminar característica del LiCoO2, y el pico (104) a 20 = 45° el cual indica la unidad básica Co - O - Co que forma el compuesto laminar. La alta relación en intensidades (001)/(104) sugiere una buena cristalinidad en el material (23, 24). Las microfotografías SEM de varias zonas de la muestra óptima Li1-xCoO2 (x = 0,0), permite identificar que el producto presenta una distribución de tamaño homogéneo, identificándose aglomerados de partículas, donde el tamaño medio de las partículas es del orden de 1,0±0,2 ^m (Figura N° 4), este producto muestra un tamaño menor a los materiales comerciales reportados (Tabla N° 2), con una forma angular, muy próximo a productos obtenidos por métodos sol gel (25).
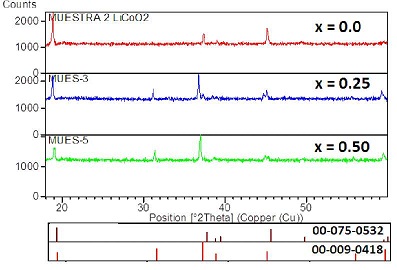
Figura N° 3. Espectro de Difracción de rayosXde las muestras Li1-xCoO2 con x = 0,00; x = 0,25y x = 0,50

Figura N°. 4 Imágenes de SEM de la muestra óptima de LiCoO2. La barra corresponde (a) 10 ¡m, y (b) 2 ¡xm
Tabla N° 2. Parámetros característicos de materiales comerciales de LiCoO2, ofertados por diferentes empresas.
| PROPIEDADES DE CÁTODOS TIPO LC | EMPRESA | |||
| Linyi Gelón Co., Ltd. | Beiying Chuangya Technology Co., Ltd. | Shanghai Technology Co., Ltd. | EQ-Lib-LCO | |
| Co % | 60.0 ± 1.0 | 60.0 ± 0.5 | ||
| Li % | 6.07 a 7.03 | 6.8-7.2 | ||
| pH | 9-11.5 | 9.5 - 11.5 | 9.5 - 11.5 | 9.05 - 11.05 |
| Densidad (g/ml) | 2.4-2.9 | 2.6 | 1.7-2.9 | 2.1-2.9 |
| Area Superficial(BET) (m2/g) | <0.5 | 0.15 - 0.5 | 0.2-0.6 | 0.4-0.75 |
| Diámetro (D10) ^m | 4 - 11 | 2 - 7 | 4 - 7 | 2 - 6.5 |
| Fórmula | LiCoO2 | LiCoO2 | LiCoO2 | LiCoO2 |
| Apariencia | Polvo Negro | Polvo Negro | Polvo Negro | Polvo Negro |
| Peso Molecular (g/mol) | 97.88 | 97.88 | 97.88 | 97.88 |
| Capacidad primera descarga (Ah /Kg) | 145 | 145 a 1C | ||
| Producción (Toneladas. Métricas Mes) | 25 | 300 | ||
El método de síntesis por reacción en estado sólido, habitualmente no permite un adecuado control estequiométrico y conduce a un tamaño muy grande de partículas, lo que ha originado que se desarrollen nuevas rutas de síntesis de estos materiales, como ser sol gel, precipitación coloidal y otros (26 -32). No obstante, por el momento estos proceso son menos rentables económicamente por lo que aún no han sido implementados industrialmente, aunque el tamaño de partícula obtenido en estos métodos es menor, lo que favorece los proceso de difusión del ion litio en la estructura laminar, favoreciendo la eficiencia en los proceso de carga / descarga (33, 35).
Oxido de Manganeso, Níquel y Litio (LM, LNM)
La fase LiMn2O4 presenta una estructura tipo espinela (Figura N° 5) ampliamente utilizada en baterías de ion Li, y tal vez es el compuesto más estudiado para este tipo de aplicación (36 - 39). Posee la estructura de la espinela normal, donde los oxígenos ocupan las posiciones 32e del grupo espacial Fd3m. El manganeso ocupa la mitad de las posiciones octaédricas 16d, mientras que el litio se sitúa en posiciones tetraédricas 8a. Las posiciones tetraédricas 8a y las octaédricas 16c vacías proporcionan un espacio intersticial interconectado que permite la difusión rápida del litio en las tres coordenadas espaciales (39 - 49).
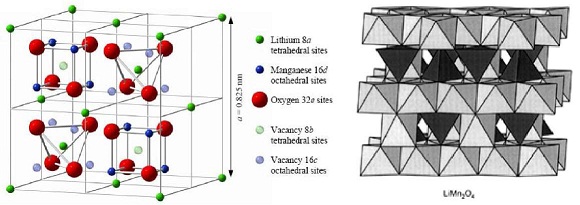
Figura N° 5. Estructura de la espinela LiMn2O4, donde se identifica los diferentes tipos de huecos ocupados, y la inserción/expulsión tridimensional de los iones litio. (37)
El óxido de manganeso litio LiMn2O4 se ha constituido como un material alternativo al LiCoO2 en las baterías de ion litio, en especial por su buena respuesta electroquímica, bajo carácter contaminante y precio reducido (39 - 49) en comparación con las características altamente contaminante del Co, y su alto costo, siendo TRONOX la empresa líder en el mercado hasta el año 2010, productora de este material catódico con 700 TM/año (Figura N° 6) siendo su principal comprador la empresa E-one para la fabricación de baterías primarias y secundarias de ion litio (50).
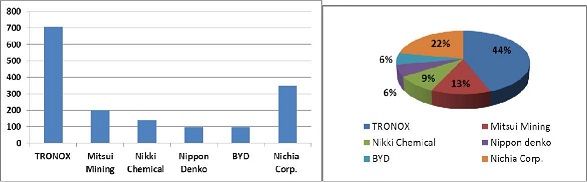
Figura N° 6. Empresas productoras y volúmenes de LiMn2O4 en el 2010 (en TM/año) (50).
La síntesis convencional a nivel industrial del material tipo LiMn2O4 es en reacciones en estado sólido. Estas reacciones se desarrollan por diferentes tipos de precursores que afectan las condiciones de síntesis, y las características morfológicas y electroquímicas del producto final (51 - 54). En el presente trabajo se ha sintetizado LiMn2O4, a partir de dos precursores diferentes (Parte experimental: MnO2 - Serie I), y (Parte experimental: MnCO3 - Serie II).
Los espectros de difracción de rayos X, para los productos sintetizados a partir de oxido de manganeso (Serie I), permite identificar que el oxido Li1Mn2O4 - espinela se va favoreciendo conforme se desarrolla la litiación (ficha 000018-736). Sin embargo, en todas los productos, incluyendo la composición optima de x = 1,0, se identifica la presencia de otras fases, en especial Li1Mn2O4 - tetragonal (Figura N° 7). En cambio, los espectros de difracción de rayos X de los productos obtenidos a partir de carbonato de manganeso (Serie II) (Figura N° 8), permiten identificar como fase única al Li1Mn2O4 - espinela para la composición con x = 1,0. Estos resultados están en consistencia de que la utilización de diferentes precursores define fuertemente la estructura y pureza final del material catódico, y por tanto sus propiedades electroquímicas (53, 54). De hecho el utilizar como precursor el MnCO3, favorece la obtención de de un material catódico tipo Li1Mn2O4 - espinela óptimo a menores temperaturas.
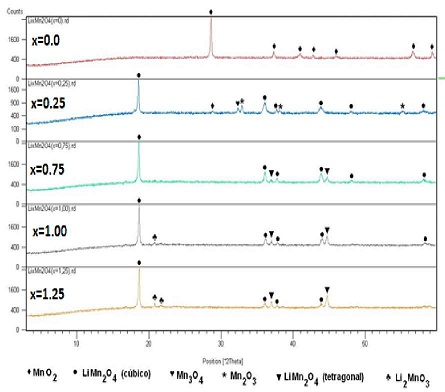
Figura N° 7. Espectros de DRX de las muestras obtenidas por tratamiento de MnO2 + Li2CO3 a 850°C por 20 h. con incrementos "x" de litio en LixMn2O4.
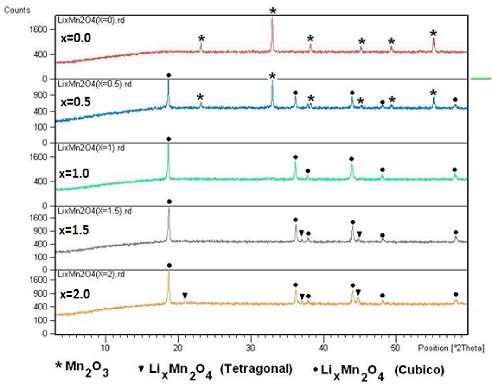
Figura N° 8. Espectros de DRX de las muestras obtenidas por tratamiento de MnCO3 + Li2CO3 a 800°C por 20 h. con incrementos "x" de litio en LixMn2O4.
No obstante, si bien el uso de LiMn2O4 inicialmente se extendió para remplazar al LiCoO2, esto fue limitado por ser de menor capacidad en 10% comparado con el LiCoO2, y presenta una muy baja estabilidad estructural durante el proceso de ciclización (55 - 59), donde el material va perdiendo fácilmente su capacidad debido a su distorsión estructural por la presencia del ion Mn+2, la disolución del manganeso en el electrolito, perdida de cristalinidad en los proceso de ciclización, y la descomposición del electrolito a altos potenciales. Se hicieron varios intentos para eliminar estos problemas, en especial el dopaje en la espinela por diferentes tipos de cationes como Al3+, Co2+, Cr2+, Ni2+, y Fe3+ o por modificación de la superficie del LiMn2O4 con diferentes materiales como TiO2, MgO, LiAlO2, y Al2O3 (60 - 65 ). En función de los resultados publicados, se ha demostrado que una de las alternativas más adecuadas es la incorporación de Ni.El ion Ni+2 remplaza al manganeso, para generar un producto óptimo, en una proporción de 0,5 molar con la estequiometría final LiNi05Mn15O4 adecuado para su aplicación industrial (66 - 74), el producto mantiene su estructura tipo espinela. La síntesis es realizada por reacciones en estado sólido, las cuales son relativamente simples y utilizables para la producción en masa. La síntesis realizada a partir de Li2CO3, NiO y MnCO3 (Serie III) como reactivos nos ha permitido obtener la fase tipo espinela, Li1Ni0.5Mn1.5O4 con una estructura cúbica, sin embargo se identifican algunas señales de óxido de níquel, consistentes con la bibliografía, donde se sugiere que es dificultoso obtener una fase completamente pura: habitualmente se identifica la presencia de óxidos de níquel (LixNi1-xO) (Figura N° 9), característicos por la pérdida de oxígeno a altas temperaturas (75 - 79).
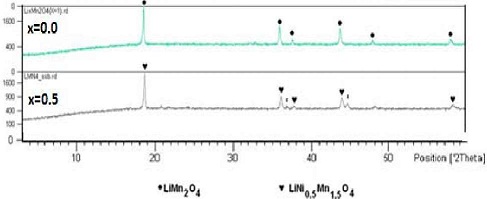
Figura N° 9. Espectros de DRX de las muestras obtenidas por tratamiento de MnCO3 + Li2CO3 + NiCO3 a 800°C por 20 h. de la serie LiNixMn2-xO4., con x=0,0; 0,50 (la impureza J corresponde a la fase de LixNi1.xP2).
Las imágenes de SEM para el producto óptimo de LiMnO4 sintetizado con carbonato de Manganeso (Serie II, x =1,0), muestra una distribución de diámetro de partículas homogéneo, en el orden de 4 - 10 ^m (Figura N°. 10), este producto está en consistencia con los materiales comerciales (Tabla N° 3).

Figura N°. 10 Imagen SEM de la fase optima LiMn2O4, obtenida con MnCO3, a 800°C, en un tiempo de 20h.
Tabla N° 3. Propiedades del LiMnP4 en productos comerciales
| EMPRESA | |||||
| PROPIEDADES | TRONOX* | Zhengzhou | Xian Huijie | Linyi Gelon New | L&F |
| DEL LM | Blue Ribbon (China) | (China) | Battery Baterials Co. Ltd. (China) | (Korea) | |
| Tamaño de partícula | 6-15 | 12-18 | 12-20 | 13-17 | 5-15 |
| Densidad (g/ml) | 1,5-1,7 | 2.8-3.2 | 1,8 | >2 | 1,45 |
| BET SA (m2/g) | 0,5-1,3 | 0.4-0.8 | 1,0 | 0,4-1,0 | 0,58 |
| Capacidad de | 96-110 | 121 | >115 | >102 | 101,3 a 4,3 |
| descarga (mA-h/g) | V | ||||
| Pérdida de | -0,02%/ciclo | 400 ciclos. | - | 100 ciclos, <10% | 96,7% |
| capacidad | 20% | eficiencia | |||
Fosfato de Hierro y Litio (LFP)
Entre las varias estructuras tipo Olivina, constituidas por una red de enlaces covalentes fuerte de aniones tetraédricos (XO4)n con (X = P, S, As, Mo y W), y metales en posiciones octaédricas, identificados como potenciales electrodos catódicos por Godenough en 1997 (80), el LiFePP4, se ha constituido en el producto de mayor interés comercial como material catódico de baterías de ion litio, fundamentalmente por sus características amigables al medio ambiente, bajo costo de sus precursores, larga vida en el proceso de ciclización, y una relativa buena capacidad especifica de 170 mAh/g (81 - 84). No obstante, el principal problema de este material es el control del estado de oxidación en su síntesis, dado que es muy fácil que el Fe+2 se oxide a Fe+3 durante el tratamiento térmico de reacción, lo que ha hecho que en los sistemas de reacción en estado sólido se tenga un cuidado especial en el control de la atmosfera reductora del medio (85 - 88). Existen diferentes métodos de síntesis del material tipo olivina LiFePO4 (reacción en estado sólido, hidrotermal, y sol gel) que permiten mejorar su desempeño electroquímico como material catódico en baterías recargables de ion litio (89 - 92).
Entre los materiales comerciales, el LiFePO4 es uno de los pocos que permite la inserción y la extracción de todos los iones litio sin deterioro de la estructura de intercambio (93, 94). Esto por que presenta una fuerte estructura de enlaces covalentes P - O tridimensional formada por los polianiones (PO4)3-, existiendo dos fases en los extremos de la reacción en el proceso de carga o descarga (Figura N° 11), en estas condiciones se justifica la presencia de una disolución sólida en la vecindad de los miembros finales LiFePO4 y FePO4 (96, 97). La presencia de estos micro dominios cristalinos está fuertemente relacionada al tamaño de partícula, donde el comportamiento es optimizado cuando las partículas son del orden de nano escala (98) favoreciéndose fuertemente un buen comportamiento electroquímico (conductividad iónica vs. conductividad eléctrica).
Los espectros de DRX de la serie de LixFePO4 con x = 0,25; 0,50; 0,75 y 1,00 (Figura N°. 12 ) sintetizados por la ruta hidrotermal permite identificar el proceso de cambio de fase presente en los fenómenos de descarga (94, 95), así
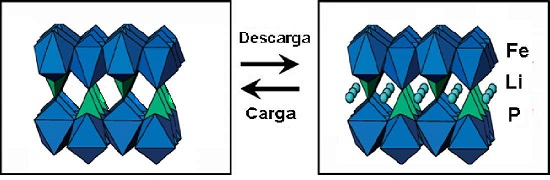
Figura N° 11. Estructura del FePP4, y del LiFePP4 antes y después del proceso de carga / descarga (la dirección del eje b de la celda unidad es correspondiente con el eje de transporte de iones litio) (94, 95).
a bajos contenidos de Li se identifica señales de la fase Fe3(PO4)2 (ficha 01 - 081 - 0694) consistente con el bajo contenido de oxígeno en el proceso hidrotermal, al incrementarse el contenido de Li, las señales van desapareciendo y se identifican nuevas señales características de la fase tipo litiofilita (LiFePO4 - ficha 00 - 040 - 1499), hasta obtener como fase única a este material para la muestra con x =1,00. A partir de las señales características del producto optimo identificado (LiFePO4 a x = 1,0) se calcula con la ecuación de Scherrer el tamaño medio de los micro dominios cristalinos (d = 0,16 ± 0,03 ^m).
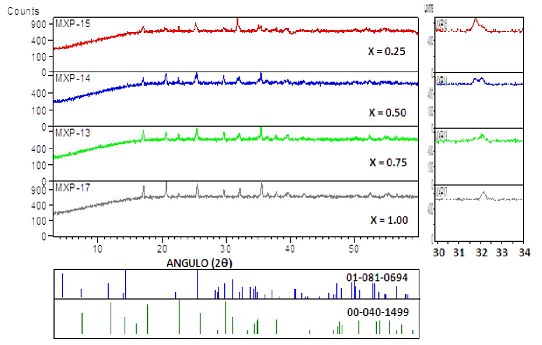
Figura N°12. Espectros de DRX de la serie de LixFePP4 con x = 0,25; 0,50; 0,75y 1,00, a la derecha se observa la desaparición de la señal característica de la fase Fe3(PP4)2 (28 = 31.6°), y el incremento de las señales de la fase LiFePP4(20 = 32,3°), con el incremento de Li.
Las imágenes de SEM (Figura N° 13) del producto con x = 1,00, correspondiente a la fase LiFePO4, permiten identificar una alta homogeneidad en el tamaño (promedio de 2,5±0,4 ^m) y forma de las partículas, las cuales están apiñadas formando cúmulos del orden de 30 a 50 ^m. Así mismo, en la figura de la derecha se observan planos y ángulos característicos del hábito cristalino de las partículas de este compuesto.

Figura N° 13. Micro imágenes de SEM para la con x = 1,00, Litiofilita - LiFePP4
El diámetro medio de las partículas es consistente con los reportados para materiales comerciales (Tabla N°.4). Si bien se ha sintetizado el LiFePO4 por tratamiento hidrotermal (88, 89), otros autores reportan la síntesis de este material por procesos sol- gel (99 - 101), o en estado sólido (102), donde en el primer caso se puede partir de sales o alcóxidos, pero requiere necesariamente un tratamiento térmico adicional, y para el segundo caso se puede partir de
Li2CO3-, FeSO4, y (NH4) H2PO4. En función de los reactivos de partida y del tratamiento térmico las propiedades electroquímicas de este material pueden variar, e incluso el método de síntesis ha demostrado que en el mismo es adecuado incluir el material conductor eléctrico, dado que el LFP por sí sólo presenta una muy mala conductividad eléctrica, lo que generalmente se resuelve con la incorporación de carbono en el orden del 1 al 5% en peso (100, 103 - 105).
Tabla N° 4. Ficha técnica de productos comerciales de LiFePO4 grado batería.
| PROPIEDADES DEL MATERIAL CATÓDICO LFP | EMPRESAS | |||
| Linyi Gelon New Battery Materials Co,Ltd. | Shanghai New Element Material Company Limited | HIKO IM&EX Co. LTD | ||
| %Li | 3,5-4,5 | 4,3 | 4,1 | |
| %Fe | 33-36 | 33,5 | 35,2 | |
| %P | 18-20 | 19,5 | 19,4 | |
| %C | 1,5 | 2 | ||
| Ciclo | 2000 | 500 | ||
| Superficie esp. (m2/g) | 18 | 15 | 15 | 17 |
| Tamaño (^m) | 4-6 | 3-5 | 4-8 | 2-6 |
| Densidad (g/ml) | 0,8 | 1 | 1,1 | 0,53 |
| Capacidad (mAh/g) | 142 | 142 | 140 | |
| Capacidad de suministro | 25 Ton/ mes | 35 Ton/mes | 166 Ton/mes | 10 Tom/ mes |
SINTESIS Y CARACTERIZACION DE MATERIALES ANODICOS (G, LTO)
El material anódico de mayor uso comercial en baterías de ion litio es el grafito, fundamentalmente porque tiene un buen ciclo de vida, abundante en el mercado, bajo costo y no es toxico (106 - 115). No obstante, este material presenta dos desventajas, por un lado una capacidad energética relativamente baja (375 mAh/g) en comparación con otros materiales anódicos, y la deposición de litio metálico en su estructura, como dendritas, en los procesos de carga y descarga; lo que, a largo plazo, si las condiciones de la batería no son adecuadas, produce un corto circuito en la misma (116, 117). Esto ha hecho que se desarrollen nuevas alternativas en materiales anódicos, entre ellas la utilización de metales o aleaciones de alta pureza (119, 120), o materiales basados en estaño o silicio (126 - 132). Estos materiales presentan una alta capacidad de energía (Tabla N° 5), pero su gran desventaja es que en los proceso de carga/descarga de litio se produce grandes cambios en su volumen (hasta de 300%) (Figura N° 14) (124 - 126), generando un problema de tensión física, y el deterioro de la estructura cristalina llegando en muchos casos a su pulverización, por tanto una baja capacidad de ciclización.
Tabla N° 5. Comparación de la capacidad especifica teórica, densidad de carga, cambio de volumen, y potencial de materiales catódicos (123).
| Materiales | Li | C | LÍ4TÍ5O12 | Si | Sn | Sb | Al | Mg | Bi |
| Densidad (gcm-3) | 0,53 | 2,25 | 3,5 | 2,33 | 7,29 | 6,7 | 2,7 | 1,3 | 9,78 |
| Fase litiada | Li | LiC6 | LÍ7TÍ5O12 | Li44Si | Li44Sn | Li3Sb | LiAl | Li3Mg | Li3Bi |
| Capacidad especifica teorica (mAhg-1) | 3862 | 372 | 175 | 4200 | 994 | 660 | 993 | 3350 | 385 |
| Densidad de carga teorica (mAhcm-3) | 2047 | 837 | 613 | 9786 | 7246 | 4422 | 2681 | 4355 | 3765 |
| Cambio de volumen (%) | 100 | 12 | 1 | 320 | 260 | 200 | 96 | 100 | 215 |
| Potencial vs. Li ( ~ V) | 0 | 0,05 | 1,6 | 0,4 | 0,6 | 0,9 | 0,3 | 0,1 | 0,8 |
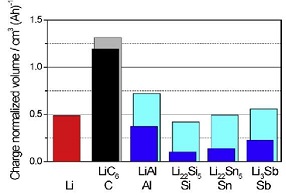
Figura N° 14. Cambios de volumen en los procesos de carga/descarga en diferentes materiales anódicos. (124, 125).
Entre estos materiales anódicos, como se observa en la figura anterior, el carbón tipo grafito (G) es el que presenta el menor cambio de volumen durante los procesos de carga y descarga (Figura N°. 15), pero adicionalmente presenta un potencial redox más negativo que la mayoría de los óxidos metálicos, calcogenuros, y polímeros, y presenta un buen comportamiento ante el proceso de intercalación del Li:
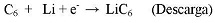
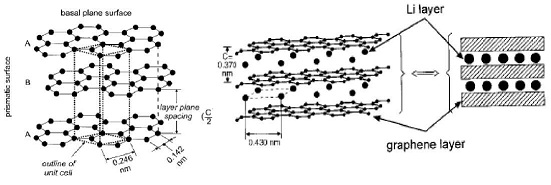
Figura N° 15. Estructura del carbón tipo grafito (espaciado interlaminar c/2 = 3,35Á) (izquierda), la incorporación de iones litio aumenta el parámetro c (c/2 = 3,75 Á) (derecha)(22).
Actualmente se está desarrollando bastante investigación con el propósito de mejorar aún más las propiedades del grafito, especialmente con la incorporación de metales dentro la estructura (126 - 128). Así es el caso específico de la incorporación de estaño (129 - 132), donde nano partículas de Sn amorfo pueden ser dispersas sobre la superficie del grafito o incluso algunas nano partículas pueden ingresar inter laminarmente, mejorando su capacidad de descarga y sus reacciones cinéticas del grafito anódico, optimizando el proceso de ciclización. El materiales anódico Li4Ti5Oi2 (LTO), tipo espinela - Li[Lii/3Ti5/3]O4, puede ser cargado hasta llegar a Li7Ti5Oi2, con una capacidad teórica de 175mAh/g:
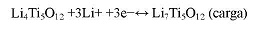
El material muestra una excelente capacidad para mantener su capacidad incluso arriba de 100 ciclos (99%), fundamentalmente por no presentar cambios de volumen en este proceso, es no tóxico, y es térmicamente estable en los procesos de carga y descarga, estas excelentes propiedades hace que este material sea un candidato excelente como material anódico en baterías de ion litio de potencia (133 - 139) remplazando poco a poco al grafito. Su comercialización aún depende de sus procesos de síntesis, los cuales pueden ser en reacción en estado sólido (139 -140, 144), sol gel (141 - 143), combustión (145, 146), y otros (147, 148), aunque actualmente varias empresas ya lo están comercializando (Tabla N° 6).
Se ha sintetizado Li4Ti5Oi2 por la ruta de los atranos (ruta sol - gel) (143) (parte experimental). El proceso térmico ha sido desarrollado a diferentes temperaturas, optimizándose el producto a 850 °C. Los espectros de DRX de las muestras optimas sintetizadas con una relación molar de Li:Ti = 4:5, y diferente contenido de agente direccional: Bromuro de Cetil Trimetil Amonio (CTAB) (M1 = 0.0 CTAB, M2 = 1.8CTAB) presentan señales características de la fase tipo espinela Li4TsO12 (Ficha 00 - 26 - 1198 ) y de la fase Li2TiO3 (Ficha 00 - 033 - 0831) (Figura N° 16) (145), no obstante, el análisis de SEM (Figura N° 17) demuestra que para el producto sintetizado con material orgánico (M2) se obtiene una mejor distribución de diámetro de partículas. El espectro de DRX del producto sintetizado con mayor relación molar de Li:Ti = 5:5 (M3), muestra señales características solo de la fase de Li4Tl5Oi2 (A.S.T.M. 49-0207). El tamaño de partícula medio obtenido (1,4 ^m), es consistente con productos comerciales (Tabla N° 6).
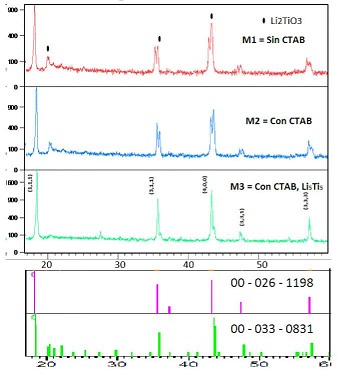
Figura N° 16. Comparación de DRX de los productos a 850°C correspondientes a los productos óptimos: M1 (Li:Ti =4:5, sin CTAB), M2 (Li:Ti = 4:5, con CTAB), y M3 (Li:Ti = 5:5, con CTAB) (Ficha 00 - 26 - 1198 del L14T15O12, y la Ficha 00 - 033 - 0831 a la fase Li2TiO3).

Figura N° 17. Imagen SEM de la muestra optima M3.
Tabla N° 6. Propiedades del Li4Ti5O12 ofertado en el mercado por diferentes empresas.
| PROPIEDADES | EMPRESAS | ||||
| Linyi Gelon | SÃDCHEMIE | Shanghai New Element Mat. | MK-NANO Nanotechnology | KERTAK Nanotechnology | |
| Pureza | 98% | 99% | 98% | ||
| Densidad | 1,6 | 1,5 | |||
| Aspecto (color) | Blanco | Blanco | Negro | Negro | Blanco |
| Tamaño de partícula | 100nm | 50nm | 50nm | ||
| (BET) Area superficial | 1-2 m2/g | 10 m2/g | 1-2 m2/g | 30 m2/g | |
| Formula | Li4Ti5O12 | Li4Ti5O12 | Li4Ti5O12 | Li4Ti5O12 | Li4Ti5O12 |
| Capacidad específica | 165 mAh/g | 160 mAh/g | 165 mAh/g | No Específica | No especifica |
| Producción | 100 Ton/mes | 10Ton/mes | |||
SÍNTESIS Y CARACTERIZACIÓN DE ELECTROLITOS
Las baterías de ion litio presentan actualmente hasta un rango de 4,5 V en su funcionamiento, esto hace que un electrolito no pueda ser utilizado en medio acuoso. En este contexto, comercialmente se esta utilizando electrolitos no protónicos (Tabla N° 7), como el LiPF6 o LiClO4, que tengan una buena conductividad iónica, alta estabilidad química, y bajo costo, los mismos son disueltos en algunos solventes orgánicos que deben ser líquidos en el rango de -20 a 60°C, tener por tanto bajo punto de fusión, alto punto de vaporización, adecuada densidad que favorezca una alta movilidad iónica (149 - 150).
Tabla N° 7. Conductividad especifica de algunas sales electrolíticas en solventes específicos (DME = 1,2 Dimetoxietano, DMC =Dimetil Carbonato, DEC = Dietil Carbonato, PC =Propilen Carbonato) (149)
| Sal Electrolítica | Conductividad Especifica (mS/cm) | Solvente |
| L1PF6 | 16,6 | DME |
| 11,2 | DMC | |
| 7,8 | DEC | |
| LiCF3SO3 | 8,3 | DME |
| 3,1 | DMC | |
| 2,1 | DEC | |
| Li(CF3SO2)N | 13,3 | DME |
| 9,2 | DMC | |
| 6,5 | DEC | |
| LiClO4 | 18 | PC/DME |
Uno de los mayores problemas al utilizar sales electrolíticas en solventes orgánicos es su flamabilidad, fundamentalmente por que las temperaturas de trabajo en las baterías de potencia pueden superar fácilmente el punto de ebullición del solvente, ocasionando muchas veces la inflamación o explosión de las baterías. Esto hace que la búsqueda de nuevos electrolitos en estado gel (150) o sólido (151 - 160) sea en los últimos años un tema de relevante interés, no solo por problemas de inflamabilidad, sino que permiten tener sistemas mucho más simples de construcción de las baterías. No obstante, en estos materiales aún se tiene muy baja conductividad iónica, lo que está evitando su comercialización.
Entre los electrolitos sólidos más promisorios se encuentran las perovskitas tipo (La,Li)TiO3 (LLTO) [151 - 157], los cerámicos tipo Li9SiAlO8, los cuales derivan del Li4SiO4 (158 - 162), por otro lado las estructuras tipo superconductores iónicos (Li - NaSICON), de fórmula general LiM2(PO4)3 con M = Zr o Ti, son muy prometedores (163 - 172). Estos materiales son sintetizados en reacciones en estado sólido a temperaturas altas (164 - 166). Se ha evaluado la formación de la fase LiTi2(PO4)3 (Figura N° 18) (parte experimental). Los mismos materiales están siendo incorporados en diferentes matrices, con una distribución bifásica tipo de la fase tipo Li - NASICON en una matriz cerámica típica de AlSiO (173), en la cual nosotros hemos remplazado la fase cerámica, por una fase tipo LixSi i-xBxO2, optimizado para la composición 2(LixBxSi1-xO2) - 4(LiTi2P3O12) con x = 0,75 (Figura N° 18). En el espectro de difracción de rayos X se identifica las señales características de la fase tipo LiTi2(PO4)3 , con un microdominio cristalino del orden de 80±5 nm, el cual está distribuido en la fase de silicoborato de litio (Figura N° 19).
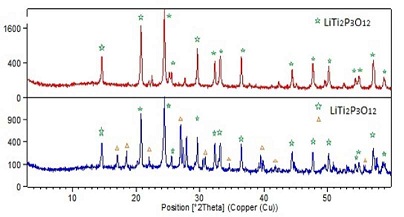
Figura N° 18. Espectros de DRX para producto optimo de LiTi2P3O12 (espectro superior), y para el sistema bifásico 2(LixBxSi1xO2) - 4(LiTi2P3O12) (espectro inferior).
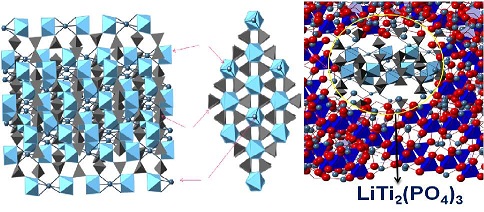
Figura N° 19. Estructura de fase LiTi2P3O12 tipo NASICON (izquierda), y distribución de la fase tipo NASICON dentro la fase de LixBxSi1-xO2 (derecha).
En la actualidad, los electrolitos sólidos están empezando a ser comercializados para el sector de baterías de ión litio, con propiedades específicas en función de su aplicación (Tabla 8).
Tabla N° 8. Propiedades de un electrolito solido de ion litio comercial ofertado por la Empresa Ohara - Inc.Co, del Japón (174).
| PROPIEDADES | CONDUCTIVIDAD IONICA | -50 °C | 1,8x10-5 |
| ELECTRICAS | DE LITIO | 25 °C | 1,2x10-3 |
| (102 S/m = S/cm) | 500 °C | 1,4x10-1 | |
| PROPIEDADES | COEFICIENTE DE | 30 - | 94 |
| TERMICAS | EXPANSION TERMICA | 350°C | |
| a (10-7/K) | 350 -600°C | 82 | |
| PROPIEDADES | GRAVEDAD ESPECIFICA | 3.05 | |
| MECANICAS | DUREZA (Hk) | 590 | |
| RESISTENCIA A LA TORCION | 140 | ||
| (N/mm2) | |||
| PROPIEDADES | RESISTENCIA AL AGUA RW (P) | 1 | |
| QUIMICAS | RESISTENCIA A ACIDOS RA(P) | 1 | |
MATERIAS PRIMAS EINSUMOS EN LA PRODUCCIÓN DE ELECTRODOS CATÓDICOS
Una evaluación preliminar de la síntesis de diferentes electrodos demandados y de interés comercial para baterías de ión litio de potencia, nos ha permitido identificar los posibles compuestos químicos necesarios para la obtención de los mismos (Tabla N° 9). Es de notar que, en todos los casos, es necesario tener reactivos de alta pureza (mayores al 99,5%), dado que eso permite obtener electrodos con buena pureza; favoreciéndose en gran medida sus propiedades electroquímicas, en especialmente en el proceso de carga/descarga de baterías de ión litio. La oferta actual de las empresas en el mercado de proveedores, es de productos de alta calidad, con una muy buena pureza química, y con las características morfológicas y electroquímicas adecuadas.
En general, las empresas productoras de electrodos para baterías de litio producen sus productos en función de las demandas específicas del mercado, es decir en función a contratos específicos con empresas que producen sistemas de almacenamiento de energía ya establecidos en el mercado. Por otro lado, en el mercado abierto se identifica ofertas de diferentes empresas con producciones que van desde 120 TM/año de Li4Ti5Oi2 hasta de 3 600 TM/año para LiCoO2, estos volúmenes actualmente bajos, podrán ser incrementados en los próximos años por la demanda de baterías de ión litio para HEV, o EV. Los electrodos son productos de química fina, por lo que el costo de los mismos es muy alto, así por ejemplo, el LiNixMnyCo1-x_yO2 cuesta aproximadamente 90 $ /Kg, esto es 90 000 $/TM (175).
Tabla N° 9. Compuestos químicos identificados en función para los procesos de síntesis de diferentes electrodos comerciales para baterías de ion litio.
| ELECTRODOS | ||||||
| CÁTODOS | ÁNODO | ELECTROLITO | ||||
| LiCoO2 | LiFePO4 | LiMn2O4 /LiNiMnO4 | Li5Ti12O2 | LiTi2(PO4) / LixSi1-xBxO2 | ||
| E L E M E N T O S | Li | Li2CÃ3 > 98% | LÍ2CO3 > 98% LiCl 99% LiÃH* H2O 98% | LÍ2CO3 > 98% | LÍ2CO3 > 98% LiNO3 )8% LiOH* H2O 99,9% | Li2CO3 > 98% |
| Co | Co(NO3)2*6H2O C0CÃ3 > 99% | |||||
| Ni | Ni(NO3)2 *6H2O NiCO3 > 98% | |||||
| Mn | MnCO3*H2O MnO2> 99% | |||||
| Fe | FeSÃ4> 99,5 % FeCO3 > 99,5 % | |||||
| P | H3PO4 88% (NH4)2HPO4 > 98% NH4H2PO4 > 98% | H3PO4 (s) | ||||
| Ti | TiO2 > 99% Ti (OR)4 ) > %98 | TiO2 > 98% | ||||
| Si | SiO2 > 99,6% | |||||
| B | H3BO3> 85 % | |||||
Por tanto, la obtención de electrodos es dependiente de productos de química fina, los que a su vez dependen de un proceso previo de producción de química básica, la cual depende de insumos adecuados, en muchos casos minerales que ya han sido tratados previamente (beneficiado). Todo lo cual demanda la evaluación y extracción de los mismos (Tabla N° 10, Ejemplo para el LiFePO4).
Tabla N° 10. Etapas propuestas de procesamiento desde minerales para llegar a obtener LiFePO4
| EXPLORACION Y EXTRACCION | BENEFICIADO | QUÍMICA BÁSICA | QUÍMICA FINA | SÍNTESIS DE ELECTRODOS |
| Apatita (Roca fosfórica -Cas(PO4)2) | Reducción de tamaño Flotación | Producción de ácido fosfórico (30% en P2O5) | Concentración y clarificación de ácido fosfórico (54 - 70 % en P2O5) Producción de MAP, DAP (grado batería 99.5%) | FOSFATO DE HIERRO LITIO (LiFePO4) (Mayor a 99,6%) |
| Hematita (Fe2O3) Limonita (FeO(OH):nH2O) Magnetita (Fe3O4) Siderita(FeCO3) | Reducción de tamaño Concentrado Peletizado | Metalurgia de reducción y disolución, o disolución reductora | Recuperación y purificación de FeSO4 | |
| Salmueras (Sales de Li, K, Mg, Ca, otros) | Concentración de salmueras | Producción de Li2CO3 (97%) | Purificación del Li2CO3 (99.7%) |
CASOS DE ESTUDIO PARA LA OBTENCION DE ELECTRODOS EN BOLIVIA Caso 1: Material Catódico LiFePO4
Para la obtención de LiFePO4 se ha identificado tres procesos característicos, la ruta en estado sólido (Figura N° 20), actualmente la más utilizada a nivel comercial, el proceso sol- gel y el tratamiento hidrotermal (Figura N° 21). Bajo estas propuestas se identifican los precursores correspondientes y los procesos tecnológicos a seguir:
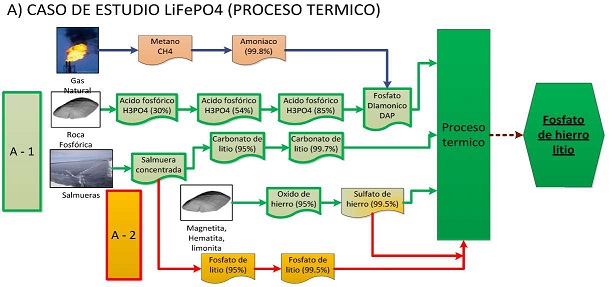
Figura N° 20. Etapas en el procesamiento de materiales para la obtención del LiFePO4, por reacción en estado solido
En Bolivia existen diversos yacimientos identificados de roca fosfórica (Tabla N° 11). Varios de ellos han sido evaluados y caracterizados mineralógicamente, pero no así cuantificados. Se han reportado, identificado y caracterizado los yacimientos de Roca Fosfórica de la Provincia de Capinota del departamento de Cochabamba, encontrando que este yacimiento tiene potencial para su explotación y posterior industrialización hacia ácido fosfórico, del cual se puede obtener (NH4)H2PO4 (MAP), o el (NH4)2HPO4 (DAP), compuestos fundamentales para la producción del electrodo LiFePO4 por la ruta de estado sólido.
Las mayores reservas de hierro en Bolivia se encuentran en la serranía del Mutún, que alberga el yacimiento mineral ferro-manganeso Mutún. Se encuentra ubicada en la provincia Germán Busch del departamento de Santa Cruz,
Tabla N° 11. Yacimientos de roca fosfórica identificados en Bolivia, y algunas de sus características
| Yacimiento | Localización | Cuantificación | Ley (%P2O5) | Observaciones |
| Paloma Pampa | Capinota Cochabamba (Lat. -17,7810 - Lon. -66,2495) | 2,8 M ton | 25% | SERGEOTECMIN (GEOBOL-ENAF, 1979) (ordovícico -sedimentario) |
| Prospecto Illuri | Tiraque, Cochabamba | â | 23% | SERGEOTECMIN |
| Camino nuevo Oruro - Cochabamba | Km 47 camino nuevo Oruro - Cochabamba | 200 000 ton | SERGEOTECMIN (ordovícico -sedimentario) | |
| Prospecto caranavi | Caranavi - La Paz (lat -15,8144, lon. -67,5828) | GEOBOL (ordovícico -sedimentario) | ||
| Prospecto Chacarilla | Chacarilla, Sicasica, La Paz (72 km Oeste NO de Oruro) | Capas de 10 a 30 cm | 24% | Golzales(1985), Notholt (1999) (ordovícico -sedimentario) |
| Cerro colorado | Puerto Suárez Santa Cruz | 11.9% | (Appleton, 1991) (Precámbrico Igneo) | |
| Prospecto Sepulturas | Sepulturas, Oruro (7 km Este de Oruro) | 300 000 m3 (una capa de 0.5m) | 9.3% | (Golzales,1983) |
El proceso de producción de ácido fosfórico con una concentración de 30% en P2O5 (Figura N° 20) utiliza la roca fosfórica con 30% en P2O5 y ácido sulfúrico 98,7%, donde luego se pasa a una etapa de concentración y clarificación donde se puede llegar a 54% en P2O5. Este puede pasar por una segunda etapa de concentración mediante evaporación al vacío, este proceso permite obtener un acido con 85% de pureza que puede ser utilizado para la producción de compuestos activos de cátodos para batería de ion litio por la vía hidrotermal (Figura N° 21).
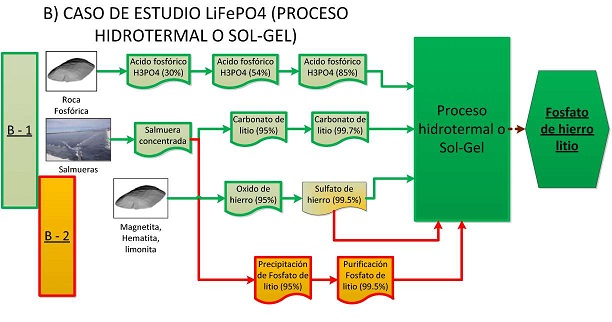 Figura N° 21.Etapas en el procesamiento de materiales para obtener LiFePO4 por la ruta sol gel o hidrotermal.
Figura N° 21.Etapas en el procesamiento de materiales para obtener LiFePO4 por la ruta sol gel o hidrotermal.
aproximadamente a 700 kilómetros de la ciudad de Santa Cruz de la Sierra y a 50 - 60 kilómetros de la ciudad fronteriza boliviana de Puerto Suárez. El yacimiento mineral está diseminado en un área de aproximadamente 65 kilómetros cuadrados, los minerales que la conforman son: magnetita, hematita, limonita y, en menor cantidad, siderita. También se identifica mineral de manganeso, azufre, y fósforo, con contenidos bajos y altos, por sectores. Las reservas brutas estimadas de mineral de hierro bordean los 40 mil millones de toneladas métricas con una ley promedio del 50% y, las de manganeso se estiman en 10 mil millones de toneladas métricas (176). Si bien, en Bolivia la reserva del Mutún es la más grande en hierro y manganeso, se tienen otros yacimientos identificados que pueden ser otras alternativas, como ser los desmontes de las minas de Huanuni, Ubina, Colavi, Pulacayo, San José, ubicadas en los departamentos de Oruro o Potosí, donde se tiene grandes cantidades de Pirita (FeS2) (177), también se identifican yacimientos de goethita FeO(OH) hidróxido, o limonita (FeO(OH):nH2O) en el cerro Pozoconi de Huanuni, y en vetas estrechas en Challapata departamento de Oruro. La siderita FeCO3 se encuentra como ganga en variados yacimientos hidrotermales, en vetas y depósitos metasomáticos, entre ellos en las gangas de la mina Matilde, y de muchas minas de la de la cordillera de Muñecas - Oruro (177). Los procesos para obtener sales de hierro de alta pureza son diversos, entre ellos el proceso industrial más conocido es por reducción del hierro con hidrógeno a partir del óxido puro. Proceso propuesto para el tratamiento de minerales del Mutún para la obtención de hierro esponja (176), el mismo se puede hacer reaccionar con ácido sulfúrico, u otro ácido para producir la correspondiente sal de alta pureza.
El desarrollo para la producción de Li2CO3 en Bolivia, a partir de salmueras del salar de Uyuni - Potosí es un proceso que ya se ha iniciado, y pretende llegar a la producción de Li2CO3-de alta pureza (mayor al 99,7%), para la obtención de electrodos a mediano plazo. El proceso pasa por un primera etapa de concentración por evaporación solar (Figura N° 20 o 21), y el posterior tratamiento del concentrado para llegar al carbonato.
Una alternativa atractiva en Bolivia, es la obtención de LiPO4, a partir de salmuera concentrada, el cual posteriormente puede ser purificado y tratado con Fe2O3, o sales de hierro para la obtención del electrodo LiFePO4 por la ruta de reacción en estado sólido, o por proceso hidrotermal (Figura N° 20, 21).
Caso 2. Material catódico LiMn2O4
Como se mencionó anteriormente, el yacimiento de la serranía del Mutún se constituye en un depósito atractivo de manganeso, el cual pude ser recuperado en el proceso de tratamiento de los minerales de hierro en la producción de acero. Otros yacimientos importantes son los identificados en el occidente del País (Tabla N° 12).
Para la obtención de LiMn2O4 el método utilizado comercialmente es el proceso de reacción en estado sólido, y como se ha visto, también hay muchos estudios por tratamientos hidrotermales o sol- gel, que pretenden mejorar las características electroquímicas de los materiales (Figura N° 22).
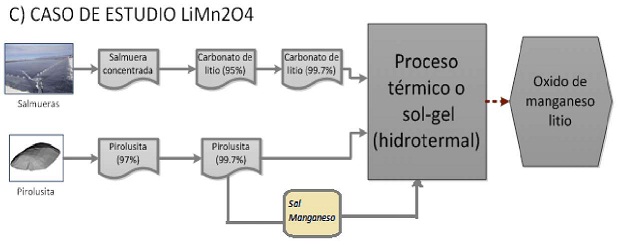
Figura N° 22. Etapas del proceso de obtención del electrodo LiMnP4
Tabla N° 12. Ocurrencias de Manganeso en Bolivia (Pirolusita=MnO2; Psilomelana=BaMnMn8P16(OH)]4; Criptomelana=K(Mn4+,Mn2+)¡P16: Rodocrosita= MnCO3
| Yacimiento / Localización | Mn [%] | Mineral | Ref. |
| Cerro Mutún; Santa Cruz | 44 | Psilomelana y Pirolusita | (178) |
| Mina Mantos Negros; La Paz | 50 | Pirolusita | (179) |
| Mina Lourdes; Pucamayo, Chuquisaca | 50 | Psilomelana | (178) |
| Mina Negra; Pajancha, Potosí | 35 | Psilomelana y Pirolusita | (178) |
| Uquilla; San Pedro de Quemes, Potosí | 27 | Psilomelana | (180) |
| Jahuincha; San Pedro de Quemes, Potosí | 27 | Psilomelana | (180) |
| Virgen de Copacabana; Kelluyo, Potosí | 43 | Psilomelana y criptomelana | (180) |
| Litoral y Exótica; Kelluyo, Potosí | 35 | Psilomelana y criptomelana | (180) |
| Mina Okalchaloma; Okalchaloma, Potosí | 25 | Psilomelana | (180) |
| Mina Jorgito; Cerro Gordo, Potosí | 30 | - | (180) |
| Mina Apalupe; Potosí | 34 | (180) | |
| Mina Charaque; Potosí | 40 | - | (180) |
| Mina Cotani; Potosí | 20 | - | (180) |
| Mina Yauricoya; Potosí | 36 | - | (180) |
| Mina Illimani; Potosí | - | Rodocrosita | (180) |
Los yacimientos de manganeso en Potosí, alcanzan a 43 depósitos de los cuales 26 han sido evaluados y 5 han sido preseleccionados, siendo éstos las minas de Apalupe, Copacabana, Charaque, Cotani y Yauricaya, cuyas reservas alcanzan a 429213 TM a 150174 TMF entre reservas positivas, probables y prospectivas. Si se considera una planta de 120000TM de mineral concentrado anual y la cantidad de reserva calculada, estas alcanzaran una vida útil de 36 años aproximadamente (180).
Para la obtención de espinel LiMn2O4, el óxido de manganeso Mn2O3 de alta pureza es producido por un proceso de dos etapas mediante el cual se calcina carbonato de manganeso en una atmósfera baja en contenido de oxígeno, seguido por calcinación en una atmósfera de alto contenido de oxígeno (181). En este caso se observa como una mejor alternativa utilizar directamente el MnCO3 como precursor. Posteriormente, el óxido de manganeso (o MnCO3) y carbonato de (Li2CO3) se tratan por medio de varias etapas de tostación en un horno rotativo (182). Durante las diferentes etapas, la atmósfera cambia en el horno rotatorio de una condición inerte (adición de N2) a una oxidante (adición de O2). El polvo se suspende entonces con agua, seguido de secado por aspersión (evaporación del agua).
Para la síntesis por medio solgel o hidrotermal, el manganeso debe estar en forma de sal, por lo que es necesario obtenerlo como carbonato, o sulfato de manganeso.
En los tres casos se requiere de carbonato de litio grado batería (mínimo de 99.7%) como precursor de litio.
Para la posible obtención del material dopado con Níquel, (Li(NiMn)2O4) en Bolivia se tiene el yacimiento ubicado en el cerro Pelón, dentro el complejo denominado el Rincón del Tigre, en el Pantanal boliviano, más propiamente entre los municipios Carmen Rivero Tórrez, de la provincia Germán Busch, y San Matías, de la provincia Ángel Sandoval. Este yacimiento es considerado gigante, con un estimado de 5.5 millones de toneladas de mineral con 1% níquel.
CONCLUSIONES
Se analiza las características de los electrodos para baterías de ion litio, identificándose las diversas rutas de obtención de los diferentes materiales, para lo cual, como referencia en Bolivia, se ha optimizado el proceso de síntesis de algunos materiales catódicos (por proceso en reacción en estado sólido para LiCoO2, LiMn2O4, LiNi0.5Mni.5O4, y por tratamiento hidrotermal para el LiFePO4), anódico (ruta sol- gel - atranos para Li4Ti5Oi2), y para un material electrolito sólido (LiTi2P¡O12 y el sistema bifásico 2(LixBxSi1-xO2) - 4(LiTi2P¡Oi2) con x = 0,75), identificándose los precursores y los métodos de síntesis. Se caracteriza para cada caso las ofertas en el mercado de electrodos. Finalmente se muestra la identificación de las etapas de los procesos de obtención para dos electrodos catódicos (LiMn2O4) y (LiFePO4), a partir de potenciales precursores existentes en Bolivia.
AGRADECIMIENTOS
El presente trabajo ha sido desarrollado en el marco de los proyectos: "Materiales para baterías de litio de potencia", y "Energía y Desarrollo Sostenible", financiados por el programa de cooperación UMSA - ASDI /TB - BCR. Se agradece a los equipos de investigación del IGEMA, y del IMETMAT que han colaborado en la caracterización estructural de los materiales, o precursores en estudio, y el auspicio de la Dirección de electroquímicos y Baterías de la Gerencia de Recursos Evaporíticos de la COMIBOL.
PARTE EXPERIMENTAL
Síntesis de Li1-xCoO2
El proceso de síntesis para identificar el proceso de litiación se desarrolló mediante la reacción en fase sólido-sólido con flujo de aire continuo, a partir de los precursores de Li2CO3 (Sigma- Aldrich) > 99,60 % y Co(NO3)2-6H2O (Sigma-Aldrich) > 99,70 %, bajo la relación Li1-xCoO2 donde x varia de (x = 0,0; 0,125; 0,250; 0,375; 0,500) con un tratamiento térmico de dos rampas de temperatura, la primera a 600 °C por 12 h, y la segunda 900 °C por 24 h. El análisis estructural de los productos se realizó por difracción de Rayos-X, y la caracterización estructural morfológica por Microscopía Electrónica de Barrido SEM Phillips XL-30.
Síntesis de Li1-xMn2O4 y LiNixMn2-xO4.
Para la síntesis de la espinela LiMn2O4 se realizó un proceso de reacción sólido-sólido. El trabajo de laboratorio fue dividido en tres series. En la serie I, los óxidos fueron sintetizados a 850°C y 20 horas con precursores carbonato de litio (Fluka Chemika) y bióxido de manganeso (Fluka Chemie) en diferentes relaciones atómicas Li:Mn y con enfriamiento rápido de los productos (quench-in). La serie II, los óxidos fueron sintetizados por descomposición de carbonatos de litio (Fluka Chemika) y de manganeso (Fluka Chemie) a 800°C por 20 horas con enfriamiento a velocidad controlada de 300°C/h (quench in off). Para la serie III se ha introducido en el producto óptimo Ni, serie LiNixMn2-xO4 con x = 0,00; 0,25 y 0,50 a 800°C por 20 horas. El análisis estructural de los productos se realizo por difracción de Rayos-X, y la caracterización estructural morfológica por Microscopía Electrónica de Barrido SEM Phillips XL-30.
Síntesis de Li1-xFePO4
Se sintetizó el LixFePO4 mediante el método hidrotermal usando como precursores de partida Li2CO3(Sigma-Aldrich), FeSO4 -7H2O(Sigma-Aldrich) y H3PO4(Sigma-Aldrich), en relación molar del Li donde x= 0,26: 0,50: 0,75: 1. Se disolvió los precursores en agua destilada y se llevaron a un reactor de teflón par (bomba hidrotermal) donde se ajustó el pH a medio básico. Una vez mezcladas las soluciones se procede a la reacción hidrotermal a 170°C y durante 18 h. El producto obtenido se caracterizó mediante la técnica de difracción de rayos X (DRX), (SEM) y análisis químico (ICP).
Síntesis de Li4Ti5O12
En el proceso de síntesis se utilizó tetrabutoxido de titanio (97%, GFS chemicals), trietanolamina (98%, Sigma -Aldrich), carbonato de litio (98% Fluka Chemie) y Cetiltrimetilamonio CTAB (98%, GFS Chemicals) como agente direccional. Se realizó un tratamiento térmico a 550°C por 4 horas, 650°C por 2 horas y a 850°C por 8 horas. Se realizaron 3 series a distintas relaciones molares Li/Ti y CTAB, la primera 4Li:5Ti sin CTAB, la segunda 4Li:5Ti con CTAB, y la tercera 5Li:5Ti con CTAB. Se realizó la caracterización por las técnicas de SEM, BET y DRX
Síntesis de electrolito sólido (composito)
Se realizó una síntesis por medio de una reacción en estado sólido de boro silicatos de litio (LixBxSi1-xO2) con x variable desde 0,0; 0,25; 0,33; 0,5; 0,66; 0,75 y 1 en función estequiométrica para mantener la electro neutralidad siguiendo un tratamiento térmico a 1 000°C para favorecer una matriz sólida cerámica partiendo de precursores como: Li2CO3, sílice (SiO2), ácido bórico (H3BO3) (Sigma-Aldrich) Se realizó la síntesis y evaluación de la formación del material LiTi2P3Oi2 en función a la temperatura, para la formación del compuesto con una estructura de tipo NASICON.
Finalmente, el composito de la matriz rígida tipo A(LixBxSi1-xO2) con x= 0,0; 0,25; 0,5; 0,70 : BLiTi2P3Oi2 con diferentes proporciones A.B han sido sintetizados por reacción ene estado sólido. Todas las muestras fueron caracterizadas estructuralmente por DRX.
Notas
*Corresponding author: saulcabreram@hotmail.com
REFERENCIAS
(1) K. Nakajima, Y. Nishi, in: T. Osaka, M. Datta (Eds.), Advanced Li-ion Batteries, Energy Storage Systems for Electronics, Gordon and Breach Science Publishers, 2000, pp. 109-129. [ Links ]
(2) Bruno Scrosati, Jürgen Garche. Journal of Power Sources 195 (2010) 2419-2430 [ Links ]
(3) D. Howell, FY2006 Progress Report, Office of FreedomCar and Vehicle Technologies, U.S. Department of Energy, Washington, DC, 2006. [ Links ]
(4) Arumugam Manthiram, J. Phys. Chem. Lett. 2011, 2, 176-184 [ Links ]
(5) Castaldo, Joe, "The Lithium Deficit,"Canadian Business; 4/27/2009, Vol. 82 Issue 7, p17-18. [ Links ]
(6) Paul A. Nelson, Danilo J. Santini1 and James Barnes, Argonne National Laboratory, US Department of Energy, International Battery, Hybrid and Fuel Cell Electric Vehicle Symposium, Stavanger, Norway, May, 2009
(7) J.F. Martin, A. Yamada, G. Kobayashi, S.I. Nishimura, R. Kanno, D. Guyomard, N. Dupre, Electrochem. Solid State Lett., 11 (2008) A12-A16. [ Links ]
(8) D.Q. Liu, Z.Z. He, X.Q. Liu, Journal of Alloys and Compounds, 440 (2007) 69-73. [ Links ]
(9) D.Y.W. Yu, K. Donoue, T. Kadohata, T. Murata, S. Matsuta, S. Fujitani, Journal of the Electrochemical Society, 155 (2008) A526-A530. [ Links ]
(10) T.-F. Yi, C.-L.Hao, C.-B.Yue, R.-S. Zhu, J. Shu, Synthetic Metals, 159 (2009) 1255-1260. [ Links ]
(11) J.S. Gnanaraj, V.G. Pol, A. Gedanken, D. Aurbach, Electrochemistry Communications, 5 (2003) 940-945.
(12) H. Li, Z.X. Wang, L.Q. Chen, X.J. Huang, Adv. Mater., 21 (2009) 4593-4607.
(13) M. Yao, K. Okuno, T. Iwaki, T. Awazu, T. Sakai, Journal of Power Sources, 195 (2010) 2077-2081.
(14) Y.H. Chen, C.W. Wang, X. Zhang, A.M. Sastry, Journal of Power Sources, 195 (2010) 2851-2862.
(15) S.F. Lux, F. Schappacher, A. Balducci, S. Passerini, M. Winter, Journal of the Electrochemical Society, 157 (2010) A320-A325.
(16) A. Guerfi, M. Kaneko, M. Petitclerc, M. Mori, K. Zaghib, Journal of Power Sources, 163 (2007) 1047-1052.
(17) V. Srinivasan, J. Newman, Journal of the Electrochemical Society 151 (10) (2004) A1530-A1538.
(18) M. Doyle, J. Newman, Journal of Applied Electrochemistry 27 (1997) 846-856.
(19) C.W. Wang, A.M. Sastry, Journal of the Electrochemical Society 154 (11) (2007), A.1035-1047.
(20) Myounggu Parka, Xiangchun Zhanga, Myoungdo Chunga, Gregory B. Lessa, Ann Marie Sastry, Journal of Power Sources 195 (2010) 7904-7929. [ Links ]
(21) Lunblad A, Bergman B (1997) Solid State Ionics 96:173-181 [ Links ]
(22) Martin Winter, Jürgen O. Besenhard,* Michael E. Spahr, and Petr Novak, Adv. Mater. 1998, 10, No. 10. [ Links ]
(23) Liu Jing, Wen ZhaoYin, Journal of Inorganic Materials, 2002, 17 (6) : 1157 [ Links ]
(24) Liao Gang, Hu Guorong, Peng Zhongdong, Xiao Jin, Zhang Xinlong, Journal of Wuhan University of Technology - Mater. Sci. Ed., 2005, Vol 20, N° 4, 73 - 76. [ Links ]
(25) X. L. Zeng , Y. Y. Huang, F. L. Luo, Y. B. He, D. G. Tong, J Sol-Gel Sci Technol (2010) 54:139-146 [ Links ]
(26) Jeong ED, Won MS, Shim YB (1998), J Power Sources 70:70-77 [ Links ]
(27) Kumta PN, Gallet D, Waghray A, Bolmgren GE, Setter MP (1998), J Power Sources 72:91-98 [ Links ]
(28) Rho YH, Kanamura K, Fujisaki M, Hamagami J, Suda S, Umegaki T (2002), Solid State Ionics 151:151-157 [ Links ]
(29) Lala S, Montoro L, Donato E, Rosolen J (2003), J Power Sources 114:127-132 [ Links ]
(30) Castro-Garcia S, Castro-Couceiro A, Senaris-Rodriguez S, Soulette F, Julien C (2003), Solid State Ionics 156:15-26 [ Links ]
(31) Kwang Man Kim , Sang Hyo Lee, Sanghyo Kim, Young-Gi Lee, J Appl Electrochem (2009) 39:1487-1495
(32) X. L. Zeng, Y. Y. Huang, F. L. Luo, Y. B. He, D. G. Tong, J Sol-Gel Sci Technol (2010) 54:139-146
(33) Chongqiang Zhua, Chunhui Yanga, Wein-Duo Yangb,*, Ching-Yuan Hsiehc, Huei-Mei Ysaic,Yun-Sheng Chenb, Journal of Alloys and Compounds 496 (2010) 703-709.
(34) J.-T. Lee, Y.-J. Chu, F.-M. Wang, C.-R. Yang, C.-C. Li, Journal of Materials Science, 42(2007) 10118-10123.
(35) Jianlin Li, Claus Daniel, David Wood, Journal of Power Sources (2010) doi:10.1016/ j.jpowsour.2010.11.001.
(36) M. M. Thackeray, W. I. F. David, P. G. Bruce, and J. B. Goodenough, Mater. Res. Bull. (1983).18, 461
(37) Martin Winter, Jürgen O. Besenhard,* Michael E. Spahr, and Petr Novak, Adv. Mater. 1998, No. 10.,10.
(38) J. C. Hunter, J. Solid State Chem.(1981), 39, 142
(39) D. Guyomard and J. M. Tarascon, Solid State Ionics (1994). 69, 222
(40) J. Bates, D. Lubben, N. Dudney, and F. Hart, J. Electrochem. Soc. (1995) 142, L149.
(41) G. Amatucci and J. M. Tarascon, J. Electrochem. Soc. (2002) 149, K31
(42) S. R. Das, S. B. Majumder, and R. S. Katiyar, J. Power Sources (2005) 139, 261.
(43) S. R. Das, Istevao R. Fachini, S. B. Majumder, and R. S. Katiyar, J. Power Sources (2006) 158, 518.
(44) R. Singhal, M. S. Tomar, and R. S. Katiyar, Research Signpost entitled "Advanced Materials and Methods for Lithium Ion Batteries," ISBN: 978-81-7895-279-6, edited by S. S. Zhang (2007), Chap. 4.
(45) T. Horiba, T. Maeshimaa, T. Matsumura, M. Koseki, J. Arai, Y. Muranaka, Journal of Power Sources 146 (2005) 107-110
(46) Christopher S. Johnson, Journal of Power Sources (2007) 165 559-565
(47) M.J. Arago, C. Perez-Vicente, J.L. Tirado, Electrochemistry Communications 9 (2007) 1744-1748
(48) Artur Brauna, Hongxin Wang, Tobias Funk, Soenke Seifert, Elton J. Cairns, Journal of Power Sources 195 (2010) 7644-7648
(49) K. Y. Chung, H. S. Lee, W. S. Yoon, J. McBreen, and X. Q. Yang, J. Electrochem. Soc. (2006),153, A774
(50) Christophe PILLOT, PRESENT AND FUTURE MARKET SITUATION FOR BATTERIES, http.c.pillot@avicenne.com, 2010.
(51) J.M. Tarascón, E. Wang, F.K. Shokoohi, W.R. McKinnon, S. Colson, J. Electrochem. Soc, 138(10), 2859 (1991).
(52) J.M. Tarascón, W.R. McKinnon, F. Coowar, T.N. Bowmer, G. Amatucci, D. Guyomard, J. Electrochem. Soc, (1994) 141(6), 1421.
(53) HongJun Yuea, XingKang Huanga,b, DongPing Lva, Yong Yanga, Electrochimica Acta 54 (2009) 5363-5367
(54) W. Bowdena, T. Bofinger, F. Zhang, N. Iltchev, R. Sirotina, Y. Paik, H. Chen, C. Grey, S. Hackney, Journal of Power Sources 165 (2007)609-615
(55) H. Yamaguchi, A. Yamada, and H. Uwe, Phys. Rev. B (1998) 58, 8.
(56) K. Y. Chung, H. S. Lee, W. S. Yoon, J. McBreen, and X. Q. Yang, J. Electrochem. Soc. 153, A774 2006 .
(57) K. Y. Chung, C. W. Ryu, and K. B. Kim, J. Electrochem. Soc. 152, A791 2005 .
(58) M. M. Thackeray, Prog. Solid State Chem. 25, 1 1997 .
(59) Y. Shin and A. Manthiram, J. Electrochem. Soc. 151, A204 2004.
(60) Eftekhari A (2004) J Power Sources 130:260 [ Links ]
(61) Sun YC, Wang ZX, Chen LQ, Huang XJ (2003) J Electrochemical Soc 150:A1294 [ Links ]
(62) Lee SW, Kim KS, Moon HS, Kim HJ, Cho BW, Cho WI, Ju JB, Park JW (2004) J Power Sources 126:150. [ Links ]
(63) Gnanaraj JS, Pol VG, Gedanken A, Aurbach D (2003) Electrochem Commun 5:940 [ Links ]
(64) Zhou WJ, He BL, Li HL (2008) Mater Res Bull 43:2285 [ Links ]
(65) Shiau Fong Tay & Mohd Rafie Johan, Ionics, 2008, DOI 10.1007/s11581-010-0438-x. G.A. Nazri, Lithium ion battery science and technology, Springer, USA, 2008
(66) Jun Liu , Ji-Guang Zhang , * and M. Stanley Whittingham, Adv. Mater. 2012, 24, 2109-2116 G.A. Nazri, Lithium ion battery science and technology, Springer, USA, 2008
(67) S. Patoux, L. Daniel, C. Bourbon, H. Lignier, C. Pagano, F.L. Cras, S. Jouanneau, S. Martinet J Power Sources 189, 344, 2009
(68) N. Amdouni, K. Zaghib, F. Gendron, A. Mauger, C.M. Julien, J Magn Magn Mater 309,100, 2007
(69) M. Kunduraci, J. F. Al-Sharab, G. G. Amatucci, Chem. Mater., 18, 3585, 2006
(70) J.H. Kim, C.S. Yoon, S.T. Myung, J. Prakash and Y.K. Sun, Electrochemical and Solid-State Letters, 7 (7), A216, 2004
(71) J.H. Kim, S.T. Myung, C.S. Yoon, S.G. Kang and Y.K. Sun, Chem. Mater., 16, 906, 2004
(72) Xiaohua Ma, Byoungwoo Kang, and Gerbrand Ceder, Journal of The Electrochemical Society, 157 _8_ A925-A931 _2010
(73) Jie Xiao , * Xilin Chen , Peter V. Sushko , Maria L. Sushko , Libor Kovarik , Jijun Feng , Zhiqun Deng , Jianming Zheng , Gordon L. Graff , Zimin Nie , Daiwon Choi ,
(74) Jun Liu , Ji-Guang Zhang , * and M. Stanley Whittingham, Adv. Mater. 2012, 24, 2109-2116
(75) H.S. Fang, Z.X. Wang, X.H. Li, H.J. Guo, W.J. Peng, Materials Letters, (2006) 60, 1273
(76) Z.Y. Chen, S. Ji, V. Linkov, J.L. Zhang, W. Zhu, Journal of Power Sources, (2009) 189, 507
(77) G.Q. Liu, L. Qi, L. Wen, Rare Metal Materials and Engineer, (2006), 35, 299,
(78) Y. Ji, Z.X. Wang, Z.L. Yin, H.J. Guo, W.J. Peng, X.H. Li, Chinese Journal of Inorganic Chemistry (2007), 23, 597
(79) Rahul Singhal, Jose J. Saavedra-Aries, Rajesh Katiyar, Yasuyuki Ishikawa, Marius J. Vilkas, Suprem R. Das, Maharaj S. Tomar, and Ram. S. Katiyar1, Journal of Renewable and Sustainable Energy (2009), 1, 023102
(80) Padhi AK, Nanjundaswamy KS, Goodenough JB (1997) J Electrochem Soc 144:1188
(81) J.M. Tarascon, M. Armand, Nature 414 (2001) 359.
(82) C. Delmas, M. Maccario, L. Croguennec, F. Le Cras, F. Weill, Nat. Mater. 7 (2008) 665.
(83) J.B. Goodenough, Y. Kim, Chem. Mater. 22 (2010) 587.
(84) D. Jugovic, D. Uskokovic, J. Power Sources 190 (2009) 538.
(85) Anderson AS, Thomas JO, J Power Sources (2001), 97-98:498
(86) Huang H, Yin S, Nazar LF, Electrochem Solid-State Lett (2001), 4:A170 [ Links ]
(87) Croce F, Epifanio AD, Hassoun J, Deptula A, Olezac T, Scrosati B (2002) Electrochem Solid-State Lett 5:A [ Links ]
(88) OU XiuQin, Xu ShengZhao, Liang GuangChuan, Wang Li and Zhao Xia, Sci China Ser E-Tech Sci, Jan. 2009, vol. 52, No. 1, 264-268. [ Links ]
(89) Kiyoshi Kanamura, Shohei Koizumi, Kaoru Dokko J Mater Sci (2008) 43:2138-2142. [ Links ]
(90) P.P. Prosini, M. Lisi, S. Scaccia, J. Electrochem. Soc. 149, A297-A301 (2002). [ Links ]
(91) S. Y. Chung, J. T. Bloking, Y. M. Chiang, Nat. Mater. 2002, 1, 123.
(92) Kiyoshi Kanamura, Shohei Koizumi, Kaoru Dokko, J Mater Sci (2008) 43:2138-2142.
(93) Okada S, Sawa S, Egashira M, Yamaki J, Tabuchi M, Kageyama H, Konishi T, Yoshino A (2001) J Power Sources 97-98:430-432
(94) C. Delmas, M. Maccario, L. Croguennec, F. Le Cras, and F. Weill, Nature materials VOL 7 August 2008 www.nature.com/naturematerials
(95) J. L. Allen & T. R. Jow & J. Wolfenstine, J Solid State Electrochem (2010) 14:889-895.
(96) Yonemura, M., Yamada, A., Takei, Y., Sonoyama, N. & Kanno, R., J. Electrochem. Soc. 151, A1352-A1356 (2004).
(97) Yamada, A., Koizumi, H., Sonoyama, N. & Kanno, R., Electrochem. Solid State Lett. 8, A409-A413 (2005).
(98) Meethong, N., Huang, H. Y. S., Carter,W. C. & Chiang, Y., Electrochem. Solid State Lett. 10, A134-A138 (2007).
(99) J. Yao . K. Konstantinov . G. X. Wang . H. K. Liu, J Solid State Electrochem (2007) 11: 177-185.
(100) Xueliang Li, Weidong Wang, Chengwu Shi, Hua Wang and Yan Xing, J Solid State Electrochem (2009) 13:921-926.
(101) G. Arnold, J. Garche, R. Hemmer, S. Stro'bele, C. Vogler, M. Wohlfahrt-Mehrens, Journal of Power Sources 119-121 (2003) 247-251.
(102) Dan Li, Yudai Huang, Dianzeng Jia, Zaiping Guo, Shu-Juan Bao, J Solid State Electrochem (2010) 14:889-895.
(103) George Ting-Kuo Fey, Tung-Lin Lu, Feng-Yu Wu, Wen-Hsien Li, J Solid State Electrochem (2008) 12:825-833.
(104) Xueliang Li, Weidong Wang, Chengwu Shi, Hua Wang, Yan Xing. Jing Liua,b, JiaweiWanga, Xuedong Yana, Xianfa Zhanga, Guiling Yanga, Abraham F. Jalboutc, RongshunWanga , Electrochimica Acta 54 (2009) 5656-5659
(105) Jianguo Ren, Weihua Pu, Xiangming He, Changyin Jiang, Chunrong Wan, Ionics (2011) 17:581-586.
(106) Gary McChesney, Dan Walden, Future Fuel, Chemical Co., Project ID: ARRAVT012, 2011, 372- 386
(107) N. Takami, A. Satoh, M. Hara, T. Ohsaki, J. Electrochem. Soc. 1995,142, 371.
(108) A. Satoh, N. Takami, T. Ohsaki, Solid State Ionics 1995, 80, 291.
(109) T. Zheng, J. S. Xue, J. R. Dahn, Chem. Mater. 1996, 8, 389.
(110) H. Lee, Y. Kim, M. Hong, S. Lee, J. Power Sources 141 (2005) 159.
(111) Q. Si, K. Hanai, N. Imanishi, M. Kubo, A. Hirano, Y. Takeda, O. Yamamoto, J. Power Sources 189 (2009) 761.
(112) Z. Luo, D. Fan, X. Liu, H. Mao, C. Yao, Z. Deng, J. Power Sources 189 (2009) 16.
(113) C.M. Park, H.J. Sohn, J. Electrochem. Soc. 157 (2010) A46.
(114) M. Yoshio, H. Wang, K. Fukuda, T. Umeno, N. Dimov, Z. Ogumib, J. Electrochem. Soc. 149 (2002) A1598.
(115) W. Liu, Z. Guo, W. Young, D. Shieh, H. Wu, M. Yang, N. Wu, J. Power Sources 140 (2005) 13
(116) A.K. Shukla, T.P. Kumar, Curr. Sci. 94 (2008) 314.
(117) M. Winter, J.O. Besenhard, M.E. Spahr, P. Novak, Adv. Mater. 10 (1998) 725
(118) D. Larcher, S. Beattie, M. Morcrette, K. Edstrom, J.C. Jumas, J.M. Tarascon, J. Mater. Chem. 17 (2007) 3759.
(119) M.M. Thackeray, J.T. Vaughey, L.M.L. Fransson, J. Met. 54 (2002) 20.
(120) M. Winter, J.O. Besenhard, Electrochim. Acta 45 (1999) 31
(121) R. Benedek, M.M. Thackeray, J. Power Sources 110 (2002) 406.
(122) U. Kasavajjula, C. Wang, A.J. Appleby, J. Power Sources 163 (2007) 1003
(123) W.-J. Zhang / Journal of Power Sources 196 (2011) 13-24
(124) M. Winter, J. O. Besenhard, Electrochim. Acta 45 (1999) 31
(125) Bruno Scrosati*, Jürgen Garche, . Journal of Power Sources 195 (2010) 2419-2430
(126) Daniel Waszak, Elzbieta Frackowiak, Materials Science-Poland, Vol. 23, No. 3, 2005
(127) Wen Jie Jin, Taek Rae Kim, Seung Hwan Moon, Yun Soo Lim, Myung Soo Kim, Materials Science Forum (2006), Vol. 510 - 511, 10781081.
(128) Fu, L.J. ; Zhang, H.P. ; Wu, Y.P. ; Wu, H.Q. ; Holze, R., Electrochemical and Solid-State Letters. (2005)- 8(9) A456 - A458
(129) Basker Veeraraghavan, Anand Durairajan, Bala Haran, Branko Popov and Ronald Guidotti, Journal of The Electrochemical Society, (2002). 149 - 6, A675-A681
(130) Ke Wang, Xiangming He, Jianguo Ren, Changyin Jiang, Chunrong Wan, Journal of New Materials for Electrochemical Systems (2007) 10, 167-170 .
(131) G X Wang, Jung-Ho Ahn, M J Lindsay, L Sun, D H Bradhurst, S X Dou, H K Liu, Journal of Power Sources (2001) Volume: 97-98, 211-215
(132) Xiuyan Wang, Zhaoyin Wen, Bin Lin, Jiu Lin, Xiangwei Wu, Xiaogang Xu, Journal of Power Sources, Volume 184, Issue 2, 1 October 2008, Pages 508-512.
(133) S. Panero, P. Reale, F. Ronci, B. Scrosati, P. Perfetti, V. Rossi Albertini, Chem. Phys. 3 (2001) 845-847.
(134) K. Nakahara, R. Nakajima, T. Matsushima, H. Majima, J. Power Sources 117 (2003) 131-136
(135) H. Ge, N. Li, D. Li, C. Dai, D. Wang, J. Phys. Chem. C 113 (2009) 6324-6326.
(136) J. Shu, J. Solid State Electrochem. 13 (2009) 1535-1539.
(137) Z.Y. Zhong, C.Y. Ouyang, S.Q. Shi, M.S. Lei, ChemPhysChem 9 (2008) 2104-2108.
(138) P.P. Prosini, R. Mancini, L. Petrucci, V. Contini, P. Villano, Solid State Ionics 144(2001) 185-192.
(139) K.-C. Chou, W.H. Qiu, K. Wu, G.H. Zhang, Rare Metals 25 (2006) 399-406.
(140) K. Zaghib, M. Simoneau, M. Armand, M. Gauthier, J. Power Sources 81-82 (1999) 300-305.
(141) Y.-H. Rho, K. Kanamura, J. Solid State Chem. 177 (2004) 2094-2100.
(142) Y.-J. Hao, Q.-Y. Lai, D.-Q. Liu, Z.-U. Xu, X.-Y. Ji, Mater. Chem. Phys. 94 (2005)382-387.
(143) Manuel Ortega, Mario Blanco, Eduardo Palenque, Saúl Cabrera, Revista Bol. Quím. Vol. 28, No.2 - 2011, 130 - 134
(144) Tsuyoshi Hoshinoa,*, Kenichi Katob, Yuri Natori b, Mutsumi Nakamurab, Kazuya Sasakic, Fusion Engineering and Design 84 (2009) 956-959.
(145) Kimio Hayashia, Takayuki Terai c, Katsuyoshi Tatenumab T. Yuan, K. Wang, R. Cai, R. Ran, Z. Shao, J. Alloys Compd. 477 (2009) 665-672.
(146) M.W. Raja, S. Mahanty, M. Kundu, R.N. Basu, J. Alloys Compd. 468 (2009) 258-262.
(147) S.Y. Yin, L. Song, X.Y. Wang, M.F. Zhang, K.L. Zhang, Y.X. Zhang, Electrochim. Acta 54 (2009).
(148) G. Wang, J. Xu, M. Wen, R. Cai, R. Ran, Z. Shao, Solid State Ionics 179 (2008).
(149) Masataka Wakihara, Material Science and Engineering R33 (2001), 109 - 134.
(150) C. Robillard, A. Vall'ee, H. Wilkinson, The impact of lithium-metalpolymer battery characteristics on telecom power system design, see Avestor web site (www.Avestor.com).
(151) Jeffrey W. Fergus, Journal of Power Sources 195 (2010) 4554-4569
(152) Ruijuan Yang a, Yinghui Wang a, Xiaopeng Hao b, Jie Zhan b, Shiquan Liu, Journal of Non-Crystalline Solids 357 (2011) 2192-2196.
(153) R. Jimenez, A. Rivera, A. Várez, J. Sanz, Solid State Ionics 180 (2009) 1362-1371.
(154) A.A. Shibkova, A.A. Surin, Z.S. Martem'yanova, V.I. Voronin, A.P. Stepanov, I.V. Korzun, L.A. Blaginina, V.P. Obrosov, Glass Ceram. 64 (3-4) (2007) 124-128.
(155) V. Thangadurai, W. Weppner, J. Electrochem. Soc. 151 (1) (2004) H1-H6.
(156) Y. Inaguma, L. Chen, M. Itoh, T. Nakamura, Solid State Ionics 70-71 (1994)196-202.
(157) O. Bohnké, Solid State Ionics 179 (2008) 9-15.
(158) J. Rogez, P. Knauth, A. Garnier, H. Ghobarkar, O. Schäf, J. Non-Cryst. Solids 262 (2000) 177-182.
(159) A. Kuhn, M. Wilkening, P. Heitjans, Solid State Ionics 180 (2009) 302-307.
(160) J.M. Kim, G.B. Park, K.C. Lee, H.Y. Park, S.C. Nam, S.W. Song, J. Power Sources 189 (2009) 211-216.
(161) F. Berkemeier, M.R.S. Abouzari, G. Schmitz, Ionics 15 (2009) 241-248.
(162) P. Heitjans, E. Tobschall, M. Wilkening, Eur. Phys. J. Special Top. 161 (2008)97-108.
(163) J.S. Thokchom, N. Gupta, B. Kumar, J. Electrochem. Soc. 155 (12) (2008)A915-A920.
(164) J.S. Thokchom, B. Kumar, J. Power Sources 185 (2008) 480-485.
(165) B. Kumar, D. Thomas, J. Kumar, J. Electrochem. Soc. 156 (7) (2009) A506-A513.
(166) J. Fu, Solid State Ionics 104 (1997) 191-194. [ Links ]
(167) J.S. Thokchom, B. Kumar, J. Power Sources 195 (2010) 2873-2876. [ Links ]
(168) X. Xu, Z. Wen, Z. Gu, X. Xu, Z. Lin, Solid State Ionics 171 (2004) 207-213. [ Links ]
(169) X. Xu, Z. Wen, Z. Gu, X. Yang, J. Zhang, Z. Gu, Solid State Ionics 177 (2006)2611-2615. [ Links ]
(170) N.V. Kosova, E.T. Devyatkina, A.P. Stepanov, A.L. Buzlukov, Ionics 14 (2008)303-311. [ Links ]
(171) T. Zhang, N. Imanishi, S. Hasegawa, A. Hirano, J. Xie, Y. Takeda, O. Yamamoto, N. Sammes, J. Electrochem. Soc. 155 (12) (2008) A965-A969. [ Links ]
(172) S. Hasegawa, N. Imanishi, T. Zhang, J. Xie, A. Hirano, Y. Takeda, O. Yamamoto, J. Power Sources 189 (2009) 371-377. [ Links ]
(173) R. Ramaraghavulu, S. Buddhudu Ceramics International, March (2011), 23 [ Links ]
(174) http://www.ohara-inc.co.jp/en/product/electronics/licgc.html, http://www.faqs.org/patents/app/20110300451
(175) Jianlin Li, Claus Daniela, David Wood, Journal of Power Sources 196 (2011) 2452-2460. [ Links ]
(176) José Luís Urdininea, www.hidrocarburosbolivia.com [ Links ]
(177) Salomón Rivas, Federico Ahlfeld, Minerales de Bolivia y sus parajes, Tomos I, II, La Paz, 2009. [ Links ]
(178) Arzabe, Hugo; Fluidización de minerales de manganeso; UMSA; La Paz, 1979. 140 p. [ Links ]
(179) CEPROMIN; El bióxido de manganeso en Bolivia; Serie Recursos Naturales, 1992. [ Links ]
(180) Camacho Antonio; Proyecto Bióxido de Manganeso, inventariación, evaluación y preselección de yacimientos de manganeso; GEOBOL [ Links ]
(181) EU Measures for monitoring the average specific emissions of carbon dioxide from new passenger cars. http://ec.europa.eu/environment/air/transport/co2/co2_monitoring.htm (Accessed June 14, 2010). [ Links ]
(182) Heil, G.; Kormann, C.; Adel, J. Lithium Oxide Containing Lithium Intercalation Compounds. European Patent Application No. EP1204601, published on 2/19/2003 [ Links ]












 uBio
uBio 

