Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Boliviana de Química
On-line version ISSN 0250-5460
Rev. Bol. Quim vol.27 no.2 La Paz Dec. 2010
ARTICULO ORIGINAL
STEREOCHEMICAL ANALYSIS OF NATURAL PRODUCTS BY NMR THE J-BASED APPROACH, A SHORT REVIEW[*]
José A. Bravo, José Vila, Mauricio Peñarrieta, Patricia Mollinedo
Instituto de Investigaciones Químicas (IIQ) Carrera de Ciencias Químicas Universidad Mayor de San Andrés, (UMSA) Casilla 303 La Paz- Bolivia. Instituto de Investigaciones en Productos Naturales (IIPN, UMSA), Casilla 303 La Paz- Bolivia.
Keywords: Stereochemistry, flexible macrocyciclic, conformation, configuration, natural products, NMR, homonuclear coupling, hetereonuclear coupling, J-based approach
ABSTRACT
This is a short review on some available information regarding recent advances in the application of new approaches to the establishment of the close relationship conformation/configuration in flexible systems. These are usually characterized by containing a number of stereogenic sites and it became interesting to evaluate how the new tools could help in defining configurations. The new developments are particularly suitable for the analysis of natural products. Indeed, we are here circumscribed only to the so-called J-based approach.
Corresponding author: jbravo@umsa.bo
RESUMEN
Esta es una revisión breve de información disponible sobre avances recientes en la aplicación de nuevos enfoques para el establecimiento de la relaciones conformación/configuración en sistemas flexibles. Estos se caracterizan por contener un número de sitios estereogénicos y se ha hecho interesante evaluar como estas nuevas herramientas podrían ayudar a definir configuraciones. Los nuevos desarrollos son particularmente apropidaos para el análisis de productos naturales. Claro está, en la presente contribución nos circunscribimos solo al llamado enfoque J-based approach.
INTRODUCTION
The fact of the need of unambiguously determining the stereochemical features in as much as possible chiral centers (some times it becomes impossible) in complex organic molecules, particularly bioactive natural products can eventually derive in an existential problem to chemists. This problem was boarded at the beginning by synthesis. Spectroscopic methods started to be used in accordance with the technical electronic and generic advancement in equipments during the time. One of the most used techniques at the albor of the use of spectrometric tools was circular dichroism [1] (CD) which became a classical method when determining the relative configuration in an asymmetric carbon particularly in rigid systems such as steroids.[2] The high field NMR spectrometers arrival opened dramatically the door to a faster and precise configuration determination. This is a short review on some available information regarding recent advances in the application of new approach to the establishment of the close relationship conformation/configuration in flexible systems. These are usually characterized by containing a number of stereogenic sites and it became interesting to evaluate how the new tools could help in defining configurations. The new developments are particularly suitable for the analysis of natural products. Indeed, we are here circumscribed only to the so-called J-based approach.
El hecho de tener que determinar las características estereoquímicas sin ambigüedades en la mayor cantidad posible de centros quirales (a veces llega a ser imposible) en moléculas orgánicas complejas, particularmente productos naturales bioactivos puede eventualmente derivar en un problema existencial para los químicos. Este problema fue abordado en un principio por síntesis. Los métodos espectroscópicos comenzaron a ser usados a la medida de los avances técnicos electrónicos y genéricos al pasar del tiempo. Una de las mas usadas técnicas en los albores del uso de herramientas espectroscópicas fue el dicroismo circular [1] (CD) que llegó a ser un método clásico en la determinación de la configuración relativa en un carbón asimétrico particularmente en sistemas rígidos tales como los esteroides.[2] Con el advenimiento de los espectrómetros RMN de alto campo se abrió de un modo dramático la puerta hacia mas rápidos y precisos análisis de determinación de configuración. Esta es una revisión breve de información disponible sobre avances recientes en la aplicación de nuevos enfoques para el establecimiento de la relaciones conformación/configuración en sistemas flexibles. Estos se caracterizan por contener un número de sitios estereogénicos y se ha hecho interesante evaluar cómo estas nuevas herramientas podrían ayudar a definir configuraciones. Los nuevos desarrollos son particularmente apropiados para el análisis de productos naturales. Claro está, en la presente contribución nos circunscribimos solo al llamado enfoque J-based approach.
NMR is certainly one of the most powerful techniques for the determination of the relative configuration in organic compounds. Indeed, these spectral tools are also applicable to the problem of determining the substituent relative spatial orientations in asymmetrical synthesis products. The first approach to the determination of the spatial orientation by NMR is the one-dimension homonuclear vicinal scalar coupling 3JHH and its two-dimensions complement the correlation spectroscopy experiment COSY. Sometimes, it becomes unavoidable the use of techniques for the observation of through-space proximities based on the NOE effect, namely: NOESY and ROESY.
In physalolactone and derivatives [3] (Fig. 1), for instance, we start with the C-12 position, proton H-12 (4.57 ppm) is defined as a-axial due to its diaxial coupling constant (J = 10.3 Hz) with H-11 (1.31 ppm) that rests so defined in an axial position. Proton H-1 (4.95 ppm) possesses a coupling constant of J = 2.3 Hz with each H-2 (2.13 and 1.77 ppm). This let suggest its b equatorial position. In the ROESY experiment an Overhauser effect of H-1(4.85 ppm) and CH3-19 (1.03 ppm) as well as a second with H-11 (1.54 ppm) corroborates this position (Fig. 2). It cab be inferred from this example that there is a direct relationship between configuration and conformation. This analysis being realized over rigid conformers of physalolactone B and derivatives, the assignment of configurations in centers C-1 and C-12 in cyclohexanoids A and C, for example, is assured.
La espectroscopia de NMR es ciertamente una de las más poderosas técnicas instrumentales para el análisis de la configuración relativa de compuestos orgánicos. Las técnicas de NMR son también aplicables al problema de determinar la orientación espacial relativa de los substituyentes en clases seleccionadas de compuestos asimétricos (sintéticos). Las primera aproximación a la determinación de orientaciones por NMR es el 3JHH en 1D 1Hnmr apoyada por su extensión 2D: la Cosy. Un complemento ineludible en ocasiones es el uso de técnicas de observación de proximidades nucleares espaciales basadas en los efectos NOE, 2DNMR: Noesy, Roesy
En physalolactone B y derivados [3], (Fig. 1) por ejemplo, H-12 se define en posición a-axial, (4.57 ppm) debido a su constante de acoplamiento diaxial (J = 10.3 Hz) con H-11 (1.31 ppm) que queda también definido en una posición axial. El proton H-1 (4.95 ppm) posee una constante de acoplamiento de J = 2.3 Hz con cada H-2 (2.13 y 1.77 ppm). Esto sugiere su position b ecuatorial. En el experimento ROESY un efecto Overhauser de H-1(4.85 ppm) y CH3-19 (1.03 ppm) asi como un segundo efecto con H-11 (1.54 ppm) corrobora esta posición ecuatorial para H-1. (Fig. 2). Deducimos de este ejemplo que existe una relación directa entre configuración y conformación. Siendo el análisis realizado sobre confórmeros estables de physalolactone B y derivados, la asignación de configuraciones en los centros C-1, C-12, de los ciclohexanoides A y C por ejemplo, esta asegurada.
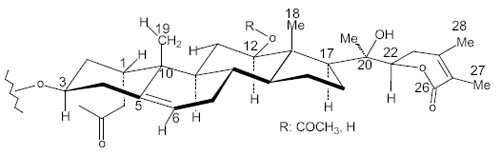
Fig. 1. Physalolactone B, and derivatives, configuration at positions 1 and 12
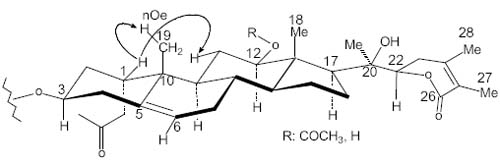
Fig. 2. Physalolactone B, and derivatives, confirmation by ROESY of H-1 position
However, there are several cases when the mono-dimensional analysis by 1HNMR complemented by the bidimensional NOESY/ROESY is not enough to define stereochemistry on chiral centers. In such cases the relationship between conformation and configuration requires a broader profile and must be considered in a more profound manner. We refer to the assignment of the relative (and absolute) configuration in the case of flexible systems: polysubstituted open chains and macrocycle compounds. This a harder labor for which an only strategy for the strereochemical analysis is not available yet. Such difficulties can be expressed by the stereochemistry paradigma of NMR: if the conformation of a molecule is known then its configuration can be known and vice-versa, from the configuration of a system, its conformatopn can be derived. The solution in certain cases was proposed by Murata et al. [4], that utilized the hetero an homonuclear 2DNMR achieved a quantitative approach for the relationship conformation/configuration. Concretely, the observation of the heteronuclear 2,3JCH couplings at the stereogenic carbons contribute to the definition of the most stable conformer over which it is possible to establish the 3JHH values that permit a configuration establishment. Another approach to the problem in specific cases consider quantum chemistry calculations of theoretical 13C chemical shifts for the stereogenic centers.[5, 6] The comparison between experimental and calculated chemical shifts could provide an efficient mode to identify and discriminate diastereomers. The first boarded method is called as the J - based approach [5] and the second based on the comparison of experimental and calculated data is named as the d - based approach.[5, 6]
Sin embargo, existen numerosos casos en los que el análisis 1D1Hnmr, y 2Dnmr Cosy, Roesy no es suficiente para la definición de la estereoquímica en centros quirales. En dichos casos la relación conformación-configuración adquiere un perfil mas amplio y debe ser considerada de manera mas profunda. Se refiere a asignar la configuración relativa (y absoluta) en el caso de sistemas flexibles: cadenas abiertas polisubstituidas y compuestos macrocíclicos. Es una labor mas difícil, en cuyo caso una única estrategia de análisis estereoquímico no esta aun disponible. Dichas dificultades se expresan en el paradigma estereoquímico de la NMR : Si conoces la conformación de una molécula puedes facilmente obtener su configuración; y vice-versa, de la configuración de un sistema puedes derivar su conformación. La solución para ciertos casos especifícos fue propuesta por Murata y col. [4], quienes haciendo uso de la 2Dnmr hetero y homonuclear lograron un acercamiento cuantitativo para la relación configuración conformación. Concretamente, la observación de los acoplamientos heteronucleares, 2,3JCH de los centros estereogénicos contribuye a la definición del confórmero más estable sobre el cual establecer las relaciones 3JHH que permitan definir una configuración. Un otro enfoque hacia la solución de problemas de casos específicos considera cálculos de química cuantica de desplazamientos químicos teóricos de 13C para centros estereogénicos.[5, 6] La comparación entre desplazamientos químicos teóricos y experimentales puede proveer un modo eficiente para identificar y discriminar diastereómeros. El primer método basado en valores de acoplamientos nucleares es el denominado: Enfoque: J - based approach [5] y el segundo basado en la comparación de valores de desplazamientos químicos de 13C es el enfoque: d - based approach.[5, 6]
The J - based approach[5]
Its a methodology based on the detailed analysis of homonuclear (H–H) y heteronuclear (C–H) 2,3J couplings. This can be applied to molecules characterized by a macrociclic skeleton that posses an undetermined number of oxygenated and methylated sterocenters. The J values are useful for conformational and stereochemical studies in organic molecules, providing relevant geometric information. The coupling constants between three-bond distant protons 3JHH are directly related to their dihedral angles through the Karplus equation.[7] (Fig. 3) Besides the Karplus relation, vicinal coupling constants also depend on other molecular parameters such as bonds angle and bonds length, electronegativity, and the relative position of the substituyents linked to the fragment: H–C–C–H. The heteronuclear (1H–13C) vicinal coupling constants (3JCH) follow a Karplusoid relatioship and they can be used to derive additional angular constraints. The 2JCH, values that involve núclei that do not describe a dihedral angle, can still be useful when the α-carbon supports an electronegative substituyent, (O, X). In this case, the relative magnitude of the 2J coupling constants can be related to the dihedral angle between the proton and the electronegative atom linked to the coupled carbon (Table 1) [5, 7]. This table shows typical 3,2JCH values that involve nuclei that do not describe a dihedral angle when the α-carbon supports an electronegative substituyent, (O, X). In such case, the relative magnitude of the two-bonds coupling constants can be related to the dihedral angle between the proton and the electronegative atom linked to the coupled carbon.
El enfoque: J - based approach [5]
Es una metodología basada en un análisis detallado de acoplamientos: homo nuclear (H–H) y heteronuclear (C–H) 2,3J. Paramoléculas caracterizadas por un esqueleto macrocíclico flexible que porta un número indeterminado de estereocentros oxigenados y metilados. Los valores J son útiles para estudios conformacionales y estereoquímicos de moléculas orgánicas, proveyendo información geométrica relevante. Las constantes de acoplamiento entre protones separados por 3 enlaces (3JHH) están directamente relacionadas a sus ángulos dihédricos a través de la famosa ecuación de Karplus [7]. Además de la relación de Karplus, las constantes de acoplamientos vecinales H–H también dependen de otros parámetros moleculares: ángulos de enlace, longitudes de enlace y la electronegatividad y la posición relativa de los substituyentes ligados al fragmento: H–C–C–H. Las constantes de acoplamiento heteronuclear (1H–13C) vecinal (3JCH) siguen una relación Karplusoide y, por lo tanto, pueden ser usadas para derivar restricciones angulares adicionales. Valores 2JCH, que involucran núcleos que no describen un ángulo diedro, pueden aun ser útiles cuando el carbon-α soporta un substituyente electronegativo, (O, X). En ese caso, la magnitud relativa de la constantes de acoplamiento a dos enlaces puede relacionarse al ángulo diedro entre el protón y el átomo electronegativo unido al carbón acoplado (Tabla 1,) [5, 7]. La tabla 1 [5, 7] muestra valores típicos de 3,2JCH, que involucran núcleos que no describen un ángulo diedro cuando el carbon-α soporta un substituyente electronegativo, (O, X). En ese caso, la magnitud relativa de las constantes de acoplamiento a dos enlaces puede relacionarse al ángulo diedro entre el protón y el átomo electronegativo unido al carbón acoplado.
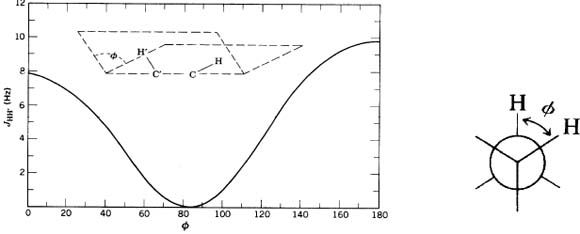
Fig. 3. Relationship between vicinal interproton dihedral angle and coupling constant [7, 8]
The J-based method to determine configurations is function of: the use of 3JHH, 2,3JCH and NOE data; particularly adequate to acyclic structures with stereogenic carbons with -OH, -OR, or Me substituyents [5, 9-13]. In acyclic systems, the coupling constants 3JHH are observed as an average of the all corresponding conformers. Thence it is not possible to establish a univocal correspondence between a J value and a particular conformer. (In the present discussion we will consider only staggered conformers). Hence, the exclusive use of homonucleares 3JHH coupling constants for stereochemical assignments is not feasible in flexible systems (contrasting with rigid systems or cyclic compounds). This situation dramatically changes when additional angular information on the undetermined stereochemistry of a C2 fragment is furnished by the 2,3JCH couplings.
Table 1. 3JHH and 2,3JCH (Hz) coupling constant values for anti and gauche*[5]

The J-based method analyzes H-C-C-H fragments where both carbons are asymmetrical. In any macrocycle or flexible chain is possible to establish the anolgy between a fragment 2C with the 2,3-disubstituted butane, which exist in two relative diasteromeric configurations: [5] Syn (threo), Anti (erythro), see Fig. 4. Each of these can be arranged in three staggered rotamers or conformers , to afford a total of 6. Each configuration (syn and anti) presents one anti conformer and two gauche conformers. Fig. 5 presents a qualitative approach of the magnitude de the different couplings over each conformer, under the Karplus law [5]. From this scheme (Fig. 5) we extract principally that 3JHH as well as 3JCH are large values in anti, and small values in gauche, in both configurations always according to Karplus. For the syn threo configuration, if we dispose of all constants it is possible to identify the conformer A1 or A3, the same with B1 and B3 corresponding to the la anti erythro configuration. However the constants values do not permit to make the difference between A2 and B2. Techniques of NOE must be employed to discriminate between A2 and B2, concretely the protons in the substituents X o Y.[5] (Fig 6).
El método J-based de determinación de configuración NMR es función de: el uso de 3JHH, 2,3JCH y NOE data; particularmente adecuado a estructuras acíclicas con carbonos estereogénicos con substituyentes -OH, -OR, o Me [5, 9-13]. En sistemas acíclicos, las constantes de acoplamiento 3JHH son observadas como un promedio ponderado de todos los confórmeros correspondientes. Por ende no es posible establecer una correspondencia unívoca entre el valor de J y un confórmero en particular. (En la presente discusión nos referiremos solo al tipo escalonado). Entonces el uso exclusivo de las constantes de acoplamiento homonucleares 3JHH para asignaciones estereoquímicas no es factible en sistemas flexibles (a diferencia de los sistemas rígidos o compuestos cíclicos). La situación cambia dramáticamente cuando información angular adicional sobre la estereoquímica indeterminada de un fragmento C2, es proporcionada por acoplamientos 2,3JCH. El método J-based analiza fragmentos H-C-C-H donde ambos carbonos son asimétricos. En cualquier macrociclo o cadena flexibles puede establecerse la analogía de un fragmento con el butano 2,3-disubstituido. El butano 2,3-disubstituido tiene dos configuraciones diasteroméricas relativas:[5] Syn (threo), Anti (erythro), ver Fig. 4. Cada una de estas puede ser colocada en tres rotámeros o confórmeros escalonados, para dar un total de 6. Cada configuración (syn y anti) presenta un confórmero anti y dos gauche. El esquema de la Fig. 5 presenta una apreciación cualitativa de la magnitud de los diferentes acoplamientos sobre cada confórmero, sobre la base de la relación de Karplus [5]. De este esquema (Fig. 5) se extrae principalmente que tanto 3JHH como 3JCH son valores grandes en anti, y pequeños en gauche, en ambas configuraciones, de acuerdo a Karplus. Para la configuración syn threo, si se cuenta con todas las constantes es posible identificar al confórmero A1 o al A3 y lo propio con B1 y B3 de la configuración anti erythro. Sin embargo los valores de las constantes no permiten diferenciar a A2 de B2. Se debe usar técnicas de NOE para discriminar entre A2 y B2, concretamente H en los substituyentes X o Y [5] (Fig. 6).
The first step in the determination of the relative configuration of two vicinal methine groups comes from the evaluation of their 3JHH. If the value is small, we are dealing with the gauche conformer and the additional measurement of 3 or 4 2,3JCH will allow to decide between A1 or A3 (threo) or B1 o B3 (erythro).[5] If 3JHH is large we are faced to an anti conformer that conducts to A2 B2. In these cases we are unable to choose between a configuration assignment between syn (threo) and anti (erythro). In such cases the relative configuration can be attibuted using NOE information between C1 and C4 protons and protons in substituents Y and X. When 3JHH is of an intermediate value (4-8Hz), the relative orientation of H2/H3 corresponds to an interconversion between two conformers gauche and anti.
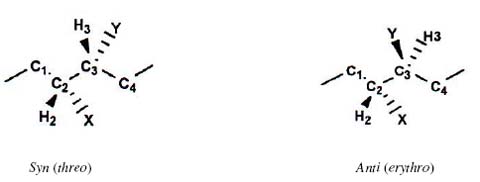
Fig 4. El butano 2,3-disubstituido tiene dos configuraciones diasteroméricas relativas:[5]
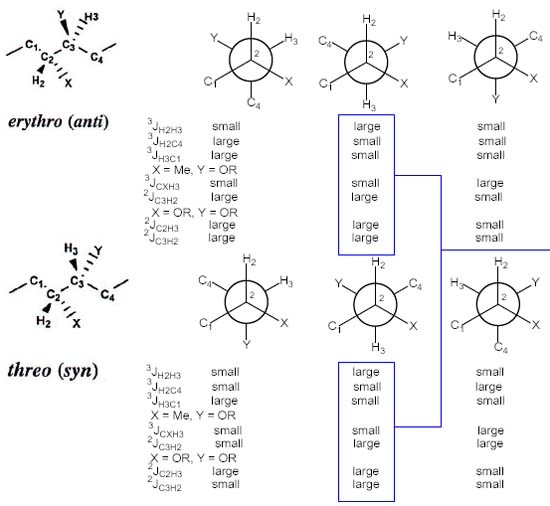
Fig 5. A qualitative approach of the magnitude de the different couplings over each conformer, under the Karplus law for a 2,3-disubstituted butane[5]
Fig 6. The constants values do not permit to make the difference between A2 and B2. Techniques of NOE must be employed to discriminate between A2 and B2, concretely the protons in the substituents [5]
In these cases to define configuration we must call to the use of un conformational equilibrium analysis using ab initio calculations of geometries and energies that allow estimate average coupling constants.[5]
El primer paso en la determinación de la configuración relativa de dos metinos vecinales, viene de la evaluación de sus 3JHH. Si resulta un valor pequeño (0-4 Hz), se trata de un confórmero gauche y la medición adicional de 3 o 4 2,3JCH mediciones, permitirá decidir entre A1 o A3 (threo) o B1 o B3 (erythro).[5] Si 3JHH es grande estamos frente a un confórmero anti que lleva a los tipos A2 B2. En estos casos se presenta una asignación de configuración ambigua entre syn (threo) y anti (erythro). En tales casos la configuración relativa puede ser atribuida usando información NOE entre los protones de C1 y C4 y posiblemente protones en los sustituyentes Y y X. Cuando 3JHH es intermedia, (4-8Hz), la orientación relativa de H2/H3 corresponde a una interconversión entre dos confórmeros gauche y anti. En estos casos para definir la configuración se debe acudir al uso de un análisis de equilibrio conformacional usando cálculos ab initio de geometrías y energías que permitan estimar constantes de acoplamiento promedio.[5]
Often, organic molecules contain two asymmetrical centers separated by a methylene. In this case, if the two stereotopic protons are stereospecifically assigned, the methylene carbon can be treated as one more asymmetry center with adjacent methines. Protons at C-3 are distinguished by their Chemicals shifts and labeled as Hh and Hl as the proton at high and low field respectively. We proceed as before, establishing first 3JHH and then complementing with 3 or 4 2,3JCH more for C2-C3 and then for C3-C4.
A menudo, las moléculas orgánicas contienen dos centros de asimetría separados por un metileno. En ese caso si se asigna estereoespecíficamente los dos protones estereotópicos, el carbono metilénico puede ser tratado como un centro de asimetría más, con metinos adyacentes. Los dos protones de C-3 se distinguen por sus desplazamientos químicos Hh y Hl como protones a campo alto y bajo respectivamente. Se procede como anteriormente, estableciendo primero 3JHH y luego complementando con 3 o 4 más 2,3 JCH para C2-C3 y después para C3-C4.
For an approach to the experimental of the measurement of 3JCH we refer the reader to the corresponding literature [5] and references therein.
Para un enfoque sobre la medición experimental de 3JCHs el lector deberá dirigirse directamente a la literatura de referencia [5] y la bibliografía dada ahí.
As an example of the application of the J-based approach the macrolide sphinxolide has been boarded [5, 14-17]. Sphinxolide: parent member of the family of cytotoxines derived from marine sponges of the Lithistida order, it is a potent antitumoral macrolide (Fig. 7).
Como un ejemplo de la aplicación del método J-based, el macrolide sphinxolide ha sido estudiado. [5, 14-17] Sphinxolide: miembro parental de la familia de citotoxinas derivada de esponjas marinas del orden Lithistida, es un macrólido potente antitumoral (Fig. 7).

Fig. 7. Sphinxolide: un macrociclo con una cadena lateral flexible
Sphinxolide: possesses 17 stereogenic centers and a flexible hydrocarbon framework. It is featured by a side chain and a macrolactonic ring. The Murata et al.s methodology was applied to sphinxolide, this contains the C24-C28 fragment full of asymmetrical centers. As a manner of example we will detail the C24-C25 couple (Fig. 8).
Sphinxolide: posee 17 centros estereogénicos y un esqueleto hidrocarbonado flexible. Caracterizado por una cadena lateral y un anillo macrolactónico. Aplicando la metodología de Murata et al. a sphinxolide, a manera de ejemplo éste contiene el fragmento de centros asimétricos entre C24-C28. Nosotros detallaremos la pareja C24-C25 (Fig. 8).
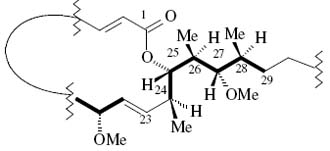
Fig. 8. The C24-C28 full of asymmetrical centers fragment of sphinxolide
The configurations showed in Fig. 7 and 8 for sphinxolide in the C24 to C28 stereogenic centers were defined by the J-based methodology. We now proceed to analyze as a sample, the C24-C25 couple. For that purpose we will apply a conformational analysis. The J-based analysis made for the C24-C25 couple in the literature [5] for the definition of conformations and configurations is exposed in Table 2.
Las configuraciones mostradas en la Fig. 7 y 8 para sphinxolide en los centros estereogénicos C24 al C28, fueron definidas precisamente utilizando la metodología J-based. Nosotros procederemos ahora a analizar a manera de muestra, la pareja C24-C25. Para tal propósito aplicaremos un análisis conformacional. El análisis hecho para la pareja C24-C25 en la literatura [5] para la definición de conformaciones y configuraciones se expone en la Tabla 2.
Table 2. J values measured over stereogenic centers C24-C25 letting propose a configuration for C24 and C25 in sphinxolide

DISCUSSION
Assuming that the real configuration is the one exposed in Table 2 (see column segment), we will extract the C24-C25 couple as seen in Fig. 8 and we will look at it with the C25 in the front (tripod 25) and with the C24 in the back (tripod 24) of this Lewis projection. From there on we will rotate clockwise or counterclockwise one or other tripod until getting the conformation indicated for the configuration in the column segment (Table 2). This stepwise route will conduct us through diverse conformations that we will evaluate after values of 3JHH (Hz) and JHC on Table 2 and on Table 1. After that we will propose the opposite configuration for C24 (leaving the original configuration in C25 unaltered) and then we will evaluate again in the proposed manner above. Then we will propose the opposite configuration for C25 (leaving the original configuration for C24 unaltered) and proceed as done before. A final approach to be evaluated will be when we will combine the opposite configurations for C24 and C25 together. For a development of the diverse conformational/configurational/coupling constants analysis see Fig. 9 to 12.
Asumiendo que la configuración real es la expuesta en la columna segment de la Tabla 2, extractaremos la pareja C24-C25 como se ve en la Fig. 8 y la observaremos desde el lado con el C25 adelante (trípode 25) y con el C24 detrás (trípode 24) de esta proyección de Lewis. A partir de allí rotaremos en el sentido o contra el sentido de las agujas del reloj uno u otro trípode hasta obtener la conformación indicada por la configuración en la columna segment (Table 2). Esta ruta a pasos, nos conducirá a través de diversas conformaciones que evaluaremos de acuerdo a los valores de 3JHH (Hz) y JHC de la Tabla 2 y de la Tabla 1. Después de esto, propondremos la configuración opuesta para C24 (dejando inalterada la de C25) y luego evaluaremos de nuevo en la manera propuesta arriba. Entonces propondremos la configuración opuesta para C25 (dejando inalterada la de C24) y procederemos como antes. Un enfoque final corresponderá a la evaluación cuando combinemos ambas configuraciones opuestas para C24 y C25. Fig. 9 a 11 exponen el desarrollo de los diversos análisis conformacional/configuracional y de constantes de acoplamiento correspondientes.
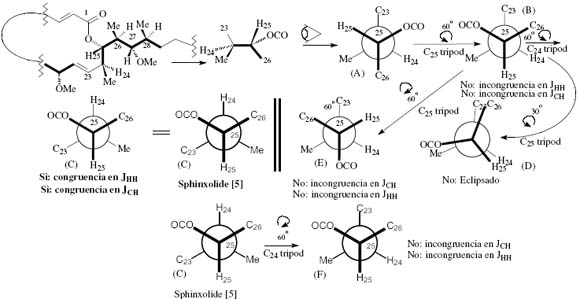
Fig. 9. Conformational analysis I: From Sphinxolide´s anti configuration (erythro) and anti conformation (diaxial), as it is just described in the literature [5], we derive some other conformers (A to E). (A) to (C) are the same and correspond to the configuration reported for sphinxolide [5].The readings of the experimental data is made on Tables 1 and 2
From Fig. 9 we extract that conformers A to C are the same and it corresponds to sphinxolide [5]. Conformer E shows H24 and H25 in a gauche orientation (opposed to the 3JHH value from Table 2). Conformer D is not a staggered conformer. Conformer F shows H24 and H25 in a gauche orientation (opposed to the 3JHH value from Table 2). Thence the only conformation/configuration is the one showed by conformer C (id to A and B). This first conformational/configurational analysis leads to conclude that the J (HH) or (CH) measuring method until mow shows that the configuration for the C24-C25 couple is an anti configuration (erythro) and an anti conformation (diaxial). We will now try to find other configurations/conformations that agree with the experimental data for the C24-C25 couple and see if there is only one or more than one stereochemistry for an atom in particular. There must be warned at this stage that since we are not working with a strict framework models analysis, some of the stereochemical possibilities, for instance when changing one sterocenters stereochemistry for its opposite one, has only a theoretical character and is used here only in order to evaluate the experimental data for its validity.
De la Fig. 9 extraemos que los confórmeros A a C son el mismo y este corresponde al sphinxolide [5]. El confórmelo E muestra H24 y H25 en una orientación gauche (opuesta al valor 3JHH de la Tabla 2). El confórmelo D no es un confórmero escalonado y se desestima. El confórmero F muestra H24 y H25 en una orientación gauche (opuesta al valor 3JHH de la Tabla 2). Por lo tanto la única conformación/configuración es la que muestra al confórmero C (id a A y B). Este primer análisis conformacinoal/configuracional, nos lleva a concluir que el método de mediciones de J (HH) ó (CH) hasta ahora muestra que la configuración para la pareja C24-C25 es una configuración anti (erythro) y una conformación anti (diaxial).Ahora trataremos de encontrar otras configuraciones/conformaciones que estén de acuerdo con los datos experimentales para la pareja C24-C25 y ver si hay un unica o mas de una estereoquímicas para un átomo en particular. En este punto del análisis debemos advertir que dado que no estamos utilizando un sistema de modelos moleculares, algunas de las posibilidades estereoquímicas, por ejemplo cuando se cambia la estereoquímica de un centro por su opuesta, tiene un sentido, al menos en principio, puramente teórico, y es usado aquí para evaluar la validez o sea congruencia o incongruencia con los datos experimentales.
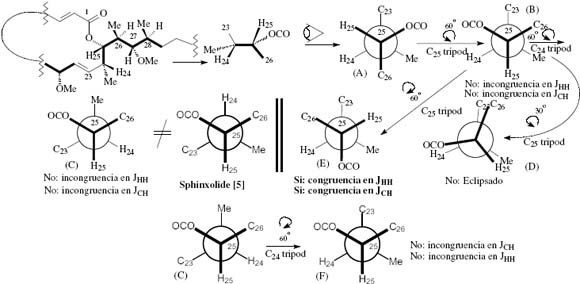
Fig. 10. Conformational analysis II: The inverted configuration at C24 is assayed for analysis under the J-based approach. There is a total congruence with the obtained experimental data in conformer E, if considering that Table 1 permits a reading of a large and negative 2JCH when the 3JHH is large and we have one oxygenated functionality. This fact may indicate the opposite configuration at C24 with respect to the one reported for sphinxolide [5]. This would eventually open the possibility of an uncertain stereochemistry assignment at C24 by the J-based method (cf. however the conditions mentioned in page 115). If Table 1 permits a reading of a large and negative 2JCH only with a small 3JHH then no ambiguity in assignment of stereochemistry is suggested. The readings of the experimental data is made on Tables 1 and 2
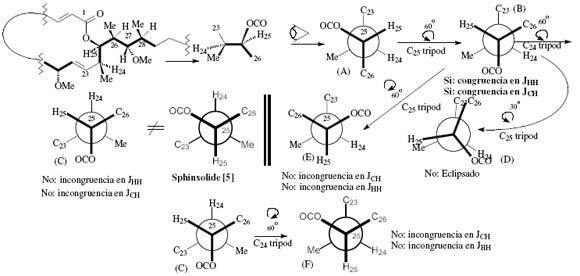
Fig. 11. Conformational analysis III: The inverted configuration at C25 is assayed for analysis under the J-based approach. There is a total congruence with the obtained experimental data in conformer B, if considering that Table 1 permits a reading of a large and negative 2JCH when the 3JHH is large and we have one oxygenated functionality. This fact may indicate the opposite configuration at C25 with respect to the one reported for sphinxolide [5]. This would eventually open the possibility of an uncertain stereochemistry assignment at C24 by the J-based method (cf. however the conditions mentioned in page 115). If Table 1 permits a reading of a large and negative 2JCH only with a small 3JHH then no ambiguity in assignment of stereochemistry is suggested. The readings of the experimental data is made on Tables 1 and 2
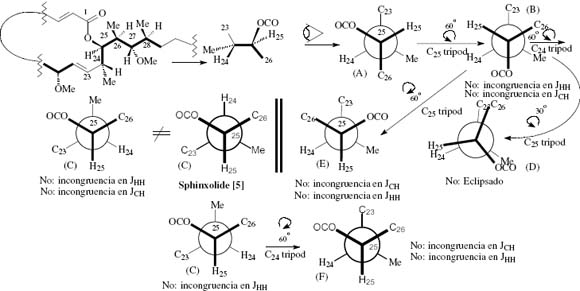
Fig. 12. Conformational analysis IV: We considered here both inverted configurations at C24 and 25 (regardin g sphinxolide [5]) and it have been assayed for analysis under the J-based approach. There is a total incongruence with the obtained experimental data in all conformers. Thus definitely it is possible with certainty in this case, using the J-based method, to affirm that this diasteromer does not fit the experimental data and then we conclude that this is not the compound reflected by table 2.
CONCLUSION
After a reading of table 2 (experimental data for sphinxolide after the measurements under the J-based approach) and Table 1, and considering that under the way of reading Table 1 as separating data by large and small 3JHH values groups scope, and assigning a large 2JCH value only when we have assigned a small value to 3JHH, the method for defining unambiguously the configuration to a couple of stereogenic vicinal carbons is precise, at least in the present case of sphinxolide. However, if the way to read table 2 includes the possibility of assigning a large value to a 2JCH value (supposed for a small 3JHH) when we are faced to a large 3JHH, the method guides to ambiguous stereochemical assignments (considering nevertheless the considerations regarding framework models enounced in page 115).
El método J-based approach permite la asignación sin ambigüedades de configuraciones en el marco de un análisis mixto configuración/conformación, para el caso particular del sphinxolide, fragmento C24-25. Esto si es que se procede a un interpretación de la Tabla 1 en la que se separan datos de valores de 2,3 JCH en las columnas correspondientes en función de los valores grandes y pequeños de 3JHH. Sin embargo, si se interpreta la posibilidad de lectura de un valor grande de 2JCH para un valor grande de 3JHH, entonces la ambigüedad en la asignación de configuraciones toma lugar y el método pierde precisión.
ACKNOWLEDGMENTS
We appreciate the invitation for lecturing at the First National Symposium on Natural Products IIPN, National Academy of Sciences of Bolivia, La Paz, Nov. 10 to 12, 2010, made by Prof. Willy Rendón Director of the IIPN and of the symposium, and Prof. Germán Llanos, Dean of the Department of Chemistry, Universidad Mayor de San Andrés at La Paz.
REFERENCES
1. NINA BEROVA, KOJI NAKANISHI, ROBERT W. WOODY (editors) Circular Dichroism, principles and applications, 2nd edition, 2000, John Wiley Editions [ Links ]
2. S. GÖRÖG Circular Dichroism pag. 1117 in Steroid Analysis, Hugh L. J. Makin editor, 2010, Springer-Verlag
3. BRAVO J. A., SAUVAIN M., GIMENEZ A., BALANZA E., SERANI L., LAPRÉVOTE O., MASSIOT G., LAVAUD C. J. of Nat. Prod., Vol. 64, 720-725 (2001). [ Links ]
4. N. MATSUMORI, D. KANENO, M. MURATA, H. NAKAMURA, K. TACHIBANA. J. Org. Chem. 64, 866 (1999). [ Links ]
5. RICCIO, R, BIFULCO, G, CIMINO, P, BASSARELLO C, GOMEZ-PALOMA, L Pure Appl. Chem., Vol. 75, Nos. 2–3, pp. 295–308, 2003.© 2003 IUPAC, R. Riccio et al [ Links ]
6. WANG, B, DOSSEY, A, WALSEN S, EDISON A, MERZ, K J. of Nat. Prod., Vol. 72, 709-713 (2009).
7. KARPLUS, M J. Chem. Phys. 30, 11 (1959). [ Links ]
8. SILVERSTEIN R M, CLAYTON BASSLER G, MORRILL, T Spedtrometric identification of organic compunds, 5th edition, 1991, John Wiley Editions [ Links ]
9. N. MATSUMORI, D. KANENO, M. MURATA, H. NAKAMURA, K. TACHIBANA. J. Org. Chem. 64, 866 (1999). [ Links ]
10. H. LUESCH, W. Y. YOSHIDA, R. E. MOORE, V. J. PAUL, T. H. CORBETT. J. Am. Chem. Soc. 123, 5418 (2001). [ Links ]
11. M. WU, T. OKINO, L. M. NOGLE, B. L. MARQUEZ, R. T. WILLIAMSON, N. SITACHITTA, F. W. BERMAN, T. F. MURRAY, K. MCGOUGH, R. JACOBS, K. COLSEN, T. ASANO, F. YOKOKAWA, T. SHIOIRI, W. H. GERWICK. J. Am. Chem. Soc. 122, 12041 (2000). [ Links ]
12. K. SHIMBO, M. TSUDA, N. IZUI, J. KOBAYASHI. J. Org. Chem. 67, 1020 (2002). [ Links ]
13. H. IKEDA, N. MATSUMORI, M. ONO, A. SUZUKI, A. ISOGAI, H. NAGASAWA, S. SAKUDA. J. Org. Chem. 65, 438 (2000). [ Links ]
14. C. BASSARELLO, G. BIFULCO, A. ZAMPELLA, M. V. DAURIA, R. RICCIO, L. GOMEZ-PALOMA. Eur. J. Org. Chem. 39, 47 (2001). [ Links ]
15. G. GUELLA, I. MANCINI, G. CHIASERA, F. PIETRA. Helv. Chim. Acta 72, 237 [ Links ]
16. M. V. DAURIA, L. GOMEZ-PALOMA, L. MINALE, A. ZAMPELLA, J. F. VERBIST, C. ROUSSAKIS, C. DEBITUS. Tetrahedron 49, 8657 [ Links ]
17. A. ZAMPELLA, C. BASSARELLO, G. BIFULCO, L. GOMEZ-PALOMA, M. V. D'Auria. Eur. J. Org. Chem. 5, 785 (2002). [ Links ]
[*] Exposed at the First National Symposium on Natural Products IIPN, National Academy of Sciences of Bolivia, La Paz, Nov. 10 to 12, 2010














