Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Boliviana de Química
On-line version ISSN 0250-5460
Rev. Bol. Quim vol.27 no.1 La Paz Aug. 2010
ARTICULO ORIGINAL
CONCENTRADOS DE SAPONINA DE CHENOPODIUM QUINOA Y DE CAIPHORA ANDINA: ALTERNATIVAS COMO BIOCONTROLADORES DE HONGOS FITOPATÓGENOS
Reynaldo Tenorio1, *Enrique Terrazas1, María Teresa Alvarez1, José Luis Vila2, Patricia Mollinedo2
1 Instituto de Investigaciones Fármaco-Bioquímicas
2 Instituto de Investigaciones en Productos Naturales, Universidad Mayor de San Andrés-UMSA
Keywords: Biocontroladores, fitopatógeno, Saponinas-cascaras de quinua-Chenopodium quinoa, Caiphora andina
ABSTRACT
The biocontroler activity of the extracts from Caiphora andina (PA) M-17 and a saponin isolated from the skin of Chenopodium quinoa Wild. (M-16) were assessed. The decreasing in the rate of growth of the fungal phytopathogen during 12 days was used as indicator of the biocontroler activity of the plant extract. The biocontroler activity was compared against the synthetic fungicide Sistane used as positive control at 1 mL/L. The M-16 showed an inhibition of 42% of the Aspergillus flavus. When the plant extracts M-16 and M-17 were used against Ulocladium spp an inhibition of 35% and 36% was achieved respectively. Fusarium spp was susceptible in 47%. Aspergillus flavus was inhibitedin 42% during 4 days by saponin M-16. Thus, this research shows the potential use of plant extracts including saponins as controler agents of phytopathogenic fungi.
Corresponding author: enrique.terrazas@yahoo.com
RESUMEN
Se evaluó la actividad biocontroladora de extractos concentrados de Caiphora andina (PA) M-17y el concentrado de saponina asilado de la cáscara de Chenopodium quinoa Wild. (M-16). La disminución de la velocidad de crecimiento del hongo fitopatógeno durante 12 días fue utilizado como parámetro de medición para determinar la actividad biontroladora de los extractos de plantas. El fungicida sintético Sistane a 1mL/L de concentración fue empleado como control positivo. El extracto M-16 presento una inhibición de 42 % sobre Aspergillus flavus. Ulocladium spp. fue inhibido en un 35 % con el extracto M-16 y 36 % con el extracto M-17. Fusarium spp. fue inhibido en un 47 %. Las saponinas, M-16 inhiben se en un 42 % a la cepa Aspergillus flavus a los 4 días iniciales del experimento. Estos resultados muestran un potencial empleo de estas plantas incluyendo las saponinas como agentes controladores de hongos fitopatógenos.
INTRODUCCION
Los cultivos plantas son atacados por muchas enfermedades y plagas, siendo uno de los agentes principales los hongos que se aprovechan de las plantas para satisfacer sus demandas nutricionales. El hecho de que la enfermedad no se presente en grandes masas hace que pierda espectacularidad y no tiene la importancia que merece.
En el último siglo el uso indiscriminado de productos químicos como pesticidas produjo un desequilibrio, afectando indirectamente a animales y en forma directa a las personas, pero eso no se evidencio sino años después teniendo que muchos de estos pesticidas ser retirados del mercado tal es el ejemplo del DDT.
El cultivo ecológico tomo gran importancia en estos últimos tiempos, tanto para el consumo interno y más para la exportación. Siendo que este tipo de productos ecológicos tiene un valor agregado al momento de ser comercializado en el mercado exterior.
La quinua fue considerada muchas veces como una planta de limitado potencial agronómico y comercial por el bajo rendimiento. No obstante, el área sembrada con quinua ha aumentado a un promedio anual de 34 por ciento desde 1979. Al ser la quinua, una planta típica de nuestra zona andina, presenta una mayor distribución, en cuanto a diversidad de formas de genotipos y de progenitores silvestres, en la actualidad tiene una distribución a nivel mundial. Este cultivo era de rentable en su producción, sin uso de fertilizantes ni pesticidas, así mismo por la gran adaptación a diferentes condiciones agroclimáticas, constituyó un producto de fácil elección para los requerimientos de los consumidores de productos naturales, sanos y nutritivos. La quinua al igual que otras especies del mismo género, alcanzan ahora un gran valor comercial por sus características nutricionales, es así que la quinua (Chenopodium quinoa), la cañihua (Chenopodium pallidicaule y el amaranto (Amaranthus caudatus) son granos andinos que se caracterizan por contener proteínas de alto valor biológico (aminoácidos esenciales disponibles al organismo animal para satisfacer su requerimiento durante una situación biológica) y valor nutricional (aminoácidos para síntesis de proteínas totales juntamente con otros nutrientes).
Existen instituciones en Bolivia como ser PROINPA, PROBIOMA, Probiotec, Biotop que están introduciendo al mercado, productos basados en esporas liofilizadas de hongos antagónicos aplicadas a plantas que son afectadas por plagas que atacan a los sembradíos de nuestro país, causando una importante y favorable ayuda para la producción agroecológica. Se tiene conocimiento de las plagas y enfermedades que atacan a la quinua entre los que podemos mencionar las plagas de insectos a los cortadores de plantas o gusanos de tierra (Capitarsia turbata), del follaje y granos (Eurysacca melanocampta); entre las enfermedades tenemos al mildiu (Peronospora farinosa), podredumbre marrón del tallo (Phoma exigua var fobeata), mancha foliar (Achomycota hyalapospor), mancha ojival del tallo (Phoma sp). Los únicos datos que se tienen para combatir el mildiu es el mejoramiento genético de las diferentes variedades de quinua, muchos con existo como el tipo Sajama, pero otros no por las condiciones del terreno y las climáticas.
La tuna (Opuntia ficus-indica) es una planta que produce frutos comestibles de agradable placer se adapta a las condiciones áridas y semiáridas lo cual facilita el crecimiento y producción en zonas donde caída de lluvia es muy poca o solo se presenta en determinadas fechas del año. Son ampliamente utilizadas en alimento humano. Entre las enfermedades se han detectado ataques muy severos a la roya de la tuna. Así mismo se ha determinado la presencia de Cercospora sp., Phytophthora sp. y pudriciones de origen bacteriano en las pencas.
En el año 2008 la producción de tuna (Opuntia ficus-indica) tuvo una caída en cuando a la producción y muchos de los productores, sufrieron grandes pérdidas, debido a la infestación de sus cultivos por hogos patógenos. No se hicieron estudios previo en Bolivia sobre qué tipos de enfermedades atacan a la tuna, la extraña enfermedad empieza de forma mucoide expulsando un exudado hacia el exterior para luego secarse y necrosarse esto va agravando y marchitando a la penca de la tuna. Se necesita incrementar la búsqueda de alternativas de tratamiento fitosanitario no contaminante.
La Castaña, Castanea sativa Miller, el café sin tostar y la quinua lideran las exportaciones hacia Alemania. Sin embargo el problema de almacenamiento influye negativamente en los controles de calidad para la exportación de este producto, por lo que se necesita buscar un producto que ayude a la conservación del mismo en el almacenamiento antes de la exportación.
Actualmente la necesidad de encontrar otras alternativas apara el tratamiento de estas enfermedades se está desarrollando en muchos países, algunos como Dinamarca ha bajado su consumo de pesticidas, en América Latina, Cuba es uno de los países donde se trabaja con mucho éxito en la busquedad de nuevos biocontroladores.El uso de biocontroladores se empezó a estudiar como una forma novedosa de control de enfermedades con el uso de hongos trabajo realizado especialmente en Cuba (6), el uso de Trichoderma para combatir otros hongos o el uso de campos magnéticos para el mayor crecimiento de este hongo.
En Bolivia el Instituto de Investigaciones Fármaco Bioquímicas dependiente de la Universidad Mayor de San Andrés desde el año 2000 comenzó con una línea de trabajo en la búsqueda y producción de biocontroladores de microorganismos con actividad biológica inhibitoria de fitopatógenos de importancia tanto agrícola como económica para nuestro país, a partir del año 2007 el Instituto de Investigaciones en Productos Naturales se incorpora en la búsqueda de bicontroladores pero a partir de productos naturales aislados de plantas y especies liquenicas. Se estudiaron específicamente el control de fitopatógenos de la haba y de la papa, a través del screening de los hongos del cepario del I.I.F.B. y especies vegetales seleccionadas por quimiotaxonomia,con posible actividad biológica contra estos patógenos.
RESULTADOS, DISCUSION
De las muestras infectadas, colectadas de la hoja de quinua, penca de tuna y castaña. Utilizando los medios de cultivo a adecuados para cada muestra se trabajaron con los hongos aislados para cada especie (Tabla 1)
En los cultivos de quinua el microorganismo patógeno aislado es P. farinosa, este es considerado un parasito obligado. Principal causante del mildiu del cultivo de quinua, causa por la cual no se puede realizar trabajos in vitro. P. Farinosa ha sido detectada en cultivos de quinua en zonas geográficas donde muestra una muy buena adaptación del patógeno. El desarrollo del mildiu se produce en las épocas lluviosas, en el altiplano sur, donde la precipitación fluvial es baja no se presenta. Sin embargo se aisló otro hongo que es Ulocladium spp. Que a pesar de ser un hogo saprofito, (al momento del aislamiento este hongo se encontraba invadiendo a la hoja de forma saprófita y no produjo daño al realizar los postulados de koch modificados); se eligió para el trabajo, por la naturaleza de los extractos vegetales, ya que nos permitirá seguir y verificar la relación entre las saponinas producidas por la planta y los microorganismos que habitan en la misma.
De las especie Opuntia ficus-Indica se asiló el hongo patógeno principal, identificado como Fusarium spp. La presencia de este hongo identificado por su morfología y la presencia de microconidios y macroconidiosla forma de crecimiento muestra, que al los primeros días de crecimiento no presenta color, pero al parar el tiempo de incubación va cambiando el color a un rojo-carmín o violetacomo agente causal de la enfermedad necrosante en la penca de tuna, ya fue descrito.
De los hongos aislados de la muestra de castaña, Castanea sativa Miller, no podríamos afirmar que las cepas Aspergillus flavus y Aspergillus niger sean patógenos en sí, del fruto por qué no producen enfermedad alguna, pero al ser estos saprofitos muy agresivos crecen en cualquier superficie donde la humedad sea propicio. Ambos producen micotoxinas, especialmente A. flavus que produce aflatoxinas y es un problema para cumplir con los requisitos de exportación ya que la concentración permitida de aflatoxinas no deben mayores a 15 ppb de aflatoxina total según el Codex Alimentarius y limita su presencia en maníes Estados Unidos de Norte América, permite un máximo de 20 ppb de aflatoxina total. La Unión Europea ha establecido el límite de 2 ppb para aflatoxina B1 y 4 ppb para aflatoxina total en nuez procesada.
Tabla 1. Hongos de trabajo aislados de la quinua, tuna y castaña con sus respectivos códigos

*Hongo saprófito de Chenopodium quinoa.
**Hongo saprófito de fruto de Castanea sativa, productor de Aflatoxinas
Obtención de Extractos Vegetales
Las muestras vegetales fueron colectadas en la provincia Camacho, Localidad de Carabuco, Comunidad de Ollajsantia a 3800msnm (JV-M-16, Concentrado-Saponinas) y en la La Cumbre a una altura de 4200 msnm. Caiphora andina (JV-M-17). 500 g de los residuos (cáscara) de Chenopodum quinoa (JV-M-16)fue secada y molida, posteriormente se realizó su pre-tratamiento con solventes de baja polaridad (Eter de Petroleo 20-40°C), luego se sometió a una extracción solido- líquido con mezclas de agua-etanol, por 24Hrs., por triplicado. Obteniéndose un extracto de color amarillo. El extracto concentrado se re-cristalizó en una mezcla de metanol-acetato de etilo-cloroformo, obteniéndose un precipitado un sólido. El sólido fue analizado con patrones por CCF y por espectroscopía. Luego del análisis de los resultados se vio que se trata de una mezcla de dos moléculas de triterpenos glicosilados. 800g de Caiphora andina (JV-M-17) fueron procesados en una extracción solido-líquido en solvente acuso-metanólico (PA 50/50), por 24 Hrs. en triplicado. Ambos extractos fueron posteriormente concentrado y secado, para su evaluación de actividad microbiológica.
Dilución en placa e inhibición con extractos de vegetales
Se seleccionaron solo las cepas que se consideraron potencialmente patogenias cepas Bol TR-1, JR-1, y la cepa Bol RQ-2; Tabla 1. Los extractos de plantas fueron seleccionados de un trabajo previo de screening. De los cuales se escogieron trabajar con las muestras que M-16 y M-17.
En las pruebas antifúngicas, con la cepa Bol RT-1 y las muestras 16 y 17 usando como control positivo Sistane (Myclobutanil + azufre) un antifúngico sintético a una concentración de 1 mL/L, las muestras 16 y 17 de concentración 1 mg/L, en un tiempo de 12 días de crecimiento, podemos ver que existe una declinación en la curva de crecimiento con la Muestra 17 y aun menor de la Muestra 16, comparando con el control positivo (que no existe un crecimiento mayor a los 8 mm) y el control positivo, (Figura 1) y si solo tomamos en cuenta los días 4; 7; 12, se ve una declinación en el crecimiento por días comparando con el control negativo ( sin tratamiento).
Comparando la cinética de crecimiento 3,5 mm/día del control negativo, la cinética de crecimiento de 2,25 mm/día con la Muestra 17 y de 1,7 mm/día de la Muestra 16 comparado con el control positivo de 0,5 mm/día) podemos decir que el efecto de control sobre el crecimiento del hongo de las muestras 16 y 17, es evidente. Con la cepa Bol JR-1 se evidencia un resultado muy parecido pero en menor grado, donde la cinética de crecimiento para el control negativo de 3,5 mm/día es mayor a la velocidad de crecimiento con la muestra 16 de 1,8 mm/día; la velocidad de crecimeinto para la muestra 17 es de 2,4 mm/día igualmente menor que el control negativo. Las velocidades de crecimeinto de las muestras 16 y 17 comparadas con el control positivo 0,5 mm/día son mayores. (Figura 2) Podemos decir que el tratamiento con la muestra 16 disminuye la cinetica de crecimiento de la cepa JR-1. Con la cepa RQ-2 no se observan diferencias significativas comparadas con el control negativo en la velocidad de creciento con ningun tratamiento muestras 16 y 17 hasta los 12 días de cultivo. Sin embargo hasta los días 3 y 6 la muestra 16 parace mas bien ayuda en el crecimiento de la cepa, lo cual demuestra que la muestra 16 no tiene efecto sobre el hongo saprofito Ulocladium spp., Bol-RQ-2mas bien tiene efecto controlador sobre Bol-RT1, Fusarium que es potencialmente patogeno actuando de esta manera sinergica potenciando al saprofito e inhibiendo al patógeno. (Figura 3).
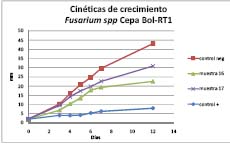
Figura 1
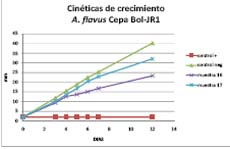
Figura 2
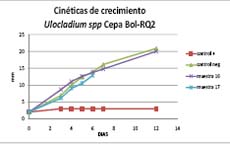
Figura 3
Porcentaje de inhibición de los extractos de plantas
El porcentaje de inhibición para la cepa Bol RT-1 sin tomar en cuenta el día inicial de inoculación tenemos que al día 4 con la Muestra 16 un 34,4 % de inhibición, la muestra 17 presenta 8,92 %; el al 7mo día la Muestra 16 un 34,7 % de inhibición, la muestra 17 presenta 23,9 %; al 12vo día la Muestra 16 un 47,6 % de inhibición, la muestra 17 presenta 28,3 %. Indica que la mayor inhibición se produjo al día 12 con un 47,6 % de la muestra 16. (Figura 4).Estos resultados indicarían que el mejor extracto a utilizar seria el 16 ya que para Fusarium spp. (Bol RT-1) presenta una inhibición del 47 %. Los resultados para la cepa Bol RQ-2 tenemos que al 3er día con la Muestra 16 un -24,2 % de inhibición, la muestra 17 presenta 10,87 %; el al 6mo día la Muestra 16 un 1,44 % de inhibición, la muestra 17 presenta 7,19 %; al 12vo día la Muestra 16 un 35.28 % de inhibición, la muestra 17 presenta 36,89 %, mayor inhibición se produjo al día 12 con un 36,89 % de la muestra 17. Lo interesante es que con la Muestra 16 al 3er día tiene un % de crecimiento del 124,6; 24,6 % más que el control negativo. (Figura 5). Los resultados nos indican que estos extractos no son para nada efectivos contra Ulocladium spp. (Bol RQ-2).
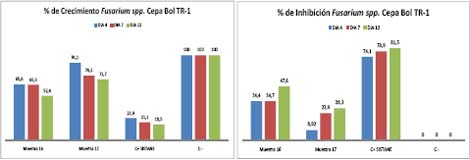
Figura 4
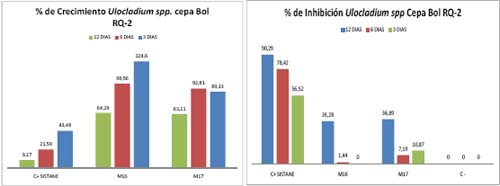
Figura 5
*El % I negativo del 24% implica que la muestra 16 potencializa el crecimiento en 24% en comparación del cultivo sin ningún tratamiento.
Para los resultados de los extractos ensayados con la cepa Bol JR-1 tenemos que al 4to día con la Muestra 16 un 18,7 % de inhibición, la muestra 17 presenta un 12,9 % de inhibición, el al 7mo día la Muestra 16 un presenta un 33,6 % de inhibición y la muestra 17 presenta 9,88 %; al 12vo día la Muestra 16 la inhibición es de 42 %, la muestra 17 presenta 20,1 % de inhibición; mayor inhibición se produjo al día 12 con un 42 % de la muestra 17. Lo interesante es que con la Muestra 16 al 3er día tiene un % de crecimiento del 124,6; 24,6 % más que el control negativo (Figura 6). La muestra 16 prueba se eficiente contra Aspergillus flavus (Bol JR-1).
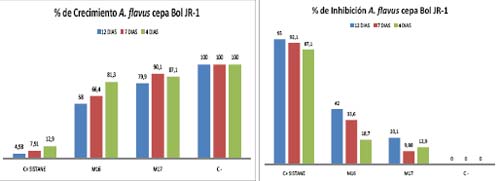
Figura 6
En cuanto a la cinética de estas cepas más lento que es la Cepa Bol RQ-2 se tiene una cinética de crecimiento de 2,053 mm/día, La cepa Bol RT-1 se tiene una cinética de 3,567 mm/día y la Cepa Bol JR-1 presenta una cinética de 3,192 mm/día, todo esto a temperatura ambiente. Con las muestras de los extractos de plantas se vio el mejor efecto producido por extracto M-16 a los 12 días con su mayor inhibición 47,6 % sobre Fusarium spp. (Bol RT-1) y Aspergillus flavus con 42 % de inhibición a los 12 días se debe a que las plantas contienen compuestos flavonoides que pueden ser antifúngicos, antibacterianos o antiparasitarios. Con las muestras de los extractos de plantas se el mejor efecto producido fue por extracto M-16 aislada de Chenopodium quinoa) y a los 12 días con su mayor inhibición 47,6 % sobre Fusarium spp. (Bol RT-1) y Aspergillus flavus con 42 % de inhibición a los 12 días. Algo parecido tenemos en un trabajo con extracto metanolico de Cestrum nocturnun L. frente a Rhizpus stolonifer con una inhibición miceliar de 66 y 50 % (algo superior a la obtenida en el presente trabajo) de 2 fracciones que en estudios posteriores determinaron que correspondían a saponinas esterioideas. Considerando como el primer reporte de inhibición por saponinas sobre hongos fitopatógenos. Así también Solanaceae y Asteraceae mostraron eficacia contra Mycosphaerella fijiensis ya que presentan como constituyentes principales, alcaloides, esteroides, fenoles, flavonoides, saponinas, taninos y triterpenos. Extrañamente la Con la cepa de Ulocladium spp (Bol RQ-2) no presenta una clara inhibición como las anteriores, sino que contrariamente favorece en una etapa el desarrollo del hongo, esto puede deberse a que los hongos pueden liberar una gran cantidad de enzimas que le permitirían degradar a la los compuestos tóxicos, y usarlo en alguna parte de su metabolismo, lo mismo se repite (aunque en mayor proporción) con la saponina, lo que pensaría utilizar a este hongo como un detoxificante. Esto se vio también es un otro estudio donde describen que existe estimulación en el crecimiento del Fusarium los extractos de las especies de varias especies de plantas como ciguaraya (Trichila glabra L.), cigua (Nectandra coriácea), paraíso (Melia azedererach Lin) y el tabaco (Nicotiana tabacum L.). La muestra 17 presenta 28,3 % con Fusarium spp, 20,1% Aspergillus flavus y un 36,89 % de inhibición con Ulocladium spp, con se debe a que las plantas contienen compuestos como metabolitos mayoritarios a flavonoides y triterpenos. Los extractos de saponinas no dieron los resultados que se hubiera querido esperar, salvo con Aspergillus flavus (Bol JR-1) pero esto a los 4 días con una inhibición de 42,4 % y luego va disminuyendo la efectividad del extracto, al parecer los hongos son capaces de contrarrestar el efecto de estos agentes tóxicos.
SECCION EXPERIMENTAL
Recolección de muestra
Se trabajaron con muestras del IIFB área de biotecnología fúngica aisladas de Quinua (Chenopodium quinoa), tuna (Opuntia Picus-Indica), la castaña (Castanea sativa Miller).
Medios de cultivo
Los medios de cultivo es Agar Papa Dextrosa (PDA) que se prepara a partir de papa 250 g/L, glucosa 10 g/L y Agar bacteriological (AGAR Nº 1 de OXOID Ltda, Basingstoke, Hampshire, England). Determinamos el género en base a la observación microscópica de los conidióforos, conidios y clamidosporas además de las características macroscópicas observadas en el medio de cultivo sólido.
Examen Microscópico en placa
Tomar la caja petri o el tubo donde se desarrolló el micelio y observar con la ayuda de una lupa:
Anverso
Aspecto del frente hifal: velloso, seco, algodonoso, etc.
Formación de macro estructuras sexuales
Color: de la especie fúngica
Reverso
Aspecto del frente hifal: rugoso, liso
Pigmento: Presente, no presente
Identificación mediante los postulados de Koch Modificados
Se busca cumplir con los postulados de Koch. El hongo debe estar presente en todos los casos de la enfermedad.
El hongo causante de la enfermedad debe ser aislado. A la infección a una plata u hoja sana, se debe reproducir los mismos signos y síntomas de la enfermedad. De debe aislar al mismo hongo causante de la enfermedad.
Cámara húmeda
Preparar una cámara húmeda en cajas petri o envases tipo tapers que contengan algodón y papel húmedos previamente esterilizados
Infección
Realizar un daño mecánico sobre la epidermis de la penca con una aguja bacteriológica previamente infectada.
Desarrollo. Observar el desarrollo y la repetición de los signos característicos de la enfermedad de la tuna detallando en la forma como empieza a generar daño, ver la presencia de exudación o necrosamiento.
Aislamiento de la enfermedad
Aislar el hongo para posteriormente identificarlo utilizando los medios anteriormente usados.
Extractos de plantas
Se trabaja con extractos de plantas procedentes del Instituto de Investigaciones en Productos Naturales (IIPN) de la Carrera de Química FCPN-UMSA. Se trabaja con las siguientes Muestras: Muestra 16 (Saponina aislada de Chenopodium quinoa), muestra 17 (Caiophora andina extracto PA) a una Concentración de 1000 ug/L, y el Control + Sistane a una concentración 1 mL/L
Método de dilución en placa y siembra
Para cada muestra y extractos de plantas. El medio de cultivo PDA se esperó que este a un temperatura de 70 ºC y se añadió la muestra de extracto de planta a estudiar, se vació en una placa petri (técnica de dilución en placa), y se esperó que el medio solidifique. Para el control positivo se añade en antifúngico – Sistane.
Se mede el crecimiento del frente hifal cada cierto tiempo con la una regla milimetrada, en las 8 direcciones o puntos cardinales (Norte, noreste, Este, sureste, sur, suroeste. Oeste, noroeste). Las mediciones se realizaron desde el borde a la punta de los micelios en desarrollo. Para el control Positivo se utiliza Sistane (1 mL/L) antifúngico químico, y se procede de manera similar como a los extractos. Para el control negativo se adiciona agua al medio PDA. Se sembró un taco (disco de hongo patógeno y agar que se toma de la placa petri extraído con sacabocado de diámetro de 4 mm) en el centro de la placa petri con medio PDA-extracto, y se repite lo mismo con en control positivo y el control negativo. Esto se realizo por triplicado. Se incubó 18 °C (temperatura ambiente del laboratorio) a por 2 semanas. Compara el crecimiento las muestras con relación al control positivo y negativo. Con los datos obtenidos se procederá a realizar una gráfica de las cinéticas de crecimiento y de la actividad inhibitoria de cada cepa calculando el Porcentaje de Crecimiento e Inhibición.
REFERENCIAS
1.F. J. F. DE ANA MAGÁN, Las hogueras en el monte y el ataque del hongo Leptographium gallaeciae sp. nv.sobre P. pinaster Ait. Boletin del servicio de plagas, 1982-(8). [ Links ]
2. Organización de Naciones Unidas para la Agricultura y Alimentación-FAO Código de conducta sobre la distribución y el uso de pesticidas, 2002 [ Links ]
3.MUJICA et al. LA QUINUA (Chenopodium quinoa Willd.) ANCESTRAL CULTIVO ANDINO, ALIMENTO DEL PRESENTE Y FUTURO,FAO, Santiago, 2001 [ Links ]
4. Instituto Nacional de Estadística – INE, Bolivia, La cobertura temática de la Base de Datos de costos de producción de la Encuesta de Hogares de 2007 se basa en la PARTE D: COSTOS DE PRODUCCIÓN de la SECCIÓN 9 INGRESOS DEL PRODUCTOR AGROPECUARIO INDEPENDIENTE , 2007. [ Links ]
5.AYALA, Guido, Raíces Andinas - Contribuciones al conocimiento y a la capacitación- Capítulo 7-Aporte de los cultivos andinos a la nutrición humana, Universidad Nacional Mayor de San Marcos, Lima, Perú, p 102 [ Links ]
6.Bonifacio A., Gandarillas H.; Saravia, R., Determinar la herencia de caracteres cuantitativos y cualitativos de la quinua instituto Boliviano de Tecnología Agropecuaria - IBTA. Estación Experimental de Patacamaya. [ Links ]
7. CEREZAL, P., Duarte G. Algunas características de tunas (Opuntia ficus-índica (L.) Miller) cosechadas en el altiplano andino de la 2da Región de Chile, J. PACD, 2005, 35:34-56 p. [ Links ]
8. Francisco Prieto, et al. CARACTERIZACIÓN FÍSICA Y QUÍMICA DE SEMILLAS DE OPUNTIAS (Opuntia spp.) CULTIVADAS EN EL ESTADO DE HIDALGO, MÉXICO Bioagro 2006, 18(3):163-169. [ Links ]
9.QUEZADA et al, ETIOLOGÍA DE LA MANCHA NEGRA DEL NOPAL (Opuntia ficus-indica Mill) EN TLALNEPANTLA, MORELOS, MÉXICO, Agrociencia 2006, 40: 641-653. [ Links ]
10. Bolivia exporta 2007. 25. ver enlace http://www.camexbolivia.com/joomla/index.php?option=com_content&task=view&id=19&Itemid=48 [ Links ]
11.Pérez Y., Cantillo T., Ramos E., González M. y López M., PROSPECCIÓN DE HONGOS DE SUELO CON POTENCIALIDADES PARA EL CONTROL BIOLÓGICO EN SUELOS DE AGROECOSISTEMAS CUBANOS FITOSANIDAD 2009 13(1):3-5 http://www.inisav.cu/fitosanidad/UN/Art.%201.pdf [ Links ]
12. BECQUER ET AL Efecto de la interacción Trichoderma-rizobio en Vigna luteola SC-123 Pastos y Forrajes2004, 27(2):139-145 [ Links ]
13. GONZALEZ A Estudio de la cinética de crecimiento en fase sumergida del biocontrolador Trichoderma viride bajo la influencia de campos electromagnéticos, TECNOLOGÍA QUÍMICA 1999, 19(1): 67-71 [ Links ]
14.ASTORGA, P. 2004. Estudio de Posibles biocontroladores de fitopatógenos de la Haba (Vicia faba) y la Papa (Solanum tuberosum). Tesina de Grado, Instituto de Investigaciones Fármaco Bioquímicas, Facultad de Ciencia Farmacéuticas y Bioquímicas, Universidad Mayor de San Andrés.
15.CIANCAS J, Efecto biocontrolador de la cepa trichoderma inhamatum Bol12qd-1 sobre el fitopatógeno Botritis cinerea mancha chocolate en cultivos de haba de la comunidad de Chirapaca, Tesis de Grado, Instituto de Investigaciones Fármaco Bioquímicas, Facultad de Ciencia Farmacéuticas y Bioquímicas, Universidad Mayor de San Andrés. [ Links ]
16. GÖKER Markus et al.,How do obligate parasites evolve? A multi-gene phylogenetic analysis of downy mildews Elsevier Fungal Genetics and Biology (2007) 44:105–122. [ Links ]
17. CHOI Young, HONG Seung, SHIN Hyeon, Re-consideration of Peronospora farinosa infecting Spinacia oleracea as distinct species, Peronospora effusa, Elsevier mycological research 2007, 3:381 –391. [ Links ]
18. SOLVEIG Danielsen, Heterothallism in Peronospora farinosa f.sp. chenopodii, the causal agent of downy mildew of quinoa, Journal Basic Microbiology. 2001,41 (5):305 – 308. [ Links ]
19. DANIELSEN Solveig, AMES Teresa EL MILDIU (Peronospora farinosa) DE LA QUINUA (Chenopdium quinoa) EN ZONA ANDINA Manual práctico para el estudio de la enfermedad y del patógeno, Departamento de Capacitación y Comunicación CIP, LIMA, 2000. [ Links ]
20. SANABRIA Nelly,GUADARRAMA Angel,ROMERO Hilda,Caracterización de especies de Fusarium mediante patrones electroforéticos de proteínas, Revista Facultad de Agronomía, 2002,28:161-173. [ Links ]
21. JOFFE A, PALTI J. Taxonomic Study of Fusaria of the Sporotrichiella Section Used in Recent Toxicological Work, APPLED MICROBIOLOGY, 1975, 29(5):575-579 [ Links ]
22.QUEZADA et al, ETIOLOGÍA DE LA MANCHA NEGRA DEL NOPAL (Opuntia ficus-indica Mill) EN TLALNEPANTLA, MORELOS, MÉXICO, Agrociencia 2006, 40: 641-653. [ Links ]
23. PILDAIN, M. CABRAL, D, VAAMONDE, G, POBLACIONES DE Aspergillus flavus EN MANÍ CULTIVADO EN DIFERENTES ZONAS AGROECOLÓGICAS DE LA ARGENTINA, CARACTERIZACIÓN MORFOLÓGICA Y
TOXIGÉNICA, Revista de Investigaciones Agropecuarias INTA, 2005, 34(3):3-19
24. BOLET Miriam, SOCARRÁS María, Micotoxinas y cáncer, Rev Cubana Invest Biomed 2005;24(1):54-9 [ Links ]
25. UNIDAD NACIONAL DE INOCUIDAD ALIMENTARIA UNIA – SENASAG, "Logros del SENASAG, en materia de INOCUIDAD ALIMENTARIA" Ministerio de Desarrollo Rural, Agropecuario y Medio Ambiente Trinidad, enero de 2007. 56p [ Links ]
26. TENORIO Reynaldo, Aislamiento, identificación, y ensayos de control biológico de fitopatógenos de la Quinua (Chenopodium quinoa), tuna (Opuntia Picus-Indica), la castaña (Castanea sativa Miller) Realizado en el IIFB área biotecnología fúngica, FCFB, UMSA. 2008. Tesis en imprenta [ Links ]
27.BARRERA Laura, BAUTISTA Silvia, Actividad Antifungica de Polvos, Extractos y fracciones de Cestrum nocturnun L. sobre el crecimiento Miceliar de Rhizopus stolonifer (Ehrenb.: Fr.) Vuill, Revista mexicana de FITOPATOLOGIA, 2008, 26(1): 27-31. [ Links ]
28. NIÑO Jaime, DETERMINACION DE LA ACTIVIDAD ANTIFÚNGICA DE EXTRACTOS VEGETALES SOBRE EL HONGO Mycosphaerella fijiensis Morelet, Scientia et Technica 2007,33:425-426 [ Links ]
29. PUENTE Mayra, et al Determinación de la actividad alelopática de extractos vegetales sobre algunos hongos fitopatógenos del suelo, Centro Agrícola, 2003, 30(1):64-68 [ Links ]
30. ROJAS Wilfredro, SOTO José Luis y CARRASCO Enrique., Estudio de impactos sociales, ambientales y económicos de la promoción de la quinua en Bolivia, PROIMPA, La Paz 2004. [ Links ]
31.PUENTE Mayra, et al Determinación de la actividad alelopática de extractos vegetales sobre algunos hongos fitopatógenos del suelo, Centro Agrícola, 2003, 30(1):64-68 [ Links ]
32. DIAZ Luz, Interacciones moleculares entre plantas y microorganismos: saponinas como defensas químicas de las plantas y su tolerancia a los microorganismos., Revista de Estudios Transdisciplinarios Serie verde 2009, 1(2):31 -54 [ Links ]
33.OYOTE Guadalupe, INDUCCIÓN DE RESISTENCIA EN JITOMATE (Solanum lycopersicum L.) CON EXTRACTOS DE BACTERIAS PATOGENAS Tesis Instituto politécnico nacional Michoacán México, 2008 [ Links ]
34. Montes RobertoK, Diversidad de compuestos químicos producidos por las plantas contra hongos fitopatógenos, Revista Mexicana de Micología, 2009, 29: 73-82. [ Links ]
35. NAVARRO García, et al. 2003. Antifungal activities of nine traditional Mexican medicinal plants. Elsiever Journal Ethnopharmacology, 2003, 87(1): 85-88.














