Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Revista Boliviana de Química
versión On-line ISSN 0250-5460
Rev. Bol. Quim v.24 n.1 La Paz 2007
ARTÍCULO ORIGINAL
Titulaciones de precipitación A Escala Normal y A Microescala
Boris Valdivia Zambrana*, Mauricio Ormachea Muñoz
Laboratorio de Servicio y Análisis, Instituto de Investigaciones Químicas, Universidad Mayor de San Andrés
Campus Universitario, Bloque de Química, Cota Cota, Calle No. 27, Casilla 303,
ABSTRACT
This document shows the comparison of the micro- and normal-scale levels of the titration or precipitation of a silver nitrate solution with sodium chloride using potassium chromate as an indicator, according to the Mohr Method. Thus, it has been able to evidence by means of a statistical analysis, an acceptable approach among the values obtained in each scale.
Key words: micro-, normal-scale titration levels, silver nitrate, Mohr Method
RESUMEN
El presente trabajo describe la titulación potenciométrica de una solución de nitrato de plata con cloruro de sodio, a partir de la concentración obtenida se hizo una comparación de titulación a nivel microescala y escala normal empleando indicador cromato de potasio, según el (Método de Mohr). Los resultados obtenidos en cada escala nos permite realizar un análisis estadístico de la aproximación de los valores determinados.
INTRODUCCIÓN
La potenciometría consiste en medir la fuerza electromotriz (fem) de una célula galvánica a través de la cual la corriente que pasa es cero, la variable que nos interesa es la modificación del potencial de un electrodo sencillo en que tiene lugar variaciones de concentración o de pH(1) .
Una aplicación común de la potenciometría es la detección del punto final en las valoraciones ácido-base, donde el potencial de un electrodo de metal, como: Plata (Ag) sumergido en una solución de sus iones a un a una temperatura de 25º C, es comparable a
la siguiente relación:
E = Eº Ag/AgCl - (0.0591/ n) * log PAg n
Las reacciones que se verifican en esta titulación son:
i) Ag+ + Cl- ==> AgCl(s)
ii) CrO42- + 2 Ag+ ==>Ag2CrO4(s)
En la mayor parte de las valoraciones que implican la medida del potencial en unidades de pH, los datos obtenidos corresponden a diferentes volúmenes de nitrato de plata, estos se representan de manera gráfica mediante una curva obteniendo la posición de mayor pendiente(3) para el punto final de la titulación.
RESULTADOS Y DISCUSIÓN
1. Estandarización de AgNO3 con NaCl
Mediante la titulación potenciometrica, se determinó la concentración real del nitrato de potasio con patrón estándar. El curso de la titulación y punto final se refleja en la grafica No.1.
El sistema de titulación propuesto en el presente trabajo no es posible aplicarlo a nivel micro-escala, debido a la dificultad del material utilizado y equipo descrito en la figura No.1.
2. Titulación del AgNO3 con NaCl, con indicador (método de pesada)
La estandarización del nitrato de plata con patrón estándar nos permite conocer la concentración real de la solución de AgNO3 , a partir del cual es posible efectuar una comparación en la titulación por pesada con patrón estándar en microescala y escala normal.
La comparación realizada indica que la desviación estándar obtenida en ambos casos es mínima, similar variación ocurre con los limites de confianza, por lo tanto el porcentaje de error del método en ambas escalas es menor a la unidad (ver tabla N°3).
De acuerdo a los resultados obtenidos se concluye que la titulación de nitrato de plata a nivel microescala, mediante el método de pesada de patrón estándar es adecuado para su aplicación en los ensayos típicos de la química analítica; lo cual disminuye sustancialmente el gasto de reactivos comparado con la titulación clásica.
Finalmente el trabajo realizado tiene gran aplicación en el análisis de aguas naturales, relativamente claras de manera particular la determinación de cloruros en concentración bajas.
EXPERIMENTAL
1.Estandarización del AgNO3 con NaCl
En principio se preparó solución de cromato de potasio al 5%, mediante una balanza analítica se pesó
A la vez se preparó
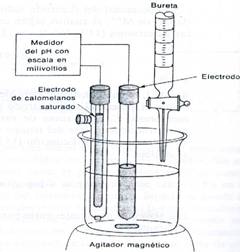
Fig.1 Sistema de medición potenciometrica Fuente: Skoog D. y West D
Una vez añadido 1ml. de indicador, se midió el potencial de la solución antes de añadir el primer volumen de AgNO3 ~ 0.01N, luego se sigue el curso de la titulación tomando nota del volumen añadido y el potencial registrado hasta llegar al punto de equivalencia. La concentración del nitrato de plata en el punto equivalente, se muestra en la tabla no.1
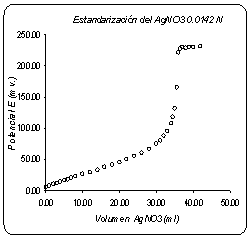 |
Gráfico No.1. Titulación potenciometrica Estándarización del AgNO3 con NaCl
Tabla No.1 Estandarización de AgNO3 0,01N
| Ag NO3 | Concentración |
| Pto.Equiv. | 0.01425 N. |
2. Titulación por pesada de NaCl
2.1 Escala normal
Mediante el uso de una estufa eléctrica se procedió a secar NaCl a
2. Titulación por pesada de NaCl
2.2 Micro Escala
La técnica seguida en esta titulación es similar al apartado 2.1, una vez preparada cada muestra en tubos de ensayo de 10 ml, se adicionó 100 uL. de indicador, homogenizando luego en un agitador vortex; la titulación se realizó mediante el uso de micro-pipetas de 100, 500 y 1000 uL, respectivamente de acuerdo al viraje del indicador, hasta llegar al punto final de la titulación.
En función a los resultados obtenidos, a continuación se presenta datos de concentración de la titulación por pesada del NaCl en escala normal y en micro-escala, según la tabla no.2
Tabla No.2
(Método de Pesada del NaCl)
| Escala | Normal | Microescala |
| Concentración | 0.0143 N. | 0.0141 N. |
3. Tratamiento estadístico
Los resultados obtenidos en la estandarización de nitrato de plata con cloruro de sodio nos permite hacer una comparación con respecto a la titulación por pesada de patrón estándar, en micro-escala y escala normal, a la vez determinar el error del indicador empleado.
Por lo que es necesario aplicar el tratamiento estadístico correspondiente, que implica realizar pruebas de significancia, para cada ensayo realizado en función a datos experimentales.
La tabla No.3 reporta datos de concentración promedio y la desviación estándar en la titulación por pesada correspondiente a cada escala aplicada.
Tabla No. 3 Valores de concentración y desviación estándar
| Parámetro | Concentración Escala normal | Concentración Microescala |
| Punto Equivalente | 0.0143 N | 0.0141 N |
| Desviación Estándar | 0.00021 | 0.00014 |
| Limites de Confianza | 0.0005 | 0.0004 |
| % Error | 0.7 % | 0.7 % |
Las pruebas de significancia del análisis estadístico en el presente trabajo, nos permite valorar si existe diferencia significativa dentro de cada escala.
En primera instancia se debe realizar el cálculo de la varianza experimental (F), respecto a la desviación normal de las dos escalas y comparar el valor obtenido con el valor teórico de F en bibliografía, de tablas estadísticas.(ver Tabla No. 4)
El valor obtenido del cociente entre la variable F experimental y el teórico, nos permite efectuar el calculo de la (t) de student experimental, luego este valor comparamos con el (t) student teórico, para determinar si existe diferencia significativa entre ambas escalas. (ver Tabla No. 4)
Tabla No. 4 Datos estadísticos calculados
| Pruebas de estadística | Valores |
| F experimental | 2.22 |
| F teórico | 3.18 |
| Desviación Total | 0.0002 |
| t student experimental | 2.18 |
| t student teórico | 2.26 |
Los resultados estadísticos calculados, muestran diferencia significativa de los valores experimentales respecto a los valores teóricos.
AGRADECIMIENTOS
El presente trabajo a sido posible gracias a la colaboración de:
El Dr. Edgar Coronel por las indicaciones efectuadas en su elaboración.
El Lic. Jorge Quintanilla, del Laboratorio de Hidroquímica por la colaboración efectuada en el préstamo de materiales para el análisis a nivel Microescala.
REFERENCIAS
1. Química Analítica 1979 Dick J. G. Págs. 308,309, 310
2. Química Analítica Cuantitativa 1979 Arthur Vogel, Págs. 50, 92
3. Química Analítica Cuarta edición 1990 Skoog D. y West D.
4. Química Analítica 1981 Christian Gary Págs. 249.
5. Métodos Normalizados 1989 APHA, AWWA, WPCF. Págs. 2-38.












 uBio
uBio 

